| 乳杆菌菌株的体外益生效果评价及研究 |
益生菌是具有生物活且摄入适量会对宿主产生有益作用的微生物[1]。益生菌通过预防炎症、增强免疫力发挥有益代谢活性[2]。乳酸菌是存在于人体肠道中的重要益生菌, 它们在维持人体肠道环境的微生态平衡和提高机体免疫力方面有着关键作用。乳酸菌表面存在脂磷酸壁酸、肽聚糖、表层蛋白(S层蛋白)和其他细胞壁相关多糖[3-4]。目前, 乳杆菌如植物乳杆菌、鼠李糖乳杆菌、双歧杆菌等是世界上常用的益生菌菌属。不是每株乳杆菌都可作益生菌, 需经科学方法验证后的菌株才可作为益生菌。近年来乳酸菌行业发展迅速, 筛选益生菌并建立具有自主知识产权的益生菌菌库能为开发适合我国发展需要的益生菌制剂、乳酸菌菌种、发酵剂等打下坚实基础。因此研究益生菌在免疫调节中发挥的作用并对其进行安全性评价, 对开发更安全的益生食品具有重要意义[5]。
本研究主要通过对乳杆菌的降解胆固醇能力、抗氧化能力、γ-氨基丁酸产生能力、模拟人工胃液、胆盐耐受能力进行测定, 旨在筛选出具有益生性的优良乳杆菌。不仅能为直投式发酵剂菌株的筛选及研究提供重要的理论基础,而且有利于研发益生菌制品, 使食疗治未病的前景更加开阔。
1 实验材料和方法 1.1 材料及试剂发酵实验所用到的菌株217-107、110、136、138、139、140、141、142为我实验室保藏菌株。
胆固醇、牛胆盐、猪胆盐、胃蛋白酶、胰蛋白酶.1, 1-二苯基-2-三硝基苯肼(DPPH):生工生物工程有限公司; 邻苯二甲醛:天津精细化工研究所; 氢氧化钾、正己烷、冰醋酸、浓硫酸:天津市富宇精细化工有限公司; 苯骈戊三酮(茚三酮):医药集团化学试剂有限公司; 层析薄板; 正丁醇; 冰乙酸; 去离子水; 薄层铝板。
胆固醇溶液:胆固醇0.06 g, 牛胆盐0.12 g, 蔗糖脂肪酸酯0.06 g, 冰乙酸5 mL, 吐温0.6 mL。上述物质加入试管中, 超声振荡直到完全溶解。用0.2 μm的有机细菌过滤头过滤[6]。
0.2 mg/mL胆固醇培养基:在300 mL灭菌后的MRS培养基中加入5.6 mL现配的胆固醇溶液和灭过菌的12 mL 6 mol/L NaOH溶液, 振荡混匀。
展开剂:正丁醇:冰乙酸:去离子水=4:1:2
显色剂:于展开剂中加入茚三酮(0.4 g/L)。
人工胃液:胃蛋白酶过滤除菌, 溶解在灭菌的0.5% NaCl溶液中, 终浓度为3 g/L, 用浓盐酸调节pH至2.0。
人工肠液:胰蛋白酶(1 g/L)和猪胆盐(1 g/L)溶解在灭菌的0.5%NaCl溶液中, 并用NaOH溶液调pH至8.0[7]。
1.2 实验仪器U-3900紫外-可见分光光度计:日本日立公司; ZHJH-C1214C垂直流超净工作台:上海智城分析仪器制造有限公司; BPH-9042恒温培养箱:上海一恒科学仪器有限公司; HVE-50全自动高压灭菌锅:华粤集团有限公司。
1.3 培养基MRS培养基:蛋白胨10 g, 牛肉膏10 g, 酵母粉5 g, 葡萄糖20 g, 柠檬酸三铵0.58 g, 硫酸锰0.25 g, 无水乙酸钠1.88 g, 磷酸氢二钠1.63 g, 乙酸钾2.25 g, 吐温80 mL, 加水至1 L, 115 ℃灭菌30 min。
GMRS培养基:MRS培养基中加入10 g谷氨酸钠, 115 ℃, 灭菌30 min。
1.4 实验方法 1.4.1 胆固醇标准曲线的绘制在当天配制的邻苯二甲醛工作液中溶入胆固醇, 使后者浓度分别为5、10、15、20、25、30 μg/mL, 再加入浓H2SO4 1 mL, 迅速将其混匀, 静置10 min后在550 nm下测吸光值, 绘制胆固醇标准曲线。
1.4.2 菌株胆固醇降解能力测定用改良的邻苯二甲醛法。取4 mL已发酵样品到具塞试管内, 取3 mL 33% KOH溶液加入其中并混匀, 再加95%乙醇3 mL, 混匀后在漩涡振荡器上振荡1.5 min。60 ℃水浴15 min, 迅速冷却到室温后向试管中加入正己烷3 mL,混匀, 再加入蒸馏水2 mL,混匀, 静置10 min。取2 mL上层液体加入到10 mL离心管, 置于恒温50 ℃的培养箱中挥发。向挥发后的每个离心管中加入2 mL当天配制的邻苯二甲醛工作液并混匀, 静置10 min后加入1 mL H2SO4, 迅速混匀并静置10 min。在550 nm下测定吸光值, 测菌株胆固醇含量[8-9]。
菌株按2%接种在MRS-STC-CHOL培养基上, 在恒温37 ℃下发酵24 h。分别测定初始及培养上清液(10 000 r/min, 10 min, 4 ℃)中胆固醇的含量, 按下式计算胆固醇的脱除率。
胆固醇脱除率(%)=[(初始胆固醇含量-上清液胆固醇含量)/初始胆固醇含量]×100%[10]。
1.4.3 菌株产γ-氨基丁酸能力测定菌株活化后按2%接种量接于GMRS培养基中恒温37 ℃培养48 h。取1 mL菌液备用。在距薄板一端2.5 cm处划一基线, 每隔2 cm点一个样, 写上点样标记, 用移液枪吸取2 μL标准液, 轻轻点在纸上,标记位置。注意点样直径不超过5 mm, 边点样边用吹风机吹干, 在展开剂中平衡5 h, 于烘箱内(85 ℃)放置15 min, 显色[11]。
1.4.4 菌株清除DPPH自由基能力测定取不同OD(0.5/1.0)下的8种菌液1 mL, 加入2 mL浓度为0.5 mmol/L的DPPH乙醇溶液并混匀, 在室温下避光反应30 min后, 离心处理(8 000 r/min, 10 min, 4 ℃)。取上清液,于517 nm下测吸光度, 用无菌水空白调零。对照组用等体积无菌水代替菌液, 空白组用等体积乙醇代替DPPH溶液。计算公式如下[12]:
| $ 清除率\left( \% \right) = [1 - ({A_{\rm{s}}} - A)/{A_0}] \times 100\% $ |
式中:A为空白组吸光度; A0为对照组的吸光度; As为样品组的吸光度。
1.4.5 菌株在人工胃肠液中耐受性测定将2%过夜培养的菌株转接到新鲜MRS培养基中, 在37 ℃股好恒温培养至OD600=1.0。离心(6 000 r/min, 3 min)收集菌体, 弃掉上清液后加入等体积的人工胃液或人工肠液, 于37 ℃静置培养6 h。等比稀释, 涂布平板, 活菌计数, 取三次平行实验平均值[13]。
2 结果与分析 2.1 菌株降解胆固醇能力评价 2.1.1 胆固醇标准曲线的绘制回归方程为y=0.0344x-0.0633, R2=0.9943。由此可知, 测定结果呈良好线性关系。
 |
| 图 1 胆固醇标准曲线 |
2.1.2 菌株降解胆固醇能力测定
恒定培养条件下菌株MRS-STC-CHOL培养液胆固醇含量及降解情况见表 1。
| 表 1 胆固醇含量与降解情况 |
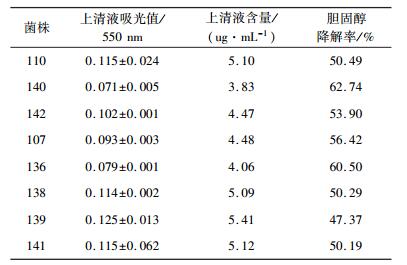 |
由表 1知, 菌株都有降解胆固醇的能力, 其降解能力的强弱因菌株的不同而有所差异。其中, 菌株140、136体外降解能力较强, 降解率分别高达62.74%、60.50%, 除Lactobacillus capularis139外, 其余菌株降解率均在50%以上。胆固醇水平过高会导致心血管疾病。在目前对于乳酸菌降解胆固醇能力的研究中, 降解率最高约48%[14], 因此筛选出降解率高的菌株具有重要意义。
2.2 菌株对产γ-氨基丁酸能力的评价为更好地体现菌株的益生性能, 选用薄板层析进一步验证。以γ-氨基丁酸标准品为基准和实验室已确定产γ-氨基丁酸的菌株4作阳性对照,结果如图 2所示。根据标准品的展开距离得出, 8株乳杆菌均具有产γ-氨基丁酸的能力, Lactobacillus casei 140产γ-氨基丁酸能力强, Lactobacillus acidophilus subspecies 141产γ-氨基丁酸能力较弱。γ-氨基丁酸具有重要的生理功能, 如健脑、促睡眠、降血压等。因此, 产γ-氨基丁酸能力强的菌株有望为以后研发益生制品提供基础。
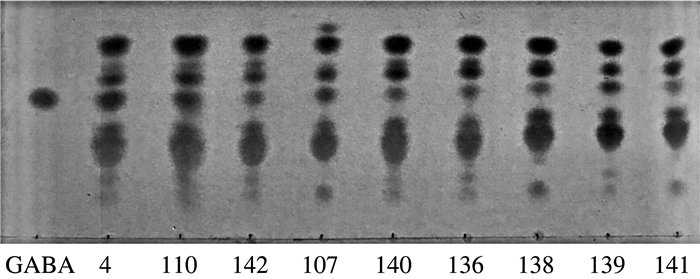 |
| 图 2 薄板层析GABA实验结果 |
2.3 对菌株DPPH清除自由基能力的评价
如图 3所示, 菌株浓度不同, 抗氧化能力不同。测定菌株在不同时期的抗氧化能力。由图 1、图 2选取菌株110、140、107、142,与实验室已知抗氧化能力强的菌株217-1、217-3、217-7做阳性对照, 发现L.yoelii142具有较强的抗氧化能力,菌体浓度高时达到79.50%, 菌体浓度低时达73.5%。此外, Lactobacillus plant110在菌体浓度高时也表现出较高的抗氧化能力。在已有研究中, 乳酸菌的抗氧化能力为41%[15]。研究发现, 癌症、衰老或其他疾病与自由基增加有很大关系, 乳酸菌的抗氧化能力可以有效克服自由基危害。
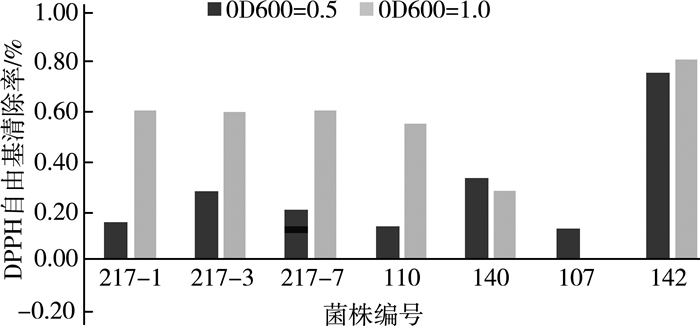 |
| 图 3 菌株DPPH自由基清除能比较 |
2.4 对菌株人工胃肠液耐受性的评价
以筛选得到的4株菌为出发菌株, 通过模拟人工胃、肠液, 对此4株菌的人工胃、肠液耐受性做比较, 结果如图 4、图 5所示。
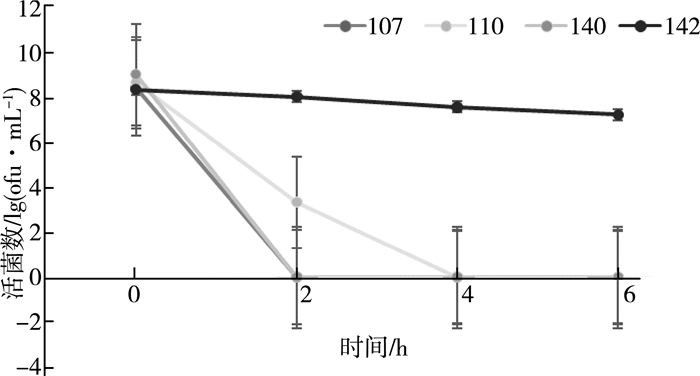 |
| 图 4 菌株在pH=2.0的人工胃液中活菌数变化情况 |
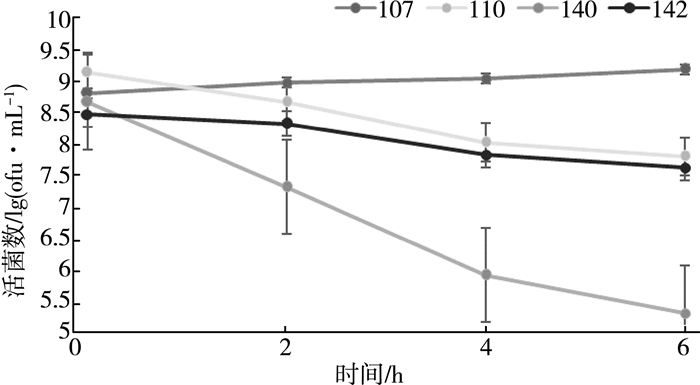 |
| 图 5 菌株在pH=8.0的人工肠液中活菌数变化情况 |
由图 4、图 5可知, L.yoelii142对人工胃、肠液耐受性较高。在人工胃液(pH=2.0)中, 6 h时菌活数为1×108cfu/mL, 在2 h时菌活数减少,变化率仅3.6%。在人工肠液(pH=8.0)中, 6 h时菌株107菌活数达1×109cfu/mL, L.yoelii142菌活数为1×107cfu/mL, 变化率为10%。L.casei140活菌数为1×107cfu/mL,变化率为13.4%。以上实验证明, 不同的乳杆菌菌株的抗酸胁迫能力不同。L.yoelii142最适合在酸性环境中生长。
3 总结本文旨在评价乳杆菌的体外特性。从实验室乳酸菌菌库中选取8株乳杆菌为出发菌株, 对其进行体外降解胆固醇能力、抗氧化能力、耐人工胃、肠液能力测定, 旨在筛选出一株具有高抗活性的乳杆菌。通过各项指标的测定, 将降解胆固醇实验和产γ-氨基丁酸实验结合, 筛选出4株乳杆菌进行人工胃、肠液耐受性实验, 从而筛选出具有优良抗酸胁迫能力的Lactobacillus yoelii.142。筛选乳杆菌的工作可为以后开发各种乳酸菌发酵剂打下坚实的理论基础。
| [1] |
孙芝兰.卷曲乳杆菌益生特性及黏附机理研究[D].济南: 山东大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10422-1012461386.htm
|
| [2] |
XING Z, TANG W, GENG W. In vitro and in vivo evaluation of the probiotic attributes of Lactobacillus kefiranofaciens XL10 isolated from Tibetan kefir grain[J]. Applied Microbiology and Biotechnolology, 2017, 101(6): 2467-2477. DOI:10.1007/s00253-016-7956-z |
| [3] |
CANDELA M, MACCAFERRI S, TURRONI S, et al. Functional intestinal microbiome, new frontiers in prebiotic design[J]. International Journal of Food Microbiology, 2010, 140(2-3): 93-101. DOI:10.1016/j.ijfoodmicro.2010.04.017 |
| [4] |
CHIU Y H, TSAI J J, LIN S L, et al. Characterisation of bifidobacteria with immunomodulatory properties isolated from human breast milk[J]. Journal of Functional Foods, 2014, 7: 700-708. DOI:10.1016/j.jff.2013.12.015 |
| [5] |
JYOTI C, DUBEY R C, GYANEEDRA S, et al. Evaluation of probiotic potential and safety assessment of Lactobacillus pentosus MMP4 isolated from Mare's lactation[J]. Probiotics and Antimicrobial Proteins, 2018(1): 22-31. |
| [6] |
王晓君, 潘道东, 张佳程. 乳杆菌降胆固醇体外筛选的培养基研究[J]. 中国酿造, 2010, 29(4): 26-28. DOI:10.3969/j.issn.0254-5071.2010.04.008 |
| [7] |
程秀芳, 王丛丛, 谷巍. 乳杆菌在体外模拟胃肠环境中的抗性研究及其发酵特性[J]. 药学研究, 2012, 31(1): 6-8. |
| [8] |
唐雅茹, 于上富, 国立东, 等. 一株降胆固醇乳杆菌的筛选及其益生作用的研究[J]. 食品工业科技, 2016, 37(1): 142-144;152. |
| [9] |
丁苗, 刘洋, 葛平珍, 等. 发酵酸肉中降胆固醇乳杆菌的筛选、鉴定及降胆固醇作用[J]. 食品科学, 2014, 35(19): 203-207. DOI:10.7506/spkx1002-6630-201419041 |
| [10] |
李昵.降胆固醇乳杆菌的筛选及其降解机理研究[D].厦门: 集美大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10390-1012489107.htm
|
| [11] |
冀林立.传统乳制品中产γ-氨基丁酸乳杆菌的筛选、鉴定及发酵条件优化[D].呼和浩特: 内蒙古农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10129-2008132082.htm
|
| [12] |
陈芳甜.观赏海棠果抗氧化活性的研究[D].泰安: 山东农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10434-1012486878.htm
|
| [13] |
孙艳波. 酸奶用乳杆菌的人工消化耐受性研究[J]. 中国乳品工业, 2005, 33(9): 30-31. DOI:10.3969/j.issn.1001-2230.2005.09.007 |
| [14] |
卢海鹏.传统酸马奶乳杆菌的鉴定及降胆固醇作用[D].呼和浩特: 内蒙古农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10129-1018882440.htm
|
| [15] |
姚沛琳, 苏博, 徐礼生, 等. 市售酸奶中乳杆菌的抗氧化和耐酸耐胆盐能力分析[J]. 宿州学院学报, 2018, 33(7): 111-114. |
 2019, Vol. 33
2019, Vol. 33


