| 基于响应面法优化“二次包埋”制备蓝莓爆爆珠的工艺研究 |
近年来, 利用天然的、生物相容的、可生物降解的多糖输送生物活性物质的新方法逐渐走入人们的视野。物理交联技术(如离子致凝胶法)是人们关注的其中一个重点, 这些技术不但操作简单、温和, 而且没有传统的化学交联过程中可能由于交联剂而产生的毒性[1-2]。研究人员在藻类中分解出了一类天然阴离子型线性多糖——海藻酸钠, 其主要成分为甘露糖醛酸和古洛糖醛酸, 是一种可生物降解的、低成本的具有生物相容性的生物聚合物, 由于其可以在温和的条件下与钙离子等多价阳离子(交联剂)结合形成凝胶, 因此被广泛应用于水凝胶珠的制备。
根据制备方法的不同, 球化技术可以分为两类:碱性球化和反向球化。以海藻酸钠和钙离子为例, 向含有钙离子的溶液中加入海藻酸钠溶液的方法, 被称为碱性球化。这可以使钙离子渗透到海藻酸钠液滴中, 并从表面到液滴内部形成海藻酸钙。相反, 在反向球化中, 将钙离子溶液注入到海藻酸钠中, 钙离子与海藻酸钠结合并形成海藻酸钙外壳。而碱性球化由于海藻酸钠在与钙离子结合前, 与低pH、低极性物质(如酒精溶液)混合时, 可能会发生凝胶化, 无法起到将目标物质包埋到水凝胶珠中的作用。相反的, 反向球化法可以将钙离子溶液与其他各种材料混合后再滴入海藻酸钠溶液中。Tsai等人[3]将反向球化的技术应用于萝卜藻酸盐水凝珠生产的同时, 使功能性化合物避免被胃液破坏, 提高了功能性化合物的吸收效率。Bubin等人[4]则通过这种方法生产了火龙果珍珠, 同样对火龙果中多种营养成分进行了保护。因此, 对蓝莓果汁进行包埋, 有助于提高果汁中花青素的生物利用度和有效改善花青素的稳定性。
研究基于反向球化与碱性球化相结合的方法对蓝莓果汁进行二次包埋形成爆爆珠, 运用Box-Behnken设计法, 建立回归模型, 优化选择爆爆珠成型的技术参数。为蓝莓爆爆珠生产提供理论依据和技术参数, 同时为蓝莓深加工开辟新途径。
1 材料与方法 1.1 材料与仪器新鲜蓝莓果汁;乳酸钙、海藻酸钠、胃蛋白酶(1 200 u/g)、胰酶;95%乙醇
分析天平、紫外分光光度计、数显游标卡尺、恒温水浴锅
1.2 方法 1.2.1 实验方法利用反向球化与正向球化相结合的方法将蓝莓果汁与不同浓度的乳酸钙溶液混合后滴入到配置好的1%的海藻酸钠溶液中。爆爆珠成型后, 静置不同时间过滤收集, 使用蒸馏水和95%乙醇依次清洗后, 将其放置于不同浓度的乳酸钙溶液中, 静置不同时间后过滤收集, 再用蒸馏水和95%乙醇清洗。
1.2.2 蓝莓爆爆珠直径的测定使用数显游标卡尺对制备好的蓝莓爆爆珠直径进行测定。
1.2.3 蓝莓爆爆珠包埋率的测定包埋率测定采用Gong等人的实验方法[5], 并做了一些修改。将制备好的蓝莓爆爆珠破碎后, 4 000 r/min下离心5 min, 提取上清液, 运用pH示差法测量上清液中花青素含量H1。用同样的方法测定蓝莓汁—乳酸钙混合溶液中花青素含量H2, 使用以下公式计算包埋率(Y1):
| $ {Y_1} = \frac{{{H_1}}}{{{H_2}}} \times 100\% $ | (1) |
精确量取16.4 mL稀盐酸(9.5%~10.5%), 10 g胃蛋白酶, 将其混合放入相关容器中, 并加入800 mL水, 将其摇匀, 同时再次加水将溶液稀释成1 000 mL, 制得模拟胃液(SGF)。
精确量取6.8 g磷酸二氢钾, 并加入500 mL水使其充分溶解, 取氢氧化钠溶液0.1 mol/L, 将溶液pH值调至6.8;精确量取10 g胰酶, 加入适当的水使其充分溶解后, 将两溶液进行混合, 同时再次加水将混合后的溶液稀释至1 000 mL, 制得模拟肠液(SIF)。
将制好的蓝莓爆爆珠放置在300 mL SGF中, 于37 ℃、50 r/min下恒温水浴30 min。取出爆爆珠, 用纸巾擦净表面水渍, 破碎后测定花青素含量。
将制好的蓝莓爆爆珠放置在300 mL SIF中, 于37 ℃、50 r/min下恒温水浴60 min。取出爆爆珠, 用纸巾擦净表面水渍, 破碎后测定花青素含量。
用下述公式计算释放率:
| $ 花青素释放量 = 1 - \frac{{{H_a}}}{{{H_b}}} \times 100\% $ | (2) |
其中:Ha:上清液中花青素含量,
Hb:混合溶液中花青素含量。
1.2.5 蓝莓爆爆珠溶胀率的测定称取蓝莓爆爆珠的重量W1, 于室温下将其置于10 mL蒸馏水中10 min, 取出爆爆珠, 用纸巾擦干表面水渍后, 称取重量W2。按照以下公式计算溶胀率(Y2):
| $ {Y_2} = ({W_2} - {W_1})/{W_1} \times 100\% $ | (3) |
采用pH示差法对蓝莓汁进行花青素含量测定[6]。
1.3 单因素试验及响应面设计 1.3.1 蓝莓爆爆珠制备的单因素试验以蓝莓果汁包埋率为指标, 利用单因素试验研究蓝莓爆爆珠制备的工艺条件:
在第一次凝胶时乳酸钙浓度(M1) 0.12 mol/L, 第二次凝胶时间(T2) 6 min, 第二次凝胶时乳酸钙浓度(M2) 0.05 mol/L的条件下, 研究第一次凝胶时间(T1)(5 min、15 min、25 min、35 min)对包埋率的影响;
在T1为25 min, T2为6 min, M2为0.05 mol/L的条件下, 分析探索M1(0.04 mol/L、0.08 mol/L、0.12 mol/L、0.16 mol/L、0.20 mol/L)对包埋率的影响;
在T1为25 min, M1为0.12 mol/L, M2为0.05 mol/L的条件下, 研究T2 (2 min、4 min、6 min、8 min、10 min)对包埋率的影响;
在T1为25 min, M1为0.12 mol/L, T2为6 min的条件下, 研究M2 (0、0.025 mol/L、0.05 mol/L、0.075 mol/L、0.1 mol/L)对包埋率的影响。
1.3.2 蓝莓爆爆珠制备的响应面设计通过分析单因素试验结果的相关数据, 运用Design-Expert 12软件中的Box-Behnken试验进行对第一次凝胶时间(T1)、第一次凝胶时乳酸钙浓度(M1)、第二次凝胶时间(T2)、第二次凝胶时乳酸钙浓度(M2)四个条件进行四因素三水平的响应面优化试验, 对蓝莓爆爆珠的制备工艺进行工艺参数优化。试验因素与水平如表 1所示。
| 表 1 爆爆珠制备工艺优化Box-Behnken试验因素及水平 |
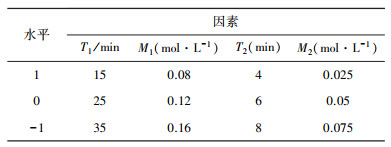 |
2 实验结果与讨论 2.1 单因素实验结果及分析 2.1.1 第一次凝胶时间对蓝莓爆爆珠包埋率的影响
如图 1所示, 在第一次凝胶化的前25 min, 随着时间的增加, 包埋率也逐渐升高, 而超过25 min后, 反而出现了下降的趋势。由于本实验中包埋率是通过花青素含量来计算的, 因此这可能是因为在第一次凝胶化的过程中, 溶液中的钙离子倾向于向海藻酸钠溶液中扩散, 而溶液中的花青素同时也向海藻酸钠溶液中扩散, 从而导致包埋率随着凝胶化时间的延长而下降。另一方面, 第一次凝胶化是形成爆爆珠外层的主要步骤, 若凝胶化时间过短, 会导致形成的爆爆珠外壳比较薄, 容易在第二次凝胶化过程中损失花青素, 导致包埋率的下降。因此选择第一次凝胶时间为25 min。
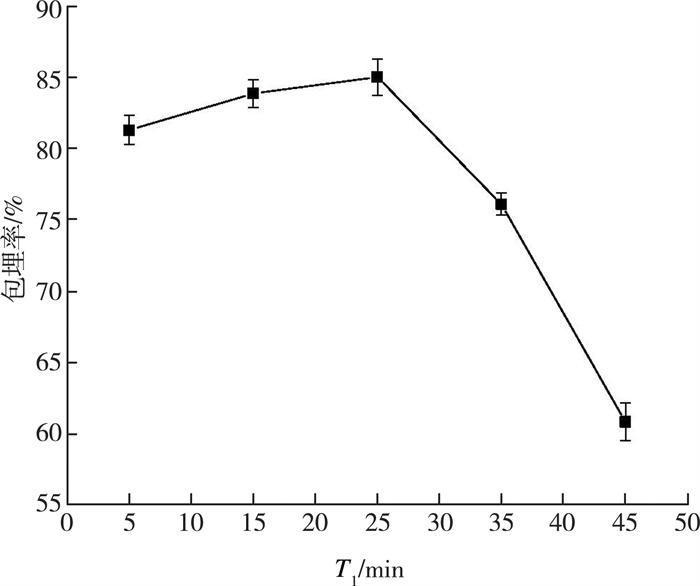 |
| 图 1 第一次凝胶时间对爆爆珠包埋率的影响 |
2.1.2 第一次凝胶时乳酸钙浓度对蓝莓爆爆珠包埋率的影响
如图 2所示, 随着乳酸钙浓度的上升, 包埋率逐渐上升, 当第一次凝胶时乳酸钙浓度达到0.12 mol/L时, 包埋率最高, 为85.03%, 而当乳酸钙浓度继续上升时, 包埋率反而呈现了下降趋势。这可能是由于乳酸钙浓度低时, 不足以完全包埋目标溶液;而当乳酸钙浓度过高时, 溶液较为粘稠, 所需的固化时间过长, 导致花青素向海藻酸钠溶液中扩散, 影响了爆爆珠的包埋率。因此, 第一次凝胶时乳酸钙浓度为0.12 mol/L比较合适。
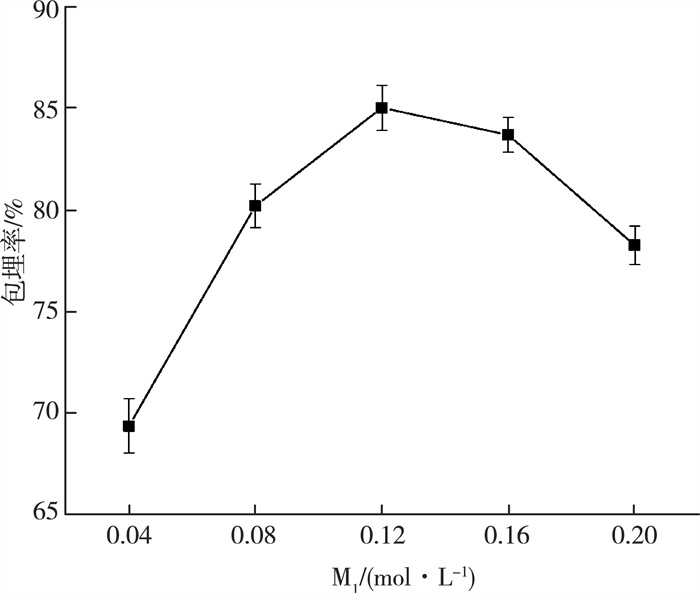 |
| 图 2 第一次凝胶时乳酸钙浓度对爆爆珠包埋率的影响 |
2.1.3 第二次凝胶时间对蓝莓爆爆珠包埋率的影响
第二次凝胶化的目的是加固爆爆珠的外壳, 使其能够更好地包裹住目的溶液。因此, 随着第二次凝胶时间的增加, 包埋率也随之上升, 这个结果与第一次凝胶化时的结果类似, 因此选择第二次凝胶时间为6 min较为适宜。
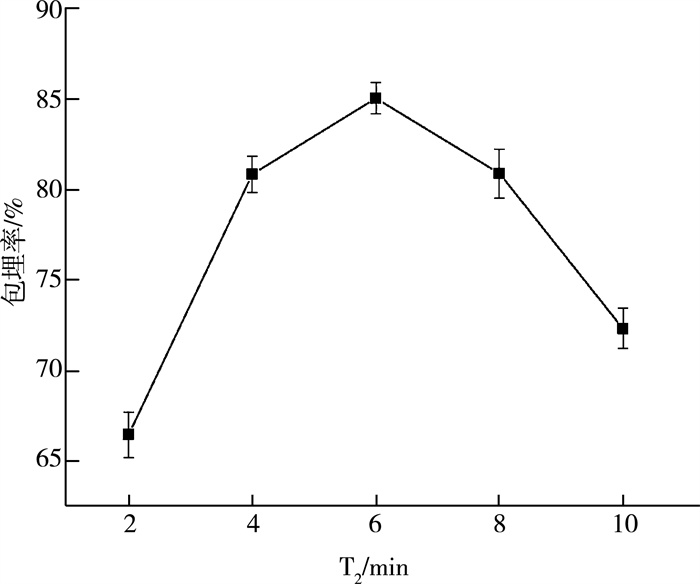 |
| 图 3 第二次凝胶时间对爆爆珠包埋率的影响 |
2.1.4 第二次凝胶时乳酸钙浓度对蓝莓爆爆珠包埋率的影响
与第一次凝胶时乳酸钙浓度结果相类似, 随着浓度的升高, 爆爆珠外壳能够更快的加固, 从而使包埋率提高。当浓度超过0.05 mol/L时, 乳酸钙浓度继续增加对包埋率影响较小且有下降趋势, 结合生产实际, 考虑到成本问题, 选择0.05 mol/L作为第二次凝胶时乳酸钙的浓度比较合适。
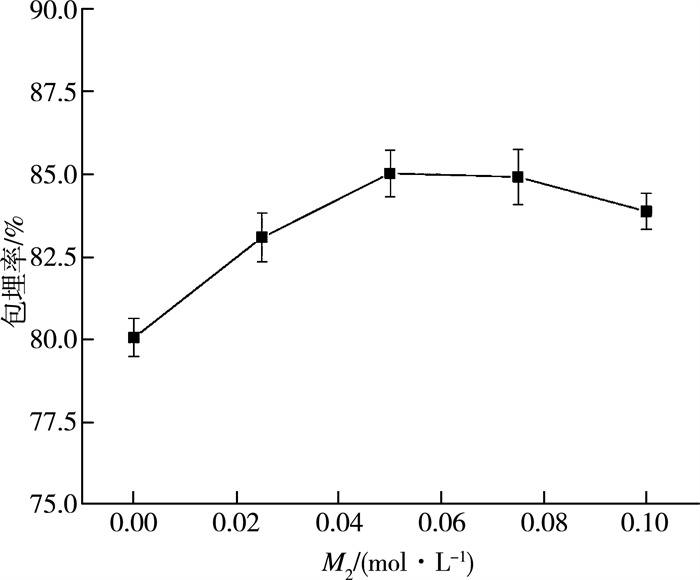 |
| 图 4 第二次凝胶时乳酸钙浓度对爆爆珠包埋率的影响 |
2.2 响应面设计结果及分析
根据单因素实验结果, 对蓝莓爆爆珠制备的工艺条件进行了响应面设计, 试验方案与结果如表 2所示。
| 表 2 爆爆珠制备工艺优化Box-Behnken试验方案与结果 |
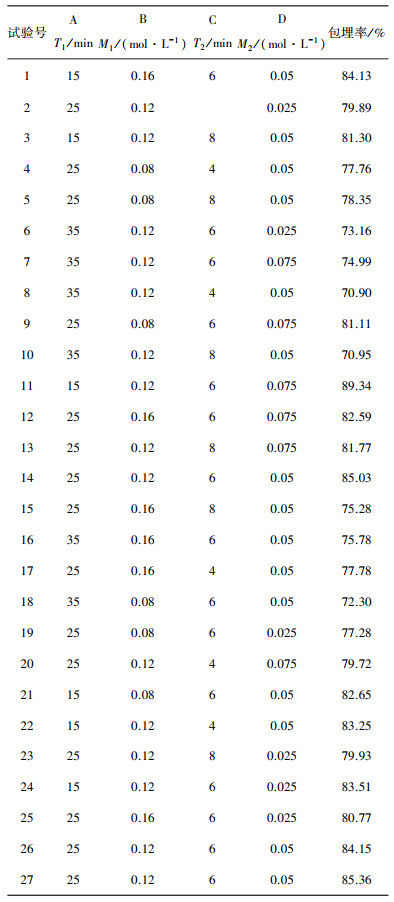 |
根据表 2中相关数据, 通过运用Design-Expert 12软件进行式多项回归拟合, 拟合结果如表 3所示。
| 表 3 爆爆珠包埋率的多元回归模型方差分析 |
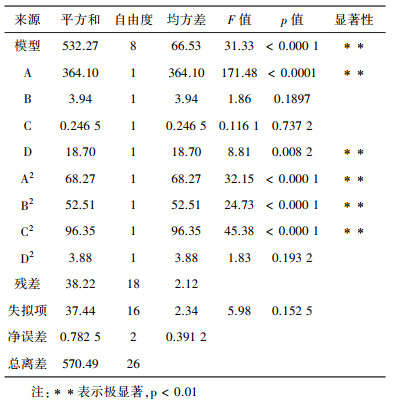 |
对回归模型的分析可得回归方程为:包埋率=84.85-5.51A+0.5733B-0.1433C+1.25D-3.58A2-3.14B2-4.25C2-0.8529D2。根据表 3相关数据显示, 回归模型p值小于0.000 1时, 该模型呈现极显著状态, 模型失拟项p值为0.152 5>0.05, 模型失拟项不显著, 表明该模型能够对试验很好的进行模拟分析。校正系数R2=0.9 330, 说明该模型拟合度良好, 能够对实验结果进行准确的分析和预测。
由上表可知, T1对蓝莓爆爆珠的制备具有极显著影响, M1虽未达到显著水平, 但也有较好的影响。为了更方便清楚的反映出蓝莓爆爆珠制备受各因素间交互作用的影响关系。通过运用Design-Expert 12软件绘制响应面图和等高线图。
图 5和图 6反映了爆爆珠成型过程中各因素对包埋率的影响, 根据回归模型, 可以发现在第一次凝胶时间为17 min, 乳酸钙浓度为0.121 mol/L;第二次凝胶时间为6 min, 乳酸钙浓度为0.068 mol/L时, 可得最大包埋率为87.43%。为确保数据的准确可靠, 基于以上条件, 又进行了三次实验, 根据实验结果计算出平均包埋率为87.17%, 该值在响应面的预测区间内, 证明该回归模型可以准确预测爆爆珠的包埋率。
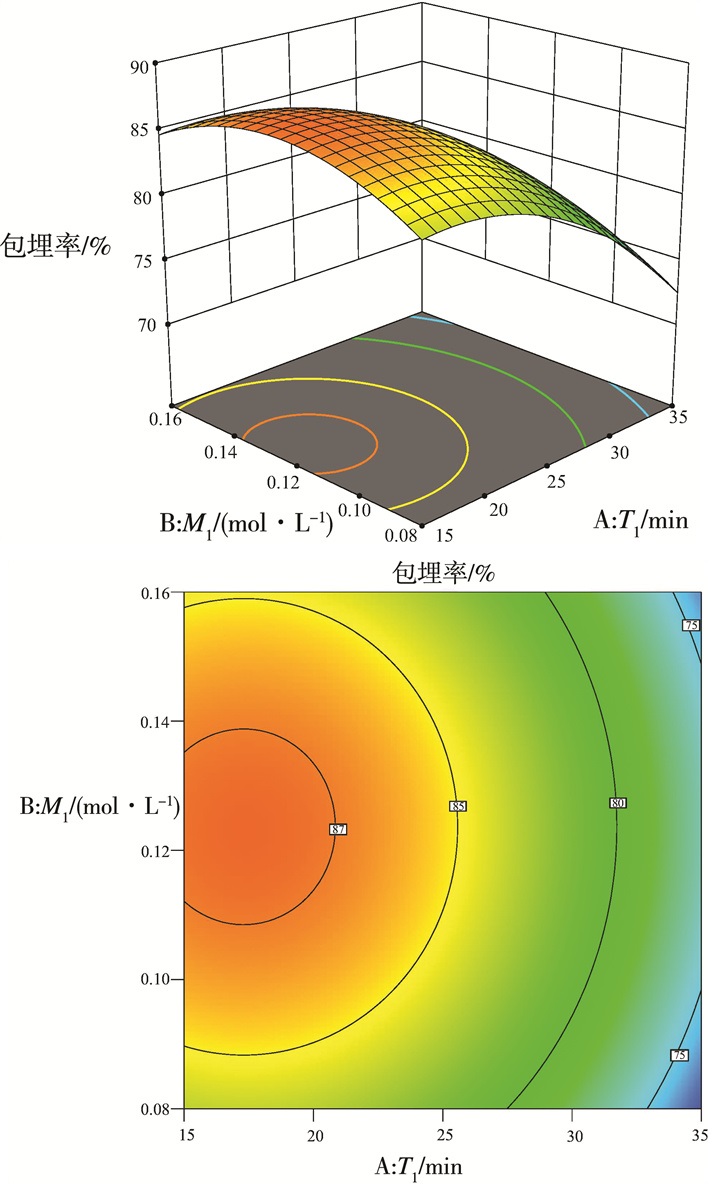 |
| 图 5 第一次凝胶时间和乳酸钙浓度对爆爆珠包埋率影响的响应面和等高线图 |
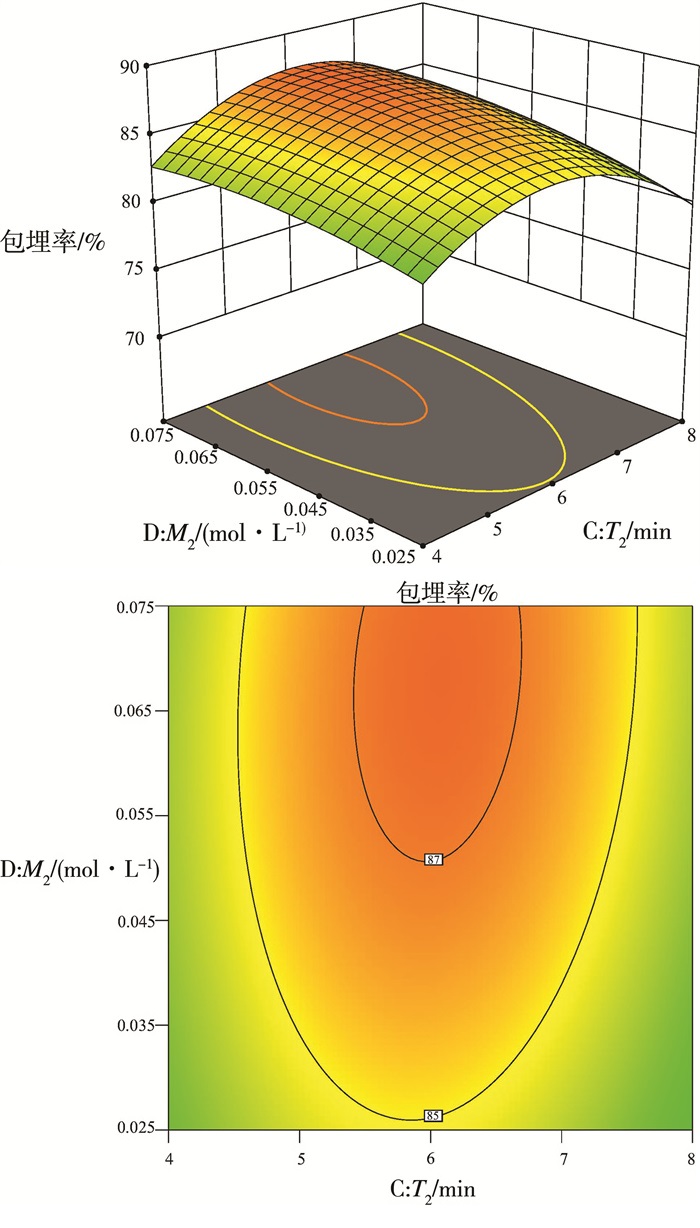 |
| 图 6 第二次凝胶时间和乳酸钙浓度对爆爆珠包埋率影响的响应面和等高线图 |
对在此条件下制备的爆爆珠进行的性质分析可得直径为(4.35±0.51) mm, 相关释放率在模拟胃液中为23.61%, 在模拟肠液中为42.43%, 爆爆珠溶胀率为2.52%。为了有效地将花青素输送到肠道并确保有效吸收, 需要在胃中保持较低的释放率, 在肠道环境中有较高的释放率。根据相关实验数据显示, 模拟肠液中的释放率较高, 相反释放率在模拟胃液中较低, 这说明爆爆珠在模拟胃液环境中性质稳定, 有较好的耐酸性, 能够使花青素得到有效吸收。水凝胶胶囊的膨胀表明离子强度的降低, 通常会导致化合物从胶囊中释放出来[7-8]。溶胀率越低, 说明爆爆珠性质越稳定。而在此条件下生产的爆爆珠溶胀率仅为2.52%, 说明其能保持较好的稳定性, 更易于贮存。
3 结论研究了反向成球法制备蓝莓爆爆珠的生产工艺, 考察了第一次凝胶过程中凝胶时间和乳酸钙浓度以及第二次凝胶过程中凝胶时间和乳酸钙浓度对蓝莓爆爆珠包埋率的影响。通过进行单因素试验, 确定了凝胶过程中凝胶时间和乳酸钙浓度的最适作用条件范围, 为响应面设计优化爆珠成型条件提供了研究基础。
根据单因素试验结果, 通过响应面设计研究了蓝莓爆爆珠制备的工艺方法, 得到回归模型。通过三次平行验证试验证明了该模型对于蓝莓爆爆珠包埋率能够进行较好的预测, 确定了爆爆珠制备的工艺参数为, 第一次凝胶过程中凝胶时间和乳酸钙浓度分别为17 min、0.121 mol/L;第二次凝胶过程中凝胶时间和乳酸钙浓度分别为6 min、0.068 mol/L。在此条件下可得到爆爆珠制备的最大包埋率, 为87.43%。
通过此实验方法可以得到性质稳定的蓝莓爆爆珠产品, 其直径为(4.35±0.51) mm, 释放率在模拟胃液中为23.61%, 在模拟肠液中为42.43%, 爆爆珠溶胀率为2.52%。因此, 在实际生产中, 反向球化法的二次凝胶方法可以为爆爆珠的生产提供一种方案选择。
| [1] |
NAYAK A K, PAL D, SANTRA K. Swelling and drug release behavior of metformin HCl-loaded tamarind seed polysaccharide-alginate beads[J]. International Journal of Biological Macromolecules, 2016, 82: 1023-1027. DOI:10.1016/j.ijbiomac.2015.10.027 |
| [2] |
NAYAK A K, DAS B, MAJI R. Calcium alginate/gum arabic beads containing glibenclamide: development and in vitro characterization[J]. International Journal of Biological Macromolecules, 2012, 51(5): 1070-1078. DOI:10.1016/j.ijbiomac.2012.08.021 |
| [3] |
TSAI F, KITAMURA Y, KOKAWA M. Liquid-core alginate hydrogel beads loaded with functional compounds of radish by-products by reverse spherification: optimization by response surface methodology[J]. International Journal of Biological Macromolecules, 2017, 96: 600-610. DOI:10.1016/j.ijbiomac.2016.12.056 |
| [4] |
BUBIN S F A, MAT ALI S, SHUKRI R, et al. Characterization and stability of pitaya pearls from hydrocolloids by reverse spherification[J]. International journal of food properties, 2019, 22(1): 1353-1364. DOI:10.1080/10942912.2019.1647234 |
| [5] |
GONG R, LI C, ZHU S, et al. A novel pH-sensitive hydrogel based on dual crosslinked alginate/N-α-glutaric acid chitosan for oral delivery of protein[J]. Carbohydrate Polymers, 2011, 85(4): 869-874. DOI:10.1016/j.carbpol.2011.04.011 |
| [6] |
JUNGMIN L, DURST R W, WROLSTAD R E, et al. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study[J]. Journal of Aoac International, 2005(5): 1269-1278. |
| [7] |
MCKENNA BA, NICHOLSON, et al. Effects of Ca, Cu, Al and La on pectin gel strength: implications for plant cell walls[J]. CARBOHYD RES, 2010, 2010, 345(9): 1174-1179. |
| [8] |
SIEPMANN J, PEPPAS N A. Modeling of drug release from delivery systems based on hydroxypropyl methylcellulose (HPMC)[J]. Advanced Drug Delivery Reviews, 2012, 64(S): 163-174. |
 2021, Vol. 35
2021, Vol. 35


