| 基于重组毕赤酵母的2-癸烯酸生物合成研究 |
中链脂肪酸(MCFAs)通常是指由8~10个碳原子组成碳链的脂肪酸, MCFAs广泛应用于化学、医药、食品及化妆品等相关行业[1], MCFAs衍生物可作为合成具有高耐水性、耐用性的生物塑料等聚合物的原材料[2-3], 是非常理想的生物可降解材料。可以用于调节动物营养代谢、提高畜产品品质、降低畜产品微生物污染[4];可以作为添加剂在化妆品中发挥抗氧化的作用等[5]。目前脂肪酸及其衍生化合物的工业生产主要是基于植物油或动物脂肪中提取, 或基于石化合成路线[6]。化石资源的过度使用以及化学合成方法对环境问题有很大影响, 人们将目光转向通过微生物生物合成生产中链脂肪酸[7]。
10-羟基-2-癸烯酸又称10-HDA, 是蜂王酸中特有的一种既含双键又含不饱和键的中链脂肪酸衍生物。分子式为C10H18O3, 常温下是白色粉末状晶体, 性质非常稳定, 研究发现其具有抗菌、抗肿瘤、抗氧化、增强免疫力、调节血糖等重要生理功能, 但由于其提取困难, 合成复杂, 一直未能规模化生产, 严重制约其下游产业的发展[8]。
探索生物合成10-HDA一直为各界学者所关注, 目前研究发现至少要经过脱氢形成双键和对碳链末端进行ω端氧化形成羟基两个过程能合成10-HDA, 本课题组研究发现癸烯酸是重要合成中间物质[9], 虽然在大肠杆菌中已初步探索出合成途径, 但由于细菌对10-HDA有抑制作用, 一直没能实现产量突破, 已知巴斯德毕赤酵母(Pichia pastoris)易于培养操作, 高密度发酵水平很高, 产物易提纯, 表达菌株稳定。利用代谢工程改造酵母生产多不饱和脂肪酸也比较成熟[10]。毕赤酵母属于甲醇营养型酵母, 能在以甲醇为唯一碳源和能源的培养基上生长毕赤酵母没有稳定的附加体质粒, 所以一般用整合型(YIp)载体作为外源基因的表达载体[11]。
因此我们也选择毕赤酵母GS115作为表达细胞。另外, 硫酯酶能催化水解脂酰-ACP和饱和脂肪脂酰链[12], 生物体内的长链脂肪酸分解经过β氧化不断缩短碳链长度, 产生的短链脂肪酸产物需要及时从循环中释放出来, 脂酰辅酶A硫酯酶(acyl-CoA thioesterase)是β氧化途径辅助酶的一种, 在生物体内就发挥着这样的作用[13], 所以, 硫酯酶对中链脂肪酸的积累起着关键作用。我们在GS115的基因组上整合来源大肠杆菌(Escherichia coli)的硫酯酶和过氧化酶体中的脱氢酶基因, 进行基因改造, 利用宿主酵母高蛋白表达率、传代速度快以及发酵周期短、代谢可控的双重优点[14], 以期获得稳定、高产、易收集的胞外游离不饱和中链脂肪酸的重组菌, 进而探索一种安全、无毒害MCFAs的生产新方法, 也利于后面合成像10-HDA等高价值的不饱和羟基脂肪酸的研究。
1 材料与方法 1.1 材料与试剂 1.1.1 菌株、质粒与引物大肠杆菌、热带假丝酵母菌种、毕赤酵母(P.pastoris)GS115菌种保藏于生物基材料与绿色造纸国家重点实验室, 大肠杆菌感受态细胞DH5a购自诺唯赞公司, 质粒载体pGAPZaA购自淼灵生物科技有限公司, 实验所涉及引物见表 1。
| 表 1 本研究所用引物 |
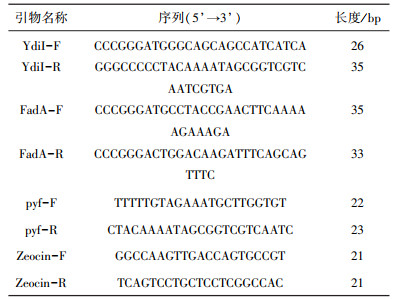 |
1.1.2 培养基
种子培养基采用LBG培养基: 葡萄糖0.5%, 蛋白胨1%, 酵母浸粉0.5%, 氯化钠1%, pH 7.0~7.4。添加25 mg/L的卡那霉素用于质粒维持。
YPD固体培养基: 葡萄糖2%, 蛋白胨2%, 酵母浸粉1%, 琼脂糖2%, 添加100 mg/ml的Zeocin筛选目的菌株。
电转缓冲液: 山梨醇1 M。
菌体复苏培养基: 酵母浸粉1%, 蛋白胨2%, 葡萄糖2%。
发酵培养基: 葡萄糖2%, 蛋白胨2%, 酵母浸粉1%, 癸酸2%, 添加100 mg/ml的Zeocin用于目的菌株维持。
以上培养基均需在高压蒸汽灭菌锅中115 ℃灭菌20 min。
1.1.3 试剂限制性内切酶均购自赛默飞世尔科技(中国)有限公司, Ezup柱式细菌基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、柱式DNA产物纯化试剂盒、DNA Marker均购自生工生物工程(上海)股份有限公司, 高纯度质粒小量快速提取试剂盒购自天根生化科技有限公司, 葡萄糖、酵母浸粉、蛋白胨(均为生化试剂)购自北京奥博星生物技术有限公司。
1.2 实验方法 1.2.1 目的片段的获取提取大肠杆菌(E.coli)和热带假丝酵母(C.tropicalis)的基因组, 从NCBI中的YdiI、FadA基因序列为依据设计引物, 通过PCR技术分别以YdiI-F, YdiI-R为引物、E.coli基因组为模板获得目的基因YdiI;以FadA-F, FadA-R为引物、C.tropicalis基因组为模板获得目的基因FadA。
1.2.2 整合型质粒pGAPZaA-Ydil-FadA的构建对质粒pGAPZaA用限制性内切酶EcoRI、KpnI进行双酶切, 用T4-DNA连接酶连接有相同末端的Ydil基因;同样对质粒pGAPZaA用限制性内切酶XhoI、NotI进行双酶切, 用T4-DNA连接酶连接有相同末端的FadA基因。其中线性化克隆载体、目的片段分别添加2 μL, 加入2 μL 10x T4 DNA Ligase buffer和1 μL Thermo Scientific T4 DNA Ligase, 补加ddH2O至20 μL使用移液枪上下轻轻吹打混匀, 于22 ℃反应10 min。待反应完成后, 用柱纯化试剂盒进行纯化, 接下来进行大肠杆菌感受态的转化, 转化过程如下: 将从-80 ℃冰箱取出的感受态细胞置于装有冰的冰盒中(5~10 min), 将10 μL DNA加入感受态细胞中, 轻轻摇动并在冰上孵育30 min, 将管置于42 ℃水浴中, 经过42 s精确热冲击后立即置于冰水浴中并静置2 min, 向小管中加入500 μL LB培养基, 然后在37 ℃, 200 r/min下孵育1 h, 使细胞复苏, 移取200 μL至涂有Zeocin抗性的平板。放置于37 ℃中培养12~14 h。挑取平板上的单菌落于LB液体培养基中, 在37 ℃培养至混浊。通过质粒小提试剂盒提取质粒, 至此获得整合型质粒pGAPZaA-Ydil-FadA。
1.2.3 酵母感受态细胞的制备挑取酵母单菌落, 接种至含有5 mL YPD培养基的50 mL离心管中, 30 ℃、200 r/min培养过夜。取1 mL的培养物接种至含有50 mL培养基的250 mL三角摇瓶中, 30 ℃、300 r/min培养3 h, 至OD560达到1.3~1.5。将细胞培养物倒入到一个无菌用冰水预冷50 mL的聚丙烯管, 于4 ℃, 5 000 r/min离心5 min, 吸取20 mL的冰预冷的无菌水将菌体沉淀重悬, 离心去上清, 再次用5 mL冰预冷的1 M山梨醇溶液将菌体沉淀重悬, 离心去上清, 最后用1 mL的冰预冷的1 M的山梨醇溶液将菌体沉淀重悬, 重悬液按每管100 μL分装到灭菌的EP管中冷冻保存。
1.2.4 重组酵母工程菌GS115-pGAPZaA-Ydil-FadA的构建提取质粒pGAPZaA-Ydil-FadA, 用限制性内切酶AvrⅡ将其线性化, 并纯化回收, 用乙醇沉淀法浓缩质粒到质粒浓度为100 μg/μL。加入到100 μL的毕赤酵母感受态细胞中, 轻轻混匀, 冰浴5 min后移入冰冷的电转杯中, 1 500 V电击5 ms, 结束后加入600 μL冰预冷的山梨醇溶液和菌体混匀, 转至1.5 mL的EP管中, 30 ℃孵育1 h。将菌体悬液涂布于含Zeocin的YPD平板上, 30 ℃条件下培养3~4 d至有转化子长出[15]。
1.2.5 阳性重组子的筛选与鉴定挑取Zeocin抗性平板上生长出的单菌落, 接种于液体YPD培养基中培养起来, 提取其基因组作为模板DNA, 以设计好的抗性引物Zeocin-F、Zeocin-R进行PCR验证。
1.2.6 发酵培养取活化后重组酵母菌的种子培养液转接于装液量为100 mL发酵培养基的500 mL三角瓶中, 接种量为5%, 30 ℃、200 r/min条件下振荡培养, 每隔12 h取样1 mL并标号, 取样至72 h。
1.2.7 发酵产物结果分析将标准品癸酸、癸烯酸分别配置浓度为0.5 g/L、0.250 g/L、0.125 g/L、0.062 5 g/L, 作为标样与每隔12 h取得发酵液样品, 先进行硅烷化处理再进行气质分析。将1 mL发酵液转入2 mL离心管, 沸水中煮沸15 min, 立即放入-20 ℃环境中15 min。然后加入1 mL乙酸乙酯振荡混匀, 静置一会, 9 000 r/min离心8 min, 将上层有机相吸取于新的1.5 mL管中(注意不要吸到下层菌液), 向上部有机相中加入150 μL NO-双(三甲基硅烷基)三氯乙酰胺, 使用一次性注射器及0.22 μm的有机滤膜将样品打入气相瓶中, 进行气质联动分析[16]。
2 结果与分析 2.1 获取目的片段用提取的大肠杆菌基因组作为模板, 以YdiI-F, YdiI-R为上下游引物进行PCR, 并将产物进行琼脂糖凝胶电泳验证, 验证结果如图 1所示。同样用提取的热带假丝酵母基因组作为模板, 以FadA-F, FadA-R为上下游引物进行PCR, 将产物进行琼脂糖凝胶电泳验证, 验证结果如图 2所示。在图中均出现了目的条带, 且条带单一, 证明基因YdiI、FadA扩增成功且引物特异性较好。
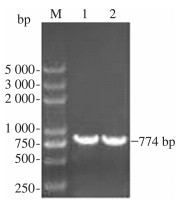 |
| 注: M为DL5000 Marker;1~2泳道为YdiI基因, 长774 bp 图 1 PCR产物电泳图 |
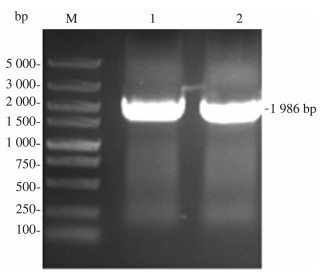 |
| 注: M为DL5000 Marker;1~2泳道为FadA基因, 长1 986 bp 图 2 PCR产物电泳图 |
2.2 整合型质粒pGAPZaA-Ydil -FadA的构建与鉴定
对质粒pGAPZaA分别用限制性内切酶EcoRI、KpnI和XhoI、NotI进行双酶切, 与有相同末端的Ydil、FadA基因进行连接, 质粒重构过程如图 3。
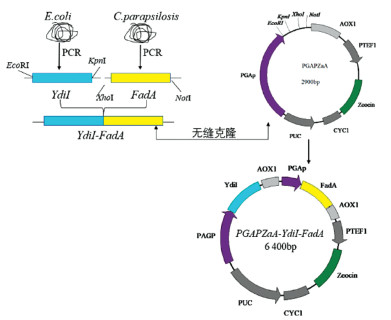 |
| 图 3 质粒构建图 |
连接好的重组质粒, 转入大肠杆菌感受态中, 经抗性筛选出阳性重组菌, 提取质粒。将提取的pGAPZaA-Ydil-FadA质粒用ArvII限制性内切酶线性化, 通过凝胶电泳进行验证, 引物为pyf-F、pyf-R, 获得结果见图 4,条带对应高度为6 000 bp以上, 与理论值6 400 bp相符, 证明质粒构建成功, 并且提取和酶切正确。
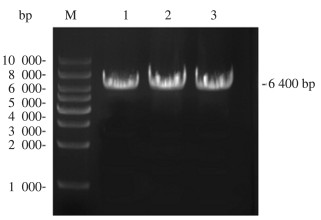 |
| 注: M为DL10000 Marker;1~3泳道为重组质粒pGAPZaA-liu-CoAo, 长6 400 bp 图 4 PCR产物电泳图 |
2.3 重组菌株的构建
将上步获得的质粒电转化到毕赤酵母GS115感受态中, 涂布在含Zeocin抗性的平板上, 3 d后单菌落长出, 挑取单菌落于液体培养基中活化, 并提取酵母基因组, 以其为模板, 以Zeocin-F和Zeocin-R为引物进行PCR, 扩增后的产物进行凝胶电泳后验证其特异性条带的大小, 结果如图 5, 证明重组质粒成功转入GS115中。
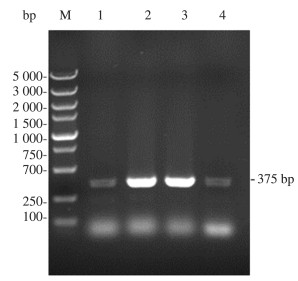 |
| 注: M为DL5000 Marker;1~4泳道为zeocin片段, 长375 bp 图 5 PCR产物电泳图 |
2.4 重组工程菌GS115-pGAPZaA-Ydil -FadA发酵结果
将获得的工程菌GS115-pGAPZaA-Ydil-FadA进行发酵培养, 同时每隔12 h取样, 并做气质联用分析, 结果如图 6, 检测到目的产物2-癸烯酸。证明硫酯酶及脱氢酶在P.pastoris GS115中成功表达, 但分析产物产量发现, 在24 h达到最高为33.7 mg/L, 结果见图 7。36 h及之后并未检测出2-癸烯酸存在, 这可能是由于P.pastoris GS115中存在能够代谢2-癸烯酸的途径, 2-癸烯酸在发酵后期作为碳源通过脂肪酸代谢过程被重新利用。
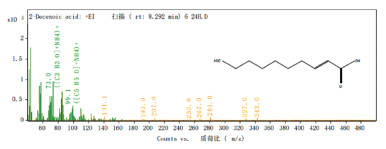 |
| 图 6 气质检测图 |
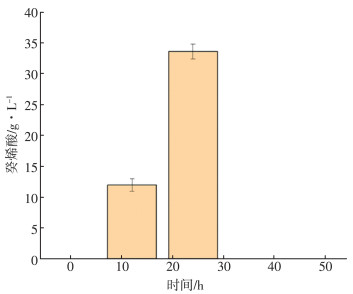 |
| 图 7 不同时间对癸烯酸产量的影响 |
3 结论与展望
本研究对毕赤酵母现有基因表达系统进行了探究与改进, 在此基础上于毕赤酵母中重新构建生物合成2-癸烯酸的代谢途径。利用毕赤酵母GS115为宿主细胞, 以癸酸为底物, 发酵生产癸烯酸。研究了毕赤酵母菌中脂肪酸氧化积累途径中的关键酶——硫酯酶、脱氢酶, 发现硫酯酶和脱氢酶可以在毕赤酵母中正常表达, 在合成不饱和脂肪酸代谢途径中发挥重要作用, 在此基础上, 我们将继续探索提高硫酯酶的活力, 将其在毕赤酵母中高效表达, 最终实现工业化生产。本实验为今后利用毕赤酵母为工程菌生产2-癸烯酸甚至是中长链不饱和脂肪酸打下了坚实的基础[17], 实现了中链脂肪酸在毕赤酵母中的异源合成。目前, 其他探索像在大肠杆菌中合成中链脂肪酸等[18-19]使得生物法合成羟基脂肪酸有了较为深入的研究[20], 本文则助力于深入了解毕赤酵母的特异链长脂肪酸调控机制, 为微生物高效合成各类链长脂肪酸及其衍生物提供重要的理论参考。有望将生物合成癸烯酸应用于工业, 显著提高其应用价值。
| [1] |
KYOUNG-ROK KIM, DEOK-KUN OH. Production of hydroxy fatty acids by microbial fatty acid-hydroxylation enzymes[J]. Biotechnology Advances, 2013, 31(8): 1473-1485. DOI:10.1016/j.biotechadv.2013.07.004 |
| [2] |
SCHEPS D, MALCA S H, RICHTER S M, et al. Synthesis of ω-hydroxy dodecanoic acid based on an engineered CYP153A fusion construct[J]. Microbial Biotechnology, 2013, 6(6): 694-707. DOI:10.1111/1751-7915.12073 |
| [3] |
LIU CHEN, LIU FEI, CAI JIALI, et al. Polymers from fatty acids: poly(ω-hydroxyl tetradecanoic acid) synthesis and physico-mechanical studies[J]. Biomacromolecules, 2011, 12(9): 3291-3298. DOI:10.1021/bm2007554 |
| [4] |
王建军, 王恬. 中链脂肪酸的生物学特性及其在动物生产中的应用[J]. 动物营养学报, 2011, 23(7): 1073-1078. DOI:10.3969/j.issn.1006-267x.2011.07.001 |
| [5] |
常致成. 生物工程在油脂化学工业中的应用(Ⅲ)——中链脂肪酸甘油酯在医药和化妆品中的应用[J]. 中国油脂, 1999(6): 50-52. DOI:10.3321/j.issn:1003-7969.1999.06.023 |
| [6] |
RUPILIUS W, AHMAD S. Palm oil and palm kernel oil as raw materials for basicoleochemicals and biodiesel[J]. European Journal of Lipid Science and Technology, 2010, 109(4): 433-439. DOI:10.1002/ejlt.200600291 |
| [7] |
LIU JINGJING, ZHANG CHUANBO, LU WENYU. Biosynthesis of long-chain ω-hydroxy fatty acids by engineered saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2019, 67(16): 4545-4552. DOI:10.1021/acs.jafc.9b00109 |
| [8] |
奉强, 韩涛, 何冰, 等. 10-羟基-2-癸烯酸合成进展[J]. 成都师范学院学报, 2016, 32(3): 101-107. DOI:10.3969/j.issn.2095-5642.2016.03.101 |
| [9] |
苏静, 王瑞明, 王芬, 等. 一种以癸酸为原料利用大肠杆菌工程菌制备10-羟基-2-癸烯酸的方法: CN109897870A[P]. 2019-06-18.
|
| [10] |
孙美莉, 刘虎虎, 邬文嘉, 等. 代谢工程改造酵母生产多不饱和脂肪酸的研究进展[J]. 化工进展, 2016, 35(3): 872-878. |
| [11] |
杜中军, 朱水芳, 黄文胜, 等. 毕赤酵母外源基因表达系统研究进展[J]. 生物技术通报, 2002(4): 9-13. |
| [12] |
HENRIK TJELLSTR M, MERISSA STRAWSINE, JILLIAN SILVA, et al. Disruption of plastid acyl: acyl carrier protein synthetases increases medium chain fatty acid accumulation in seeds of transgenic arabidopsis[J]. FEBS Letters, 2013, 587(7): 936-942. DOI:10.1016/j.febslet.2013.02.021 |
| [13] |
POIRIER YVES, ANTONENKOV VASILY D, GLUMOFF TUOMO, et al. Peroxisomal beta-oxidation-a metabolic pathway with multiple functions[J]. Biochimica et Biophysica Acta, 2006, 1763(12): 1413-1426. DOI:10.1016/j.bbamcr.2006.08.034 |
| [14] |
HAN XQ, LIU XT, YIN SH. Expression system of pichiapastoris[J]. Microbiol, 2003, 23(4): 35-53. |
| [15] |
高炳淼, 唐天乐, 长孙东亭, 等. 毕赤酵母高效电转化条件的研究[J]. 中国海洋药物, 2010(2): 5-9. |
| [16] |
孙淑慧. 生物合成10-HDA关键酶分子的克隆及工程菌构建研究[D]. 济南: 齐鲁工业大学, 2019.
|
| [17] |
郝昭程, 王腾飞, 李忠奎, 等. 拟南芥硫酯酶基因在毕赤酵母中的表达[J]. 生物工程学报, 2015, 31(1): 115-122. |
| [18] |
肖康. 利用大肠杆菌代谢工程合成中链ω-羟基脂肪酸的研究[D]. 北京: 中国农业科学院, 2017.
|
| [19] |
张希, 杨明, 宋飞, 等. 脂肪酸及其衍生物的抑菌活性[J]. 浙江大学学报(农业与生命科学版), 2013, 39(2): 155-160. |
| [20] |
章霞. 逆向脂肪酸β-氧化途径高效合成中链脂肪酸的研究[D]. 南京: 南京农业大学, 2018.
|
 2021, Vol. 35
2021, Vol. 35


