| 低共熔溶剂体系促进木质纤维素酶解效率的研究进展 |
2003年, Abbott[1]等发现, 尿素(熔点133 ℃)与氯化胆碱(ChCl, 熔点302 ℃)按2:1的摩尔比混合, 然后在80 ℃条件下进行加热后形成了熔点为12 ℃的液体。这种溶剂一般是通过两种或多种不同熔点的固体化合物按照一定的比例混合, 这样不同的化合物之间会形成范德华力、氢键等作用力, 使得晶格结构被破坏, 化合物熔点降低, 称之为低共熔溶剂(Deep eutectic solvent, DES)[2-3]。DES具有低毒性、可生物降解、可再生、成本低、易制备等特点, 同时还兼具离子液体的热稳定性、低挥发性和可设计性等优点[4], 在金属氧化物溶解[5]、酸碱催化反应[6]和生物柴油纯化[7]等领域具有广泛的应用前景。2012年, Francisco等[8]以不同种类有机酸和氯化胆碱为原料合成出多种DES, 首次证实了DES对木质纤维素类生物质的增溶能力。此后, 还发现有些种类的DES对纤维素基本不溶解, 而对木质素的溶解性好。木质素是木质纤维素的三大组分之一, 目前普遍认为木质素是纤维素酶解的抑制剂[9-10]。因此, 去除一定量的木质素既能降低木质素组分的物理屏障作用, 还能够减少木质素对纤维素降解酶的非生产性吸附, 从而提高木质纤维素的酶水解效率。
根据氢键供体(HBD)和氢键受体(HBA)对DES进行分类, 综述了不同种类DES对木质纤维素组分分馏以及对酶解效率的影响。此外, 还将DES预处理与其它现有的工艺强化的结合预处理过程进行综述, 比如微波、超声波和共溶剂等技术, 提高DES对木质纤维素的作用效率。
1 HBD对木质纤维素酶解效率的影响在利用DES预处理木质纤维素的过程中, 已经研究了包括多元醇、酸、酰胺在内的多种HBD。DES的性能因HBD的种类以及同一种类中不同类型的化合物而不同。
1.1 多元醇基DES在木质纤维素预处理过程中, 多元醇基DES已经得到了广泛的应用。多元醇与ChCl组成的DES体系可以与木质素结构中的醚键相互作用, 从而促进木质纤维素中木质素组分的去除[11]。Huang等[12]研究发现, 多元醇基DES预处理后的酶解效率与木质素的去除率呈明显的线性关系。大多数报道中DES体系是因为去除木质素能够增大纤维素的比表面积, 从而在多糖转化中增加酶对纤维素的可及性。目前, 研究较多的多元醇包括甘油和乙二醇。Zulkefli等[13]使用ChCl-甘油和ChCl-乙二醇的DES体系对油棕树进行处理, ChCl-甘油的木质素的去除率最高, 为49%, 但两者的酶解效率均低于30%。Zhang等[14]使用相同的DES体系处理玉米芯, 其木质素提取率约为油棕树的两倍, 分别为71%和88%, 葡萄糖转化率分别达到了96%和85%。导致结果差异的原因可能是不同木质纤维素类型具有不同的顽抗程度造成。Hou等[15-16]制备了多种ChCl-多元醇DES。结果表明, 和短链的二元醇相比, 长烷基链的二元醇对于木质素去除更加有效。作者将这一趋势归因于疏水性的增加, 从而促进了对具有疏水性苯丙酸结构木质素的溶解。
| 表 1 多元醇基DES预处理条件、生物质组分去除率及酶解转化率 |
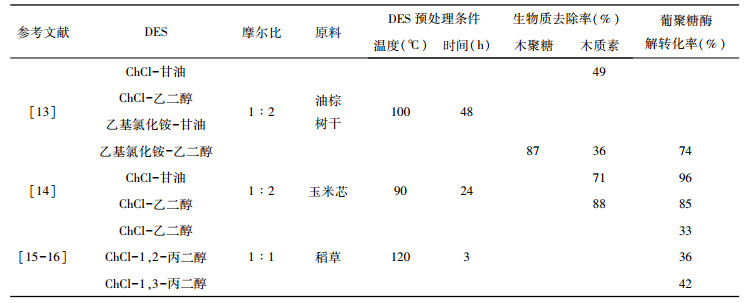 |
1.2 酸基DES
除了醇基DES外, 酸基DES也被广泛的研究。酸基DES中使用的酸通常为有机酸, 具有天然的生物可降解性。有机酸作为HBD与合适的HBA相结合, 使得酸基DES在木质纤维素预处理中的性能优于纯有机酸。Yu等[17]使用酸基DES以及相应的有机酸预处理植物残渣。结果表明, 与纯有机酸处理相比, 酸基DES的木质素和木聚糖去除率分别提高了30%和20%。在四种DES体系中, ChCl-乙醇酸DES体系的木质素和木聚糖去除率最高, 分别为58%和90%, 但纤维素剩余量最少, 只有55%。作者认为, 乙醇酸兼具羧酸和醇的性质, 在木质素和木聚糖去除效果上优于其他几种酸。ChCl-甲酸体系的木质素和木聚糖去除率略低于ChCl-乙醇酸体系, 但其葡萄糖回收率达到了98%, 最终酶解转化率高达98%。
酸基DES表现出良好的生物质分馏性能, 因此研究酸中官能团的作用对于确定适合木质纤维素分馏的酸基HBD具有重要意义。Zhang[14]和Tan[18]等的研究结果表明, 不同官能团的存在对酸基DES的分离效率有很大影响。与一元酸HBD相比, 含一个以上羧基(二元酸或三元酸)的HBD降低了DES的木质素提取率。除了酸中的主要官能团羧基外, 酸中存在的其他化学基团也会影响DES的性能。Hou等[15-16]研究发现, 在80 ℃时, 含氯的2-氯丙酸DES对木聚糖的去除率比含羟基的乳酸DES更高, 分别为54%和19%, 但木质素的去除率相当。说明在酸中存在一个强吸电子基团, 如Cl-, 对半纤维素组分的水解有利。Tan[18]等使用多种酸基DES对油棕果壳进行预处理, 根据木质素提取效率, 由大到小依次为:ChCl-甲酸(62%)、ChCl-乙酸(27%)、ChCl-丙酸(20%)、ChCl-丁酸(14%)。作者将这一趋势归因于烷基对氧的供电子性质, 增强了酸羟基中的氢键强度, 从而使酸的电离强度降低, 形成弱酸。这说明当HBD中存在较长的烷基链时, DES与生物大分子之间的相互作用会减弱。Yu[17]等的研究结果也证明了这一点。因此, 进一步探究不同官能团与生物质之间的相互作用及影响至关重要。
| 表 2 酸基DES预处理条件、生物质组分去除率及酶解转化率 |
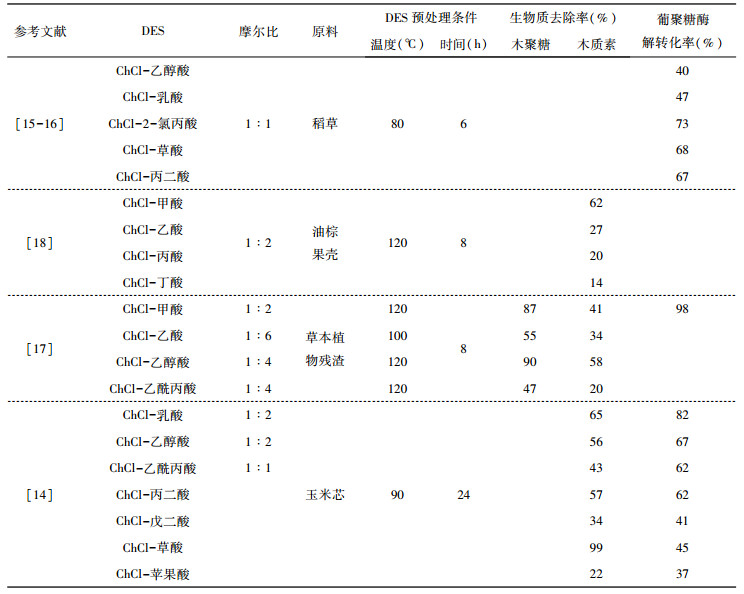 |
1.3 胺基酰胺基DES
胺基和酰胺基DES体系虽然是最早引入的DES体系之一, 但与多元醇基和酸基DES体系相比, 研究的较少。这些碱性DES体系具有中等的生物质分离效率。Pan[19]和Tan[20]等研究发现, ChCl-尿素DES对不同来源生物质(稻草和油棕空果壳)的木质素去除率分别约为45%和34%。除了ChCl-尿素DES外, Hou等[15-16]还使用ChCl-甲酰胺DES对稻草进行处理。结果表明, 两种DES体系的木质素去除率均在46%左右, 酶解转化率都为41%, 均高于未预处理的24%。Zhao等[21]使用多种胺基(单乙醇胺、二乙醇胺和甲基二乙醇胺)和酰胺基(乙酰胺和尿素)DES对麦秸进行预处理。结果表明, 三种胺基DES对生物质的分馏效果均优于酰胺基DES。作者认为, 胺基DES良好的分馏性能与其强碱性有关, 三种胺基DES的pH分别为10.4、10.5和10.9, 而酰胺基DES的pH分别为7.3和8.2。除此以外还发现, 在碱性环境下, 木质素分子中的醚键和半纤维素与木质素之间的酯键更容易断裂, 从而导致大量木质素被去除。在胺基DES中, 单乙醇胺DES去除了生物质中约81%的木质素和47%的木聚糖, 葡萄糖转化率由未预处理的21%提高到为92%。这可能是由于二乙醇胺和甲基二乙醇胺中存在额外的羟乙基, 增加了溶剂的空间位阻, 从而降低分馏效率[22-23], 酶解转化率也低于单乙醇胺。值得注意的是, 与酸基DES类似, 胺基DES具有烷基(甲基)取代的甲基二乙醇胺的分馏效率比二乙醇胺更低。相比于多元醇, 酰胺DES的木质素去除能力更强, 这与木质素是一种碱溶性木质纤维素有关[24], 酰胺具有碱性, 因此会增加木质素的溶解率。但是酸基DES除了能部分去除木质素, 还能去除对酸敏感的半纤维素组分, 因此, 虽然酰胺基DES的木质素去除能力更强, 但是酸基DES对木质纤维素的酶解效率提高程度更大[16]。
| 表 3 胺基酰胺基DES预处理条件、生物质组分去除率及酶解转化率 |
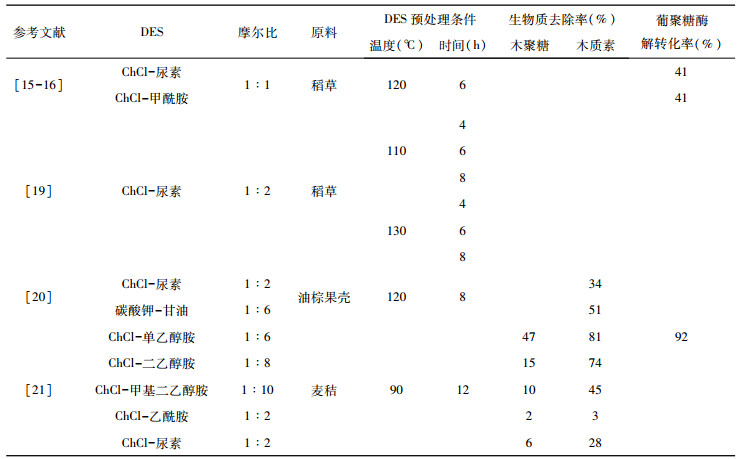 |
2 HBA对木质纤维素酶解效率的影响
除了HBD之外, HBA的选择也会影响DES的性能, 从而影响生物质的分馏效果和木质纤维素的酶解效率。目前, 最常用的HBA是ChCl、甜菜碱、乳酸等物质。与HBD相比, HBA对DES生物质分馏效果的影响研究较少。Liu等[25]使用TEBAC(三乙基苄基氯化铵)-乳酸DES体系对麦秸进行预处理, 结果显示木质纤维素中80%的木质素被脱除, 葡萄糖酶解转化率达到89%, 而未预处理麦秸的转化率只有26%。与ChCl-乳酸体系相比, TEBAC-乳酸预处理所需的时间更短, 温度更低。Zulkefli等[13]使用EAC(乙基氯化铵)代替ChCl作为HBA, 分别与甘油和乙二醇组成DES对油棕树进行预处理。研究发现, 虽然EAC-乙二醇DES只去除了36%的木质素, 但木聚糖的去除率达到87%, 且最终的葡聚糖酶解转化率也高达74%, 而未预处理油棕树的酶解转化率不到30%。作者指出, EAC作为乙基铵盐, 其结构比具有季铵盐结构的ChCl小, 这使得空间位阻较少的EAC可以更好地增溶木质纤维素组分。由于化合物是由各种官能团(吸电子和给电子)组成的, 一些研究中把部分HBD作为HBA使用。Hou[15-16]等以乳酸-乙二醇DES预处理稻草, 对木质素和木聚糖的溶解效率均高于ChCl-乙二醇DES, 且酶解效率由34%提高到了58%。这说明可以为各种不同的应用制备不同DES的多用途组合, 这也是利用DES的初衷, 即为任何预期目标确定最合适的组合。
3 辅助DES预处理促进木质纤维素酶解效率在传统的预处理过程中, 不同的生物质预处理技术经常被结合起来以提高处理效率[26]。同样, DES的木质纤维素预处理方案与其他现有的工艺强化技术如微波、超声波和水热等相结合, 能够大大提高生物质的酶解转化效率。
微波加热是一种非常规加热方法, 通过非电离辐射使植物组织破裂, 从而增加植物细胞内的压力[27]。Liu等[28-29]研究表明, 微波加热不会使生物质发生化学变化, 而是通过将电磁场施加到生物质的分子结构中, 通过介电极化引起分子碰撞, 促使生物质结构发生变化;同时增加DES的分子极性, 使DES组分能更有效地与生物质相互作用。Chen和Wan等[30]将ChCl-乳酸DES预处理与800 W的超快速45 s微波加热相结合, 对玉米秸秆、柳枝稷和芒草进行预处理。预处理后木聚糖的去除率在77%~90%之间, 木质素去除率在65%~80%之间。经预处理的玉米秸秆和柳枝稷的葡萄糖产率分别为79%和75%, 相较于未预处理原料, 柳枝稷的产糖量增加了5倍, 玉米秸秆的产糖量增加了2倍。
除了微波加热外, 超声波也是一种常用的过程强化技术。超声波振动会在反应混合物中产生空化作用, 当空化气泡在生物质表面附近坍塌时, 压力和温度升高, 从而更有效地破坏细胞壁。与微波的辅助作用类似, 超声辅助DES预处理提高了效率, 缩短了处理时间。Malaeke等[31]使用ChCl-间二苯酚DES, 在90 ℃的超声波辅助条件下探究木质素的溶解度。预处理20 min后, 木质素溶解度达到48%。
水热预处理是使用水作为溶剂在高温高压环境下破坏生物质的细胞壁[32]。Fang等[33]在DES处理枣椰渣之前, 先通过水热预处理来降低其顽抗性。在连续水热(200 ℃、10 min)和DES预处理(70 ℃、6 h)后, 去除了枣椰渣中22%的木质素和25%的半纤维素。虽然木质素和半纤维素的去除量较低, 但纤维素在生物质固体中的保留率均在90%以上, 且葡聚糖酶解转化率从44%提高到了74%。作者认为, 水热预处理破坏细胞壁, 使木质素和木聚糖分解成小碎片。
除了上述辅助方法外, Chen [34]还设计了一种通过使用H2SO4酸化溶剂来提高ChCl-乙二醇处理效率的新方法。在DES中加入1.0%的H2SO4, 酸化的DES预处理对柳枝稷中半纤维素和木质素的去除率分别达到了82%和87%, 而纯DES预处理的木质素去除率只有24%。由于木质素和半纤维素组分被溶解的多, 酸化DES预处理后生物质中的葡萄糖转化率达到86%。相比之下, 纯DES预处理生物质的葡萄糖转化率仅有11%。
4 结语与展望DES在木质纤维素原料组分分馏和促进酶解等方面表现出良好的性能, 且本身易制备、毒性低、可生物降解, 是木质纤维素预处理的一种理想溶剂。科研工作者们探究了不同种类DES体系对生物质组分分馏的影响及一些影响因素, 提出了木质纤维素各组分在DES分馏中的可能机理, 并进一步将DES预处理与多种工艺强化技术相结合, 提高了生物质组分的分离效率和葡聚糖酶解转化效率。然而, 想要得到理想的DES转化方式, 仍有许多问题急需进一步探究。木质纤维素原料的来源广泛, 需要根据原料结构特性设计合理的组分搭配及预处理过程, 以提高目标产物的得率;分析DES体系对木质纤维素结构及酶解效率的影响, 确定DES的作用机理;在大量实验结果的基础上, 辅助以化学计算和分子模拟等手段, 深入地研究DES体系组成对木质纤维素组分分馏和酶解效率的影响机理, 为寻找更加环保、高效的溶解体系奠定理论基础, 对指导生物质精炼的工业化进程具有重要的意义。
| [1] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications (Cambridge, England), 2003(1): 70-71. DOI:10.1039/b210714g |
| [2] |
ABBOTT A P, BOOTHBY D, CAPPER G, et al. Deep eutectic solvents formed between choline chloride and carboxylic acids:Versatile alternatives to ionic liquids[J]. Journal of the American Chemical Society, 2004, 126(29): 9142-9147. DOI:10.1021/ja048266j |
| [3] |
侯玉翠, 王震, 任树行, 等. 低共熔溶剂在混合物分离中的应用[J]. 科学通报, 2015, 60(26): 2490-2499. |
| [4] |
CARRIAZO D, GUTIERREZÉ M C, Ferrer M L, et al. Resorcinol-based deep eutectic solvents as both carbonaceous precursors and templating agents in the synthesis of hierarchical porous carbon monoliths[J]. Chemistry of Materials, 2010, 22(22): 6146-6152. DOI:10.1021/cm1019684 |
| [5] |
RASHEED R K, SHIKOTRA P, ABBOTT A P, et al. Selective extraction of metals from mixed oxide matrixes using choline-based ionic liquids[J]. Inorganic Chemistry, 2005, 44(19): 6497-6499. DOI:10.1021/ic0505450 |
| [6] |
HU P, WANG Y, MENG X, et al. Isobutane alkylation with 2-butene catalyzed by amide-AlCl3-based ionic liquid analogues[J]. Fuel, 2017, 189: 203-209. DOI:10.1016/j.fuel.2016.10.099 |
| [7] |
GUO W, HOU Y, WU W, et al. Separation of phenol from model oils with quaternary ammonium salts via forming deep eutectic solvents[J]. Green Chemistry, 2013, 15(1): 226-229. |
| [8] |
FRANCISCO M, BRUINHORST A V D, KROON M C. New natural and renewable low transition temperature mixtures (LTTMs):Screening as solvents for lignocellulosic biomass processing[J]. Green Chemistry, 2012, 14(8): 2153-2157. DOI:10.1039/c2gc35660k |
| [9] |
BHAGIA S, LI H, GAO X, et al. Flowthrough pretreatment with very dilute acid provides insights into high lignin contribution to biomass recalcitrance[J]. Biotechnology for Biofuels, 2016(9): 245-260. |
| [10] |
DUMITRACHE A, TOLBERT A, NATZKE J, et al. Cellulose and lignin colocalization at the plant cell wall surface limits microbial hydrolysis of populus biomass[J]. Green Chemistry, 2017, 19(9): 2275-2285. DOI:10.1039/C7GC00346C |
| [11] |
司马国宝, 王帅, 崔莹, 等. 低共熔溶剂对木质纤维素分离及木质素提取的研究进展[J]. 现代化工, 2019, 39(9): 26-30. |
| [12] |
HUANG C, ZHAO C, LI H, et al. Comparison of different pretreatments on the synergistic effect of cellulase and xylanase during the enzymatic hydrolysis of sugarcane bagasse[J]. Rsc Advances, 2018, 8(54): 30725-30731. DOI:10.1039/C8RA05047C |
| [13] |
ZULKEFLI S, ABDULMALEK E, ABDUL RAHMAN M B. Pretreatment of oil palm trunk in deep eutectic solvent and optimization of enzymatic hydrolysis of pretreated oil palm trunk[J]. Renewable Energy, 2017(107): 36-41. |
| [14] |
ZHANG C, XIA S, MA P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents[J]. Bioresource Technology, 2016, 219: 1-5. DOI:10.1016/j.biortech.2016.07.026 |
| [15] |
HOU X, LIN K, LI A, et al. Effect of constituent molar ratios of deep eutectic solvents on rice straw fractionation efficiency and themicro-mechanism investigation[J]. Industrial Crops and Products, 2018(120): 322-329. |
| [16] |
HOU X, LI A, LIN K, et al. Insight into the structure-function relationships of deep eutectic solvents during rice straw pretreatment[J]. Bioresource Technology, 2018(249): 261-267. |
| [17] |
YU Q, ZHANG A, WANG W, et al. Deep eutectic solvents from hemicellulose-derived acids for the cellulosic ethanol refining of Akebia' herbal residues[J]. Bioresource Technology, 2017(247): 705-710. DOI:10.1016/j.biortech.2017.09.159 |
| [18] |
TAN Y T, NHOH G C, CHUA A S M. Effect of functional groups in acid constituent of deep eutectic solvent for extraction of reactive lignin[J]. Bioresource Technology, 2019(281): 359-366. |
| [19] |
PA NM, ZHAO G, DING C, et al. Physicochemical transformation of rice straw after pretreatment with a deep eutectic solvent of choline chloride/urea[J]. Carbohydrate Polymers, 2017(176): 307-314. |
| [20] |
TAN Y T, NGOH G C, CHUA A S M. Evaluation of fractionation and delignification efficiencies of deep eutectic solvents on oil palm empty fruit bunch[J]. Industrial Crops and Products, 2018(123): 271-277. |
| [21] |
ZHAO Z, CHEN X, ALI M F, et al. Pretreatment of wheat straw using basic ethanolamine-based deep eutectic solvents for improving enzymatic hydrolysis[J]. Bioresource Technology, 2018(263): 325-333. |
| [22] |
LIU Q P, HOU X D, LI N, et al. Ionic liquids from renewable biomaterials:Synthesis, characterization and application in the pretreatment of biomass[J]. Green Chemistrtry, 2012, 14(2): 304-307. DOI:10.1039/C2GC16128A |
| [23] |
SANTIS S D, MASCI G, CASCIOTTA F, et al. Cholinium-amino acid based ionic liquids:a new method of synthesis and physico-chemical characterization[J]. Physical Chemistry Chemical Physics, 2015(17): 20687-20698. |
| [24] |
ADLER E. Lignin chemistry-past, present and future[J]. Wood Science and Technology, 1977, 11(3): 169-218. DOI:10.1007/BF00365615 |
| [25] |
LIU Y, ZHENG J, XIAO J, et al. Enhanced enzymatic hydrolysis and lignin extraction of wheat straw bytriethylbenzyl ammonium chloride/lactic acid-based deep eutectic solvent pretreatment[J]. ACS Omega, 2019, 4(22): 19829-19839. DOI:10.1021/acsomega.9b02709 |
| [26] |
MENON V, RAO M. Trends in bioconversion of lignocellulose:Biofuels, platform chemicals and biorefinery concept[J]. Progress in Energy and Combustion Science, 2012, 38(4): 522-550. DOI:10.1016/j.pecs.2012.02.002 |
| [27] |
LIEW S Q, NGOH G C, YUSOFF R, et al. Sequential ultrasound-microwave assisted acid extraction (UMAE) of pectin from pomelo peels[J]. International Journal of Biological Macromolecules, 2016(93): 426-435. |
| [28] |
LIU Y, CHEN W, XIA Q, et al. Efficient cleavage of lignin-carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent[J]. ChemSusChem, 2017, 10(8): 1692-1700. DOI:10.1002/cssc.201601795 |
| [29] |
LIU Y, GUO B, XIA Q, et al. Efficient cleavage of strong hydrogen bonds in cotton by deep eutectic solvents and facile fabrication of cellulose nanocrystals in high yields[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(9): 7623-7631. |
| [30] |
CHEN Z, WAN C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment[J]. Bioresource Technology, 2017(250): 532-537. |
| [31] |
MALAEKE H, HOUSAINDOKHT M R, MONHEMI H, et al. Deep eutectic solvent as an efficient molecular liquid for lignin solubilization and wood delignification[J]. Journal of Molecular Liquids, 2018(263): 193-199. |
| [32] |
SAHA B C, YOSHIDA T, COTTA M A, et al. Hydrothermal pretreatment and enzymatic saccharification of corn stover for efficient ethanol production[J]. Industrial Crops and Products, 2013(44): 367-372. |
| [33] |
FANG C, THOMSEN M H, FRANKAER C G, et al. Reviving pretreatment effectiveness of deep eutectic solvents on lignocellulosic date palm residues by prior recalcitrance reduction[J]. Industrial & Engineering Chemistry Research, 2017, 56(12): 3167-3174. |
| [34] |
CHEN Z, BAI X, LUSI A, et al. High-solid lignocellulose processing enabled by natural deep eutectic solvent for lignin extraction and industrially relevant production of renewable chemicals[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(9): 12205-12216. |
 2020, Vol. 34
2020, Vol. 34


