| 氨基葡萄糖微生物合成研究进展 |
2. 山东省微生物工程重点实验室, 济南 250353;
3. 诸城东晓生物科技有限公司, 诸城 262200
2. Shandong Key Laboratory of Microbial Engineering, Jinan 250353, China;
3. Zhucheng Dongxiao Biotechnology Co Ltd, Zhucheng 262200, China
氨基葡萄糖是一种重要的功能单糖, N-乙酰氨基葡萄糖是氨基葡萄糖乙酰化的产物, 两者在生物体的生长过程中起着重要的作用。此外, 氨基葡萄糖还是组成黏膜分泌物、结缔组织、皮肤、肌腱、韧带和软骨等必不可少的成分[1-2]。如氨基葡萄糖在治疗软骨骨性关节炎方面有着良好的作用[3], 对肝癌细胞的生长有一定的抑制作用[4]。由于氨基葡萄糖与N-乙酰氨基葡萄糖存在广泛的市场, 进一步开发相关产品的研究势在必行。
氨基葡萄糖的生产方式一般有3种, 即甲壳素水解法、生物酶转化法与微生物发酵法。甲壳素水解法会产量大量的环境污染物, 而且其原料会受到地域和季节的限制;生物转化法生产氨基葡萄糖增加了企业的生产成本, 不适用于工业化生产[5-6];微生物发酵法作为最有潜力的生产方式, 基本克服了以上两种生产方式的缺点, 具有短发酵时间, 高生产效率, 较小的环境污染力度的优点。用于发酵的微生物可以根据生产的需求对其代谢途径进行改造来提高氨基葡萄糖的产量[7]。
在微生物中生成氨基葡萄糖与N-乙酰氨基葡萄糖的关键酶主要是氨基葡萄糖合成酶(GlmS)与氨基葡萄糖乙酰化酶(Gna1)。枯草芽孢杆菌生成GlcN的代谢途径如图 1所示。首先, 胞外的葡萄糖(Glc)在PTS系统或葡萄糖激酶GlcK的作用下生成葡萄糖-6-磷酸(Glc-6P), 并在磷酸异构酶(Pgi)的催化下进一步生成果糖-6-磷酸(Fru-6P)。Fru-6P也可以由果糖激酶(GmuE)催化果糖生成, 但是由于果糖的生成成本较高, 因此一般以Glc为底物生成Fru-6P, 随后Fru-6P在GlmS与YbcM的催化作用下生成GlcN。GlcNAc则由Gna1继续催化GlcN生成。细胞外的GlcN与GlcNAc可以在NagP(PTS系统中的N-乙酰氨基葡萄糖特异性转运蛋白蛋白)的辅助作用下转运到细胞内被吸收利用。工业生产中通常将GlcNAc进行弱酸处理脱乙酰化后生成氨糖。由于运送到细胞外的GlcN和GlcNAc可以被细胞再次吸收利用, 为了提高氨糖的产量必须对细胞的相关代谢途径进行改造[6]。
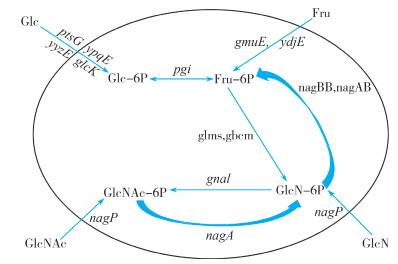 |
| 注: Glc:葡萄糖;Fru:果糖;GlcN:氨基葡萄糖; GlcNAc:乙酰氨基葡萄糖;Glc-6P:6-磷酸葡萄糖;Fru-6P:6-磷酸果糖;GlcN-6P:6-磷酸氨基葡萄糖; GlcNAc-6P:6-磷酸-N-乙酰氨基葡萄糖;ptsG、ypqE、yyzE、glcK:转运葡萄糖的蛋白;gmuE、ydjE:转运果糖的基因;pgi:6-磷酸葡萄糖异构酶基因;nagBB、nagAB:6-磷酸氨基葡萄糖脱氨酶;glms、ybcM:氨基葡萄糖合成酶基因;gna1:乙酰氨基葡萄糖合成酶基因;nagA:6-磷酸-N-乙酰氨基葡萄糖脱乙酰酶;nagP:PTS系统-N-乙酰氨基葡萄糖特异性转运蛋白。 图 1 GlcN与GlcNAc在枯草芽孢杆菌中主要代谢途径 |
1 微生物合成氨基葡萄糖的研究进展 1.1 大肠杆菌合成GlcN的研究进展
Deng等[5]在过表达GlmS的基础上对原始蛋白进行突变, 突变后得到了一株消除产物抑制的工程菌株, 使GlcN的产量达到了17 g/L;随后在前面研究的基础上将Gna1进行过表达, 发酵72 h后使得GlcNAc的产量达到了110 g/L。
陈欣[8]首先将来自大肠杆菌的GlmS基因与来自于酿酒酵母的Gna1基因在E.coli ATCC 25947(DE3)过表达后, 随后敲除了乙酰氨基葡萄糖磷酸转运子编码基因nagE, 甘露糖磷酸转运子编码基因manX, 基因ptsG和丙酮酸激酶编码因子pykF, 最后过表达了葡萄糖激酶基因glk与半乳糖苷透性酶基因GalP;采用葡萄糖分阶段流加策略与分阶段溶氧控制策略使氨基葡萄糖总产量达到了132.43 g/L。
董瑞真等[6]使葡糖胺-1-磷酸尿苷酰转移酶/葡糖胺-1-磷酸乙酰转移酶双功能基因GlmU蛋白中的葡糖胺-1-磷酸乙酰转移酶功能域失活后进行发酵20 h使得氨基葡萄糖的产量提高为1049.6 mg/L, 是原始菌株的10倍。温朝等[9-10]将GlmS的特定位点进行饱和突变后将GlcN的产量较原始菌株提高到了1.45 g/L。周丁等[11]还对GglmS核糖开关进行研究, 进一步阐释了GlcN-6P抑制GlmS的机理, 认为产物的积累会导致GlmS的酶量降低。
1.2 枯草芽孢杆菌中GlcN的生产研究进展随着人们安全意识的增强, 当下比较流行的氨基葡萄糖生产菌株是枯草芽孢杆菌。刘延峰[12]以枯草芽孢杆菌168作为出发菌株, 将基因Glms与基因gna1进行过表达, 实现了GlcNAc在枯草芽孢杆菌中的积累, 达到了240 mg/L;在此基础上敲除了GlcNAc从细胞外转运到细胞内的相关基因nagP, GlcNAc-6-P脱乙酰酶(NagA)和GlcN-6-P脱氨基酶(GamA和NagB)的编码基因使GlcNAc的产量达到了1.85 g/L;随后通过合成生物学的理性设计将GlmS和Gna1以1:2的比例被DNA介导支架结构固定在空间上相互靠近的位置;并且利用动态代谢组学方法预测在枯草芽孢存在使GlcNAc6P和GlcNAc之间的耗能性无效循环途径[13], 随后敲除GlcNAc-6-P与胞内GlcNAc之间无效循环的关键基因glcK, 最终使得GlcNAc的产量达到31.65 g/L。
徐小芳[14]在枯草芽孢杆菌内过表达了不同来源的GlmS和Gna1, 并对不同来源的GlmS和Gna1进行动力学分析, 结果发现来源于枯草芽孢杆菌的GlmS对双底物谷氨酰胺Gln与Fru-6P具有较高的催化效率和亲和力, 来源于秀丽隐杆线虫的Gna1蛋白对底物由较高的底物亲和力和催化效率。在枯草芽孢杆菌内共表达上述两种外源基因时GlcNAc的产量达到24.23 g/L。
Wu等[15]采用CRISPRi的调控方法提供了一种简单、有效且通用的方式来促进微生物细胞工厂协同利用多种碳源, 提高了GlcNAc的滴度和生产率。GuYang等[16]为了提高GlcNAc的生产率, 针对枯草芽孢杆菌的中央碳和氧化还原代谢进行了重新编程, 最终减少了溢出的乙酰辅酶A通量并消除了副产物的形成, 从而提高碳和能源利用效率, 使得转化率从0.115 g GlcNAc/1g Glc提高到0.468 GlcNAc/1g Glc, 产量达到理论途径产量的98%。
1.3 其它微生物合成GlcN的研究进展王雅婷[17]使用谷氨酸棒状杆菌来进行GlmS与Gna1的异源表达, 并导致了乙酰氨糖消耗途径与乳酸的合成途径, 发酵生产的N-乙酰氨基葡萄糖产量达到了2.23 g/L。但是大肠杆菌与枯草芽孢杆菌目前还是生产氨糖的主要模式菌株。
2 展望氨基葡萄糖的生产主要依赖于微生物发酵法, 此法相比较于酶法和几丁质法具有很多的优势。此法的操作理论主要是一方面过表达氨基葡萄糖合成酶GlmS和乙酰氨基葡萄糖合成酶Gna1;另一方面阻断旁支代谢途径的酶, 把GlcN与GlcNAc从细胞外转运到细胞内的相关蛋白失活;还有就是针对GlmS做突变, 通过增加其自身的酶活来提高氨糖的产量。除此之外, 微生物发酵过程中发酵条件的优化, 比如碳源的添加方式、分阶段DO的控制以及发酵温度的调控都会对氨糖的积累产生影响[18], 这些策略可以降低乙酸的生成量[19-20]。其次, 开发微生物动态代谢调控元件以及理性设计调控方式对于氨基葡萄糖等重要功能营养品的开发是一种新的思路[21]。
微生物发酵生产氨基葡萄糖还有很多的思路, 比如细胞中的某些膜蛋白可能会抑制GlmS与Gna1的表达活性, 敲除这些基因来进一步提高氨糖的产量;此外, 还可以针对Gna1蛋白的关键氨基酸做饱和突变来提高其与底物的亲和力, 从而提高GlcNAc的产量。总之, 代谢途径的理性设计、关键蛋白的深入研究以及细胞自身调控元件的开发都将使氨糖的产量达到一个新的高度。
| [1] |
秦志杰, 岳秋林, 刘新利. 产N-乙酰氨基葡萄糖的工程菌构建、发酵及应用研究进展[J]. 中国酿造, 2018, 37(6): 6-9. |
| [2] |
涂宇鹏, 何京桦, 乐科易, 等. 大肠杆菌BL21(DE3)氨基葡萄糖代谢调控相关基因的敲除及GlmS在其中的表达研究[J]. 复旦学报(自然科学版), 2012, 51(6): 796-802. |
| [3] |
YAMAGISHI Y, SOMEYA A, IMAI K, et al. Evaluation of the anti-inflammatory actions of various functional food materials including glucosamine on synovial cells[J]. Molecular Medicine Reports, 2017, 16(2): 1353-1359. DOI:10.3892/mmr.2017.6691 |
| [4] |
刘佃磊, 李丕武, 李瑞瑞, 等. 高产氨基葡萄糖基因工程菌的研究进展[J]. 生物技术通报, 2014(3): 36-41. |
| [5] |
DENG M D, SEVERSON D K, GRUND A D, et al. Metabolic engineering of Escherichia coli for industrial production of glucosamine and N-acetylglucosamine[J]. Metabolic Engineering, 2005, 7(3): 201-214. DOI:10.1016/j.ymben.2005.02.001 |
| [6] |
董瑞真, 李丕武, 石凤, 等. GlmU基因单功能敲除对大肠杆菌生产氨基葡萄糖的影响[J]. 中国酿造, 2018, 37(4): 23-27. |
| [7] |
牛腾飞, 李江华, 堵国成, 等. 微生物法合成N-乙酰氨基葡萄糖及其衍生物的研究进展[J]. 食品与发酵工业, 2020, 46(1): 274-279. |
| [8] |
陈欣.代谢工程改造大肠杆菌发酵生产氨基葡萄糖及过程优化与控制[D].无锡: 江南大学, 2012.
|
| [9] |
李丕武, 温朝, 汪俊卿, 等.一种大肠杆菌内氨基葡萄糖合酶表达活性的检测方法: CN110129411A[P].2019-08-16.
|
| [10] |
温朝.GlmS酶活力改造及对大肠杆菌产氨基葡萄糖的影响研究[D].济南: 齐鲁工业大学, 2019.
|
| [11] |
周丁, 王倩, 祁庆生. GlmS核糖开关研究进展[J]. 微生物学报, 2017, 57(8): 1152-1159. |
| [12] |
刘延峰.代谢工程改造枯草芽孢杆菌高效合成N-乙酰氨基葡萄糖[D].无锡: 江南大学, 2015.
|
| [13] |
LIU Y F, LINK H, LIU L, et al. A dynamic pathway analysis approach reveals a limiting futile cycle in N-acetylglucosamine overproducing bacillus subtilis.[J]. Nature Communications, 2016, 7: 1-9. |
| [14] |
徐小芳.乙酰氨基葡萄糖合成关键酶GlmS和Gna1的筛选及催化动力学分析[D].无锡: 江南大学, 2016.
|
| [15] |
WU Y K, CHEN T C, LIU Y F, et al. CRISPRi allows optimal temporal control of N-acetylglucosamine bioproduction by a dynamic coordination of glucose and xylose metabolism in Bacillus subtilis[J]. Metabolic Engineering, 2018, 49: 232-241. |
| [16] |
GU Y, LV X Q, LIU Y F, et al. Synthetic redesign of central carbon and redox metabolism for high yield production of N-acetylglucosamine in Bacillus subtilis[J]. Metabolic Engineering, 2019, 51: 59-69. |
| [17] |
王雅婷.生物法合成N-乙酰氨基葡萄糖[D].北京: 北京化工大学, 2016.
|
| [18] |
戴维, 秦宝福, 张锐, 等. 温度对乙酰氨基葡萄糖发酵的影响[J]. 山东化工, 2018, 47(10): 14-17. DOI:10.3969/j.issn.1008-021X.2018.10.006 |
| [19] |
吴首标. 重组大肠杆菌发酵过程中乙酸的控制方法研究[J]. 临床医药文献电子杂志, 2019, 6(31): 197. |
| [20] |
刘兆巍, 薛亚平, 郑裕国. 重组大肠杆菌发酵过程中乙酸的控制[J]. 发酵科技通讯, 2014, 43(2): 21-26. |
| [21] |
GU Y, XU X H, WU Y K, et al. Advances and prospects of Bacillus subtilis cellular factories:from rational design to industrial applications[J]. Metabolic Engineering, 2018, 50: 109-121. |
 2021, Vol. 35
2021, Vol. 35


