| 生物碱类中药成分微生物转化研究进展 |
微生物转化是指利用微生物产生的酶或者微生物本身将底物转化为产物的过程[1]。与化学转化相比, 微生物转化具备专一性强、条件温和、副产物少、环境友好等优势[2]。中药资源是国家战略性资源, 中药使用在我国拥有悠久的历史[3]。将微生物转化技术与中药炮制相结合, 可以解决中药使用中水溶性差、毒性强、活性低、资源短缺等问题[4]。因此, 微生物转化技术符合中药现代化发展的需求[5]。
生物碱类物质是中药中一类重要的天然活性化合物[6]。生物碱是存在于自然界中的一类含氮的有机化合物(主要存在于植物, 少数来源于动物), 有较复杂的环状结构, 多呈碱性, 大多具有生理活性, 如镇痛、抗菌消炎、止咳平喘、抗癌等作用[7]。当前, 生物碱类中药研究的热点之一是利用微生物转化生物碱类化合物, 进行结构修饰或生成新的药效成分[8]。本文主要介绍几种常见的生物碱类代表化合物的微生物转化菌种、反应酶、生化反应类型、生物转化后的药效以及该类化合物常见的检测方法等方面的研究进展。
1 微生物转化在生物碱类中药中的应用 1.1 小檗碱类生物碱微生物转化小檗碱, 常用名黄连素, 属于异喹啉类生物碱, 是黄连类中草药中主要活性成分, 被广泛应用于治疗肠道感染、降糖、降脂及抗肿瘤中[9-11]。近年来, 小檗碱又成为创新药物研究关注的重点, 受到了国内外学者的广泛关注[12]。
小檗碱在使用过程中口服吸收差, 致使生物利用度很低, 通过生物转化可以克服以上缺点。小檗碱具有独特的异喹啉类官能团骨架结构与共轭体系, 微生物可对小檗碱官能团不同的结构位点进行修饰, 得到新的结构衍生物, 此举不仅有利于使其产生新的活性, 而且有益于增强生物利用度, 使小檗碱在清热解毒以及肿瘤, 糖尿病等多发病的临床治疗中发挥重要作用[13-14]。小檗碱被不同微生物转化后的代谢产物有多种, 如土壤细菌鞘脂菌Sphingobium sp.BD3100将小檗碱转化为11-羟基小檗碱[15]; 红球菌Rhodococcus sp.BD7100将小檗碱转化为2, 3-去亚甲基小檗碱[16]; 节杆菌Arthrobacter sp.GBD-1、伯克霍尔德菌Burkholderia sp.CJ1将小檗碱转化为2, 3-去亚甲基小檗碱[17]。其中代谢产物2, 3-去亚甲基小檗碱是小檗碱类生物碱中最有效的拓扑异构酶Ⅰ抑制剂, 在抗肿瘤治疗中发挥着重要作用, 但相比于小檗碱而言, 其抗菌及降糖活性有所降低。随着研究的深入, 研究人员发现一些肠道微生物也能够生物转化小檗碱, 例如从大鼠肠道中分离到的变形杆菌属BM1和BM2菌株可将小檗碱转化为小檗红碱、药根碱、非洲防己碱、唐松草分定和2, 3-去亚甲基小檗碱[13], 代谢产物小檗红碱的抗肿瘤活性相比于小檗碱有所提高, 非洲防己碱能够抑制转移性的骨肉瘤细胞U2OS的增殖以及形成新生血管, 唐松草分定具有抗菌、抗氧化作用[18]; 另有研究表明, 大鼠肠道内的菌群可以将小檗碱转化为二氢小檗碱, 使其易被肠组织吸收[19]。
研究人员对小檗碱微生物转化的酶学机制进行研究, 发现去甲基化酶或具有类似功能的代谢酶可能是肠道微生物转化小檗碱过程中起重要作用的酶, 其中研究最为深入的是催化生成2, 3-去亚甲基小檗碱的酶—细胞色素P450(CYP450)[20]。CYP450作为一种生物体中常见的药物代谢催化酶, 能够将具有亚甲二氧基的苯基化合物进行去亚甲基催化[21], 而小檗碱C2、C3位具有典型的亚甲二氧苯基结构, 因此CYP450是代谢具有亚甲二氧基结构的小檗碱类生物碱的关键酶[22]。
微生物转化技术产生了新的药效成分, 不仅解决了小檗碱类生物碱利用率低问题, 而且还能增强其药理活性, 产生了更高的研究价值[23]。随着对微生物中小檗碱类催化酶研究的不断深入, 小檗碱类生物碱的微生物转化途径变得清晰, 同时获得多个具有新型生物活性的转化产物, 使小檗碱类生物碱具有广泛的应用前景。但现阶段的微生物转化小檗碱类化合物研究大多停留在实验室阶段。现如今, 微生物转化技术在中药炮制中的优势逐渐被业界认可, 在未来的研究工作中, 小檗碱微生物转化研究中高效的菌种、稳定的转化体系、限速酶的挖掘是发展的主要方向[24]。
1.2 喜树碱类生物碱微生物转化癌症是影响居民健康甚至夺去人们宝贵生命的疾病, 近年来, 我国癌症整体发病率居高不下, 因此研制抗癌药物刻不容缓[25]。但在化学合成药物的研发过程中, 往往伴随着高成本、长周期、高失败率等一系列问题, 而且化学药物在临床中可能出现毒副作用及耐药性等问题, 所以研究人员着手从中药中提取有效成分, 开发新的抗癌药物并投入临床应用[26]。喜树(Camptotheca acuminata), 为中国所特有的珙桐科乔木植物, 是南方主要造林树种之一。喜树中含有抗癌作用的生物碱, 由该类生物碱及衍生物所制成的药物有着较好抗癌疗效, 被广泛的应用于临床中, 具有极高的医用价值。
喜树碱(Camptothecin, CPT)是一种从中药喜树中分离得到的萜类吲哚生物碱[27], 最早由Wall等[28]从喜树的茎部分离得到, 喜树碱及其衍生物通过特异性地阻断拓扑异构酶I(Topo I)的合成来发挥抗癌作用。喜树碱对肝癌、胃癌、膀胱癌等有良好抗癌活性, 成为继紫杉醇后又一具有较好发展前景的植物来源的抗癌药[29]。但是喜树中喜树碱含量极低, 不容易获得, 造成喜树碱抗癌药物的短缺; 大量砍伐喜树, 不仅满足不了药物的需求, 还会造成自然环境的破坏和不合理的资源利用。因此开发获取喜树碱的新途径, 就成为现在急需解决的问题。
药用植物中的普遍生活着内生真菌, 这些内生真菌是重要的药用资源, 成为解决生物活性物质特别是抗癌药物短缺的一条重要途径。研究人员从喜树中广泛分离筛选产生喜树碱的内生真菌, 并进行发酵、代谢产物分析检测。盛贻林等[27]从喜树的组织中分离筛选得到15株纯化真菌, 通过摇瓶发酵, 以及TLC法与HPLC法对其菌丝体提取物进行分析, 发现有1株菌株能够产生喜树碱, 其喜树碱产量可达227 μg/L; 刘开辉等[29]从秦巴山区喜树中分离得到一株喜树碱内生真菌M-20(实验室编号), 形态特征和基因序列分析显示, 菌株M-20属于Xylaria真菌, 其喜树碱产量为233.3 μg/L; 李霞等[30]从喜树中分离得到了大约50种菌株, 其中一株产喜树碱的菌株通过形态学鉴定为青霉属, 这是首次在喜树植物中发现产喜树碱的青霉属菌株。
10-羟基喜树碱(HCPT)是喜树碱分子10位碳原子上的氢被羟基取代后的喜树碱衍生物, 同喜树碱相比, 10-羟基喜树碱的抗肿瘤效果更好, 毒性更低[31]。另外, 研究发现10-羟基喜树碱对前列腺癌、膀胱癌等多种癌症均有较好疗效, 因此广泛应用于临床治疗中。
但10-羟基喜树碱在喜树总生物碱中的含量极低, 仅占十万分之二, 提取难度较大, 并且10-羟基喜树碱的化学合成过程也过于复杂, 无法实现工业化生产。研究人员利用微生物转化的方法, 有效地解决了10-羟基喜树碱合成的问题[31]。研究人员进行菌株筛选, 发现了多种表现良好的菌株, 可以将喜树碱转化为10-羟基喜树碱。朱关平等[32]研究发现无毒黄曲霉菌株T-419能将喜树碱转化为10-羟基喜树碱, 实际得率提高到喜树碱投料量的十分之一; 朱殿生等[33]研究发现毛霉和禾谷镰刀菌有较好的微生物转化能力, 能够使喜树碱转化为10-羟基喜树碱等喜树碱类衍生物, 并且实验得出毛霉对喜树碱的最佳转化温度为30 ℃, 最佳转化时间为96 h, 最佳转化浓度为150 μg/mL, 最佳转化初始pH为6.0。另外, 喜树中分离筛选得到的内生真菌也可以产10-羟基喜树碱。王磊等[31]分离筛选喜树中可以将喜树碱转化为10-羟基喜树碱的内生真菌, 最终获得菌株F1105, 经鉴定该菌株为青霉菌属; 闵长莉[34]等采用组织块法从喜树中分离得到13株纯化的内生真菌, 通过TLC和HPLC分析, 发现其中1个菌株可以产10-羟基喜树碱, 发酵液中产量可达677 μg/L, 通过形态观察将其初步鉴定归属为无孢类群; 汪学军[35]等从喜树中分离筛选出产10-羟基喜树碱的内生真菌XK002, 经过形态学和分子生物学方法鉴定该菌株为苹果腐皮壳菌Valsa mali Miyabe et Yamada。
喜树内生菌长期生活在含有生物碱的环境中, 对生物碱具有良好的耐受性, 又因内生菌与喜树长期共生, 很可能含有与喜树相同或相似的代谢途径和合成酶类[36]。虽然目前关于喜树内生菌发酵合成喜树碱及其衍生物的关键酶及其代谢途径的报道较少, 但是关于喜树碱生物合成途径中关键酶研究的进展较快。研究喜树碱生物合成途径中关键酶, 可为我们解析喜树内生菌合成喜树碱及其衍生物的关键酶及其代谢途径提供可靠依据。以不同喜树内生菌DNA作为模板, 克隆得到喜树碱的生物合成途径中部分关键酶并与喜树植株以cDNA为模板克隆出的喜树碱生物合成途径中的关键酶基因进行比较。喜树碱的生物合成途径中有4个关键酶基因[37]——异胡豆苷合酶(STR)、色氨酸脱羧酶(TDC)、10-羟基香叶醇羟化酶(G10H)以及10-羟基香叶醇脱氢酶(HGO)。STR是萜类生物碱合成的关键酶, 能催化由莽草酸途径得到的色胺与由甲羟戊酸途径经多步反应生成的裂环马钱子苷结合形成异胡豆苷; TDC可提供催化色氨酸形成喜树碱及其衍生物的吲哚环所需要的色胺; G10H可以催化香叶醇生成10-羟基-香叶醇, 是一种细胞色素P450氧化酶。万如意等[38]在喜树中分离到的内生芽孢杆菌可发酵合成喜树碱及其衍生物, 并从其基因组中克隆出喜树碱生物合成途径中的G10H、HGO、TDC和STR关键酶基因。这为喜树碱类生物碱微生物转化所涉及到的关键酶提供了思路, 但依然需要进一步研究。
此外, 喜树碱生成10-羟基喜树碱的过程中, 筛选的菌株产生的羟化酶起主要作用。羟化酶对喜树碱进行催化的过程中, 发生了结构上的修饰——喜树碱第10位碳原子上的氢被羟基取代, 生成最终产物10-羟基喜树碱。过程中发生的反应类型为羟基化反应[39]。
喜树碱及其多种衍生物在临床中被用作常见的抗癌类药物, 因此关于喜树碱类生物碱的转化就成了研究热门。近年来, 研究人员研究发现以喜树内生细菌的DNA为模板能够克隆出部分喜树碱生物合成途径的关键酶基因, 这为喜树内生菌能发酵合成喜树碱及其衍生物提供了初步理论依据。将来进一步挖掘出喜树内生菌参与转化反应的限速酶, 了解其转化机理, 有助于喜树碱及其衍生物更广泛地应用于食品、临床、饲料生产等行业, 同时也可以改变现在微生物转化技术无法大规模工业化生产的局面, 推进喜树中药现代化的进程。同时, 微生物转化技术具有减毒增效的作用, 这也是微生物转化技术应用在生物碱类中药上的重要作用之一。
1.3 紫杉醇微生物转化紫杉醇是从红豆杉属植物中提取出的二萜类生物碱化合物, 具有较好的抗癌活性, 可用于乳腺癌、宫颈癌、卵巢癌、肺癌等发病率较高的癌症的治疗, 是临床上使用最广泛的抗癌药物之一[40]。基于紫杉醇本身显著的抗癌特性, 紫杉醇的微生物转化研究引起了各国学者的关注, 一方面研究人员利用微生物技术转化生成紫杉醇[41-42], 提高紫杉醇的产量, 解决紫杉醇在红豆杉中含量很低的问题; 另一方面研究人员利用微生物技术将紫杉醇转化为活性和水溶性更好的紫杉醇衍生物[43]。
美国施贵宝公司(BMS)的Hanson等[44]利用微生物转化进行紫杉醇的半合成, 他们从白色类诺卡氏菌(Nocardioides albus SC13911)、黄色类诺卡氏菌(N.luteus SC13912)、莫拉氏菌(Moraxella sp.)三种微生物中分离出C-13侧链水解酶、C-10脱乙酰酶、C-7木糖甙酶三种酶, 分别将红豆杉中的数种紫杉烷(BaccatinⅢ、10-deacetyl Taxol、7-xylosyl Taxol、7-xyloxyl-10-deacetyl Taxol、cephalomannie等)的13、10及7位进行水解, 得到较多单一的10-deacetyl BaccatinⅢ作为紫杉醇合成的前体。再利用化学反应, 连接上13位的侧链, 即可得到紫杉醇。
占纪勋等[45]利用32株微生物(包括真菌和细菌)对紫杉醇进行微生物转化的筛选, 经TLC检测发现铜绿假单孢菌Pseudomonas aeruginosa AS1.860、稻黄杆菌Flavobacterium oryzae AS1.1584等4种菌株具有转化紫杉醇的能力。选取铜绿假单孢菌对紫杉醇进行扩大实验, 最终分离产生了三种产物: BaccatinⅢ、BaccatinⅤ和10-deacetyl BaccatinⅢ。经实验证明, 铜绿假单孢菌AS1.860可产生与施贵宝公司所发现的C-13侧链水解酶相同功能的水解酶[44], 同时参与紫杉醇转化的还有乙酰基水解酶和羟基异构化酶, 在紫杉醇的微生物转化过程中, 发生了酯键水解的反应机制。
目前, 紫杉醇微生物转化面临合成途径尚未完全明晰, 传代过程菌种易失活, 异源活性植入难度较大等问题, 因此大部分微生物转化工作还停留在初步阶段。但微生物转化的作用不可忽视, 未来要加强对微生物转化中问题的深入研究, 优化反应条件, 提纯重要的酶、克隆酶的基因, 使微生物转化在紫杉醇类生物碱合成和结构修饰中更好的发挥作用, 也为未来工业化大生产提供理论依据。
1.4 马钱子微生物转化马钱子又名番木鳖、苦实, 为马钱科植物马钱(Strychnos nuxvomica L.)的干燥成熟种子[46]。马钱子含有多种吲哚类生物碱, 含量最高的是士的宁(strychnine)和马钱子碱(brucine), 这既是马钱子主要的药效成分, 也是其毒性成分[47]。临床应用中, 马钱子生物碱类成分在类风湿性关节炎、肿瘤、跌打损伤、中风偏瘫等疾病治疗中发挥着重要作用[48]。然而, 马钱子毒副作用较大, 士的宁是含量最高且毒性最大的马钱子来源的生物碱, 成人口服5~10 mg士的宁会出现中毒现象, 30~100 mg可致人死亡; 马钱子碱口服中毒量为15~100 mg。当马钱子碱和士的宁在临床中达到中毒剂量后, 往往可引起惊厥、痉挛、心率失常等不良反应, 甚至危及生命[49-50], 这极大限制了在临床上的应用。所以马钱子生物碱的减毒增效就成为了近年来中药现代化研究的一个热点。
采用微生物转化马钱子中的主要毒性成分士的宁和马钱子碱, 有望提高马钱子中药抗炎、镇痛的药效, 同时较大幅度地减弱士的宁和马钱子碱毒性。在现代工艺中, 常采用发酵法对毒性中药进行微生物转化, 来达到减毒增效的目的[51]。
发酵属于中药炮制的重要方法之一, 现代中药发酵技术通常结合传统中药发酵技术与生物工程学和微生物学, 在保留中药活性成分的同时, 又可以对中药毒性成分结构进行修饰, 产生新成分[52]。这也成为马钱子减毒增效的重要途径之一。潘扬等[53]利用“双向发酵”技术, 选用了槐耳、猴头等20种真菌, 将马钱子作为“药性基质”进行发酵, 并对发酵后产生的新“药性菌质”中的士的宁、马钱子碱用HPLC法进行含量检测, 同时比较马钱子生物碱指纹谱的变化。实验发现发酵后的马钱子类生物碱成分发生了明显的质与量的变化, 其中马钱子碱、士的宁含量显著下降, 而士的宁、马钱子碱氮氧化物(毒性较小的生物碱)含量增加。且指纹谱中显示出5个新产生的或含量变化较大的未知成分。
朱红栓菌对马钱子药材有较强适应性, 具有清热、解毒、消炎之功效。刘亮镜等[54]在适宜条件下利用朱红栓菌Trametes cinnabarina对马钱子进行固体发酵, 研究发酵前后士的宁和马钱子碱毒性大小的变化。发酵前测得马钱子混悬液的LD50为91.8 mg/kg, 而经过发酵后的马钱子混悬液的LD50达到119.1 mg/kg。经过发酵的马钱子的LD50上升率为29.7%, 证明马钱子经朱红栓菌发酵后毒性明显降低, 而且发酵品的镇痛作用和抗炎作用与生品没有明显区别。证明了朱红栓菌可以通过发酵法完成对马钱子的微生物转化, 实现减毒增效作用。
潘自皓等[55]以提高短刺小克银汉霉Cunninghamella blakesleeanaAS3.0970对马钱子中2种毒性主效成分—马钱子碱与士的宁的转化率, 构建高效的微生物转化体系为目标, 采用液态发酵技术, 实现对马钱子生物碱盐的微生物转化。利用短刺小克银汉霉在一定条件下对马钱子碱硫酸盐和士的宁硝酸盐进行液态发酵, 经实验发现2种底物的平均转化率分别提高了约17%与22%, 而且此微生物转化体系减毒增效作用更强。实验结果还表明底物浓度与转化时间是影响微生物转化的关键因素, 当底物质量浓度和转化时间达到20 mg/L和3 d时, 转化率最高。
研究表明采用微生物法转化马钱子, 使其主要毒性成分马钱子碱和士的宁含量下降, 而士的宁氮氧化物和马钱子碱氮氧化物含量升高[56], 且转化后的镇痛作用和抗炎作用与生品相当甚至有所提高, 说明可通过发酵手段对马钱子生物碱类进行减毒增效。验证表明马钱子碱和士的宁在生物转化中可能发生了分解及氧化反应, 使士的宁和马钱子碱氮氧化物含量增加[57]。目前, 关于马钱子生物碱微生物转化相关的酶学机制的研究却很少。深入研究马钱子发酵转化相关的酶学机制, 寻找马钱子毒性组分的转化途径, 挖掘参与转化反应的酶, 尤其是筛选限速酶, 可以更清晰的了解马钱子这种毒性中药的转化机制, 推动其在临床以及医药保健等领域更广泛的应用。随着对马钱子类生物碱微生物转化的深入研究, 马钱子类生物碱药物在临床中的应用会更加广泛, 提供更好的治疗效果。
2 生物碱类化合物的HPLC检测方法高效液相色谱法(HPLC)是一种常用的的色谱技术, 各组分通过与固定相、流动相之间的相互作用, 在色谱柱中进行分离纯化, 可用于分离、鉴定及量化中药混合物中的各组分。高效液相色谱法因其柱效高、分辨率高、稳定方便, 能同时测定几种生物碱的含量, 故在生物碱类化合物的分析检测中应用最多。很多文献中有分离测定上述生物碱的HPLC条件, 现将其进行总结, 见表 1。
| 表 1 分离测定生物碱类化合物的HPLC条件 |
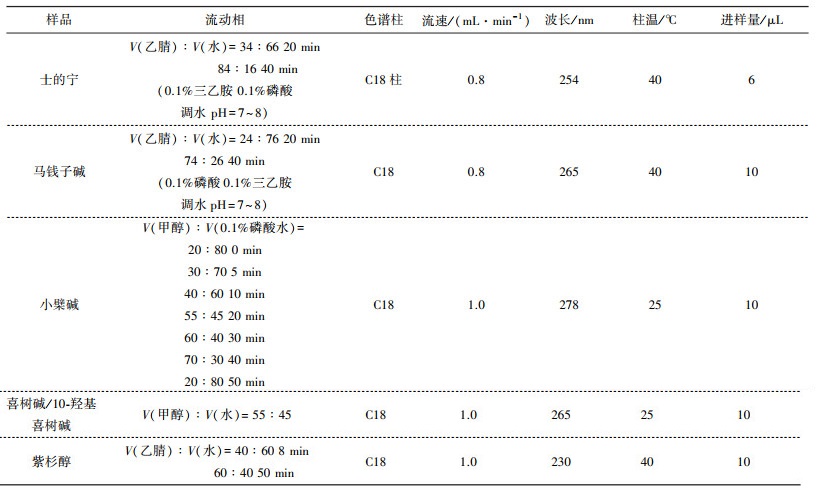 |
用HPLC法测定生物碱类化合物的含量, 不仅操作简便, 样品用量少, 而且样品分离效果好, 检测的样品均达到了基线分离, 精密度、稳定性和回收率均很好, 可作为测定生物碱含量分析的常规方法之一。
3 总结综上所述, 微生物转化技术在生物碱类中药精深加工中有着广泛的应用。虽然现阶段生物碱类中药在药理研究以及加工技术等方面都取得了一定的进展, 但是某些重要的生物碱存在化合物含量低, 稳定性差, 毒性较高等局限性。微生物转化技术有望解决上述问题, 为实现有效制备化学合成难以完成的生物碱及其类衍生物奠定基础。目前, 生物转化技术尚未广泛应用于生物碱类中药的大规模工业化生产, 需要在深入挖掘微生物转化机制, 提高活性成分的分离纯化效率等方面开展系统深入的研究。总之, 微生物转化技术对中药的研发和生产具有重要的理论价值和应用前景, 对中药现代化有着重大的意义。
| [1] |
刘庆鑫, 李慧梁, 柳润辉. 微生物转化在天然产物研究中的应用[J]. 药学实践杂志, 2012, 30(5): 321-325. DOI:10.3969/j.issn.1006-0111.2012.05.001 |
| [2] |
朱立俏. 中药化学成分的微生物转化研究概述[J]. 山东中医药大学学报, 2014, 38(1): 79-82. |
| [3] |
段金廒. 中药资源化学研究技术体系的建立及其应用[J]. 中国药科大学学报, 2012, 43(4): 289-292. |
| [4] |
马逢时, 刘家水, 谈永进. 微生物转化技术在中药资源开发中的应用研究[J]. 亚太传统医药, 2019, 15(8): 174-177. |
| [5] |
贺峦, 高学鹏, 彭杨. 微生物转化技术在中药资源开发中的应用研究[J]. 云南化工, 2019, 46(10): 35-36. |
| [6] |
关松磊, 吴雅馨, 孙赫, 等. 微生物转化技术在中药开发中的应用进展[J]. 微生物学通报, 2018(4): 900-906. |
| [7] |
JIN FX. Biotransformation of natural products[M]. Beijing: Chemical Industry Press, 2009.
|
| [8] |
刘召明, 朱雅琪, 魏雪琴. 微生物转化生物碱的研究进展[J]. 生物技术世界, 2015(8): 189-189. |
| [9] |
李东伟, 邵梦寒, 葛传慧, 等. 小檗碱调节糖脂代谢及其抗糖尿病活性的研究[J]. 生命科学, 2019, 31(2): 201-208. |
| [10] |
刘欣荣. 天然药物小檗碱的临床用途[J]. 光明中医, 2007(8): 73-75. DOI:10.3969/j.issn.1003-8914.2007.08.048 |
| [11] |
邢宇, 刘鑫, 林园, 等. 小檗碱药理作用及其临床应用研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 491-502. DOI:10.3867/j.issn.1000-3002.2017.06.001 |
| [12] |
于浩, 杜建玲. 小檗碱的药理作用及机制的研究现状[J]. 中国现代应用药学, 2020, 37(4): 501-507. |
| [13] |
李梦. 小檗碱的肠道菌群生物转化研究[D]. 上海: 上海交通大学, 2014.
|
| [14] |
赵西子, 李文芳, 邢彦超, 等. 小檗碱体内药代动力学及药理活性研究进展[J]. 辽宁中医药大学学报, 2020, 22(10): 86-90. |
| [15] |
TAKEDA H, ISHIKAWA K, WAKANA D, et al. 11-hydroxylation of protoberberine by the novel berberine-utilizing aerobic bacterium Sphingobium sp.strain BD3100[J]. Journal of Natural Products, 2015, 78(12): 2880-2886. DOI:10.1021/acs.jnatprod.5b00408 |
| [16] |
KAZUKI, ISHIKAWA, HISASHI, et al. Isolation and identification of berberine and berberrubine metabolites by berberine-utilizing bacteriumRhodococcus sp.strain BD7100[J]. Bioscience Biotechnology & Biochemistry, 2016, 80(5): 856-862. |
| [17] |
TAKEDA H, ISHIKAWA K, YOSHIDA H, et al. Common origin of methylenedioxy ring degradation and demethylation in bacteria[J]. Scientific Reports, 2017, 7(1): 7422. DOI:10.1038/s41598-017-07370-x |
| [18] |
SHAMMA M, GREENBERG M A, DUDOCK B S. Thalictrum alkaloids I.Thalifendlerine and thalifendine[J]. Tetrahedron Letters, 1965, 6(40): 3595-3598. DOI:10.1016/S0040-4039(01)99545-0 |
| [19] |
F RU, SHOU J W, ZHAO Z X, et al. Transforming berberine into its intestine-absorbable form by the gut microbiota[J]. Scientific Reports, 2015, 5: 12155. DOI:10.1038/srep12155 |
| [20] |
郑守豪, 廖国建, 胡昌华. 小檗碱类生物碱的生物转化及其酶学机制[J]. 中国中药杂志, 2020, 45(24): 5884-5889. |
| [21] |
YASU DA K, IKUSHIRO S, KAMAKURA M, et al. Metabolism of sesamin by cytochrome P450 in human liver microsomes[J]. Drug Metabolism & Disposition, 2010, 38(12): 2117-2123. |
| [22] |
孙思源. 原小檗碱类生物碱与CYP450和药物转运体的相互作用研究[D]. 杭州: 浙江大学, 2013.
|
| [23] |
杨念云, 张启春, 朱华旭, 等. 黄连生物碱类资源性化学成分研究进展与利用策略[J]. 中草药, 2019, 50(20): 5080-5087. DOI:10.7501/j.issn.0253-2670.2019.20.034 |
| [24] |
李艳, 周剑, 何东贤, 等. 微生物转化在现代中药研发中的应用[J]. 中国抗生素杂志, 2020, 45(5): 418-422. DOI:10.3969/j.issn.1001-8689.2020.05.003 |
| [25] |
陈梦涵, 杨鸣华, 孔令义. 喜树碱类药物的研究与开发[J]. 世界科学技术-中医药现代化, 2016, 18(5): 724-730. DOI:10.11842/wst.2016.05.002 |
| [26] |
刘赟. 喜树内生真菌产活性物质及分析[D]. 咸阳: 西北农林科技大学, 2014.
|
| [27] |
盛贻林, 李云霞, 俞文榜, 等. 一株喜树内生菌的分离与发酵试验[J]. 药物生物技术, 2016, 23(5): 390-392. |
| [28] |
WALL M E, WANI M C, COOK CE, et al. Plant antitumor agent I.The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata[J]. J Am Chem Soc, 1966, 88(16): 3888-3890. DOI:10.1021/ja00968a057 |
| [29] |
刘开辉, 丁小维, 邓百万, 等. 一株喜树内生真菌的分离及其产喜树碱的初步分析[J]. 食品与发酵工业, 2010, 36(2): 30-33. |
| [30] |
李霞, 刘佳佳, 陈建华, 等. 产喜树碱喜树内生真菌的筛选及喜树内生真菌的SRAP分析(英文)[J]. 中国生物工程杂志, 2011, 31(7): 60-64. |
| [31] |
王磊, 龙秀锋, 肖青, 等. 一株10-羟基喜树碱转化内生菌的筛选及鉴定[J]. 生物技术, 2014, 24(1): 80-85. |
| [32] |
朱关平, 林隆泽, 潘文君, 等. 生物转化喜树碱为10-羟基喜树碱的研究[J]. 科学通报, 1978(12): 761-762. |
| [33] |
朱殿生, 张彧, 于营, 等. 喜树碱生物转化优良菌株的筛选及其转化条件初步研究[J]. 大连轻工业学院学报, 2007(1): 18-20. DOI:10.3969/j.issn.1674-1404.2007.01.006 |
| [34] |
闵长莉, 汪学军. 喜树产10-羟基喜树碱内生真菌的分离鉴定[J]. 西北植物学报, 2009, 29(3): 614-617. DOI:10.3321/j.issn:1000-4025.2009.03.029 |
| [35] |
汪学军, 闵长莉, 刘文博, 等. 一株产10-羟基喜树碱喜树内生真菌的分离和鉴定[J]. 中国抗生素杂志, 2011, 36(6): 407-411. |
| [36] |
邓静, 刘吉华, 余伯阳. 具有生物碱转化活力的4株喜树内生真菌的鉴定[J]. 药物生物技术, 2006(6): 436-441. DOI:10.3969/j.issn.1005-8915.2006.06.012 |
| [37] |
沈少华, 刘姬艳, 胡江琴, 等. 喜树碱生物合成途径及其相关酶的研究进展[J]. 中草药, 2011, 42(9): 1862-1868. |
| [38] |
万如意, 高琳, 苏莹莹, 等. 基于喜树碱生物合成的喜树内生菌及其关键酶基因克隆[J]. 大连工业大学学报, 2019, 38(1): 19-23. |
| [39] |
陈梦涵, 杨鸣华, 孔令义. 喜树碱类药物的研究与开发[J]. 世界科学技术-中医药现代化, 2016, 018(5): 724-730. DOI:10.11842/wst.2016.05.002 |
| [40] |
WANI M C, TAYLOR H L, WALL M E, et al. Plant antitumor agents.VI.The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia[J]. Journal of the American Chemical Society, 1971, 93(9): 2325-2327. DOI:10.1021/ja00738a045 |
| [41] |
蒋彭成, 陈碧峰, 郑水, 等. 紫杉烷微生物转化研究进展[J]. 天然产物研究与开发, 2012, 24(S1): 198-200. |
| [42] |
张欢, 赵赟鑫, 高文, 等. 紫杉醇生产现状的分析与对策[J]. 中国现代中药, 2016, 18(1): 126-130. |
| [43] |
吴亦晴, 虞劲祥, 程志红. 二萜类化合物微生物转化研究进展[J]. 中国生化药物杂志, 2016, 36(3): 9-15. |
| [44] |
HANSON R L, HOWELL J M, BRZOZOWSI D B. Enzymic hydrolysis of 7-xylosyltaxanes by xylosidase from Moraxella sp[J]. Biotechnology and Applied Biochemistry, 1997, 26(3): 153-158. |
| [45] |
占纪勋, 张元兴, 宁黎丽, 等. 铜绿假单孢菌AS1.860对紫杉醇的微生物转化[J]. 应用与环境生物学报, 2003, 4: 429-432. DOI:10.3321/j.issn:1006-687X.2003.04.021 |
| [46] |
贾旋旋, 李文, 李俊松, 等. 马钱子的毒性研究进展[J]. 中国中药杂志, 2009, 34(18): 2396-2399. DOI:10.3321/j.issn:1001-5302.2009.18.030 |
| [47] |
刘君, 张会宗. 马钱子减毒增效方法[J]. 实用中医内科杂志, 2015(6): 169-173. |
| [48] |
陈谢谢, 刘丽丽, 朱卫丰, 等. 中药马钱子减毒增效方法研究进展[J]. 江西中医药, 2018, 49(8): 63-67. |
| [49] |
任佳佳, 张学顺, 褚志杰. 马钱子减毒增效研究进展[J]. 辽宁中医药大学学报, 2016, 18(1): 221-224. |
| [50] |
吴小娟, 马凤森, 郑高利, 等. 马钱子吲哚类生物碱毒性研究进展[J]. 中药药理与临床, 2016, 32(6): 231-235. |
| [51] |
艾素, 汤伟, 郭若琳, 等. 微生物发酵中草药及其活性物质的研究进展[J]. 中国中药杂志, 2019, 44(6): 1110-1118. |
| [52] |
任佳佳, 张学顺, 褚志杰. 马钱子减毒增效研究进展[J]. 辽宁中医药大学学报, 2016, 18(1): 221-224. |
| [53] |
潘扬, 张弦, 蒋亚平, 等. 双向发酵前后马钱子生物碱含量及其HPLC指纹谱的比较[J]. 南京中医药大学学报, 2006(6): 362-365. DOI:10.3969/j.issn.1000-5005.2006.06.008 |
| [54] |
刘亮镜, 曹亮, 蒋亚平, 等. 马钱子经朱红栓菌发酵前后毒性及镇痛、抗炎作用的实验研究[J]. 南京中医药大学学报, 2009, 25(3): 205-208. DOI:10.3969/j.issn.1000-5005.2009.03.016 |
| [55] |
潘自皓, 金苗, 潘扬. 短刺小克银汉霉对马钱子生物碱盐转化工艺的研究[J]. 中草药, 2013, 44(23): 3309-3315. |
| [56] |
蔡宝昌, 秦昆明, 吴皓, 等. 中药炮制过程化学机理研究[J]. 化学进展, 2012, 24(4): 637-649. |
| [57] |
刘君, 张会宗. 马钱子减毒增效方法[J]. 实用中医内科杂志, 2015, 29(6): 159-163. |
 2022, Vol. 36
2022, Vol. 36


