| 富含多种生物活性物质的桑黄菌筛选、纯种分离及鉴定 |
b. 齐鲁工业大学(山东省科学院) 生物基材料与绿色造纸国家重点实验室, 山东 济南 250353;
2. 喜蕈菌物研究院, 山东 烟台 265400
b. State Key Laboratory of bio-based materials and Green papermaking, Qilu Universitry of Technology (Shandong Academy of Sciences), Jinan 250353, China;
2. XIXUN Fungi Research Institute, Yantai 265400, China
桑黄[1], 多生长于树木枝干, 以生长于桑树树干最为典型, 其子实体呈现黑色或者黄褐色, 故其通常被称为桑黄。分类学上对其种属仍无明确的区分, 通常是属于锈革孔菌科(Hymenochaetaceae)。古时就有古籍记载了桑黄子实体的特征颜色及部分功效[2]。在唐初甄权所著古籍《药性论》书中第一次出现了“桑黄”一词[3]。桑黄在中医学中常被用于调理五脏、止血等。在现代药理学中, 桑黄所含有如萜类、多酚、多糖、黄酮等成分, 对于的抗氧化, 肿瘤的预防及抑制方面有较大的药用潜力[4-8]。综上所述, 桑黄具有很高的研究与开发价值。
时至今日, 人们对于健康问题愈加重视, 养生以及日常的防护逐渐变得流行, 从以往的药补到食补, 逐渐转变为现在的药食同源。在药食同源的大趋势下, 一些具有抗肿瘤、抗氧化功效的天然药材或者天然菌种逐渐引起人们的重视, 而桑黄作为一种富含活性物质的菌种, 因其优秀的抗氧化能力, 提高免疫力的能力以及对于人体的修护能力, 逐渐展露于人们的视野中。
本研究从河北承德、山东宁津及山东夏津桑树种植园中收集到11份桑黄样品(人工养殖或野生), 对其进行活性成分的提取, 测定和纯种的分离鉴定, 通过测定样品的活性物质的含量, 筛选出品质优良的品种, 为桑黄来源药用成分的研究与开发提供较好的材料。
1 材料及实验方法 1.1 材料11份样品分别来自于山东夏津桑树园、山东宁津、河北承德等地, 由齐鲁工业大学生物工程学院保藏, 分别编号为SH-11、SH-12、SH-13、SH-14、SH-15、SH-16、SH-17、SH-18、SH-19、SH-20、SH-21。采集的子实体样本形态颜色各异, 呈黑色或者黄褐色, 伞盖成马蹄状, 子实体单生, 部分样品子实体表面光滑, 部分样品子实体表面有毛糙物, 11份样品的子实体形态如图 1所示。
 |
| 图 1 桑黄样品实体子形态 |
1.2 试剂和仪器
使用北京天根生化公司植物基因组DNA提取试剂盒提取桑黄样本基因组; TAE缓冲液(50×): 来自广州硕普生物有限公司; AGAROSE LE琼脂糖: 北京天根生化公司; DNA纯化回收试剂盒: 北京天根生化公司; 离心管、枪头等耗材: 北京兰杰柯科技有限公司; 引物: 由上海生物工程股份有限公司, 按照合成单加入ddH2O, 制成10 mol/L溶液; 马铃薯葡萄糖固体培养基(PDA): 按照说明书进行配制; 液体培养基: 马铃薯葡萄糖液体培养基(PDB); TG16-WS型湘仪离心机: 湖南湘仪公司; JY-SPCT型电泳槽: 北京六一生物科技有限公司; Y04S-3C型凝胶成像系统: 北京君意公司; BSM-220.4型电子天平: 上海卓精电子科技有限公司; 84-1A磁力搅拌器: Labnet公司; 小型离心机: BioExpress公司; OSE-GP-02型TGreat梯度PCR仪(96模块): 北京天根生化公司; HZQ-F160型全温振荡培养箱: 苏州培英公司; DNP电热恒温培养箱: 上海精宏公司; LDZX-50KB型立式高压蒸汽灭菌器: 上海申安医疗器械厂; ZHJH-C1112B超净工作台: 上海智城分析仪器制造有限公司。
1.3 桑黄菌纯种分离纯化在无菌条件下, 将活性成分含量均较高的SH-18子样品用体积分数75%酒精棉进行擦拭, 达到消毒的目的, 酒精棉不宜过于湿润, 以免多余酒精渗入影响桑黄菌活性。用酒精灯灼烧手术刀刀片进行消毒, 之后用刀片将子实体切开, 切开后再次灼烧刀片, 用刀片在切面中心割出方格, 以便之后用镊子夹取。用充分灼烧过的尖嘴镊子夹取已经切割好的子实体组织, 至PDA固体平板中, 将平板放入30 ℃培养箱避光培养, 每天对其生长状况及菌落形态进行记录。等平板上的桑黄组织萌发长成至菌落, 将桑黄菌落边缘的带有新鲜菌丝的培养基用充分灼烧后灭菌过的接种针转移至新的PDA平板中, 以达到分离纯化的目的。
待形成单一菌落后, 在无菌条件下, 挑取培养基置于PD培养基进行培养, 放入30 ℃摇床中避光培养, 待其形成较多菌丝球以备鉴定。
1.4 基于ITS序列的分子鉴定 1.4.1 基因组DNA提取本实验采用植物基因组DNA提取试剂盒对桑黄样品DNA进行提取并按照其说明书操作。
1.4.2 分子鉴定本研究采用ITS进行鉴定, 引物来自上海生工生物工程有限公司, 引物为ITS1和ITS4(如表 1所示), 详细步骤见参考文献[9], 引物序列见表 1及扩增体系见表 2。
| 表 1 桑黄菌株鉴定通用引物 |
 |
| 表 2 PCR扩增体系组分及构成 |
 |
1.5 样品预处理
将SH-11至SH-21号样品子实体切取部分(切取子实体的质量烘干后需大于1 g)并切割成直径1 cm左右的碎块, 称取质量, 将碎块分别置于相应已经编好11~21编号的容器中, 放入80 ℃烘箱中烘至衡重, 期间每隔2 h称取一次质量, 待质量不变后取出, 不宜烘干时间过长。
将烘干后的子实体碎块, 称取质量, 若质量不足, 则需要添加, 将质量充足的子实体碎块放入洁净的研钵中进行研磨, 研磨成细粉末, 需注意不能有较大的未研磨充分的子实体颗粒, 将研磨好的子实体粉末转移至标有相应编号的自封袋中, 封好袋口, 放入4 ℃冰箱中保存, 以备后续实验。
1.6 标准曲线的绘制根据标准方法(T/AHFIA005-2018、GB/T 20574-2006、GB/T 15672-2009、NY/T3676-2020)绘制测定活性物质的标准曲线, 分别配置葡萄糖、芦丁、齐墩果酸标准品溶液、没食子酸标准储备液, 浓度梯度稀释后分别测出它们对应的吸光度, 以浓度为X轴, 吸光度为Y轴, 做出标准曲线, 如图 2所示。
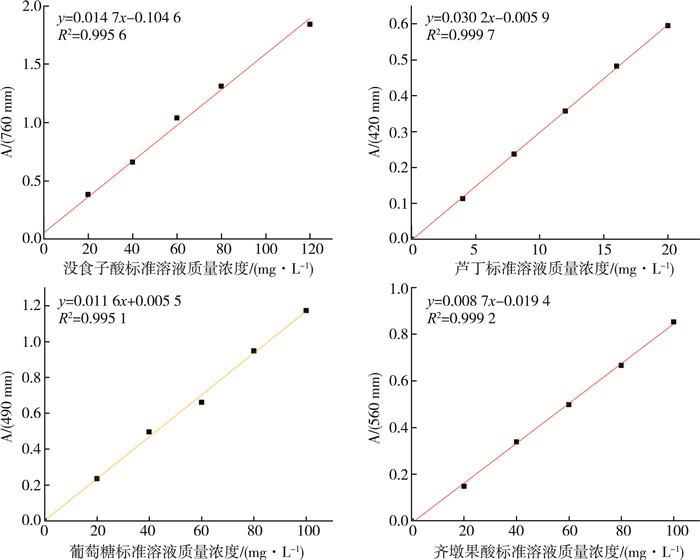 |
| 图 2 标准曲线 |
具体操作步骤根据标准方法进行操作, 标准曲线结果如下。
| $ \text { 多酚标准曲线:} y=0.014\ 7 x+0.104\ 6 \quad R^2=0.995\ 6 $ |
| $ \text { 黄酮标准曲线:} y=0.030\ 2 x-0.005\ 9 \quad R^2=0.999\ 7 $ |
| $ \text { 葡萄糖标准曲线:} y=0.011\ 6 x+0.005\ 5 \quad R^2=0.995\ 1 $ |
| $ \text { 三萜标准曲线:} y=0.008\ 7 x-0.019\ 4 \quad R^2=0.999\ 2 $ |
本实验选取SH-19、SH-20、SH-21等3个样品, 分别用体积分数70%乙醇和无水乙醇对样品进行处理, 比较活性物质的浸提效果。同时为保证数据的准确性, 即吸光度数值尽可能控制在0.2~0.8, 对样品进行不同比例的稀释, 以控制吸光度在所要求的范围内。本实验先采用上述3个样品进行预实验, 一方面探求不同浓度乙醇的提取效果, 另一方面也为后续样品的稀释确定一个初步的稀释比例。
黄酮、多酚、三萜浸提方法优化: 准确称取0.4 g菌体粉末, 加入体积分数70 %乙醇, 55 ℃超声提取1 h, 6 000 r/min离心10 min。准确吸取上清液, 转移至10 mL容量瓶, 沉淀用3 mL70%乙醇重复提取两次, 提取方式相同, 将3次上清液分别转移至10 mL容量瓶中, 加入体积分数70%乙醇定容至10 mL, 用于黄酮、多酚、三萜浓度的测定。同时, 用无水乙醇代替体积分数70%乙醇重复上述实验中的浸提方法比较提取效果。后续检测黄酮、多酚、三萜时均比较体积分数70%乙醇与无水乙醇的提取效果。
1.7.1 多酚含量测定方法根据1.6所提到的标准方法对多酚进行检测。
1.7.2 黄酮、多糖含量测定方法根据孙昊宇等对黄酮、多糖的检测方法进行检测[9]。
1.7.3 三萜含量测定方法三萜含量的检测方法, 详见1.6中的NY/T3676-2020。
1.7.4 结论与分析通过对SH-19、SH-20、SH-21等3个样品的活性成分的测定, 对比测量黄酮、多酚时的吸光度, 可以明显看出采用70%乙醇处理的样品所测出的吸光度明显大于同等稀释比例下用无水乙醇处理样品的吸光度, 同时测定出了每个样品大致的稀释比例。所以剩下样品将采用70%乙醇进行处理, 根据初步测定的稀释比例, 如有个别不合适的情况, 再进行稀释比例的更改。
多酚: 由上述实验知, 稀释比例暂定为1/20, 吸取50 μL样液至10 mL离心管中, 方法与1.7.1一致。
在实验过程中发现SH-13、SH-17号样品在此稀释比例下吸光度的数值过小, 所以调整SH-13、SH-17的稀释比例为1/4。
黄酮: 样液稀释比例暂定为1/30, 吸取50 μL样液, 用无水乙醇补至1.5 mL, 方法与上述1.7.2一致。
同时SH-11、13、14、17的吸光度需调整稀释比例, 其中SH-11稀释1/15, SH-13、14、17皆稀释1/3。
多糖: 样液稀释比例为1/10, 向10 mL比色管中加入0.1 mL样液, 补加纯水至1 mL, 方法与1.7.2一致。
SH-12、13、14、16、17需要调整稀释比例, 调整为1/5。
三萜: 样液暂定稀释比例为1/4, 取待测样液0.25 mL用无水乙醇补至1 mL, 方法如1.7.3所述。以上样液均为70%乙醇处理。
1.8 桑黄样品中主要活性成分的比较本研究共比较了11份桑黄样品的活性成分含量, 采用优化后的浸提方法对样品进行提取, 之后使用显色法通过分光光度计测出每种样品的吸光度, 通过换算得出样品活性成分含量, 通过比较活性成分的含量, 筛选出最优的样品, 进行后续的研究。
1.9 统计分析本实验进行了3组平行实验, 利用数据分析软件SPSS进行分析, 实验结果以平均值±标准差表示(P<0.05)。
2 结果与分析桑黄中含有多酚、黄酮、多糖、三萜等活性物质, 研究表明这4类物质是具有药用价值的活性成分的重要来源, 桑黄所含有的这些活性物质之丰富反映出其在药物开发领域具有很高的研究价值。本研究对采集到的11种样品进行了多糖、黄酮、多酚、三萜质量分数的检测, 测定结果如下所示。
2.1 多糖质量分数的比较多糖的作用主要是提高人体免疫机能以及抗肿瘤[5, 10-11]。本研究测定了11份样品中总多糖质量分数, 并进行比较。
经过对多糖的提取及测定, 多糖的质量分数如图 3所示, 11份样品的多糖质量分数在(15.56±1.87)~(96.35±9.01) mg/g之间, 其中SH-11的多糖质量分数与SH-21的多糖质量分数较高, 分别为(61.75±8.20)和(70.09±6.89) mg/g, SH-18的多糖质量分数为11个样品中最高, 达到了(96.35±9.01) mg/g。
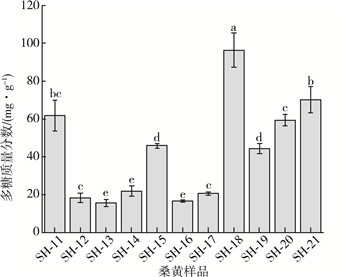 |
| 图 3 11份桑黄样品多糖质量分数 |
2.2 黄酮质量分数的比较
黄酮的药用功能较广。黄酮能调节身体机能, 增强身体免疫力, 同时黄酮作为抗氧化剂, 对人体内的氧自由基清除效果显著, 具有抗衰老的作用, 另外在修护人体, 降低心脑血管疾病的发生, 癌症的预防, 抗肿瘤等方面也有作用[5, 12]。黄酮的质量分数高低也是评价桑黄样品的优劣的重要指标之一。本研究测定了11种桑黄样品中黄酮质量分数, 结果如图 4所示。11种样品的黄酮质量分数在(1.02±0.01)~(17.08±0.29) mg/g之间通过比较11株样品的黄酮质量分数可以得出SH-18的黄酮质量分数最多, 高达(17.08±0.29) mg/g。
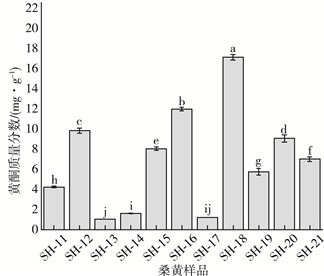 |
| 图 4 11份桑黄样品黄酮质量分数 |
2.3 多酚质量分数的比较
多酚在很多植物中都含有, 如水果、茶、红酒、蔬菜等等。多酚也是一种具有较高药用价值的成分, 具有良好的抗氧化性, 与黄酮功效类似, 在抗癌、抗氧化、抗衰老等领域有着广泛运用[13-14]。
本研究测定了11株样品多酚的质量分数, 并进行了比较。11株样品的桑黄质量分数如图 5所示。11株桑黄样品的多酚质量分数在(0.750±0.075)~(19.580±1.044) mg/g之间, 其中SH-18多酚质量分数最高, 达到(19.580±1.044) mg/g。
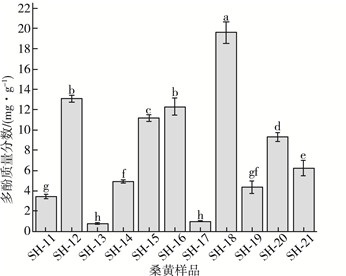 |
| 图 5 11份桑黄样品多酚质量分数 |
2.4 三萜质量分数的比较
三萜类成分具有多种生物活性功能, 常将其作为重要制剂定性、定量分析的指标。研究指出三萜类物质对癌细胞的生长有抑制作用, 三萜对于人体有诸多益处, 有促进止血, 调控血脂, 提高人体免疫力, 抗过敏, 消炎, 降血糖等作用, 因此三萜是一类药用价值极高的活性成分[15]。11株桑黄样品的三萜质量分数如图 6所示, 其质量分数在(5.75±0.07)~(12.10±0.14) mg/g之间, 其中SH-16质量分数最高为(12.10±0.14) mg/g, SH-18三萜质量分数达到了(9.10±0.14) mg/g。
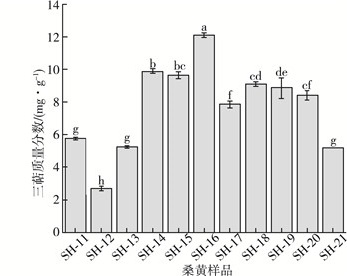 |
| 图 6 11份桑黄样品三萜质量分数 |
2.5 富含多种活性成分桑黄样品的筛选
由上述实验结果, 在11株桑黄样品中SH-18的活性成分质量分数均处在较高水平, 其中SH-18所含多糖的质量在11株桑黄样品中处于最高水平, 对比于张俊等[16]对不同来源桑黄活性成分的检测, 其样品所含多糖质量分数最高为80.86 mg/g, 高于其最高水平。黄丽洋等[17]对不同树种来源桑黄活性成分进行比较, 发现在暴马丁香上生长的桑黄含有的多糖质量分数最高为98.20 mg/g, 与SH-18的多糖质量分数基本相当, 为后续研究进一步提高SH-18产多糖的量提供了新思路。在11株样品中SH-18多酚质量分数最高, 对比张俊等[16]对不同来源桑黄活性成分的测定多酚质量分数为6.79~33.18 mg/g, SH-18多酚质量分数处于较高水平。SH-18黄酮质量分数为(17.08±0.29) mg/g, 对比谢春芹等[18]对17株不同来源的桑黄黄酮质量分数的检测, SH-18黄酮质量分数高于其测定的样品的最高质量分数。SH-18的三萜质量分数, 对比黄丽洋等[17]对不同树种桑黄三萜质量分数进行的研究, 其杨树上生长的桑黄子实体所含三萜质量分数最高, 为1.48 mg/g。SH-18三萜质量分数大于其最高水平。综上分析, 其原因可能是因为SH-18是一株野生菌株, 对比于人工养殖的桑黄菌株, 缺乏良好的生存条件和营养物质, 因此为了保证自身的生存, 要分泌更多的活性物质以适应恶劣的生存环境。
通过对比其它桑黄样品, SH-18所含的多糖、黄酮、多酚及三萜等活性成分质量分数处在较高水平, 将以SH-18为研究对象进行育种工作, 进一步提升活性成分质量分数。本研究对SH-18进行分离纯化、菌种鉴定并保藏至国家认定的菌种保藏中心。
2.6 富含多种活性成分桑黄菌的分离鉴定本实验采用稳定性好、效率高的18S rDNA及28S rDNA间的rDNA内转录间隔区(internal transcribed spacer, ITS)序列分析技术[11]对桑黄菌株进行鉴定。如1.4.2, 采用植物基因组DNA提取试剂盒对SH-18进行基因组的提取。对鉴定得到的序列在NCBI数据库中进行BLAST, 并且采用MEGAX软件选取Neighbor-joining法构建系统发育树, 如图 7所示。通过对比结果表明在NCBI数据库中, SH-18与菌株I.hispidus clone SH-3和I.hispidus clone SH-1相似度在99%以上, 均属于纤孔菌属(Inonotus)。SH-18桑黄样本分离纯化得到的菌株是一株粗毛纤孔菌。包海鹰等[2]分析了古籍中记载的桑黄的生长环境、子实体形态以及颜色、功效等, 发现所记载的“桑黄”一词与粗毛纤孔菌最为契合。同样印证了本实验的研究结果。
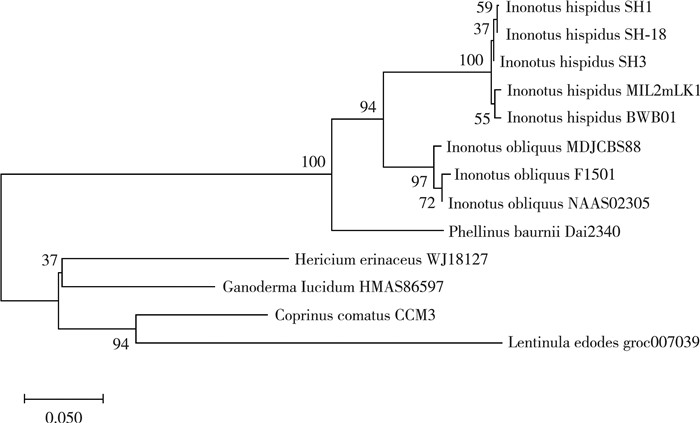 |
| 图 7 SH-18系统发育树 |
2.7 SH-18形态分析
对SH-18进行分离纯化, 转移至PDA固体平板培养, 放入30 ℃培养箱进行避光培养, 每隔2 d观察其形态直至长出单一菌落, SH-18生长较慢, 于适宜条件下培养3周左右的时间, 桑黄菌落直径可达7~9 cm, 长出的新鲜菌颜色呈白色, 形态呈绒毛状, 一段时间后, 菌丝颜色逐渐转变为黄褐色, 但菌落边缘新鲜菌丝仍为白色。形态如图 8所示。
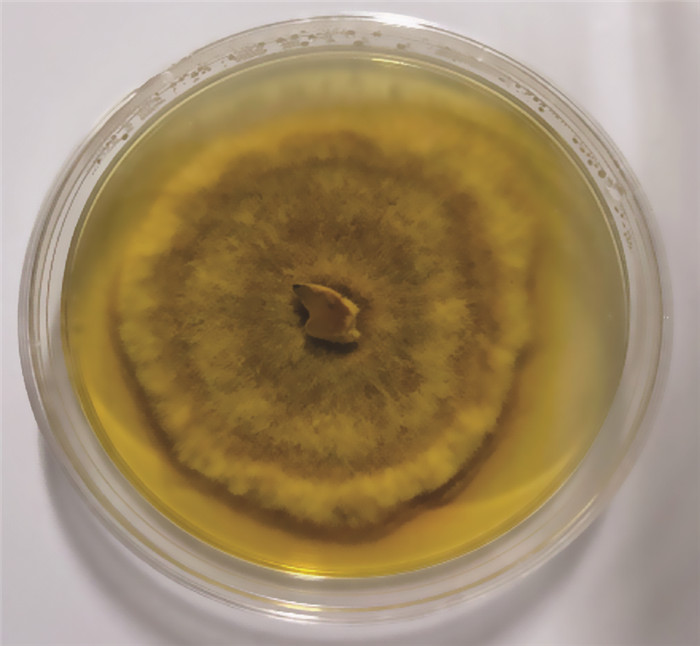 |
| 图 8 SH-18菌落形态 |
3 结论
桑黄对抗氧化、癌症的预防都有着较好的作用。随着药食同源观念的深入人心, 桑黄这种天然的药食两用的真菌有着极大的研究与开发价值。本研究对不同来源的桑黄样品所含的多酚、三萜、黄酮、多糖等活性物质的质量分数进行了全面的测定, 筛选出一株富含上述活性成分的桑黄菌株SH-18, 其黄酮质量分数为(17.08±0.29) mg/g, 多酚质量分数为(19.58±1.04) mg/g, 多糖质量分数为(96.35±9.01) mg/g, 三萜质量分数为(9.10±0.14) mg/g。通过与已有的报道对比后可知SH-18所含的上述活性物质质量分数均处于较高的水平, 经鉴定分析, 将SH-18菌株归为粗毛纤孔菌(I.hispidus)。选取SH-18作为后续研究的出发菌株, 并将ITS序列上传至NCBI, GeneID为OM438243。
| [1] |
王伟科, 宋吉玲, 巫优良, 等. 药用真菌桑黄分子鉴定及遗传多样性分析[J]. 浙江农业学报, 2019, 31(2): 307-314. DOI:10.3969/j.issn.1004-1524.2019.02.17 |
| [2] |
包海鹰, 杨烁, 李庆杰, 等. "桑黄"的本草补充考证[J]. 菌物研究, 2017, 15(4): 264-270. |
| [3] |
王寿南, 陈青君, 张国庆, 等. 一株野生桑黄的分离鉴定与生物学特性[J]. 应用与环境生物学报, 2016, 22(4): 667-674. |
| [4] |
刘鑫, 侯若琳, 金珊珊, 等. 药用真菌粗毛纤孔菌的分子甄别及其发酵液抗乳腺癌活性研究[J]. 菌物学报, 2018, 37(2): 215-225. |
| [5] |
钱骅, 赵伯涛, 陈斌, 等. 桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性[J]. 食品工业科技, 2015, 36(12): 104-108. |
| [6] |
张维博, 王家国, 李正阔, 等. 药用真菌桑黄的研究进展[J]. 中国中药杂志, 2014, 39(15): 2838-2845. |
| [7] |
黄丽洋, 石卉, 王晓婷, 等. 野生桑黄菌株的分离、鉴定和次生代谢物分析[J]. 中草药, 2013, 44(23): 3394-3399. |
| [8] |
吕国英, 宋婷婷, 蔡为明, 等. 野生桑树桑黄和杨树桑黄化学成分及抗氧化活性比较[J]. 菌物学报, 2021, 40(7): 1833-1843. |
| [9] |
孙昊宇, 亓正良, 刘新利. 野生桑黄菌分离鉴定及生物活性成分分析[J]. 齐鲁工业大学学报, 2020, 34(6): 5-12. |
| [10] |
袁满, 付婷伟, 徐晨, 等. 桑黄子实体多糖提取工艺优化及其抗氧化活性[J]. 食品工业科技, 2021, 42(11): 103-108. |
| [11] |
王豪, 钱坤, 司静, 等. 桑黄类真菌多糖研究进展[J]. 菌物学报, 2021, 40(4): 895-911. |
| [12] |
叶晶晶, 曹宁宁, 吴建梅, 等. 桑黄黄酮的研究进展[J]. 四川蚕业, 2021, 49(3): 38-41. |
| [13] |
谢春芹, 杨鹤同, 吴琴燕, 等. 桑黄黄酮、多糖高产优良菌株的筛选试验[J]. 江苏农业科学, 2019, 47(14): 209-212. |
| [14] |
昝立峰, 包海鹰, 李丹花. "桑黄"类真菌中多酚物质及其生物活性研究进展[J]. 天然产物研究与开发, 2016, 28(1): 147-155. |
| [15] |
谢江宁, 宋素芬, 李香, 等. 桑黄总三萜的提取及其体外抗脑胶质瘤U251活性[J]. 中国实验方剂学杂志, 2012, 18(5): 24-26. |
| [16] |
张俊, 颜新培, 李一平, 等. 不同来源和采收时期桑黄子实体的主要活性成分含量比较[J]. 蚕业科学, 2021, 47(6): 568-574. |
| [17] |
黄丽洋, 石卉, 王晓婷, 等. 野生桑黄菌株的分离、鉴定和次生代谢物分析[J]. 中草药, 2013, 44(23): 3394-3399. |
| [18] |
谢春芹, 杨鹤同, 吴琴燕, 等. 桑黄黄酮、多糖高产优良菌株的筛选试验[J]. 江苏农业科学, 2019, 47(14): 209-212. |
 2023, Vol. 37
2023, Vol. 37


