| 球孢白僵菌形态转换的内在机制分析 |
病原真菌改变自己的细胞形态来适应新环境的现象是普遍存在的[1]。高度极化的多细胞菌丝态和单细胞的酵母态是最常见的细胞形态, 这两种形态之间的转换对病原真菌的致病性和生命周期非常重要[2]。菌丝与分生孢子相结合, 有利于真菌对抗各种恶劣环境并扩散生长。波萨达斯球孢子菌(Coccidioides posadasii)是一种能引起肺球孢子菌病的致病菌, 在宿主死亡后以菌丝形态生长在尸体和附近的土壤[3]。采用微卫星位点分析不同地区的波萨达斯球孢子菌表明, 南美的波萨达斯球孢子菌是由美国德克萨斯州的人类或其它哺乳动物南迁带来的[4]。菌丝态还有利于病原真菌从体外侵染宿主, 比如秕糠马拉癣菌(Malassezia furfur)和威尼克外瓶霉菌(Exophiala werneckii)采用菌丝形态侵入人类的表皮表层引起皮肤病[5]。当病原真菌侵入宿主后, 多存在于宿主的吞噬细胞中, 在那里它们与免疫系统的其它部分隔绝。由于吞噬细胞内菌丝的长期生长会导致细胞破裂, 从而使真菌暴露在宿主免疫系统中, 所以一些病原真菌会在宿主体内由多细胞的菌丝生长转换为单细胞的酵母生长[6]。还有一些病原真菌使用酵母细胞形态逃避宿主的免疫防御并改变宿主行为, 偏侧蛇虫草菌(Ophiocordyceps unilateralis)的酵母样细胞能够侵入多刺蚁(Polyrhachis ants)的肌肉或神经系统, 控制蚂蚁离开蚁穴, 找到合适的叶子或树枝后紧紧咬住后等待死亡[7]。
球孢白僵菌(Beauveria bassiana)是一种国内外广泛使用的广谱性昆虫病原真菌, 在我国主要用来防治马尾松毛虫和玉米螟, 取得了良好的效果[8-10]。相对于化学杀虫剂, 球孢白僵菌主要有保护生态系统、对环境无污染、对人体无害等优点。作为一种国内外广泛使用的昆虫病原真菌, 其与宿主的相互作用被当作模式系统进行研究。球孢白僵菌一方面可以通过宿主的体壁、气孔等途径外部侵入, 另一方面可以通过呼吸道和消化道等途径内部侵入[11]。在侵染循环中, 球孢白僵菌主要经历了分生孢子, 菌丝和芽生孢子三种形态[12]。分生孢子形态有利于球孢白僵菌随风扩散和黏附到宿主体表; 菌丝形态有利于侵入宿主体壁和摄取营养; 芽生孢子形态会释放细胞表面的碳水化合物, 以逃避宿主免疫系统的检测, 有利于球孢白僵菌在宿主体内的增殖[13]。
本次研究模拟了球孢白僵菌在侵染宿主时的形态转换, 具体为分生孢子萌发形态, 营养菌丝产孢形态和芽生孢子的繁殖形态, 通过RNA-Seq的手段寻找他们之间的关联。
1 材料与方法 1.1 菌株实验中使用的菌株为球孢白僵菌B.bassiana ARSEF 2860。
1.2 培养基的配置SDAY培养基: 4%葡萄糖、1%蛋白胨、1%酵母粉和2%琼脂。
GB培养基: 2%蔗糖、0.5%蛋白胨。
NLB培养基: 4% 葡萄糖、0.4% 硝酸铵、0.3% 磷酸二氢钾和0.3% 硫酸镁。
1.3 样本的培养产孢形态: 将新鲜的球孢白僵菌分生孢子放到0.02%的吐温80中混合均匀, 调到悬浮液浓度为107 mL-1, 取100 mL的孢子悬浮液涂布到含有玻璃纸的SDAY培养基上, 在恒温25 ℃, 12 h光照12 h黑暗的环境下倒置培养6 d, 取下玻璃纸上的菌丝快速放到液氮中速冻, 然后放到-80 ℃冰箱待用[14]。
萌发形态: 从在SDAY培养基上生长14 d的菌丝上收集新鲜分生孢子, 用0.02%的吐温80悬浮后在漩涡振荡器上混匀, 接种到GB培养基中使其终浓度为106 mL-1。在25 ℃的摇床中培养, 通过血球计数板测量分生孢子的萌发率, 当萌发50%左右时终止培养, 离心收集菌体并用PBS洗涤两次后吸干上清液, 放入液氮中速冻, 然后放到-80 ℃冰箱中待用。
芽生孢子形态: 将新鲜球孢白僵菌菌丝接种到NLB培养基中培养48 h, 然后滤纸过滤除去菌丝, 收集芽生孢子后调节菌液浓度为106 mL-1, 再重新接种到NLB培养基中培养72 h, 离心收集芽生孢子并用PBS缓冲液洗涤两次后吸干上清液, 放入液氮中速冻, 然后放到-80 ℃冰箱中待用。
1.4 RNA的提取将收集的样品在液氮中研磨成粉末状, 然后取适量体积放入1.5 mL的离心管中, 加入1 mL的Trizol, 在漩涡震荡仪上震荡3 min后, 在室温下静置5 min。把冷冻离心机调到4 ℃预冷, 等温度恒定后将离心管12 000 r/min离心10 min。取上清液至新的1.5 mL离心管, 加入等体积的异戊醇上下颠倒混匀, 在-20 ℃冰箱中静置1 h后, 在4 ℃离心机再次12 000 r/min离心15 min。弃上清, 加入1 mL 75%乙醇, 用移液枪吹洗沉淀。在4 ℃下10 000 r/min离心3 min, 吸去上清液, 放在冰上晾干。最后用30 μL DEPC水溶解沉淀[15]。
1.5 mRNA建库与测序分析本文章的建库与测序分析交由华大基因公司负责。
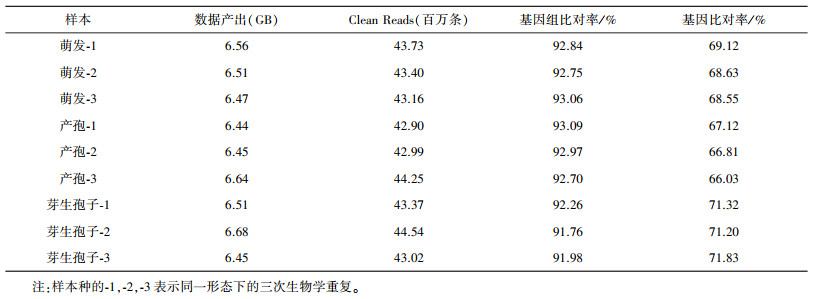
2 结论和分析 2.1 转录组测量数据的基础分析利用华大基因的BGISEQ-500平台, 本项目对球孢白僵菌3种形态下的9个样本(每种形态3个重复样本)进行分析, 每个样本得到约6.5 GB的数据。每个样本得到的clean reads数超过4千万条(表 1)。
| 表 1 转录组测序数据的基础分析 |
 |
2.2 三种形态下表达的基因差异
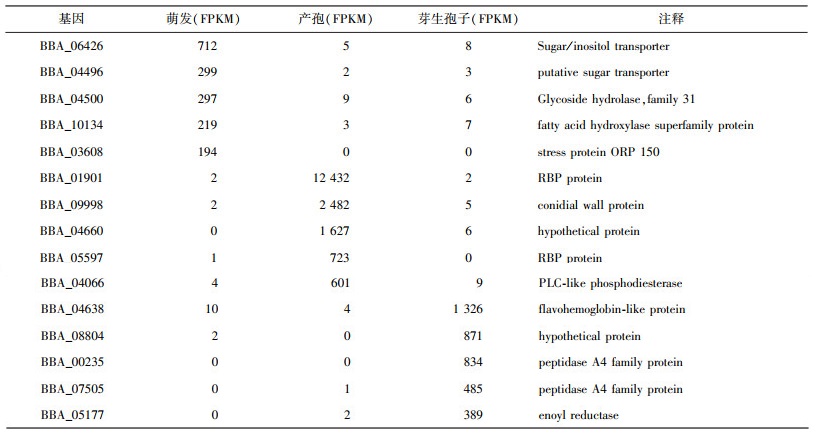
通过转录组测序, 萌发形态表达了5 995个基因, 产孢形态表达了6 083个基因, 而芽生孢子形态下表达的基因数量最多, 达到了6 137个基因, 其中5 029个基因是三种形态下共同表达的(FPKM>10, 图 1)。基因表达数目最多的芽生孢子形态比基因表达数目最小的萌发形态只多了142个基因, 占芽生孢子态基因表达数目的2.3%, 说明三种形态下表达的基因数量差别并不大。每一种形态下都有自己独特的表达基因, 比如在萌发形态中MFS transporter(BBA_06426和BBA_04496), 产孢形态中的chitinase(BBA_09998)和芽生孢子形态的nitric oxide dioxygenase(BBA_04638)。表 2中按平均表达量从高到低展示了在每种形态下特异表达的前五个基因。
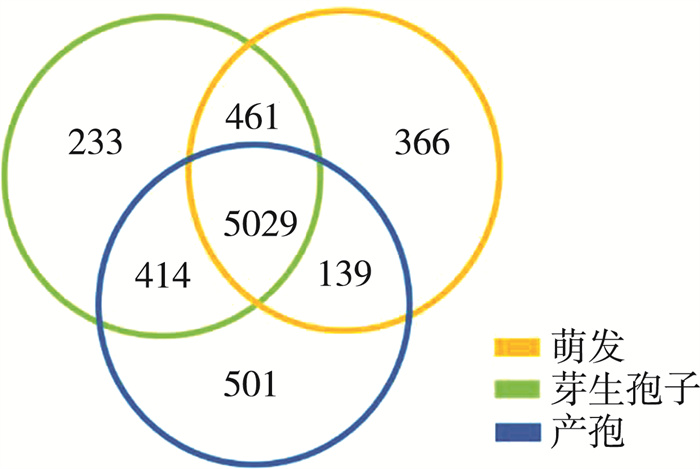 |
| 图 1 萌发、产孢和芽生孢子三种形态下基因表达的数目, 筛选标准FPKM>10 |
| 表 2 在每种形态下会特异表达的基因 |
 |
2.3 种形态下基因表达量差异性
将差异基因的阈值设置为log2 FC>2, Qvalue < 0.001来对3种形态下基因的表达量进行对比。萌发与产孢之间的差异基因数量最多(2 196个), 产孢与芽生孢子有1 454个差异基因, 萌发与芽生孢子有1 280个差异基因(图 2)。有236个基因会随着球孢白僵菌形态的改变显著改变自己的表达量, 并且在每种形态下的表达量都不相同(图 2A)。对这236个基因进行GO富集分析, 结果显示有94个基因富集在catalytic activity, 34个基因富集在了oxidoreductase activity, 50个基因富集在与membrane相关的目录(图 2B)。
 |
| A.关于差异基因数目的Veen图, 筛选标准为log2 FC>2, Qvalue < 0.001。B.236个基因的GO富集图, 从上往下按Qvalue值由小到大排列, 蓝色越深Qvalue越小; 圆点的大小代表了基因数目, 基因数目越多越大; Rich Ratio等于选定的基因集中注释到某一条目的基因数与本物种注释到该条目录基因数的比值。 图 2 球孢白僵菌3种形态差异基因的数目与GO富集分析 |
3 结论
球孢白僵菌的形态转换与其致病生理过程息息相关, 对其不同形态下基因表达水平的研究能让我们更清楚的了解球孢白僵菌的生长与致病机理。本文通过转录组测序手段, 去探索球孢白僵菌三种形态之间的区别与联系, 为后期的形态学研究打下了基础, 同时指明了方向。我们下一步将从了解单个基因出发, 逐步破解球孢白僵菌形态转换的密码, 以期望有一天我们可以使用基因工程改造出理想的菌株。
| [1] |
GAUTHIER G M, GOLDMAN W E. Dimorphism in fungal pathogens of mammals, plants, and insects[J]. PLoS Pathogens, 2015, 11(2): e1004608. DOI:10.1371/journal.ppat.1004608 |
| [2] |
GAUTHIER G, KLEIN B S. Insights into fungal morphogenesis and immune evasion: fungal conidia, when situated in mammalian lungs, may switch from mold to pathogenic veasts or sport-forming shpherules[J]. Microbe Magazine, 2008, 3(9): 416-423. DOI:10.1128/microbe.3.416.1 |
| [3] |
SHARPTON T J. Comparative genomic analyses of the human fungal pathogens Coccidioides and their relatives[J]. Genome Research, 2009, 19(10): 1722-1731. DOI:10.1101/gr.087551.108 |
| [4] |
FISHER M C, KOENIG G L, WHITE T J, et al. Biogeographic range expansion into South America by Coccidioides immitis mirrors New World patterns of human migration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(8): 4558-4562. DOI:10.1073/pnas.071406098 |
| [5] |
HOOG G S D, GUHO E. White Piedra, Black Piedra, and Tinea Nigra[M]. New Jersey: John Wiley & Sons, Ltd, 2010.
|
| [6] |
BOYCE K J, ANDRIANOPOULOS A. Fungal dimorphism: the switch from hyphae to yeast is a specialized morphogenetic adaptation allowing colonization of a host[J]. FEMS Microbiology Reviews, 2015, 39(6): 797-811. DOI:10.1093/femsre/fuv035 |
| [7] |
EVANS H C, ELLIOT S L, HUGHES D P. Ophiocordyceps unilateralis: A keystone species for unraveling ecosystem functioning and biodiversity of fungi in tropical forests[J]. Communicative & Integrative Biology, 2011, 4(5): 598-602. |
| [8] |
MEYLING N V, EILENBERG J. Ecology of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae in temperate agroecosystems: potential for conservation[J]. biological control. Biological control, 2007, 43(2): 145-155. DOI:10.1016/j.biocontrol.2007.07.007 |
| [9] |
LU D, PAVA-RIPOLL M, LI Z, et al. Insecticidal evaluation of Beauveria bassiana engineered to express a scorpion neurotoxin and a cuticle degrading protease[J]. Applied Microbiology & Biotechnology, 2008, 81(3): 515. |
| [10] |
赫英伟. 白僵菌的研究概况[J]. 黑龙江农业科学, 2010(4): 145-147. |
| [11] |
田志来, 阮长春, 李启云, 等. 球孢白僵菌对昆虫致病机理的研究进展[J]. 安徽农业科学, 2008, 36(36): 16000-16002. DOI:10.3969/j.issn.0517-6611.2008.36.090 |
| [12] |
QIU L, ZHANG J, SONG J Z, et al. Involvement of bbtpc1, an important Zn(Ⅱ)2Cys6 transcriptional regulator, in chitin biosynthesis, fungal development and virulence of an insect mycopathogen[J]. International Journal of Biological Macromolecules, 2021, 166: 1162-1172. DOI:10.1016/j.ijbiomac.2020.10.271 |
| [13] |
邱磊. 球孢白僵菌组氨酸激酶家族, 核激酶Wee1和磷酸化酶Cdc25的功能解析[D]. 杭州: 浙江大学, 2014.
|
| [14] |
朱静. 球孢白僵菌适应环境pH变化及胞内pH稳态维持的遗传分子基础及其对生物防治潜能的贡献[D]. 杭州: 浙江大学, 2016.
|
| [15] |
魏晓宇. 6-磷酸海藻糖磷酸酯酶在球孢白僵菌抗逆和侵染过程中的功能和机制[D]. 济南: 齐鲁工业大学, 2019
|
 2022, Vol. 36
2022, Vol. 36


