| GLP-1毕赤酵母表达载体的构建及重组菌株的筛选 |
近年来,2型糖尿病的发病率逐年升高,已经成为危害全世界人类健康的重大疾病之一,它会严重引发人体代谢紊乱,其发病机制为胰岛素抵抗和胰岛β细胞功能逐渐下降[1]。据统计2014年全球大约有2.46亿糖尿病患者,2025年将达到3.87亿,其中2型糖尿病患者占总数的90%~95%。已成为继肿瘤,心血管疾病之后第三大严重威胁人类健康的慢性非传染性疾病。其昂贵的治疗费用已成为全世界人民和国家的沉重负担[2-3]。
研究表明,越来越多的治疗2型糖尿病的药物正在进行研究当中,如胰高血糖素类似物(GLP)-1就是其中研究的比较热门的一个方向[4]。GLP-1的生理功能主要包括:通过G蛋白偶联受体使细胞内CAMP浓度增加, 促进胰岛素分泌; 通过调节胰岛素基因表达, 增加胰岛素的生物合成; 增加β细胞积聚, 促进新的β细胞从胰管上皮组织细胞分化, 减少细胞凋亡; 剂量依赖性延缓胃的排空; 通过调节胰岛素和胰高血糖素分泌而影响葡萄糖代谢; 通过作用于下丘脑的GLP-1受体产生短暂饱胀感减退食欲, 降低热量摄取[5]。
GLP-1在用于糖尿病治疗上有很大的前景,科研人员也正在对其做大量的科学研究。目前,构建毕赤酵母重组菌株表达蛋白药物技术日趋成熟[6-7]。此项技术可以在GLP-1新型药物的开发中有着十分重要的作用。
为了探索新的研究方法,本文构建了GLP-1基因的毕赤酵母表达载体,转化进入毕赤酵母GS115菌株,为进一步的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒和试剂pPICZαA质粒为本实验室构建保存;DNA polymerase和XbaI,XhoI限制性内切酶购自TaKaRa公司;DNA Marker700、2000、5000购自上海生工公司;质粒小提中量试剂盒DNA胶回收试剂盒购自上海生工公司。目的基因委托上海生工合成。
1.1.2 菌株大肠杆菌DH5α、酵母菌株GS115为本实验室保存。
1.2 方法 1.2.1 目的基因序列的设计利用Vector NTI Advance软件查找、对比和分析设计GLP-1基因序列,在选择好的基因序列上游引入XbaI酶切位点,在下游引入XhoI酶切位点。设计完毕送至上海生工进行合成。
1.2.2 目的基因的获取目的基因合成完毕,得到插入目的基因GLP-1的pUC57质粒,将此质粒转化进大肠杆菌感受态细胞DH5α中扩增此质粒。利用质粒小提中量试剂盒提取质粒。利用XbaI和XhoI限制性内切酶双酶切扩增的pUC57质粒。然后进行琼脂糖凝胶电泳,把含有目的基因GLP-1的凝胶切下利用胶回收试剂盒进行纯化回收得到双酶切的目的基因片段。
1.2.3 pPICZαA质粒的获取和双酶切将pPICZαA转化进入大肠杆菌DH5α感受态细胞中进行扩增,利用质粒小提中量试剂盒提取质粒,利用XbaI和XhoI限制性内切酶双酶切此质粒。
1.2.4 重组表达载体的构建将双酶切得到的GLP-1基因和pPICZαA质粒利用T4连接酶在25 ℃下连接1 h。连接完将连接产物转化进入大肠杆菌DH5α感受态细胞中。涂布含有50 μg/mL博来霉素的LB平板上,37 ℃避光培养过夜至单克隆出现。
1.2.5 重组质粒阳性克隆鉴定和测序验证将得到的单克隆挑取到含有50 μg/mL博来霉素的LB液体培养基中37 ℃震荡培养过夜。利用质粒小提中量试剂盒提取质粒。然后利用XbaI和XhoI限制性内切酶双酶切此质粒,将酶切液上样进行琼脂糖凝胶电泳,在100~200bp之间出现了目的条带GLP-1相同大小的条带。将提取的质粒作为DNA模板,以引物进行PCR验证筛选。反应条件为:94 ℃预变性3 min, 94 ℃正式变性30 s;56.9 ℃ 30 s; 72 ℃ 30 s; 72 ℃ 10 min; 4 ℃保温;共进行30个循环。然后进行琼脂糖凝胶电泳后在100~200 bp之间也出现了与GLP-1相同位置的基因片段。将两种方法都验证成功的质粒送上海生工科技有限公司测序。测序验正正确的质粒命名为pPICZαA-GLP-1。
1.2.6 重组质粒的毕赤酵母转化及阳性克隆子的PCR验证利用质粒小提中量试剂盒大量提取pPICZαA-GLP-1重组质粒, 使用限制性内切酶ScaI单酶切此质粒,使其线性化后进行切胶回收。使用氯化锂法将线性化的pPICZαA-GLP-1导入毕赤酵母GS115感受态细胞中, 涂布于含有100 μg/mL的YPDS平板上, 30 ℃培养直至单个菌落出现(酵母感受态细胞制备和电转化的详细步骤参照Invitrogen公司多拷贝毕赤表达试剂盒说明书)[8-10]。挑取单菌落, 提取基因组DNA作为模板, 使用引物进行PCR验证阳性克隆子。
2 结果与分析 2.1 基因序列的合成与酶切验证GLP-1基因委托上海生工科技有限公司合成,合成后测序得到的基因序列和最初设计的基因序列完全一致,见表 1,表中加下划线的碱基序列CTCGAG为限制性内切酶XhoI的酶切位点,碱基序列TCTAGA为XbaI的酶切位点;利用XbaI和XhoI限制性内切酶双酶切验证4个质粒均在120bp左右出现了明显的目的基因GLP-1条带,见图 1。
| 表 1 GLP-1基因序列对比 |
 |
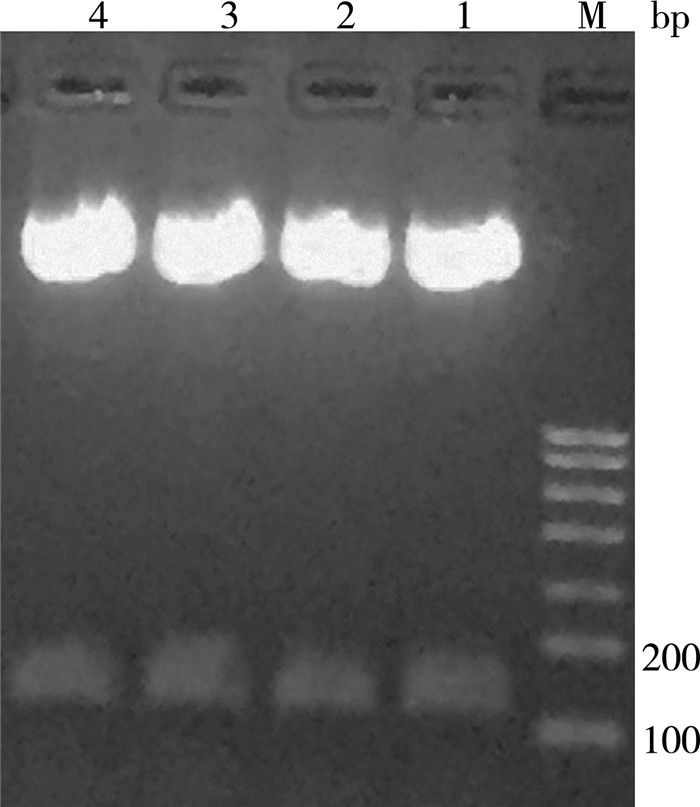 |
| M:DNA Marker D 2000;1-4:4个pUC57-GLP-1质粒双酶切 图 1 pUC57-GLP-1质粒双酶切凝胶图 |
2.2 表达质粒的构建
将2.1酶切的目的基因GLP-1与经过相同酶切处理的表达载体pPICZαA用T4 DNA连接酶连接, 并转化大肠杆菌感受态细胞DH5α。提取转化子的质粒用XhoI和XbaI进行双酶切鉴定及核酸序列的测定。重组质粒的克降送上海生工科技有限公司公司测序, 通过BLAST比对可知, 构建的序列与合成的序列100%吻合。而在图 2中, 1、3、4重组质粒经双酶切后在120 bp左右有明显条带, 证明成功构建出pPICZαA-GLP-1表达载体。
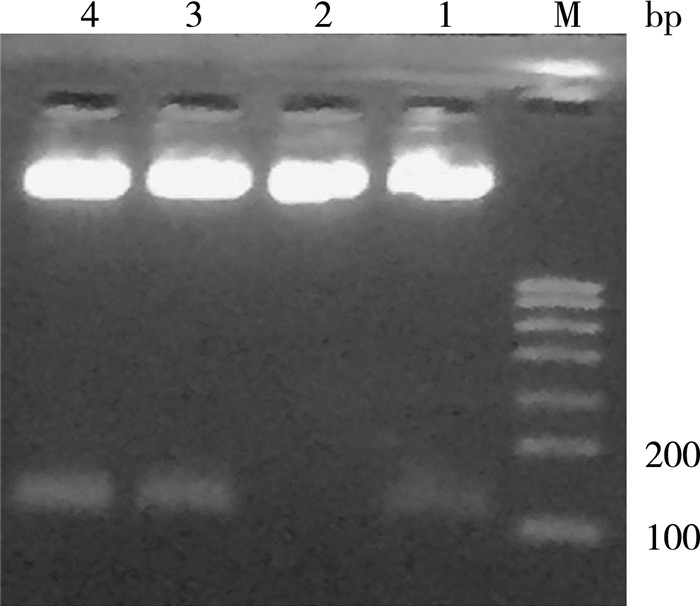 |
| M:DNA Marker D 2000;1-4:4个重组质粒双酶切 图 2 重组表达载体双酶切凝胶图 |
2.3 酵母转化子的PCR筛选
新构建的pPICZαA-GLP-1表达质粒经线性化后转化进入毕赤酵母GS115中,培养到单克隆出现, 挑取单克隆进行培养, 进行PCR验证,并且送至上海生工科技有限公司进行测序后序列完全吻合。结果如图 3所示,1-3转化子在120 bp左右出现了明显的GLP-1目的基因条带。验证了表达pPICZA-GLP-1成功转化进入了毕赤酵母GS115中。
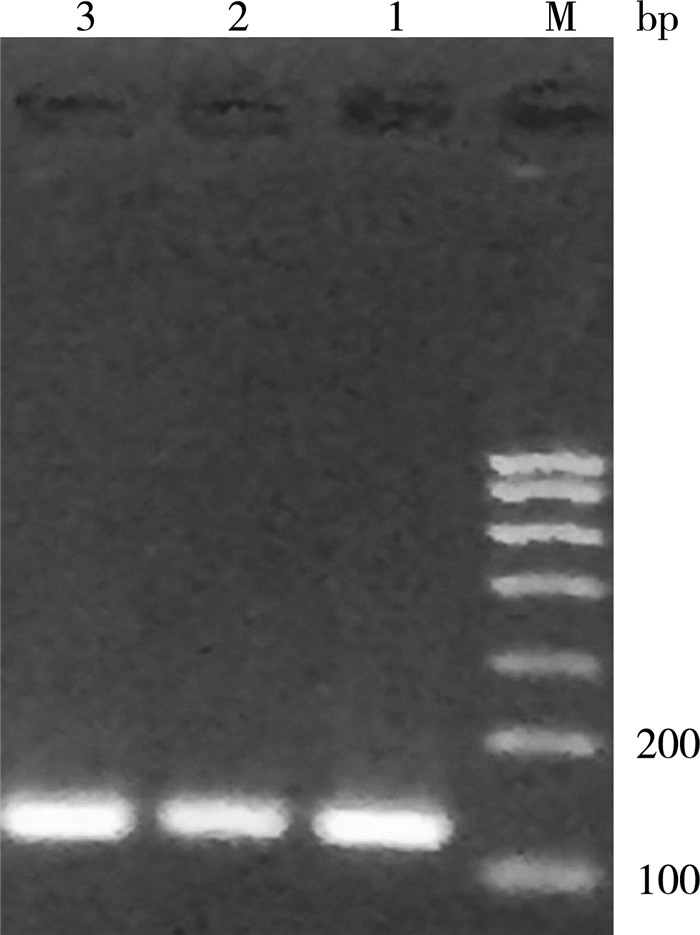 |
| M:DNA Marker D 2000;1-3:3个重组子PCR产物 图 3 重组子菌落PCR产物凝胶图 |
3 结论
GLP-1是人胰高血糖素样肽类似物,大量的研究表明GLP-1具有十分显著的口服降糖作用[11]。因此,对于它的各种新型口服药剂的研究正在大量进行。随着糖尿病等慢性疾病的流行和快速发展,用益生菌活细胞作为缓释“胶囊”的新型给药系统正悄然兴起,给糖尿病患者带来了康复的希望[10-12]。
本文成功构建了毕赤酵母高效表达载体pPICZA-GLP-1。为以后GLP-1能够在毕赤酵母中进行高效表达分泌奠定了坚实的基础。对开发GLP-1新型药物做出了贡献。
| [1] |
宋智慧, 王璐, 纪立伟, 等. GLP-1类似物在2型糖尿病中的临床应用进展[J]. 中国新药杂志, 2013, 22(5): 541-542. |
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南[M]. 北京: 北京大学医学出版社, 2010: 21-23.
|
| [3] |
王一然, 翟骁, 王奇金. GLP-1及其类似物对减缓骨质疏松作用的研究进展[J]. 中国骨质疏松杂志, 2015, 21(6): 752-754. |
| [4] |
FONSECA VA. New developments in diabetes management:medications of the 21st century[J]. Clin Ther, 2014, 36(4): 477-482. DOI:10.1016/j.clinthera.2014.01.018 |
| [5] |
OH S, LEE M, KO K S. GLP-1 gene delivery for the treatment of type 2 diabetes[J]. Mol Ther, 2003, 7(4): 478-483. DOI:10.1016/S1525-0016(03)00036-4 |
| [6] |
SHINY K, MARTIN B, GOLDON E. Modulation of taste sensitivity by GLP-1 signaling[J]. J Neuiochem, 2008, 106(1): 455-460. DOI:10.1111/j.1471-4159.2008.05397.x |
| [7] |
孙文秀. 大豆疫霉多聚半乳糖醛酸酶pspg1基因毕赤酵母表达载体的构建[J]. 安徽农业科学, 2009, 37(19): 8895-8897. DOI:10.3969/j.issn.0517-6611.2009.19.041 |
| [8] |
吴日, 马超, 李晓丹, 等. 长效促胰岛素降糖酵母的构建及其对糖尿病模型小鼠的治疗效果[J]. 遗传, 2015, 37(2): 183-191. |
| [9] |
AMBERGD C, 霍克克译. 酵母遗传学方法实验指南(第二版)[M]. 北京: 科学出版社, 2009, 78-79.
|
| [10] |
HOU J H, YAN R X, YANG L Q, et al. High-level expression of fusion protein containing 10 tandem repeated GLP-1 analogs in yeast Pichia Pastoris and its biological activity in a diabetic rat model[J]. Biosci Biotechno Biochem, 2007, 71(6): 1462-1469. DOI:10.1271/bbb.60694 |
| [11] |
YIN X, WEI D, YI L, et al. Expression and purification of exendin-4, a GLP-1 receptor agonist, in Escherichia coli[J]. Protein Expr Purif, 2005, 41(2): 259-265. DOI:10.1016/j.pep.2004.10.014 |
| [12] |
LOPES T S, WIJS I J, STEENHAUER S I, et al. Factors affecting the mitotic stability of high-copy-number integration into the ribosomal DNA of Saccharomyces cer-evisiae[J]. Yeast, 1996, 12(5): 467-477. DOI:10.1002/(SICI)1097-0061(199604)12:5<467::AID-YEA933>3.0.CO;2-3 |
 2016, Vol. 30
2016, Vol. 30


