| 产埃博霉素B纤维堆囊菌发酵条件的优化 |
纤维堆囊菌(Sorangium cellulosum)是一类广泛存在于土壤、海水以及腐败植物中的革兰氏阴性菌[1]。1993年德国国家生物技术中心(GBF)的G.Höfle等人从纤维堆囊菌菌株发酵液中分离出新型的细胞毒化合物埃博霉素(Epothilone)[2]。埃博霉素有A~H八种衍生物,其中最常见的是A、B两种。埃博霉素具有和紫杉醇相似的抗癌作用,但埃博霉素比紫杉醇结构更简单、更容易进行化学修饰、水溶性更好,同时可以对紫杉醇耐药型肿瘤细胞起到更好的抑制作用[3]。从2007年百美时施贵宝(Squibb)公司的埃博霉素B内酰胺类似物Ixabepilone(aza-epothilone B, BMS-247550) 注射剂得到美国FDA批准上市以来[4],已有7种埃博霉素衍生物应用于临床,大量临床研究结果显示出该类化合物有极大的药用价值[5]。
目前埃博霉素主要通过纤维堆囊菌的发酵进行生产,但纤维堆囊菌本身具有生长缓慢、生长密度依赖性强、易染杂菌、发酵周期长、产量低、不稳定、易受环境影响[6]等特点。王大红等[7]人通过对纤维堆囊菌发酵条件的优化,使埃博霉素B的产量达到28.24 mg/L,但产量仍较低。本文以实验室保藏的So ce2161为出发菌株,为提高埃博霉素B的产量,降低生产成本,通过一系列单因素和正交实验对纤维堆囊菌发酵条件进行优化,为后续的大规模工业化生产奠定基础。
1 材料与方法 1.1 实验材料 1.1.1 菌株纤维堆囊菌So ce2161,由实验室保藏。
1.1.2 主要试剂埃博霉素B标准品(纯度≥98%)购自美国MCE公司,其他试剂均为国产分析纯。
1.1.3 培养基1) CNST培养基(g/L):硝酸钾0.6,无水硫酸镁0.4,磷酸氢二钠0.7,EDTA-Fe(0.01 mol/L)0.5 mL,微量元素1 mL,琼脂20。
2) M26培养基(g/L):马铃薯淀粉7.5,酵母浸粉2.5,蛋白胨2.5,葡萄糖1.5,无水硫酸镁0.5,EDTA-Fe(0.01 mol/L)0.5 mL,微量元素1 mL。
3) 发酵培养基(g/L):在M26培养基基础上添加氯化钙1.5,玉米浆2 mL,大孔树脂XAD-16 18。
以上培养基均调节pH=7.2后,置于0.1 MPa条件下灭菌30 min。
1.1.4 仪器设备高效液相色谱仪(日本岛津分析仪器有限公司生产,型号GC-17A);高速离心机(长沙湘仪离心机仪器有限公司,型号TG16-WS);高温蒸汽灭菌锅(济南龙瑞商贸有限公司,型号G154DWS);恒温振荡培养箱(太仓市实验设备厂,型号HLG-A);恒温培养箱(宁波江南仪器厂,型号SPX);磁力搅拌器(江苏金城国胜实验仪器厂,型号79-1)。
1.2 实验方法 1.2.1 培养方法1) 种子培养
将保藏于甘油管中的So ce2161菌株接种于置有滤纸(直径1.5 cm)的CNST固体培养基上,平板倒置放于30 ℃恒温培养箱中静置培养144~168 h。用接种铲将菌体从平板转移至M26液体培养基中。将装有M26液体培养基的三角瓶置于30 ℃、140 r/min恒温振荡培养箱中培养60 h。
2) 发酵培养
以10%接种量对发酵培养基进行接种,将装有发酵培养基的三角瓶置于30 ℃、140 r/min恒温振荡培养箱中培养6~7 d。
1.2.2 埃博霉素B含量测定方法色谱柱规格:岛津C18,250 mm×4.6 mm×5 μm。色谱条件:检测波长249 nm;柱温40 ℃;流动相(甲醇:水=65:35),流速1.0 mL/min;进样量20 μL[8]。
1.3 发酵条件单因素优化 1.3.1 最佳发酵温度的确定发酵培养过程中,设置温度分别为28、30、32、34、36 ℃,在适宜的条件下培养,发酵结束后用蒸馏水补至最初体积,检测发酵液中的埃博霉素B的含量以确定最佳的发酵温度。
1.3.2 最佳初始pH的确定利用得到的最佳发酵温度进行实验,设置pH分别为6.8、7.0、7.2、7.4、7.6,确定最佳初始pH。
1.3.3 最佳转速的确定利用上述得到的最佳发酵条件进行实验,设置转速分别为120、140、160、180、200 r/min,确定最佳转速。
1.3.4 最佳接种量的确定利用上述得到的最佳发酵条件进行实验,将培养至对数期的种子液,设置接种量分别为2%、4%、6%、8%、10%,接种到发酵培养基中,确定最佳接种量。
1.3.5 最佳装液量的确定利用上述得到的最佳发酵条件进行实验,设置培养液体积分别为40、50、60、70、80 mL,确定最佳装液量。
1.3.6 最佳发酵时间的确定利用上述得到的最佳发酵条件进行实验,设置发酵时间分别为3、4、5、6、7 d,确定最佳发酵时间。
1.3.7 最佳种龄的确定利用上述得到的最佳发酵条件进行实验,分别选取培养到36、48、60、72、84 h种子液,接种到发酵培养基中,确定最佳种龄。
1.3.8 最佳溶氧量的确定改变三角瓶的形状,以普通三角瓶组为对照组,以挡板三角瓶组为实验组,利用上述得到的最佳发酵条件进行实验,确定最佳溶氧量。
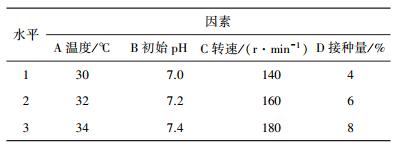
1.4 正交实验设计上述8个单因素均对埃博霉素B产量有影响,经全面考虑选择温度、初始pH、转速、装液量上述4个对埃博霉素B产量影响较大的因素作为实验因素,并分别记作A、B、C、D进行四因素三水平正交实验,见表 1。
| 表 1 因素水平表 |
 |
2 结果分析 2.1 单因素实验对产量的影响 2.1.1 温度对产量的影响
在微生物生长代谢过程中酶起到了关键作用,而温度又直接影响着酶的活性。通常情况下,过高或过低的温度都会影响酶的活性,低温抑制酶的活性,高温会使酶失活。微生物在不同的生长阶段对温度的需求也有所不同。本实验选用5组不同的温度进行实验,结果如图 1所示。
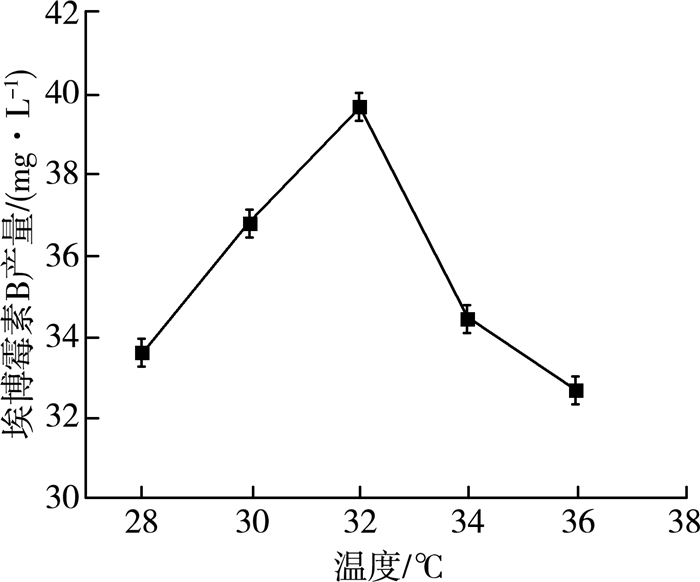 |
| 图 1 温度对埃博霉素B产量的影响 |
由图 1可以看出,随着温度的升高,埃博霉素B的产量逐渐升高,在32 ℃时产量达到最大,产量为39.71 mg/L。随着温度的继续升高,在超过32 ℃后埃博霉素B的产量呈下降趋势,这可能因为在较高的温度下纤维堆囊菌合成埃博霉素B的反应受到抑制,破坏细胞的反应趋于强势。可以得出结论:32 ℃为纤维堆囊菌产埃博霉素B的最适温度。
2.1.2 初始pH对产量的影响pH对微生物的影响主要是通过对细胞膜和酶的影响来实现的。微生物通常可以在某一pH范围内生长,但总会在某个合适的pH条件下活性最高,这一pH称为最适pH。在32 ℃、转速140 r/min、8%(V/V)接种量、60 mL/250 mL装液量、发酵5 d时间、接种种子液种龄60 h条件下,通过5组不同的pH进行实验,实验结果如图 2所示。
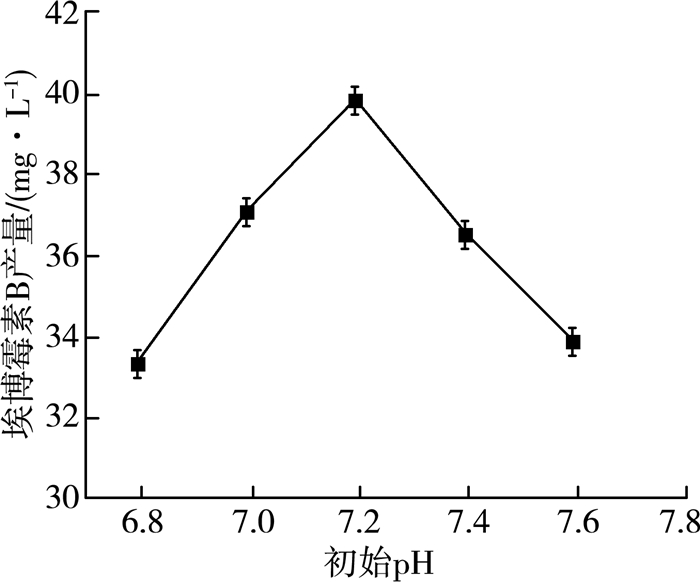 |
| 图 2 pH对埃博霉素B产量的影响 |
由图 2可以看出,随着pH的逐渐升高,埃博霉素B的产量也逐渐增大,pH为7.2时埃博霉素B的产量最高,此pH为纤维堆囊菌产埃博霉素B的最适pH。在pH超过7.2后产量逐渐减小,可能是因为随着pH的升高,纤维堆囊菌的细胞膜受到破坏[9],参与合成埃博霉素B相关酶的活性受到抑制。
2.1.3 转速对产量的影响纤维堆囊菌发酵产埃博霉素B是耗氧发酵过程。从理论上推断,氧气供给量越大,埃博霉素B产量越高。恒温振荡培养箱的转速是影响氧气供给的一个关键因素。在32 ℃、pH=7.2、8%(V/V)接种量、60 mL/250 mL装液量、发酵5 d时间、接种种子液种龄60 h条件下,通过5组不同的转速值进行实验,实验结果如图 3所示。
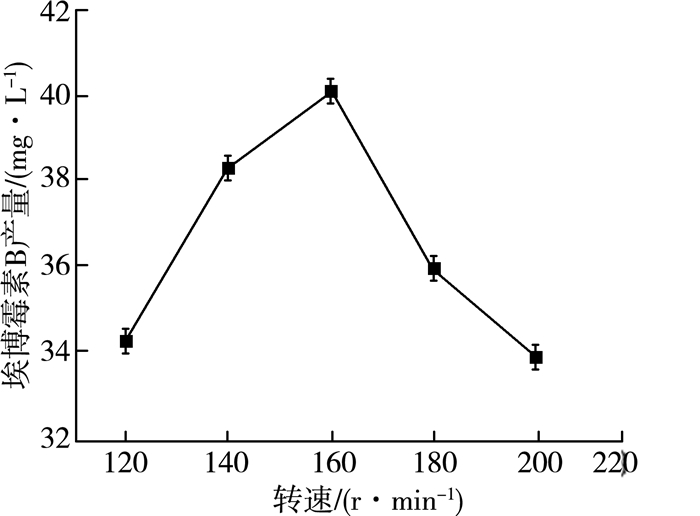 |
| 图 3 转速对埃博霉素B产量的影响 |
由图 3可以看出:随着恒温振荡培养箱转速的逐渐升,高埃博霉素B的产量也逐渐增大,这一趋势符合理论推理。转速为160 r/min时埃博霉素B产量达到最大,为40.18 mg/L。随着转速的继续增大,埃博霉素B的产量出现下降趋势。推测可能由于过高的转速使体系中培养液的湍流程度增强,液膜和气膜的厚度降低,从而导致传质阻力减小而液相传质系数增大[10]。另一方面的原因可能是,由于氧气供给量的提高,致使纤维堆囊菌分泌到胞外的粘液增多,从而导致细胞聚团现象严重,进而影响氧气的传质效率[11],导致产量下降。
2.1.4 接种量对产量的影响纤维堆囊菌是一类具有社会性细胞行为的细菌,其主要体现在生长过程中对细胞密度依赖性很强[12]。较低接种浓度会延长细胞停滞期,甚至导致发酵失败[13],合适的接种量对产量至关重要。在32 ℃、pH=7.2、转速160 r/min、60 mL/250 mL装液量、发酵5 d时间、接种种子液种龄60 h条件下,通过5组不同的接种量进行实验,实验结果如图 4所示。
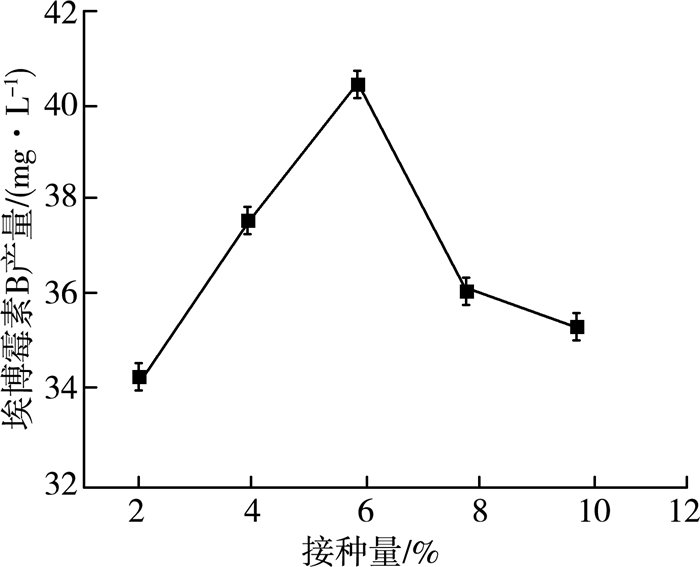 |
| 图 4 接种量对埃博霉素B产量的影响 |
由图 4可以看出:随着接种量的逐渐升高,埃博霉素B的产量也逐渐增大,最适接种量为6%。随着接种量的增大,产量出现下降趋势,推测可能是由于过大的菌体密度影响了菌体的生长,进而降低了埃博霉素B的产量。
2.1.5 装液量对产量的影响在发酵过程中,除转速外,装液量也是影响发酵体系氧气供给量的重要因素。在32 ℃、pH=7.2、转速160 r/min、6%(V/V)接种量、发酵5 d、接种种子液种龄60 h条件下,以250 mL三角瓶为发酵容器,通过5组不同的装液量进行实验,实验结果如图 5所示。
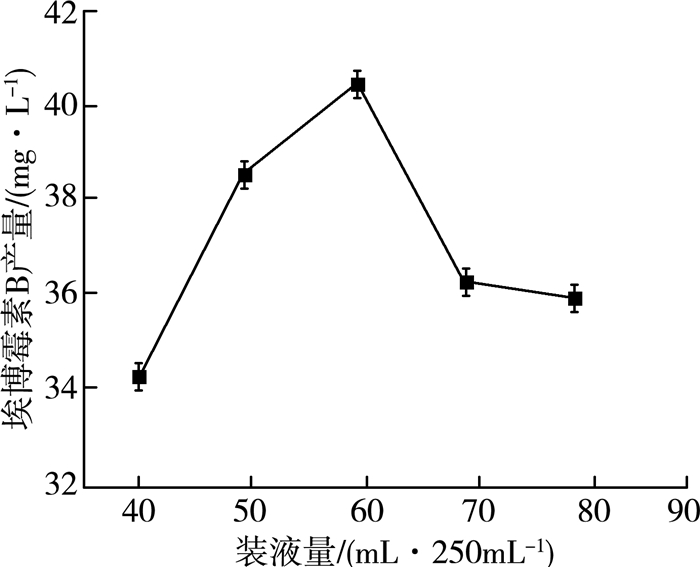 |
| 图 5 装液量对埃博霉素B产量的影响 |
由图 5可以看出:随着装液量的逐渐升高,埃博霉素B的产量也逐渐增大,在装液量为60 mL时产量达到40.53 mg/L。当装液量低于60 mL时,由于发酵体系中营养物质缺乏导致产量不高。当装液量高于60 mL时,发酵体系中的氧气供给量受到限制,从而导致产量下降。故60 mL/250 mL为最佳装液量。
2.1.6 发酵时间对产量的影响埃博霉素B是纤维堆囊菌的次级代谢产物,埃博霉素B的积累需要一定的时间。过早的结束发酵过程会影响埃博霉素B的产量,而较长时间的发酵会造成资源浪费,甚至可能导致埃博霉素B被代谢分解,从而使产量降低。在32 ℃、pH=7.2、转速160 r/min、6%(V/V)接种量、60 mL装液量、接种种子液种龄60 h条件下,通过5组不同的发酵时间进行实验,实验结果如图 6所示。
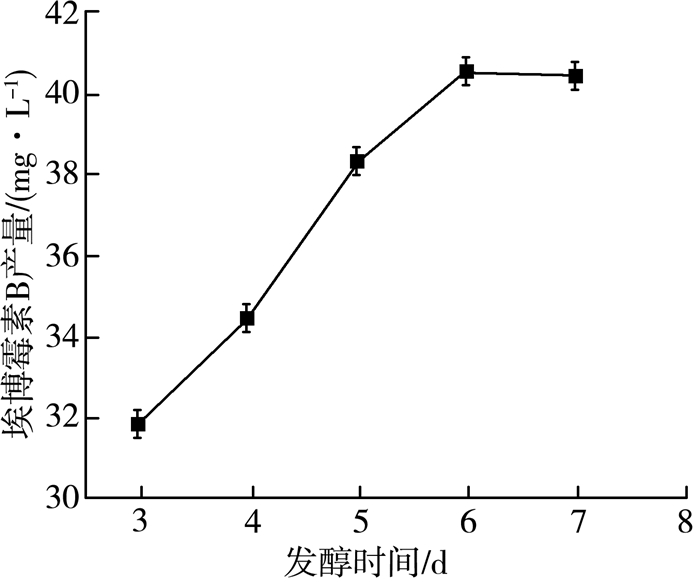 |
| 图 6 发酵时间对埃博霉素B产量的影响 |
由图 6可以看出:随着发酵时间的延长,埃博霉素B的产量也逐渐增大,在发酵进行到第6天时埃博霉素B的产量趋于稳定。从节约成本角度分析,6天发酵时间为最优。
2.1.7 种龄对产量的影响发酵过程中,种龄是衡量种子质量的一个关键因素。通常情况下我们会选择对数期的种子,这一时期的种子生长迅速,菌体量呈几何式增长,种子的活力较旺盛。在32 ℃、pH=7.2、转速160 r/min、6%(V/V)接种量、60 mL装液量、发酵6 d条件下,通过接种5组不同种龄的种子进行实验,实验结果如图 7所示。
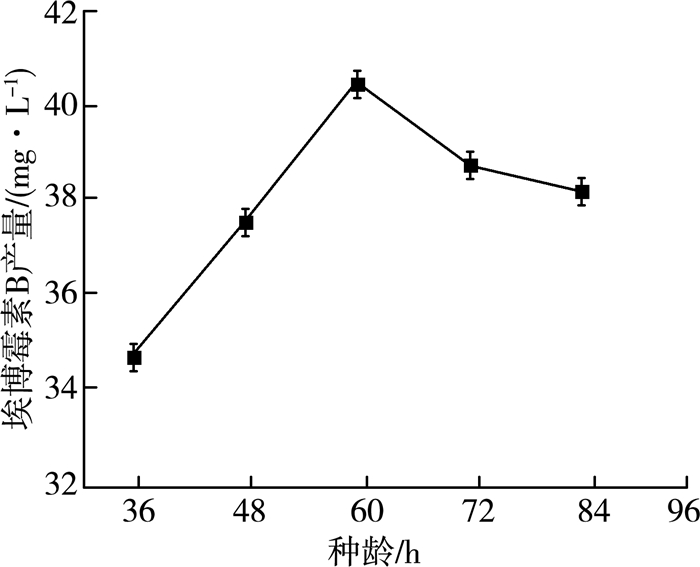 |
| 图 7 种龄对埃博霉素B产量的影响 |
由图 7可以看出,接种60 h种龄能得到最高的产量。对照该菌株的生长曲线发现60 h正处于该菌株对数期。超过60 h种龄的种子活力开始下降,从而导致埃博霉素B的产量下降。故最佳种龄为60 h。
2.1.8 溶氧量对产量的影响通过对转速和装液量的优化,在普通三角瓶发酵体系中,氧气供给量已达到最优条件。通过对三角瓶形状的改变,引进挡板三角瓶,可以进一步增强氧气的供给量,达到埃博霉素B增产的目标。在32 ℃、pH=7.2、转速160 r/min、6%(V/V)接种量、60 mL装液量、发酵6 d、接种60 h种子液的最优条件下,以普通三角瓶为对照组,以相同体积的挡板三角瓶为实验组进行实验,实验结果如图 8所示。
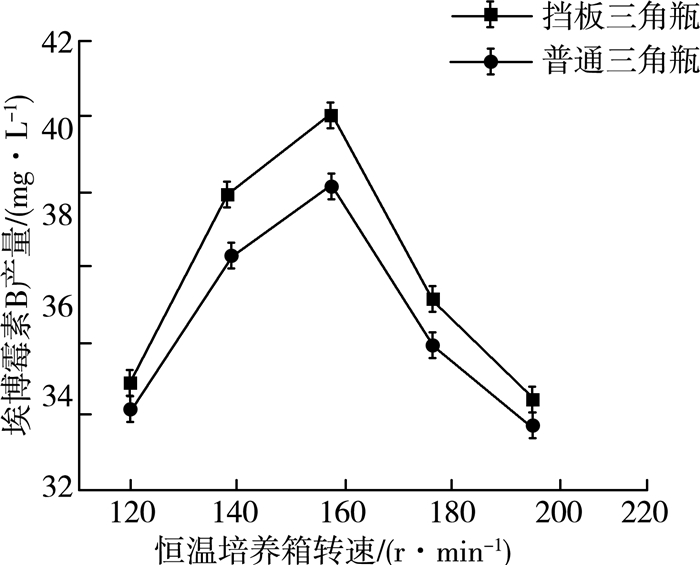 |
| 图 8 溶氧量对埃博霉素B产量的影响 |
由图 8可以看出,在不同的转速下挡板三角瓶的产量都较普通三角瓶产量高。这是由于挡板三角瓶独特的内部构造使培养液在振荡过程中与空气的接触面积增大,同时纤维堆囊菌与挡板碰撞的过程中减缓了菌体聚集抱团的现象,增大了氧气的传质速率[14],故而埃博霉素B产量提高。
2.2 正交实验通过单因素实验得到的温度(A)、初始pH(B)、转速(C)、接种量(D)四个对产量影响较大的因素,以最佳数据左右相邻的数据作为各因素的三个水平进行正交实验设计L9(34),结果如表 2所示。
| 表 2 正交实验L9(34) |
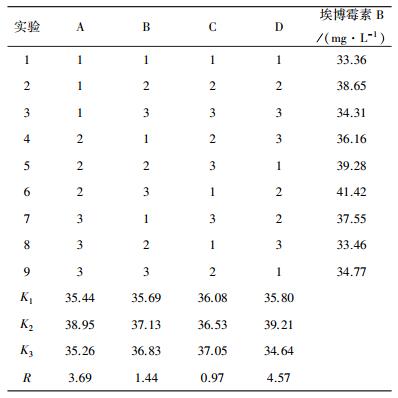 |
由表 2可以看出:RD>RA>RB>RC,即对发酵产埃博霉素B的影响:接种量>温度>初始pH>转速。同时还可以得出最优发酵条件为A2B2C3D2,即:32 ℃、pH=7.2、转速180 r/min、接种量6%。以此条件进行后续的验证实验,最终得到的埃博霉素B的产量为46.83 mg/L。
3 结论王大红等[7]选育并优化发酵条件后埃博霉素B的产量达到28.24 mg/L,龚国利等[15]通过诱变得到的突变菌株产量可达33.5 mg/L。
以纤维堆囊菌So ce2161为出发菌株,通过一系列单因素和正交实验对发酵条件进行优化,得到最佳实验条件为:使用250 mL挡板三角瓶,在温度32 ℃、初始pH=7.2、转速180 r/min、接种量6%、装液量60 mL/250 mL、发酵时间6 d、种龄60 h条件下,埃博霉素B的产量为46.83 mg/L,较未优化条件前36.92 mg/L产量提高了26.84%。
So ce2161菌株的产量较上述产量有较大优势,原因可能是菌株本身具有高产的特性,其次可能由于在埃博霉素B的发酵实验中创新性地引入挡板三角瓶作为反应容器,增加了发酵体系的溶氧量,进而提高了产量。
| [1] |
王婷. 纤维堆囊菌合成埃博霉素几个关键问题的研究[D]. 济南: 齐鲁工业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10422-2006168281.htm
|
| [2] |
孟凡欣. 埃博霉素高产菌株选育、发酵条件优化及抗肿瘤活性研究[D]. 长春: 吉林大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10183-2009094521.htm
|
| [3] |
罗立新, 汪薇, 陆一鸣, 等. 纤维堆囊菌发酵产生埃博霉素条件的优化[J]. 华南理工大学学报(自然科学版), 2006, 34(5): 48-52. |
| [4] |
钱云开. 纤维堆囊菌胞内脂类内含物成分、形成及其对埃博霉素生物合成的影响[D]. 济南: 山东大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10431-1011156693.htm
|
| [5] |
张洪. 埃博霉素衍生物抗肿瘤作用的研究[D]. 大连: 大连理工大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10141-1015573910.htm
|
| [6] |
龚国利, 王娜, 刘丽丽, 等. 纤维堆囊菌产埃博霉素B的发酵条件优化[J]. 陕西科技大学学报, 2014(1): 128-132. |
| [7] |
王大红, 原江锋, 郭文杰. 产Epothilone B纤维堆囊菌的选育与发酵优化[J]. 生物技术, 2012, 22(3): 70-73. |
| [8] |
刘雪蕊, 赵林, 等. 纤维堆囊菌接种量对埃博霉素产量的影响[J]. 齐鲁工业大学学报, 2014(1): 14-17. |
| [9] |
陆震. 埃博霉素生产菌株选育及埃博霉素抑瘤活性研究[D]. 济南: 齐鲁工业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10431-1014104260.htm
|
| [10] |
刘玉平. 搅拌式生物反应器溶解氧性能研究[D]. 济南: 山东大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10422-2006054106.htm
|
| [11] |
林小瑜. Sorangium cellulosum So0157-2纤维素降解酶的性质与功能分析[D]. 济南: 山东大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10246-1013171842.htm
|
| [12] |
赵婷峰, 龚国利. 黏细菌:天然的制药厂[J]. 生物技术通报, 2014(12): 40-46. |
| [13] |
刘元望, 李兆君, 冯瑶, 等. 微生物降解抗生素的研究进展[J]. 农业环境科学学报, 2016, 35(2): 212-224. DOI:10.11654/jaes.2016.02.002 |
| [14] |
郭欣. 平板气升环流式光生物反应器内流体力学、传质及营养元素代谢的研究[D]. 青岛: 青岛科技大学, 2014. http://www.cnki.com.cn/Article/CJFDTOTAL-JCSP201502017.htm
|
| [15] |
龚国利, 陈松, 李慧, 等. 纤维堆囊菌产埃博霉素B发酵培养基的优化[J]. 中国酿造, 2012, 31(10): 30-32. DOI:10.3969/j.issn.0254-5071.2012.10.008 |
 2017, Vol. 31
2017, Vol. 31


