| 胶原和明胶清除羟基自由基机理探究 |
2. 山东圣阳电源股份有限公司, 山东 曲阜 273100
2. Shandong Shengyang power supply Co., Ltd, Qufu 273100 China
羟基自由基具有极强的获得电子的能力, 是一种活性氧, 可与生物体内的糖、蛋白质、DNA、碱基、磷脂、有机酸等物质发生化学反应, 且反应速率快, 造成组织细胞的损伤[1]。人体在正常新陈代谢过程中即可产生羟基自由基, 因此羟基自由基被认为是毒性最大的自由基。如何清除羟基自由基是一件有重要意义的研究工作。
抗氧化剂可清除自由基, 其可捕获、中和自由基, 从而清除自由基, 降低自由基造成的组织细胞损伤, 以实现保护细胞。抗氧化剂包括合成性类和天然类[2-3]。合成的抗氧化剂其本身具有一定的毒副作用, 例如人工合成的抗氧化剂丁基羟基茴香对人体内呼吸酶的活性具有抑制作用, 并且会增加肝微粒体酶活性, 在多个国家被禁用[4]。而天然抗氧化剂因其对人体无毒副作用, 而且具有高效抗氧化活性, 并且来源广泛, 已成为研究热点[5]。天然抗氧化活性成分主要有多酚类、维生素类等化合物。近年来, 各种酚类抗氧化剂被用作鱼肉和鱼糜的抗氧化剂。维生素类抗氧化剂包括维生素C、维生素B1、维生素E和维生素A及其衍生物等。其中, 维生素C又称L-抗坏血酸, 其能够螯合金属离子、清除自由基。高等植物是天然抗氧化剂最丰富的来源, 例如水果、蔬菜、香料、草药等[6-7]。
胶原也是一种天然抗氧化剂, 并且来源广泛、成本低廉、功效众多, 对人体无毒性无副作用。研究发现, 不同来源的胶原均具有一定的自由基清除能力[8]。张鑫[9]以牛鼻肉作为原料, 利用热水提取法、酶法和酸法三种不同的提取方法分别得到胶原, 从清除羟基自由基、DPPH自由基(一种很稳定的氮中心的自由基)、ABTS自由基(2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐, 游离氯的光谱试剂)的效果方面综合评价胶原的抗氧化活性, 结果表明, 胶原的浓度与其抗氧化能力呈线性关系。熊明泽等[10]以鸿雁骨骼为原料, 采用复合酶进行酶解制备雁骨胶原, 通过超氧阴离子自由基和羟基自由基的清除能力测定, 结果显示, 雁骨胶原的抗氧化活性与其浓度正相关, 当底物浓度为6 mg/mL时, 超氧阴离子自由基和羟基自由基的清除率分别为59.21%、51.82%。上述研究表明, 浓度是影响胶原抗氧化能力的一个关键因素。
张英等[11]研究了19种氨基酸对羟基自由基的抑制作用, 研究结果表明, 这19种氨基酸中, 酪氨酸(Tyr)、天冬氨酸(Asp)、赖氨酸(Lys)、谷氨酸(Glu)、甘氨酸(Gly)和天冬酰胺(Asn)等氨基酸对自由基的清除能力较强。氨基酸中, Try清除羟基自由基能力最强, 其次是Glu和Asp, 最后是Lys, Gly和Asn。程勇杰等[12]研究发现, 羟基自由基清除能力和还原力均表现出了浓度依赖性, 氨基酸含量与抗氧化性能具有正相关性, 尤其是天冬氨酸(Asp)、谷氨酸(Glu)、丙氨酸(Ala)、组氨酸(His)、精氨酸(Arg)和脯氨酸(Pro)这六种主要氨基酸含量与还原力具有显著的正相关性。
氨基酸清除自由基机制一般是通过直接清除自由基、螯合或还原金属离子阻止其催化过氧化物生成自由基。直接清除自由基是指通过电子转移和能量转移作用, 直接清除自由基和活性氧分子[13]。目前普遍认为, 氢供体型氨基酸清除自由基主要是以下三类途径[14]: (a)一步式氢原子转移(one step H-atom transfer, HAT), 即自由基从氨基酸上直接夺去一个氢原子; (b)分步式的电子转移-质子转移(stepwise electron transfer-proton transfer, ET-PT), 即氨基酸首先发生电子转移生成其阳离子形式, 然后再进行质子转移完成整个清除自由基过程; (c)质子缺失伴随的电子转移(sequential proton loss-electron transfer, SPLET), 即氨基酸先失去一个质子, 然后伴随着电子转移完成清除自由基(图 1)。郑淋[14]通过总抗氧化能力检测试剂盒(ABTS)法和氧化自由基吸收能力(ORAC)法评价了48条含Try残基的二肽抗氧化活性, 发现大部分二肽序列中的Try具有很强的自由基清除能力, 推测这可能与其氨基酸形成氢键及荷电性质有关。
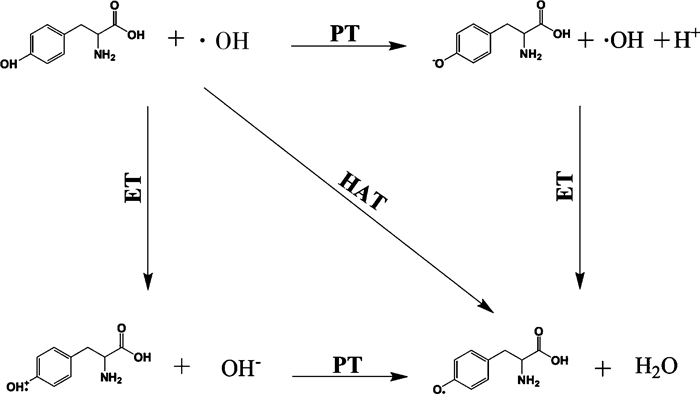 |
| 图 1 自由基获得质子过程 |
螯合或还原金属离子抑制自由基是指部分氨基酸可与金属离子形成络合物, 或还原金属离子, 进而减少金属离子对氧化作用的催化活性。据研究, 酸性氨基酸和碱性氨基酸能通过他们带电荷的侧脸基团与金属离子形成复合物[13]。Decker等[15]研究了肌肽与其组成氨基酸组氨酸相比抑制低密度脂蛋白(LDL)氧化的能力。结果发现, 肌肽和组氨酸都不是2, 2′-偶氮双(2-氨基丙烷)二盐酸盐促进LDL氧化的强抑制剂, 表明它们的主要抗氧化机制是通过铜螯合作用。
综上所述, 我们推断胶原的抗氧化性源于其分子上的氨基酸。但是, 胶原类型较多, 其分子上氨基酸种类、含量均不同, 此外胶原水解后其产物的二级结构也将影响游离氨基酸的含量。胶原清除自由基机制尚且模糊。本研究将比较胶原及其水解产物明胶的羟基自由基清除效率, 研究分子构象, 阐述其清除自由基的机理, 为进一步研究胶原类产品的抗氧化性质提供思路。
1 实验部分 1.1 材料与试剂硫酸亚铁(A.R.): 上海麦克林生化科技有限公司;过氧化氢(A.R.): 上海麦克林生化科技有限公司;水杨酸(A.R.): 天津市科密欧化学试剂有限公司;无水乙醇(A.R.): 天津市富宇精细化工有限公司;明胶(C.P.): 国药集团化学试剂有限公司;胶原(B.R.): 南京都莱生物技术有限公司。
1.2 设备与仪器AR223CN电子天平: 奥豪斯仪器(常州)有限公司;DF-101S集热式恒温加热磁力搅拌器: 郑州市予华仪器制造有限公司;DHG-9070型电热恒温鼓风干燥箱: 上海一恒科学仪器有限公司;UV2800S型紫外可见分光光度计: 上海舜宇恒平科学仪器有限公司;L-8900氨基酸分析仪: 日本日立公司;Chirascan圆二色谱仪: 英国应用光物理公司。
1.3 方法本研究参考徐文汇等[16]的方法对胶原和明胶分别进行羟基自由基的清除效果测定, 设置测试胶原和明胶的质量浓度梯度为: 2、4、6、8、10、12 mg/mL, 并比较胶原和明胶对羟基自由基的清除效果差异。参考熊明泽等[10]的方法对胶原和明胶的氨基酸种类及含量进行测定。参考张震等[17]方法对明胶的二级结构进行测定。
1.3.1 胶原和明胶溶液的配制依照设定的浓度梯度配置六组不同浓度的胶原和明胶溶液, 每份体积分别为3.5 mL和7.0 mL, 计算好溶质质量, 精确称取胶原或明胶并将其置于小试管中, 计算好去离子水体积并移取置于小试管中, 然后加入磁力搅拌器转子室温搅拌20 h, 使样品其完全溶解后, 于-25 ℃环境的冰箱中保存。
1.3.2 自由基清除能力测定羟基自由基能被水杨酸有效捕捉并生成有色物质, 其混合液在530 nm附近有强吸收。但若加入具有对羟基自由基清除作用的物质, 便会与水杨酸竞争, 从而使有色产物生成量减少, 进而导致在530 nm处的吸光度开始降低。吸光度和自由基清除率成定量关系[11]。将胶原置于室温环境自然解冻, 将明胶置于40 ℃水浴锅解冻, 向不同试管中各加1.75 mL不同浓度的胶原溶液和9 mmol/L水杨酸、10 mmol/L硫酸亚铁溶液和7.8 mmol/L的过氧化氢各0.25 mL。37 ℃下恒温反应30 min后通过紫外可见光分光光度计测得各混合液在530 nm处的吸光度, 按式(1)计算羟基自由基的清除率。
| $ 清除率=\left[1-\left(A_{x}-A_{x 0}\right) / A_{0}\right] \times 100 \%, $ | (1) |
其中:
反应体系(Ax)=样品液+水杨酸+FeSO4+H2O2; 本底(Ax0)=样品液+水杨酸+FeSO4+双蒸水; 空白对照(A0)=双蒸水+水杨酸+FeSO4+H2O2。
将计算得到的胶原对羟基自由基的清除率和明胶对羟基自由基的清除率进行汇总, 利用Origin绘制成图表。
1.3.3 胶原和明胶的氨基酸含量测定准确吸取0.200 mL混合氨基酸标准液, 用pH 2.2的缓冲液稀释到5 mL, 此标准稀释液浓度为5.00 nmol/μL, 作为上机测定用的氨基酸标准, 用氨基酸自动分析仪以外标法测定样品液的氨基酸种类和含量。
1.3.4 胶原和明胶的二级结构测定光学活性物质对左旋圆偏振光和右旋圆偏振光的吸收率不同, 当平面偏振光通过具有手性的样品之后会变成椭圆偏振光[12]。利用该原理, 使用圆二色谱测定胶原和明胶分子的二级结构。将胶原溶液和明胶溶液的质量浓度稀释至0.16 mg/mL, 混合样品在50 ℃下平衡1 h, 同时在50 ℃下, 取0.2 mL溶液于1 mm样品池中通过圆二色谱仪(CD)对胶原和明胶的二级结构进行测量, 测量温度保持在50 ℃, 氮气吹扫流速为35 mL/min。在190~260 nm范围内记录光谱, 分辨率为0.2 nm, 共扫描6次。
2 结果与讨论 2.1 型胶原和明胶对羟基自由基的清除本实验所使用的I型胶原来源于猪皮, 明胶来源于I型胶原的水解产物。将I型胶原和明胶分别配置质量浓度为2~12 mg/mL的I型胶原、明胶水溶液, 按照实验步骤中叙述的方法, 与硫酸亚铁溶液、过氧化氢溶液和水杨酸溶液混合, 测定混合液在530 nm的吸光度, 结果如图 2所示, 自由基的被清除能力随着I型胶原和明胶的浓度增加(从2 mg/mL增加到12 mg/mL)而增加。I型胶原浓度为2 mg/mL时羟基自由基清除率为46%, 12 mg/mL时羟基自由基清除率为53%;明胶浓度为2 mg/mL时羟基自由基清除率为81%, 12 mg/mL时羟基自由基清除率为96%。研究结果表明, 相比于I型胶原, 明胶清除羟基自由基的能力更强。
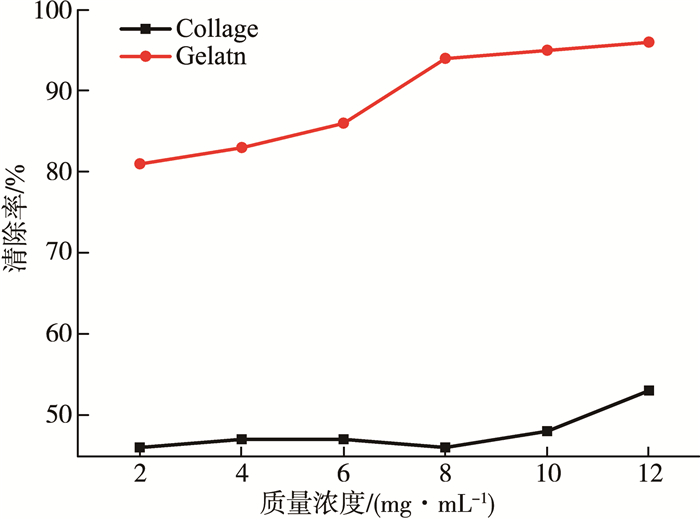 |
| 图 2 胶原和明胶清除自由基功效对比 |
2.2 羟基自由基清除机理探索 2.2.1 I型胶原和明胶分子上氨基酸分析
通过氨基酸分析仪对I型胶原和明胶进行氨基酸组成成分分析, 测定结果如表 1所示。I型胶原分子中甘氨酸含量为27.36%, 脯氨酸含量13.39%, 酪氨酸含量1.86%, 天冬氨酸含量4.19%, 赖氨酸含量2.83%, 谷氨酸含量7.28%, 丙氨酸含量6.84%, 组氨酸含量0.5%, 精氨酸含量6.23%。
| 表 1 胶原和明胶所含氨基酸种类及含量 |
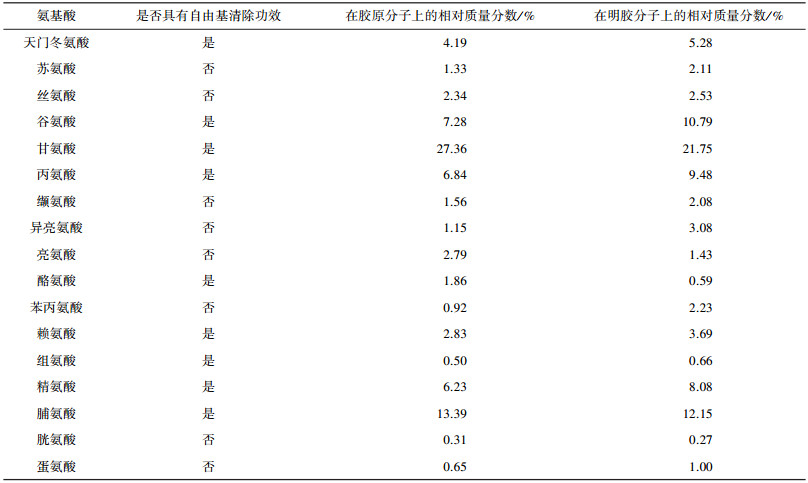 |
明胶分子中甘氨酸含量21.74%, 脯氨酸含量12.15%左右, 酪氨酸含量0.59%, 天冬氨酸含量5.28%, 赖氨酸含量3.69%, 谷氨酸含量10.78%, 丙氨酸含量9.48%, 组氨酸含量0.66%, 精氨酸含量8.08%。
将I型胶原和明胶分子中具有清除羟基自由基能力的的氨基酸进行比较分析发现, 相对含量差异不大。可以推断, I型胶原和明胶分子中氨基酸的种类和相对含量不是影响其清除自由基能力的关键。
2.2.2 I型胶原和明胶的二级结构分析胶原是由3条多肽α链组成的三聚体分子, 含有特征性重复序列(Gly-X-Y)n, X常为脯氨酸, Y常为羟脯氨酸。胶原的单体是前胶原经过加工形成的胶原, 其分子以α-螺旋结构存在, 如图 3所示[8]。
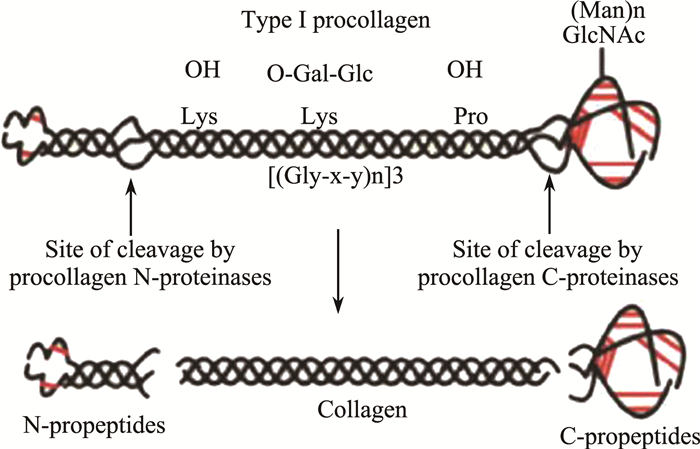 |
| 图 3 胶原结构示意图 |
明胶是胶原的水解产物, 水解过程中胶原分子被无规切断, 其分子中包含α链、β链和γ链。对不同浓度的明胶溶液进行了CD表征, 并采用峰回归计算方法和CONTIN拟合程序对二级结构含量进行了计算, 其结果如表 2所示。水溶液中明胶分子二级结构包含α-螺旋、β-回转、β-折叠、β-反折叠, 任意卷曲五种结构。其中随着明胶质量浓度的从2 mg/mL增加到12 mg/mL, 各指标呈现增大趋势, 在质量浓度为12 mg/mL时达到最大; 其中, β-回转、β-折叠、β-反折叠, 任意卷曲四种结构含量越多, 表明分子越伸展, 越有利于氨基酸暴露。
| 表 2 明胶质量浓度对其二级结构的影响 |
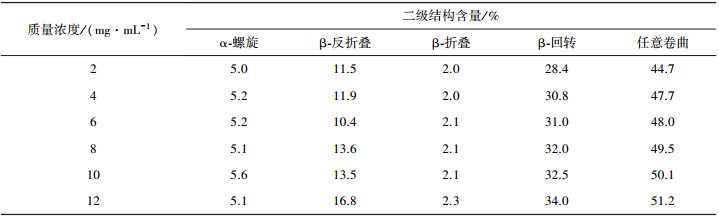 |
CD结果表明, β-回转、β-反折叠、β-折叠以及任意卷曲结构含量总和远远高于α-螺旋, 表明明胶分子链处于较高伸展度, 有利于氨基酸暴露, 有利于清除自由基。明胶质量浓度为12 mg/mL时, 上述结构总和达到最大。结合文献[13], 绘制出胶原解螺旋成明胶的结构示意图, 如图 4所示。
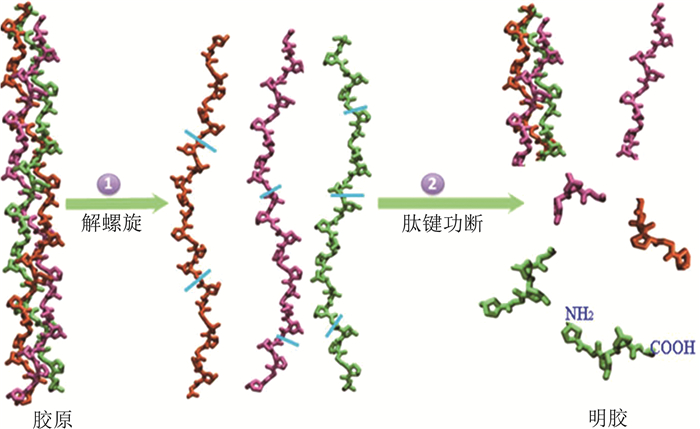 |
| 图 4 胶原分子向明胶分子转变的结构变化 |
由此可见, 明胶分子的二级结构松散, 其中的氨基酸基团大量暴露, 这导致其溶液中游离的羟基自由基有很大机会可以和这些氨基酸基团结合, 从而被清除; 而胶原的三条肽链聚合在一起, 其中的氨基酸基团暴露的相对较少, 其溶液中游离的羟基自由基有很小机会可以和这些氨基酸基团结合, 限制了自由基的被清除机会。因此, 明胶对羟基自由基的清除率明显高于胶原对羟基自由基的清除率。
3 结论本实验以猪皮中提取的I型胶原为研究对象, 通过水解得到明胶。对比研究了胶原和明胶清除羟基自由基的能力, 结果表明, 胶原和明胶均对羟基自由基具有清除能力, 且与浓度呈正相关, 该结论与文献报道一致。
明胶清除自由基的能力明显优异。通过分析I型胶原和明胶分子中氨基酸种类及含量, 结果表明, 这不是造成二者清除自由基能力差异的关键。继续进行二级结构研究, CD结果表明, 明胶分子包含α-螺旋、β-回转、β-折叠、任意卷曲四种结构, 其中β-回转、β-折叠、任意卷曲结构含量总和远远高于α-螺旋, 表明明胶分子链处于较高伸展度, 有利于氨基酸暴露, 有利于清除自由基。胶原清除自由基的能力明显弱于明胶。由于胶原的三条肽链聚合在一起, 氨基酸基团和自由基结合并清除自由基的机会被限制。
| [1] |
李惠云, 贾清秀. 浅谈氧自由基与人体健康的关系[J]. 安阳师范学院学报, 2003(2): 74-74. DOI:10.3969/j.issn.1671-5330.2003.02.029 |
| [2] |
孔保华, 孙妍, 熊幼翎. 抗氧化剂对羟自由基引起的乳清分离蛋白氧化抑制效果的研究[J]. 食品科学, 2010, 31(3): 5-10. |
| [3] |
杨芳宁. 猪皮胶原蛋白抗氧化肽的制备与活性研究[D]. 洛阳: 河南科技大学, 2012.
|
| [4] |
王玉贤. 提高菜籽油抗氧化性的进展分析[J]. 食品安全导刊, 2021(27): 161, 163. |
| [5] |
刘贺, 朱奕昊, 刘亭亭, 等. 天然抗氧化剂及协同作用研究进展[J]. 聊城大学学报(自然科学版), 2021, 34(5): 59-65. |
| [6] |
励建荣, 王忠强, 仪淑敏, 等. 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展[J]. 食品科学, 2021, 42(21): 1-7. DOI:10.7506/spkx1002-6630-20210806-088 |
| [7] |
陈林林, 李伟, 张伟. 响应面法优化鲤鱼鱼糜复合保鲜工艺[J]. 食品工业科技, 2017(2): 307-312. |
| [8] |
唐青松, 徐娥, 王丽, 等. 胶原蛋白动态平衡及其对动物肠道健康的作用[J]. 动物营养学报, 2020, 32(12): 5578-5586. |
| [9] |
张鑫. 牛胶原蛋白的功能特性及多肽的抗氧化活性研究[D]. 济南: 齐鲁工业大学, 2021.
|
| [10] |
熊明泽, 孙尧, 崔本海, 高冷. 鸿雁骨胶原多肽制备及其抗氧化活性研究[J]. 食品研究与开发, 2020, 41(21): 109-117. |
| [11] |
张英, 董绍华. 氨基酸清除活性氧自由基作用的研究[J]. 科技通报, 1997(5): 33-36. |
| [12] |
程勇杰, 陈小伟, 张沙沙, 等. 柘树植物酵素中氨基酸分析及抗氧化性能研究[J]. 食品工业科技, 2018, 39(6): 1-7. |
| [13] |
李新. 氨基酸和酚类化合物的联合抗氧化作用研究[D]. 长春: 吉林大学, 2017.
|
| [14] |
郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015.
|
| [15] |
DECKER E A, IVANOV V, ZHU B Z, et al. Inhibition of low-density lipoprotein oxidation by carnosine and histidine[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1): 511-516. |
| [16] |
徐文汇, 魏玉西, 郭奇. 剑麻花提取物的抗氧化活性研究[J]. 食品科学, 2009, 30(9): 47-50. |
| [17] |
张震. 胶原多肽薄层的制备及其表面性质的调控[D]. 济南: 齐鲁工业大学, 2020.
|
 2022, Vol. 36
2022, Vol. 36


