| 基于网络药理学研究黄酮类化合物治疗胃癌的作用机制 |
胃癌(gastric cancer)是常见的消化道恶性肿瘤[1], 尽管近年来早查早治的普及使胃癌的整体预后有所改善, 但由于遗传、生活习惯、细菌感染、情绪、环境等因素的影响, 其发病率仍逐年增长[2]。胃癌发病率是我国所有恶性肿瘤中的第二位, 死亡率居第三位, 是严峻的医疗问题[3]。胃癌患者早期无明显症状, 确诊时多为中晚期, 伴腹部疼痛肿大、恶心呕吐等体征[4]。现代医学治疗胃癌的手段一般为手术、放疗与化疗, 但通常会产生诸多不良反应损害患者机能, 且疗程较长, 临床疗效有所限制[5]。胃癌是一种复杂的疾病, 针对单一靶点的靶向治疗早已不能满足现代医学的需求, 而中药正具有多靶点、多成分治疗胃癌的特点, 在延缓胃癌发展进程、改善患者症状、延长生存时间、缓解术后副作用等方面都具有较大优势, 现也是研究热点之一[6-7]。
黄酮类化合物以2-苯基色原酮为基本骨架, 存在于多种植物、中草药中, 具有低毒、安全、有多种药理活性等优点。有学者曾对黄酮类化合物进行过研究, 例如: 香青兰总黄酮可以降低胃癌中某特定细胞的增殖与迁移水平, 抑制胃癌细胞侵袭人体, 促进胃癌细胞的凋亡[8]; 异橙黄酮可以通过调控部分信号通路起到抑制胃癌细胞增殖的作用[9]; 山柰酚可以阻碍胃癌G2期细胞的生长, 诱导胃癌细胞的凋亡, 是潜在治疗胃癌的药物成分[10], 这说明部分黄酮类化合物对胃癌具有一定的治疗作用。
网络药理学在分子水平上分析药物、靶点与疾病间复杂的互作关系, 探索药物治疗疾病的作用机制[11]。本研究利用网络药理学综合研究黄酮类化合物治疗胃癌的药理作用机制, 选取的六个黄酮类化合物均由云南民族大学教育部重点实验室在多种植物中获取, 通过分析评估这些黄酮类化合物对胃癌的治疗作用, 为新型抗胃癌药物的研发提供理论基础与实验依据, 以期获得具有治疗胃癌可能性的药物。
1 材料与方法 1.1 黄酮类化合物靶点的预测利用ChemBioDraw Ultra 14.0软件绘制六个黄酮类化合物的平面结构, 并导入TCMSP数据库检测相关药理参数, 一般口服生物利用度(oral bioavailability, OB)≥30%、类药性(drug-likeness, DL)≥0.18的药物吸收较为良好, 代谢缓慢, 适合进行药物开发[12-13]。6个小分子具体信息如表 1示。通过Swiss Target Prediction数据库(http://www.swisstargetprediction.ch)预测probability大于0的靶点, 删除重复项并整合, 得到6个黄酮类小分子靶点。
| 表 1 黄酮类化合物信息 |
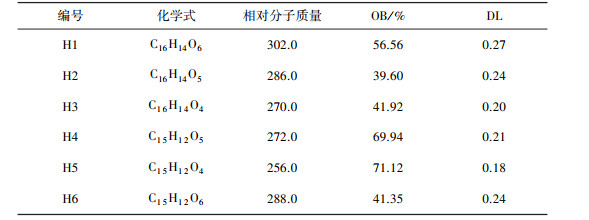 |
1.2 胃癌疾病靶点的收集
通过人类基因综合数据库GeneCards(https://www.genecards.org/)以“gastric cancer”为关键词条检索胃癌相关靶点。
1.3 获取黄酮类小分子与胃癌交集靶点利用Venn软件获取黄酮类小分子与胃癌的交集靶点, 以韦恩(Venn)图展示, 这些交集靶点可能是黄酮类化合物治疗胃癌的重要靶点。
1.4 蛋白互作网络的构建与分析为探究黄酮分子与胃癌的相互作用, 在String数据库(http://string-db.org)中上传交集靶点, 设定研究物种为人, 置信度为Highest(0.900), 获取初始PPI网络及网络信息文件。将文件导入Cytoscape3.8.0软件, 以度值(Degree)作为要素构建PPI网络, 并筛选黄酮分子治疗胃癌的核心靶点。
1.5 化合物-疾病-靶点网络的构建利用Cytoscape3.8.0软件对化合物-疾病-靶点网络图进行可视化构建, 分析黄酮类化合物对胃癌疾病的相互作用。
1.6 GO功能富集及KEGG通路富集利用R语言对交集靶点进行GO生物功能富集分析与KEGG通路富集分析, 以参数p < 0.05为筛选条件, 得到黄酮类化合物作用于胃癌的主要基因功能和通路并可视化富集分析结果。
1.7 分子对接验证通过富集分析结果找到黄酮类化合物治疗胃癌最主要的通路, 并查阅文献找出与此通路相关的蛋白, 利用PDB数据库下载蛋白结构并进行预处理。利用AutoDock对接软件将蛋白与6个黄酮类化合物进行分子对接验证其结合能力, 将对接最好的结果利用Pymol软件进行可视化处理。
2 结果 2.1 黄酮类化合物及胃癌的预测靶点Swiss Target Prediction数据库预测6个黄酮类化合物的靶点共681个, 去除重复项得到228个靶点。通过GeneCards数据库检索共获12 309个胃癌相关靶点。
2.2 黄酮类化合物与胃癌的交集靶点利用Venn软件得到交集靶点203个, 这些即为黄酮类化合物治疗胃癌的作用靶点, 交集靶点韦恩图见图 1。
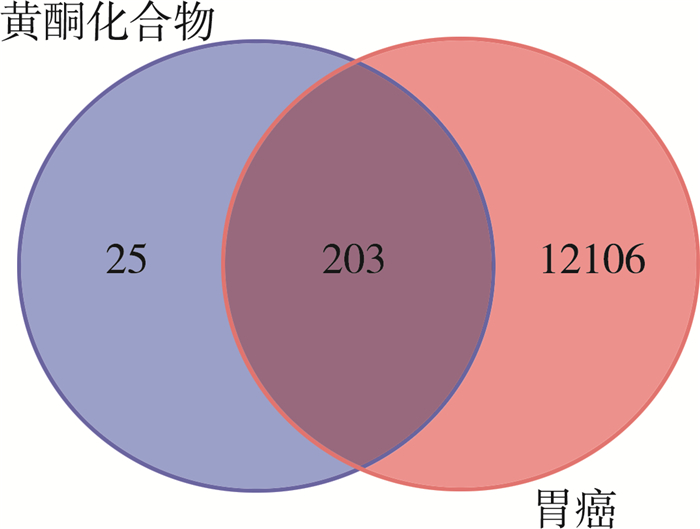 |
| 图 1 交集靶点Venn图 |
2.3 蛋白互作网络及网络核心靶点
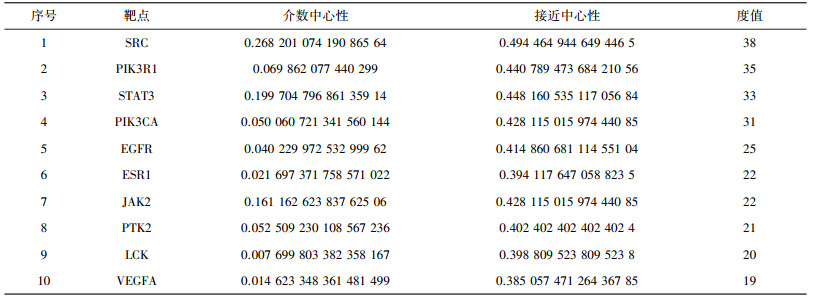
通过String数据库得到初始PPI网络图, 如图 2示。将PPI网络文件导入Cytoscape3.8.0软件中, 删去游离节点, 即得黄酮类化合物与胃癌交集靶点PPI网络。如图 3示。PPI网络中共有186个节点, 449条边, 蛋白平均度值为4.53。节点为靶点蛋白, 边表示蛋白间的相互作用, 度值与节点大小、颜色深浅成正比。根据度值、介数中心性、接近中心性等参数筛选出10个核心靶点, 靶点信息见表 2。
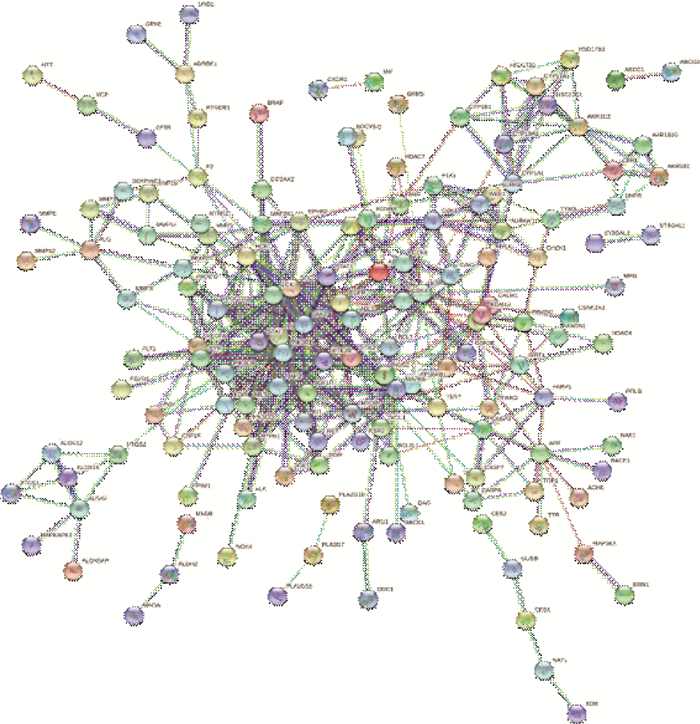 |
| 图 2 初始PPI网络图 |
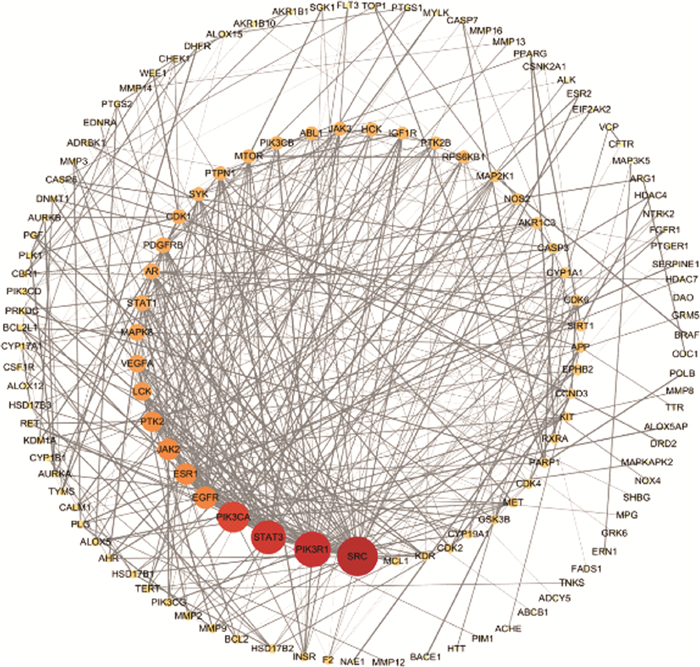 |
| 图 3 黄酮类化合物-胃癌PPI网络图 |
| 表 2 核心靶点及拓扑结构参数 |
 |
2.4 化合物-疾病-靶点网络图
利用Cytoscape3.8.0软件构建化合物-疾病-靶点网络, 见图 4。网络中共有210个节点, 6个紫色节点为黄酮类化合物, 其余203个绿色节点属于靶点, 蓝色节点为胃癌疾病, 边表示此化合物与靶点有作用关系。网络中HT1、HT3、HT4和HT5度值较高, 联结的靶点较多, 说明这些化合物可能具有抗胃癌的作用, 是新型治疗胃癌药物的潜在有效活性成分。
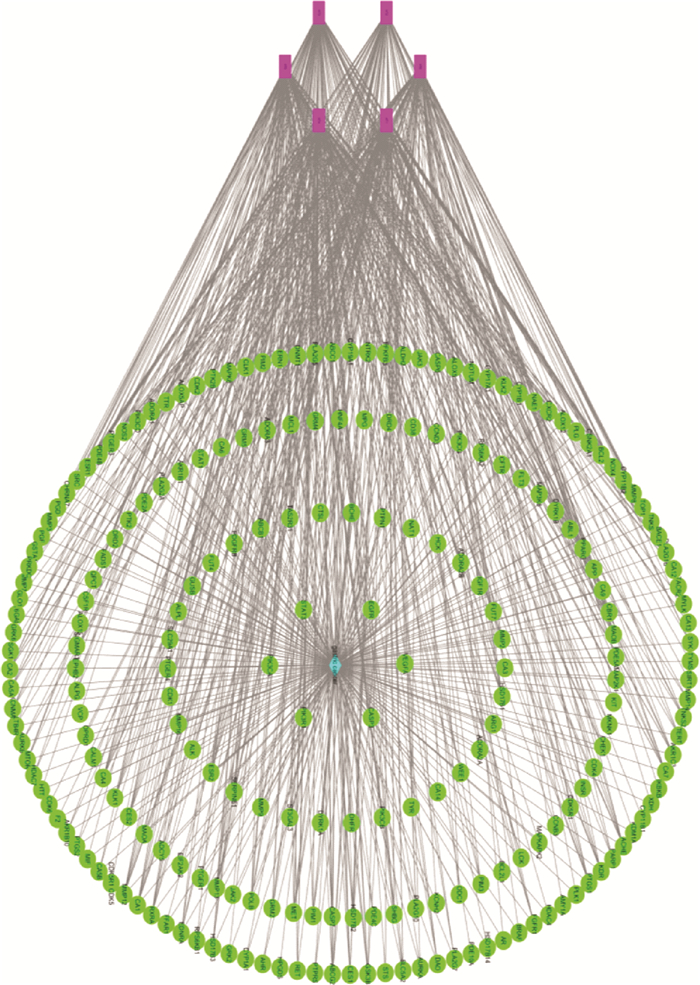 |
| 图 4 化合物-疾病-靶点网络图 |
2.5 富集分析
利用R语言进行GO基因功能富集分析与KEGG通路富集分析, 筛选得到163条GO生物过程条目和156条KEGG信号通路。
分析富集结果发现, 本文所用的黄酮类化合物对胃癌作用的生物学过程主要涉及: 蛋白质酪氨酸激酶活性、蛋白质丝氨酸/苏氨酸激酶活性、水解酶活性、蛋白磷酸酶结合、碳氧裂解酶活性、胰岛素受体底物结合、SH2结构域绑定等多种途径, 这说明了黄酮类化合物对胃癌的治疗是一个复杂的多生物学过程。图 5列出靠前20个条目, 图中柱形区域越长, 富集的基因越多, 颜色越红, p值越小, 结果越显著。本文所用的黄酮类化合物主要作用于: EGFR酪氨酸激酶抑制剂、PI3K-Akt信号通路、内分泌抵抗、胰腺癌、Ras信号通路、脂质与动脉粥样硬化、麻疹、Rap1信号通路、卵巢类固醇生成等通路。这说明了本文选取的黄酮类化合物主要通过调控上述多类通路对胃癌进行协同治疗。图 6列出靠前20条信号通路, 图中柱形区域越长, 富集的基因越多, 颜色越红, p值越小, 结果越显著。前20个GO条目信息见表 3, 通路信息见表 4。
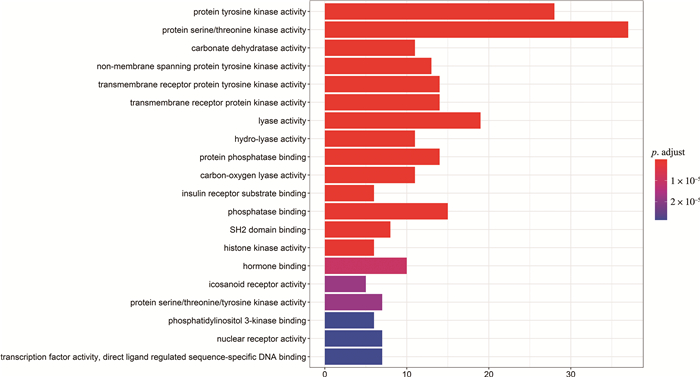 |
| 图 5 203个潜在靶点的GO富集分析 |
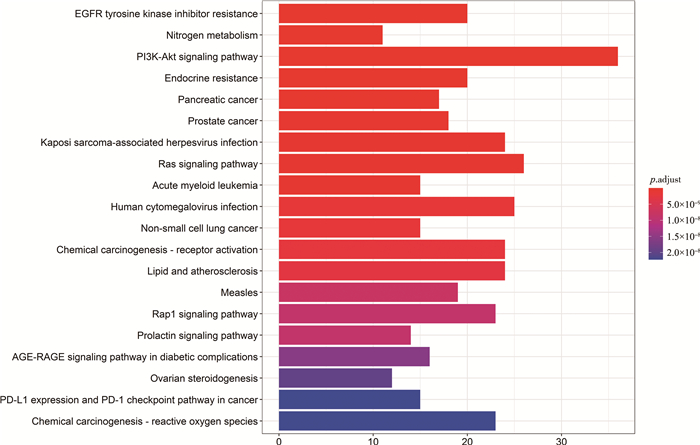 |
| 图 6 203个潜在靶点的KEGG富集分析 |
| 表 3 GO富集分析表 |
 |
| 表 4 KEGG富集分析表 |
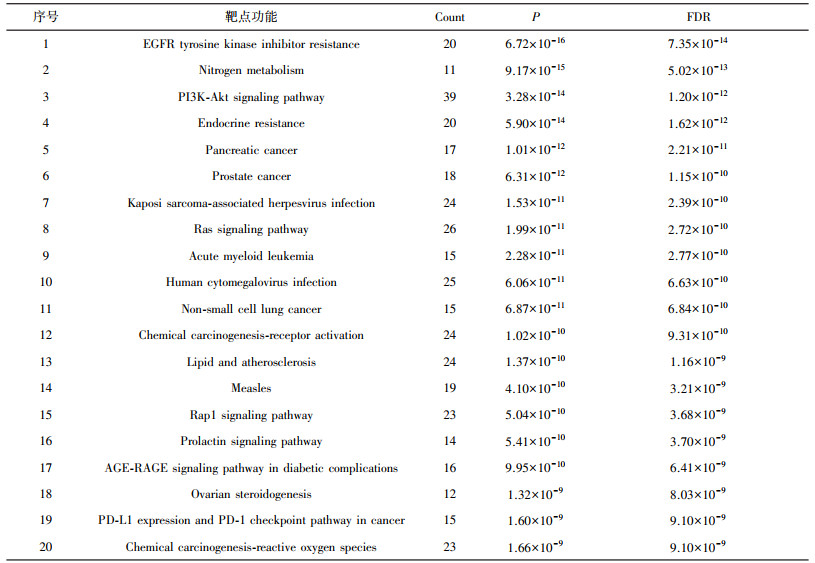 |
由图 7知, PI3K-Akt信号通路是靶点富集最多的通路, 结果显著, 说明此通路是黄酮类分子作用于胃癌的相关重要通路之一。
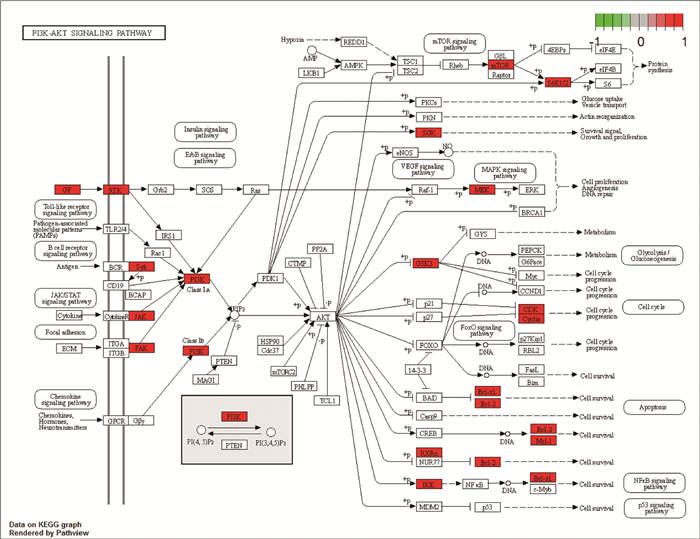 |
| 图 7 PI3K-Akt信号通路图 |
2.6 分子对接
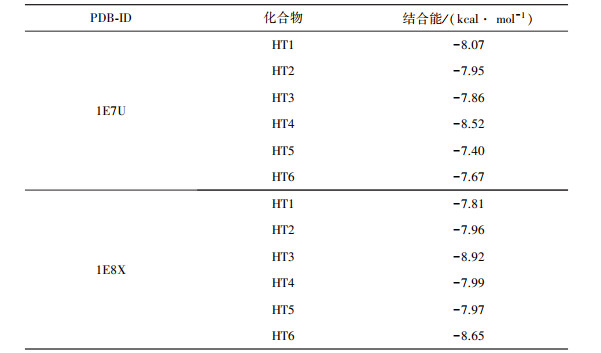
通过文献查阅, PI3K蛋白(PDB: 1E7U)、ATP/PI3K复合物结构(PDB: 1E8X)是与PI3K-Akt信号通路相关的蛋白, 下载其结构并与六个黄酮小分子分别进行分子对接, 对接结果如表 5所示。结合能小于-5 kcal/mol(1 cal=4.184 J), 说明结合能力较好, 结合能小于-7 kcal/mol, 说明结合构型有强烈的活性。所得对接结果都小于-7 kcal/mol, 说明六个黄酮类化合物与PI3K-Akt通路相关蛋白对接情况较好, 验证了上述所得结果。将结合能最小的结果进行可视化, 如图 8所示。
| 表 5 1E7U、1E8X分子对接结果 |
 |
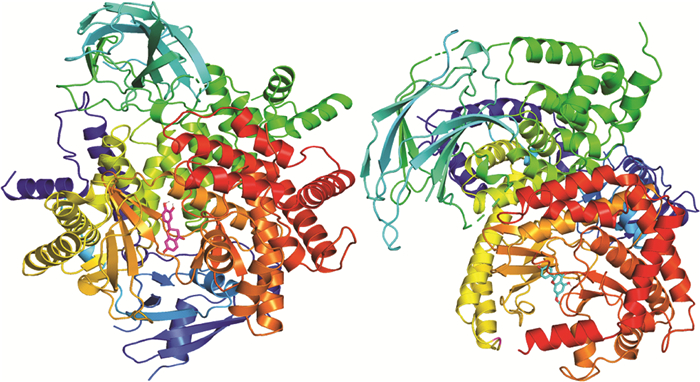 |
| 图 8 1E7U与HT4(左)、1E8X与HT3(右)分子对接图 |
3 讨论
通过对PPI网络的分析, 得到了网络中较大、颜色较深、处于网络中心位置的核心靶点, 说明黄酮类化合物抗胃癌很可能就是通过干预核心靶蛋白发挥关键作用。这些核心靶点与胃癌高度相关, 有研究表明, SRC是一种非受体酪氨酸激酶, 也是原癌基因, 通过广泛的信号传导参与幽门螺旋杆菌感染, 而此感染是引发胃癌的关键因素。SRC在胃癌病变组织中高度活化, 表达异常, 与胃癌的发展等过程高度相关[14]; 调控表皮生长因子(EGFR)可以修复胃黏膜、增加机体对胃酸和胃蛋白酶的耐受, 其异常表达也与胃癌发展进程有关[15]; 血管内皮生长因子A(VEGFA)能诱导胃癌血管的生成, 给予癌细胞转移动力, 阻碍癌细胞的凋亡[16]; PIK3CA与PIK3R1在胃癌中的突变率都很高[17], 其中磷酸肌醇3-激酶调节亚基1(PIK3R1)是一种肿瘤抑制因子, 在癌症中低表达, 其下调对癌症患者有害, 能激活PI3K-Akt通路进而调节胃癌细胞对药物的耐受度[18]; 信号转导和转录活化因子3(STAT3)在胃癌中也处于异常状态, 抑制其传导与表达可降低胃癌致瘤性[19]。
KEGG富集分析得到的通路涵盖癌症、炎症、病毒等多个方面, 对与胃癌相关的部分通路进行说明。磷脂酰肌醇3-激酶-蛋白激酶B信号通路(PI3K-Akt)能参与细胞代谢等多种过程, 几乎可被所有细胞和病毒刺激, 是很重要的通路。PI3K-Akt通路是治疗胃癌的主要分子通路[20]。涂江江等[21]通过实验验证了PI3K-Akt通路被异常激活后在胃癌干细胞中的蛋白表达量比普通肿瘤细胞高。被异常激活的PI3K-Akt通路在胃癌的增殖与转移中存在高度活化与表达过量的现象, 会促进胃癌的发展进程[22]。因此通过靶向调控此通路, 可以抑制胃癌肿瘤细胞的生长与增殖, 诱导其凋亡, 还能抑制胃癌细胞前期发展过程中的病变[23]; EGFR酪氨酸激酶抑制剂能抑制EGFR激酶区磷酸化, 阻碍相关信号传导, 从而发挥抗肿瘤疗效, 在晚期胃癌患者的治疗中也有成效[24-25]; 据统计, 在大于三分之一的胃癌病例中, Ras信号通路会被异常激活; 此外, 胃癌的转移也会造成多种代谢紊乱、脂质过氧化等不良反应, 还可能产生如动脉粥样硬化、胰腺癌等多种并发疾病, 这些疾病与肿瘤显著相关[26]; 内分泌抵抗通路与Rap1通路常与促进胃癌耐药相关; 胃癌中还存在与麻疹相关的基因, 麻疹病毒疫苗对肿瘤具有杀伤性, 诱导胃癌细胞凋亡[27]。因此推测这些通路是参与胃癌发病进程的重要通路, 可能是通过抑制胃癌细胞的增殖与转移、诱导胃癌细胞凋亡等达到治疗胃癌的目的。
综上所述, 本研究应用网络药理学初步探讨了实验室获取的6个黄酮类化合物治疗胃癌的作用机制, 说明其具有多靶点、多通路、多途径治疗胃癌的特点, 研究这些靶点与通路和胃癌的关系可以加深对胃癌的认识, 有重要的意义, 为抗胃癌新药的研发及实验提供参考思路与科学依据。
| [1] |
张利霞, 张中平, 许丽娟. IL-23和PG-1水平在不同胃部疾病患者体内的临床表达意义[J]. 中国现代医生, 2016, 54(24): 28-30. |
| [2] |
宋尚晋. 滋阴化痰方抑制胃癌转移的作用及其相关分子机制探讨[D]. 上海: 中国人民解放军海军军医大学, 2019.
|
| [3] |
朱静雅, 何义富. 抗血管生成药物在晚期胃癌二线治疗中的应用[J]. 肿瘤药学, 2021, 11(1): 1-6. |
| [3] |
詹东梅, 刘延庆. 中药逆转胃癌多药耐药的研究进展[J]. 癌症进展, 2020, 18(13): 1307-1311. |
| [4] |
张国荣, 郑娟, 张兰英. 中药联合化疗治疗晚期胃癌的临床研究[J]. 中国社区医师, 2021, 37(29): 101-102. |
| [5] |
周娓, 祝敏. 四君子汤合失笑散在气虚血瘀证中晚期胃癌患者治疗中的应用价值[J]. 世界最新医学信息文摘, 2019, 19(65): 229-230. |
| [6] |
国佳鑫, 侯丽, 蔡和平, 等. 基于"寒凝血瘀"关键病机理论探讨新加良附方治疗胃癌的网络药理学研究[J]. 世界中医药, 2021, 16(3): 373-380. |
| [7] |
李晓彤, 李慧杰, 李秀荣. 中医药在胃癌术后并发症中的应用探讨[J]. 中国中西医结合消化杂志, 2021, 29(5): 370-372. |
| [8] |
白露, 刘静静, 张欢, 等. 基于MKL1/CAAP1通路探讨香青兰总黄酮对胃癌MGC-803细胞恶性生物学行为的影响[J]. 中国老年学杂志, 2022, 42(5): 1149-1154. |
| [9] |
赵萍萍, 李美芳, 袁崇芬, 等. 异橙黄酮通过AKT/GSK-3β/β-catenin信号通路诱导胃癌AGS细胞凋亡和周期阻滞研究[J]. 中国药师, 2022, 25(1): 41-48. |
| [10] |
宋海彬. 山柰酚在体内和体外抑制胃癌生长的实验研究[D]. 哈尔滨: 哈尔滨医科大学, 2016.
|
| [11] |
丁亚杰. 基于网络药理学和蛋白质组学探究健脾复方胃肠安及活性化合物木犀草素的抗胃癌作用机制[D]. 上海: 上海中医药大学, 2019.
|
| [12] |
席晓萌, 姜云鸽, 王煜丹, 等. 基于网络药理学探究黄酮对2型糖尿病的作用机制[J]. 云南民族大学学报(自然科学版), 2022, 31(1): 15-23. |
| [13] |
殷贝, 毕艺鸣, 李安香, 等. 基于网络药理学和分子对接方法探讨热毒宁注射液抗新型冠状病毒的作用机制[J]. 中药新药与临床药理, 2020, 31(9): 1061-1069. |
| [14] |
张慧, 吴小翎. Src在胃癌中的作用[J]. 现代生物医学进展, 2012, 12(13): 2592-2595. |
| [15] |
吴自伟, 梁雯, 宋临水, 等. 基于网络药理学推测藤梨根抗胃癌成分及机制[J]. 海峡药学, 2022, 34(3): 31-35. |
| [16] |
许颖, 付纪源, 王雨情, 等. 基于网络药理学和分子对接探讨中药赤芍抗胃癌的作用机制[J]. 特产研究, 2022, 44(2): 81-89. |
| [17] |
左文明, 李锦萍, 李彩明, 等. UPLC-Q-TOF-MS/MS结合网络药理学和分子对接探讨椭圆叶花锚抗肝炎的药效物质及作用机制[J]. 天然产物研究与开发, 2021, 33(11): 1946-1956. |
| [18] |
耿艺菲, 黄志鸿, 洋雯茜, 等. 基于网络药理学和分子对接的扶正固本颗粒治疗胃癌机制研究[J]. 中国药师, 2021, 24(8): 419-427. |
| [19] |
王迪, 王霄龙, 韩福洲, 等. STAT3通路与胃癌的研究进展[J]. 国际遗传学杂志, 2013, 36(1): 42-45. |
| [20] |
曹峰, 吕欣, 董凯峰, 等. AMG-102通过调控c-Met/PI3K/Akt通路抑制喉鳞癌细胞增殖和诱导凋亡[J]. 中华肿瘤杂志, 2020, 42(2): 99-104. |
| [21] |
涂江江, 董翠梅, 陶利英, 等. PI3K/Akt信号通路在胃癌干细胞中的表达及意义[J]. 中外医学研究, 2017, 15(2): 154-155. |
| [22] |
陈小霞, 陈国忠, 梁毅锋, 等. 靶向PI3K/Akt信号通路中医药治疗胃癌的研究进展[J]. 中华中医药学刊, 2022, 40(3): 125-130. |
| [23] |
李明, 赵远, 马萍, 等. 毛兰素的药理学作用研究进展[J]. 中国细胞生物学学报, 2022, 44(2): 399-404. |
| [24] |
廖玲, 刘泓基, 彭艳, 等. 脾酪氨酸激酶及表皮生长因子受体在胃癌组织中的表达及意义[J]. 实用医学杂志, 2011, 27(17): 3147-3149. |
| [25] |
刘伟, 余英豪, 陈娟, 等. EGFR在中国胃癌患者中的表达及其临床意义[J]. 世界华人消化杂志, 2010, 18(25): 2648-2653. |
| [26] |
闫凯欣, 胡舜英. 动脉粥样硬化性疾病与肿瘤发生的相关性及机制研究进展[J]. 中华老年多器官疾病杂志, 2022, 21(1): 72-75. |
| [27] |
杨倩. 消化道肿瘤核心转录调控环的识别及其关键转录因子的功能鉴定[D]. 汕头: 汕头大学, 2021.
|
 2022, Vol. 36
2022, Vol. 36


