| 纳米金用于SPR传感器检测小分子的研究进展 |
2. 山东省农业科学院 农业质量标准与检测技术研究所, 山东济南 250100
2. Institution of Quality Standard and Testing Technology for Agro-Product, Shandong Academy of Agricultural Sciences, Jinan 250100, China
近年来, 表面等离子共振技术因其所具有的检测速度快、所需样品量少, 可全面、实时监测小分子间结合、解离过程等优点在小分子物质分子相互作用的实时监测和标记式或非标记式生物和化学分析方面具有广泛的应用前景。该技术主要由光源、贵金属芯片和棱镜三个要素执行。金属表面存在大量自由电子, 当入射光照射时, 这些自由电子会发生集体振荡, 这种现象叫做等离子振荡, 并以波的形式表现, 叫做等离子波。光在棱镜和金属芯片表面发生全反射现象时, 会形成消逝波进入到金属介质, 在特定条件下, 消逝波会与等离子波发生共振, 反射光强度将很大程度上减弱。此时对应的入射光波长为共振波长, 对应的入射角为SPR角。SPR角随金属芯片表面折射率的变化而变化, 而折射率又与金属表面结合的分子质量相关。因此, 可通过实时、动态监测SPR角的动态变化获得分子间相互作用的特异信号[1-4]。
1983年, LIEDBERG[5]首次将SPR用于IgG抗体(immunoglobulin G, IgG)与其抗原的反应测定, 随后, SPR被逐步应用于监测DNA与蛋白质之间[6-7]、蛋白质与蛋白质之间[8]、核酸与核酸之间[9]、受体与配体之间的相互作用[10], 近年来, 已被广泛应用于传感检测领域。SPR传感在医学诊断[11]、药学研究[12]、食品安全[13]及环境检测[14]等领域具有广泛的应用需求。对于大分子, SPR传感可在无需标记的情况下对其进行检测。但是对于小分子(分子量小于500 Da), 如癌症生物标记物[15-16]、激素[17-18]、抗生素[19-20]、杀虫剂[21]和爆炸性化学品等, SPR不能通过其较小的分子质量引起的微弱的折射率变化而监测到其分子间的相互作用过程, 难以达到检测的目的[22-23]。近年来, 为提高SPR检测能力并拓展其在小分子领域的使用范围, 纳米金粒子(Gold nanoparticles, Au NPs)被引入到这一高速发展的研究领域。Au NPs因其高电子密度、介电特性及易修饰等特性而受到研究者的青睐[24], 并将其应用到多种传感器的信号放大过程, 如电化学、表面增强拉曼光谱、表面等离子体共振技术等。
在本综述中, 我们将总结Au NPs在小分子SPR传感器中的应用情况, 着重介绍Au NPs在这些传感器中的信号放大原理, Au NPs与SPR芯片的连接方式及归纳近5年来Au NPs用于SPR传感器信号放大的实际应用案例, 并对其发展前景作出展望,为小分子SPR传感器应用于疾病早期诊断、食品安全、环境监测等领域的进一步发展提供参考依据。
1 Au NPs在SPR生物传感器的应用由于在传感器表面上的低浓度及小分子的分析物引起的折射率变化微小, 应用典型的SPR方法来检测是困难的。因此, 使用金属纳米材料会增强芯片的折射率, 对SPR响应造成更大的偏移。在接下来的内容中, 我们将讨论Au NPs在增强SPR响应中的应用。
1.1 原理Au NPs用于SPR传感器的信号放大有几大优点[25-28]: Au NPs具有生物相容性, 易修饰;Au NPs的单位体积的质量变化大, 有助于提高折射率的变化;球型Au NPs的直径可从几纳米变化到100纳米不等;更重要的是, Au NPs和SPR芯片的金薄膜之间存在电子耦合, 可有效增加表面粗糙度, 进而影响折射率的变化。1999年, NATAN团队首次将Au NPs应用于SPR传感器, 证明了Au NPs可提高了SPR折射率, 且检测灵敏度明显增加[29]。基于Au NPs的特性, Au NPs用于信号放大的机理主要有三种(见图 1): (a)Au NPs直接固定在SPR芯片表面, 使其与金膜表面产生电子耦合, 增加折射率变化, 通常称为无标记检测;(b)Au NPs用作标记物, 增加分子的质量, 增大折射率的变化, 通常称为有标记检测;(c)以上两种方式相结合, 通常也称为有标记检测。
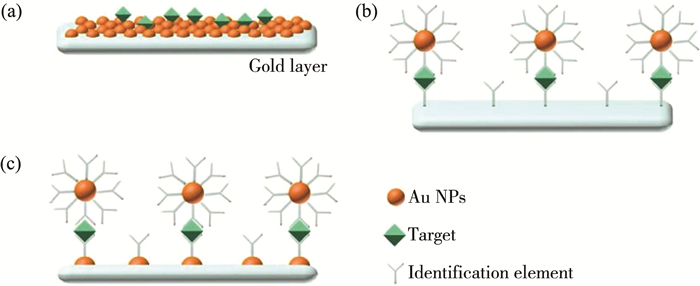 |
| 注: (a)Au NPs直接固定在SPR芯片表面; (b)Au NPs用作标记物; (c)两种方式结合。 图 1 Au NPs用于信号放大的三种原理图 |
1.2 Au NPs的制备及与SPR芯片的连接方式 1.2.1 制备方法
Au NPs可用多种方法制备, 其中应用较为广泛的是化学还原法。这一方法的原理是向一定浓度的金溶液中加入一定量的还原剂使金离子变成金原子, 形成金颗粒悬液。目前常用的还原剂有: 硼氢化钠、抗坏血酸、柠檬酸钠及鞣酸等。根据不同的还原剂可以制备大小不同的胶体金颗粒。常用来制备胶体金颗粒的方法如下:
(1) 柠檬酸三钠还原法
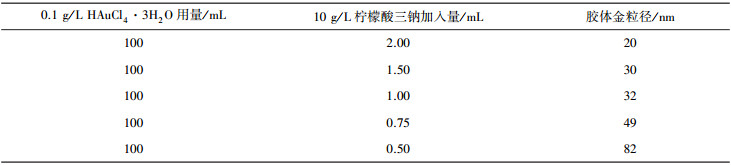
通常, 将1 mL 10 g/L的HAuCl4·3H2O添加到100 mL去离子水中, 煮沸并回流。然后, 快速添加1 mL新制备的质量浓度为10 g/L的柠檬酸三钠水溶液。20 min后, 溶液颜色从无色变为深红色。随后, 通过剧烈搅拌将溶液冷却至室温, 并保持在4 ℃以供进一步使用。表 1为柠檬酸三钠用量与胶体金颗粒直径的关系。
| 表 1 柠檬酸三钠用量与胶体金颗粒直径的关系 |
 |
(2) 鞣酸-柠檬酸钠还原法
将1 mL质量浓度10 g/L HAuCl4水溶液加入79 mL双馏水中混匀并加热到60 ℃, 然后加入4 mL质量浓度10 g/L柠檬酸钠, 0.7 mL质量浓度10 g/L鞣酸, 0.2 mL浓度0.1 mol/L K2CO3及20 ml双蒸馏水继续搅拌, 在极短的时间内加热到煮沸(大约10 min), 此时颜色由黑→蓝→亮红(近似红葡萄酒颜色)变化。上述用量合成的胶体金为10 nm, 根据所加入鞣酸(或称单宁酸)量的不同, 可合成3~17 nm颗粒大小的胶体金, 在鞣酸-柠檬酸钠还原法中, 柠檬酸钠是主要的还原剂,而鞣酸则具有双重作用, 既起还原作用, 也有保护作用, 它控制着“晶核”的形成过程, 故可改变鞣酸的用量来制备不同颗粒的胶体金(见表 2)。
| 表 2 鞣酸-柠檬酸钠还原法配置表 |
 |
(3) 硼氢化钠还原法
取0.6 mL 10 g/L氯化金水溶液加入40 mL预冷(4 ℃)双蒸馏水, 再加入0.2 mL 0.2 mol/L的K2CO3溶液, 随后边搅拌边加入新鲜配制的2 mL 0.5 mg/mL的硼氢化钠水溶液, 待溶液颜色由蓝紫色变为橙红色为止。然后继续搅拌5 min, 获得的金颗粒直径在2~5 nm之间。
(4) 种子介导法
具体合成过程是将150 μL的0.01 mol/L HAuCl4·3H2O和100 μL的0.01 mol/L H2PtCl6·3H2O添加到9.75 mL的0.1 mol/L CTAB溶液中, 然后通过在室温恒定磁搅拌下逐滴添加900 μL新制备的0.01 mol/L NaBH4(4 ℃)。所得溶液的颜色逐渐从橙色变为无色, 再变为浅粉色, 表明形成了种子颗粒。
1.2.2 Au NPs与SPR芯片的连接方式(1) 接枝法
由于胶体金颗粒具有很高的电子密度, 在可见光的激发下, 会产生强烈的电子振荡, 形成特征等离子体共振光谱。利用胶体金的这一性能, 许多科研工作者将玻片进行不同的功能化处理(如: —NH2, —SH, —CN)后, 使胶体金在玻片表面形成单层, 并以此单层为基底, 作为生物分子反应的支持介质, 进行生物传感以及生物分子之间相互作用的研究。ASHUTOSH等利用玻片为载体, 发展了一种新型的光学生物传感器, 在透明支持体上实时监测生物分子间的相互作用。这种检测方法以玻片上自然形成的单层胶体金为基底, 并在此基底修饰上生物素(biotin)分子, 来特异性识别检测链霉亲和素。
(2) 化学还原法
利用柠檬酸三钠还原HAuCl4水溶液得到红色的胶体金, 然后将玻片清洗干净之后, 放入APTMS/甲苯溶液中回流12 h后洗净, 取出, 吹干, 置于清洁干燥处备用。最后将处理好的玻片置胶体金中浸泡12 h后, 移入4×10-4 mol/L羟胺/1 g/L氯金酸溶液中, 浸泡0.5 h, 玻片表面即形成光亮的金膜素。
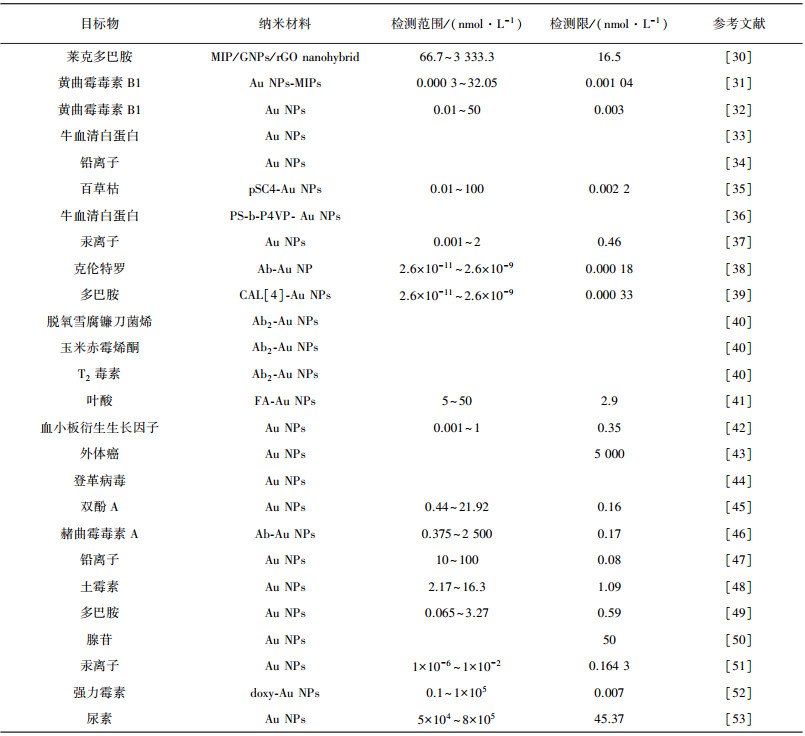
1.3 实际应用自1999年NATAN团队将Au NPs应用于SPR传感器到现在, 已经20余年的时间, 本综述将重点总结其近5年在SPR传感器的应用情况(见表 3)。
| 表 3 Au NPs用于SPR传感器信号放大的实际应用案例 |
 |
1.3.1 无标记检测
无标记检测在传感检测领域是非常受欢迎的, 因为它操作简单、检测结果直观。在小分子SPR传感无标记检测方法中, 能够特异识别靶标物的识别分子和增强信号的Au NPs是影响方法检测性能的重要因素。2016年, YAO等[30]将Au NPs、石墨烯及分子印迹聚合物(molecularly imprinted polymers, MIPs)混合, 通过离子液体将混合物接枝到SPR芯片上, 其中MIPs为识别分子, 当MIPs与靶标物相互作用时, Au NPs和石墨烯用于增大折射率的变化, 最后成功应用于莱克多巴胺的检测, 其线性范围为20~1 000 ng/mL, 检测限为5 ng/mL。为了进一步提高MIPs-SPR传感器的检测灵敏度, 2020年, AKGÖNÜLLÜ等[31]在合成黄曲霉毒素B1 (AFB1)MIPs的时候, 直接将Au NPs掺入其中, 合成Au NPs-MIPs识别元件, 该传感器的线性范围为0.000 1~10 ng/mL, 检测限可达到1.04 pg/mL(见图 2A)。同年, Bhardwaj等[32]比较了裸SPR芯片和修饰有Au NPs的SPR芯片在抗原-抗体SPR传感器中对AFB1的检测性能, 结果表明, 修饰有Au NPs的SPR芯片的传感器的灵敏度可提高100倍(见图 2B)。为了进一步提高抗原-抗体SPR传感器的检测性能, Rüger等[33]提出了牛血清白蛋白(BSA)-Au NPs-抗体的三明治结构, 用以提高检测灵敏度。多糖具有天然螯合特性, 可以结合重金属离子, 利用这一特点, ABDULLAH等[34]比较了卡拉胶和壳聚糖分别结合Au NPs后对Pb(Ⅱ)的检测效果, 实验表明, 卡拉胶作为识别元件时, SPR传感器的检测性能更好。经研究, 大环芳烃化合物也可以作为识别分子, 并可修饰在Au NPs上, 应用到SPR传感器中, DONG等[35]将对磺酸盐芳烃化合物(pSC4)修饰在Au NPs表面, 得到pSC4-Au NPs, 通过自组装固定在SPR芯片表面, 当百草枯存在时, 通过主客体识别与pSC4-Au NPs相结合, 且可进一步引起pSC4-Au NPs的聚集, 进而提高检测灵敏度, 本方法检测限可达到2.2 pmol/L (见图 2C)。光纤SPR传感器是光纤探针替代传统的SPR芯片, 更加便携及成本低廉, Lu等[36]为了得到良好的光纤SPR传感器, 考察了使用不同自组装分子层固定Au NPs时对传感器灵敏度的影响(见图 2D), 结果表明, 与使用(3-氨基丙基)三甲氧基硅烷和聚电解质的标准Au NPs沉积方法相比, 聚(苯乙烯-b-4-乙烯基吡啶)模板法的灵敏度提高了3倍, 同时研究了不同粒径Au NPs和不同粒子间隙/粒子直径比值对折射率的影响, 结果表明较大粒子的较小间隙/直径比值更能提高折射率的变化。Au NPs不仅具有良好的LSPR特性, 且具有纳米酶活性, WANG等[37]利用Au NPs的纳米酶活性, 提出了原位生成Au NPs催化3, 3', 5, 5'-四甲基联苯胺(TMB)产生TMB2+进行级联放大信号, 并成功应用于Hg2+的检测, 检测限可达到0.46 pmol/L。
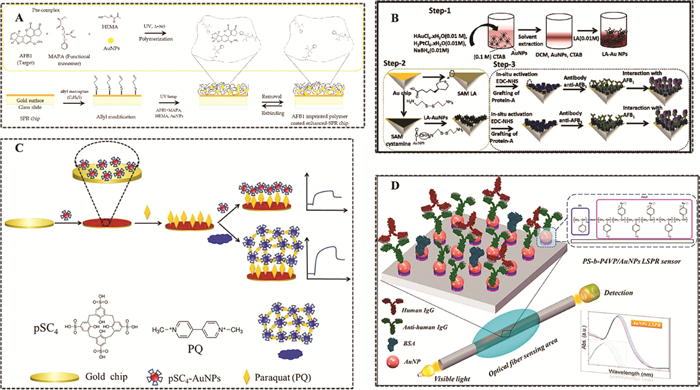 |
| 注: (A)SPR纳米传感器安装示意图[31];(B)生物传感器活性表面修饰的不同步骤示意图[32];(C)SPR芯片表面PQ检测原理图[35];(D)光纤LSPR传感器原理图[36]。 图 2 Au NPs增强SPR信号: 无标记检测 |
1.3.2 有标记检测
通常情况下, 有标记检测可更大程度上提高传感器的灵敏度。KABIRAZ等[38]将Au NPs标记到抗体上, 此标记抗体与靶标共同竞争SPR芯片上的抗原, 靶标浓度越高, 结合在SPR芯片上的标记抗体越少, 由于Au NPs质量很大, 折射率变化则更为明显, 达到信号放大的作用。而且, 他们发现Au NPs标记引起的介电常数变化不会影响亲和常数。最终, 此方案最低可检测到0.05 pg/mL的克伦特罗, 比没有标记Au NPs的检测方案灵敏度低40倍(见图 3A)。同年, ZOU等[39]则是将多巴胺半抗原标记到Au NPs上, 使此标记物与多巴胺共同竞争SPR芯片上的抗体, 最终最低可以对1.17 pmol/L多巴胺进行检测(见图 3B)。为了提高检测效率, HOSSAIN等[40]完成了脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEA)和T-2毒素的同时检测, 他们将靶标物的抗原固定在SPR芯片上, 靶标物与抗体共同竞争此抗原, 然后标有Au NPs的二抗再与结合到抗原上的抗体相识别, 靶标物的浓度越高, 结合到芯片的二抗越少, 引起的折射率变化越小。此方案成功应用于小麦中三种毒素的检测, 回收率为87%~103%, 检测限分别为15 ng/g(DON), 24 ng/g(ZEA), 12 ng/g(T-2毒素)(见图 3C)。2018年, CAO等[41]提出竞争法检测叶酸, 首先是将能够识别叶酸的蛋白固定在SPR芯片上, 然后标有Au NPs的叶酸与叶酸共同竞争识别蛋白, 达到信号放大的作用, 此方法的检测限为2.9 nmol/L(见图 3D)。
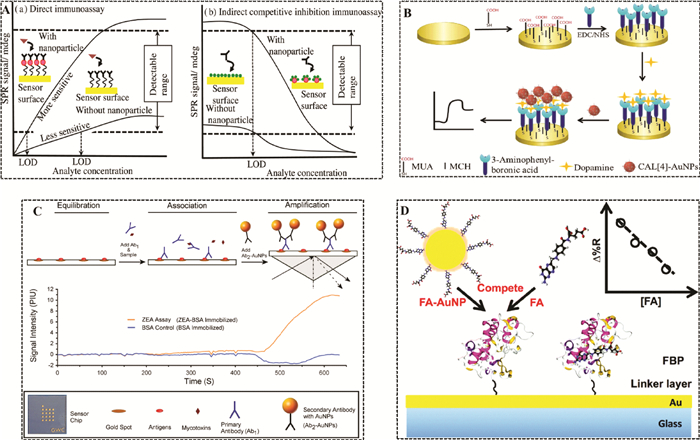 |
| 注: (A)Au NPs标记和未标记的SPR生物传感器的校准曲线比较: (a)直接免疫分析法和(b)间接竞争抑制免疫分析法[38];(B)SPR芯片表面多巴胺检测原理图[39];(C)利用二级抗体金纳米粒子(Ab2-Au NPs)标记进行信号扩增的镰刀菌真菌毒素iSPR检测方法示意图[40];(D)叶酸(FA)功能化金纳米颗粒(FA-Au NPs)增强竞争性检测FA的示意图[41]。 图 3 Au NPs增强SPR信号: 有标记检测 |
2 结论
SPR技术已从传统的光学生物传感应用扩展到生物医学、环境、工业、光催化能量转换以及安全和国防等领域。对于小分子检测, 信号放大是提高SPR传感器性能的重要研究内容, Au NPs用于信号放大已得到较为广泛的研究, 但随着科技的进一步发展, 仍需探究其提高灵敏度的应用潜能。比如, 现阶段新型纳米材料不断出现, 如二维纳米材料氮化硼(BN)、二硫化钼(MoS2)、二硫化钨(WS2)、MXene材料、金属-有机框架(MOFs)、3D打印纳米材料等, 探究Au NPs与这些新型纳米材料相结合后的信号放大作用是一个重要方向;与其他贵金属相结合达到信号放大的作用也是一种重要的途径, 如金银核壳材料、金银混合材料、金铂纳米材料等;纳米材料的形状变化是否能引起SPR性能变化也需要探究, 如Au纳米星、Au纳米棒、Au纳米立方体等。总之, 对于Au NPs应用于SPR传感器的信号放大的研究仍存在很大的研究空间, 需要研究人员进一步探索, 同时也能提升SPR传感器应用于小分子检测的应用价值。
| [1] |
HOMOLA J, YEE S S, GAUGLITZ G. Surface plasmon resonance sensors: Review[J]. Sensors and Actuators B: Chemical, 1999, 54(1/2): 3-15. |
| [2] |
于林, 刘军. 表面等离子共振技术在食品安全检测中的应用[J]. 质量安全与检验检测, 2020, 30(4): 135-136. |
| [3] |
QU J H, DILLEN A, SAEYS W, et al. Advancements in SPR biosensing technology: An overview of recent trends in smart layers design, multiplexing concepts, continuous monitoring and in vivo sensing[J]. Analytica Chimica Acta, 2020, 1104: 10-27. DOI:10.1016/j.aca.2019.12.067 |
| [4] |
RIZAL C, BELOTELOV V. Sensitivity comparison of surface plasmon resonance (SPR) and magneto-optic SPR biosensors[J]. The European Physical Journal Plus, 2019, 134(9): 435. DOI:10.1140/epjp/i2019-12819-3 |
| [5] |
LIEDBERG B, NYLANDER C, LUNSTRÖM I. Surface plasmon resonance for gas detection and biosensing[J]. Sensors and Actuators, 1983, 4: 299-304. DOI:10.1016/0250-6874(83)85036-7 |
| [6] |
MAILLART E, BRENGEL-PESCE K, CAPELA D, et al. Versatile analysis of multiple macromolecular interactions by SPR imaging: Application to p53 and DNA interaction[J]. Oncogene, 2004, 23(32): 5543-5550. DOI:10.1038/sj.onc.1207639 |
| [7] |
HE Y H, WANG Z X, HU Y Q, et al. Sensitive and selective monitoring of the DNA damage-induced intracellular p21 protein and unraveling the role of the p21 protein in DNA repair and cell apoptosis by surface plasmon resonance[J]. The Analyst, 2020, 145(10): 3697-3704. DOI:10.1039/C9AN02464F |
| [8] |
MEYER M H F, HARTMANN M, KEUSGEN M. SPR-based immunosensor for the CRP detection—a new method to detect a well known protein[J]. Biosensors and Bioelectronics, 2006, 21(10): 1987-1990. DOI:10.1016/j.bios.2005.09.010 |
| [9] |
HSIEH H Y, CHANG R, HUANG Y Y, et al. Continuous polymerase chain reaction microfluidics integrated with a gold-capped nanoslit sensing chip for Epstein-Barr virus detection[J]. Biosensors and Bioelectronics, 2022, 195: 113672. DOI:10.1016/j.bios.2021.113672 |
| [10] |
KO S, PARK T J, KIM H S, et al. Directed self-assembly of gold binding polypeptide-protein A fusion proteins for development of gold nanoparticle-based SPR immunosensors[J]. Biosensors and Bioelectronics, 2009, 24(8): 2592-2597. DOI:10.1016/j.bios.2009.01.030 |
| [11] |
YANASE Y, HIRAGUN T, ISHII K, et al. Surface plasmon resonance for cell-based clinical diagnosis[J]. Sensors, 2014, 14(3): 4948-4959. DOI:10.3390/s140304948 |
| [12] |
OLARU A, BALA C, JAFFREZIC-RENAULT N, et al. Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis[J]. Critical Reviews in Analytical Chemistry, 2015, 45(2): 97-105. DOI:10.1080/10408347.2014.881250 |
| [13] |
TRAN D T, KNEZ K, JANSSEN K P, et al. Selection of aptamers against Ara h 1 protein for FO-SPR biosensing of peanut allergens in food matrices[J]. Biosensors and Bioelectronics, 2013, 43: 245-251. DOI:10.1016/j.bios.2012.12.022 |
| [14] |
MAHMOUDPOUR M, EZZATI NAZHAD DOLATABADI J, TORBATI M, et al. Nanomaterials based surface plasmon resonance signal enhancement for detection of environmental pollutions[J]. Biosensors and Bioelectronics, 2019, 127: 72-84. DOI:10.1016/j.bios.2018.12.023 |
| [15] |
TEOTIA P K, KALER R S. 1-D grating based SPR biosensor for the detection of lung cancer biomarkers using Vroman effect[J]. Optics Communications, 2018, 406: 188-191. DOI:10.1016/j.optcom.2017.03.079 |
| [16] |
CENNAMO N, PESAVENTO M, LUNELLI L, et al. An easy way to realize SPR aptasensor: a multimode plastic optical fiber platform for cancer biomarkers detection[J]. Talanta, 2015, 140: 88-95. DOI:10.1016/j.talanta.2015.03.025 |
| [17] |
CAO Y, MCDERMOTT M T. A surface plasmon resonance based inhibition immunoassay for measurement of steroid hormones[J]. Analytical Biochemistry, 2018, 557: 7-12. DOI:10.1016/j.ab.2018.06.027 |
| [18] |
TREVIÑO J, CALLE A, RODRÍGUEZ-FRADE J M, et al. Single- and multi-analyte determination of gonadotropic hormones in urine by Surface Plasmon Resonance immunoassay[J]. Analytica Chimica Acta, 2009, 647(2): 202-209. DOI:10.1016/j.aca.2009.06.002 |
| [19] |
刘瑾, 王文, 张婉洁, 等. 基于表面等离子体共振传感器信号放大的抗生素残留检测[J]. 分析试验室, 2012, 31(11): 5-9. DOI:10.13595/j.cnki.issn1000-0720.2012.0309 |
| [20] |
LUO Q H, YU N, SHI C F, et al. Surface plasmon resonance sensor for antibiotics detection based on photo-initiated polymerization molecularly imprinted array[J]. Talanta, 2016, 161: 797-803. DOI:10.1016/j.talanta.2016.09.049 |
| [21] |
YANG G, CHO N. Development, validation, and application of a portable SPR biosensor for the direct detection of insecticide residues[J]. Food Science and Biotechnology, 17: 1038-1046. |
| [22] |
MITCHELL J S, WU Y Q, COOK C J, et al. Sensitivity enhancement of surface plasmon resonance biosensing of small molecules[J]. Analytical Biochemistry, 2005, 343(1): 125-135. DOI:10.1016/j.ab.2005.05.001 |
| [23] |
刘雪梅, 王晓琳, 仇增凤, 等. 表面等离子体共振传感技术应用于小分子检测[J]. 光谱学与光谱分析, 2021, 41(2): 511-516. |
| [24] |
ZENG S W, YU X, LAW W C, et al. Size dependence of Au NP-enhanced surface plasmon resonance based on differential phase measurement[J]. Sensors and Actuators B: Chemical, 2013, 176: 1128-1133. DOI:10.1016/j.snb.2012.09.073 |
| [25] |
LINK S, EL-SAYED M A. Size and temperature dependence of the plasmon absorption of colloidal gold nanoparticles[J]. The Journal of Physical Chemistry B, 1999, 103(21): 4212-4217. DOI:10.1021/jp984796o |
| [26] |
WANG L, LI T, DU Y, et al. Au NPs-enhanced surface plasmon resonance for sensitive detection of mercury(Ⅱ) ions[J]. Biosensors and Bioelectronics, 2010, 25(12): 2622-2626. DOI:10.1016/j.bios.2010.04.027 |
| [27] |
HE L, MUSICK M D, NICEWARNER S R, et al. Colloidal Au-enhanced surface plasmon resonance for ultrasensitive detection of DNA hybridization[J]. Journal of the American Chemical Society, 2000, 122(38): 9071-9077. DOI:10.1021/ja001215b |
| [28] |
HENDRIX M, PRIESTLEY E S, JOYCE G F, et al. Direct observation of aminoglycoside-RNA interactions by surface plasmon resonance[J]. Journal of the American Chemical Society, 1997, 119(16): 3641-3648. DOI:10.1021/ja964290o |
| [29] |
LYON L A, PEÑA D J, NATAN M J. Surface plasmon resonance of Au colloid-modified Au films: particle size dependence[J]. The Journal of Physical Chemistry B, 1999, 103(28): 5826-5831. DOI:10.1021/jp984739v |
| [30] |
YAO T, GU X, LI T F, et al. Enhancement of surface plasmon resonance signals using a MIP/GNPs/rGO nano-hybrid film for the rapid detection of ractopamine[J]. Biosensors and Bioelectronics, 2016, 75: 96-100. DOI:10.1016/j.bios.2015.08.027 |
| [31] |
AKGÖNÜLLÜ S, Yavuz H, Denizli A. SPR nanosensor based on molecularly imprinted polymer film with gold nanoparticles for sensitive detection of aflatoxin B1[J]. Talanta, 2020, 219: 121219. DOI:10.1016/j.talanta.2020.121219 |
| [32] |
BHARDWAJ H, SUMANA G, CHRISTOPHE A, et al. A label-free ultrasensitive microfluidic surface plasmon resonance biosensor for aflatoxin B1 detection using nanoparticles integrated gold chip[J]. Food Chemistry, 2020, 307: 125530. DOI:10.1016/j.foodchem.2019.125530 |
| [33] |
RVGER F, KEUSGEN M, VORNICESCU D. Gold albumin sandwich structures for enhanced biosensing using surface plasmon resonance[J]. Physica Status Solidi (a), 2021, 218(13): 2100029. DOI:10.1002/pssa.202100029 |
| [34] |
ABDULLAH S, AZEMAN N H, MOBARAK N N, et al. Sensitivity enhancement of localized SPR sensor towards Pb(Ⅱ) ion detection using natural bio-polymer based carrageenan[J]. Optik, 2018, 168: 784-793. DOI:10.1016/j.ijleo.2018.05.016 |
| [35] |
DONG H B, ZOU F, HU X J, et al. Analyte induced AuNPs aggregation enhanced surface plasmon resonance for sensitive detection of paraquat[J]. Biosensors and Bioelectronics, 2018, 117: 605-612. DOI:10.1016/j.bios.2018.06.057 |
| [36] |
LU M D, ZHU H, BAZUIN C G, et al. Polymer-templated gold nanoparticles on optical fibers for enhanced-sensitivity localized surface plasmon resonance biosensors[J]. ACS Sensors, 2019, 4(3): 613-622. DOI:10.1021/acssensors.8b01372 |
| [37] |
WANG X, LV W X, WU J H, et al. In situ generated nanozyme-initiated cascade reaction for amplified surface plasmon resonance sensing[J]. Chemical Communications, 2020, 56(33): 4571-4574. DOI:10.1039/D0CC01117G |
| [38] |
KABIRAZ D C, MORITA K, SAKAMOTO K, et al. Mechanism of surface plasmon resonance sensing by indirect competitive inhibition immunoassay using Au nanoparticle labeled antibody[J]. Talanta, 2017, 172: 1-7. DOI:10.1016/j.talanta.2017.05.003 |
| [39] |
ZOU F, WU B P, WANG X X, et al. Signal amplification and dual recognition strategy for small-molecule detection by surface plasmon resonance based on calix[4]arene crown ether-modified gold nanoparticles[J]. Sensors and Actuators B: Chemical, 2017, 241: 160-167. DOI:10.1016/j.snb.2016.10.063 |
| [40] |
HOSSAIN M Z, MARAGOS C M. Gold nanoparticle-enhanced multiplexed imaging surface plasmon resonance (iSPR) detection of Fusarium mycotoxins in wheat[J]. Biosensors and Bioelectronics, 2018, 101: 245-252. DOI:10.1016/j.bios.2017.10.033 |
| [41] |
CAO Y, GRIFFITH B, BHOMKAR P, et al. Functionalized gold nanoparticle-enhanced competitive assay for sensitive small-molecule metabolite detection using surface plasmon resonance[J]. The Analyst, 2017, 143(1): 289-296. |
| [42] |
QIAN H S, HUANG Y, DUAN X L, et al. Fiber optic surface plasmon resonance biosensor for detection of PDGF-BB in serum based on self-assembled aptamer and antifouling peptide monolayer[J]. Biosensors and Bioelectronics, 2019, 140: 111350. DOI:10.1016/j.bios.2019.111350 |
| [43] |
WANG Q, ZOU L Y, YANG X H, et al. Direct quantification of cancerous exosomes via surface plasmon resonance with dual gold nanoparticle-assisted signal amplification[J]. Biosensors and Bioelectronics, 2019, 135: 129-136. DOI:10.1016/j.bios.2019.04.013 |
| [44] |
BASSO C R, TOZATO C C, CRULHAS B P, et al. An easy way to detect dengue virus using nanoparticle-antibody conjugates[J]. Virology, 2018, 513: 85-90. DOI:10.1016/j.virol.2017.10.001 |
| [45] |
LUO Z W, ZHANG J, WANG Y M, et al. An aptamer based method for small molecules detection through monitoring salt-induced AuNPs aggregation and surface plasmon resonance (SPR) detection[J]. Sensors and Actuators B: Chemical, 2016, 236: 474-479. DOI:10.1016/j.snb.2016.06.035 |
| [46] |
KARCZMARCZYK A, REINER-ROZMAN C, HAGENEDER S, et al. Fast and sensitive detection of ochratoxin A in red wine by nanoparticle-enhanced SPR[J]. Analytica Chimica Acta, 2016, 937: 143-150. DOI:10.1016/j.aca.2016.07.034 |
| [47] |
XU Q, WANG S, BAO Q, et al. Characterization of AuNP-enhanced SPR biosensor for Pb2+detection[J]. China Environmental Science, 2020, 40(11): 5038-5044. DOI:10.3969/j.issn.1000-6923.2020.11.046 |
| [48] |
HUANG H B, LI J J, PAN S Q, et al. A novel small molecular liquid crystal catalytic amplification-nanogold SPR aptamer absorption assay for trace oxytetracycline[J]. Talanta, 2021, 233: 122528. DOI:10.1016/j.talanta.2021.122528 |
| [49] |
TVRKMEN D, BAKHSHPOUR M, GÖKTVRK I, et al. Selective dopamine detection by SPR sensor signal amplification using gold nanoparticles[J]. New Journal of Chemistry, 2021, 45(39): 18296-18306. DOI:10.1039/D1NJ01938D |
| [50] |
MELAINE F, ROUPIOZ Y, BUHOT A. Small molecule SPR imaging detection from split aptamer microarrays[J]. Procedia Technology, 2017, 27: 6-7. DOI:10.1016/j.protcy.2017.04.004 |
| [51] |
DUAN Y F, ZHANG Y, WANG F, et al. 4-mercaptopyridine modified fiber optic plasmonic sensor for sub-nM mercury (Ⅱ) detection[J]. Photonic Sensors, 2022, 12(1): 23-30. DOI:10.1007/s13320-021-0611-z |
| [52] |
KAZMI S A R, QURESHI M Z, MASSON J F. Drug-based gold nanoparticles overgrowth for enhanced SPR biosensing of doxycycline[J]. Biosensors, 2020, 10(11): 184. DOI:10.3390/bios10110184 |
| [53] |
VIKAS, GUPTA S, TEJAVATH K, et al. Urea detection using bio-synthesized gold nanoparticles: An SPR/LSPR based sensing approach realized on optical fiber[J]. Optical and Quantum Electronics, 2020, 52(6): 278. DOI:10.1007/s11082-020-02405-6 |
 2023, Vol. 37
2023, Vol. 37


