| 海带多糖中重金属脱除工艺研究 |
2. 威海海日水产食品有限公司, 山东 威海 264200;
3. 山东省海洋功能食品技术创新中心, 山东 威海 264200;
4. 山东晟达菲尔生物科技发展有限公司, 山东 枣庄 277000
2. Weihai Hairi Aquatic Food Co., Ltd., Weihai 264200, China;
3. Shandong Marine Functional Food Technology Innovation Center, Weihai 264200, China;
4. Shandong Shengdafeier Biotechnology Development Co., Ltd., Zaozhuang 277000, China
海带是我国重要的经济海藻之一, 来源广泛且价格低廉, 生产方式主要以初加工为主, 产品附加值低。海带多糖是存在于海带中的一类天然生物大分子, 近几年的研究表明, 海带的诸多活性, 如抗氧化[1]、抗肿瘤[2]、抗菌[3]、抗病毒[4]、抗凝血[5]、降血糖[6]、改善肠道微生态[7]、预防动脉粥样硬化[8]、抗衰老[9]、治疗肾病[10]等, 与海带多糖有着密不可分的关系[11]。海带多糖是海带深加工的主要产品之一, 具有很高的商业价值[12-13]。研究表明, 海带多糖中的褐藻糖胶含有糖醛酸和硫酸基团, 能够吸附和结合有毒污染物和重金属离子(Pb、As等)[14], 使得海带易于富集环境中的重金属。张乾通[15]对舟山渔场主要海产品进行分析检测, 发现受污染程度最严重的是海带类, 其中重金属铅、镉的单项污染指数值分别为0.53、1.22, 且污染还有逐年上升的趋势。长期食用重金属超标的海带系列产品会对人体健康带来巨大的风险。
目前, 国内外学者在水体[16]、土壤[17]、海产动物[18]等方面对重金属脱除做了较多研究, 对于海藻(例如海带、裙带菜、紫菜等)中的重金属脱除问题也引起了人们的重视, 但关于海带多糖中重金属脱除的相关研究报道较少。目前存在的问题为: 一是在重金属脱除过程中, 只关注某种元素的脱除效果, 不能达到同时有效脱除多种元素; 二是脱除过程可能导致原料有效成分的损失。海带多糖中重金属脱除常用的脱除剂有金属螯合剂EDTA、植酸[19]、乙醇[20]、乙酸[21]和柠檬酸[22-25]。本研究中采用的靶向硅胶是一种全新型过滤吸附材料[26], 糅合了活性炭的物理吸附、树脂的离子交换吸附、硅胶的螯合吸附, 改善了传统吸附材料官能团种类少、化学和热稳定性差、易于膨胀和收缩等问题。
本研究以海带多糖为研究对象, 采用硅胶吸附重金属, 单因素试验主要考察pH、硅胶用量、吸附温度、吸附时间对海带多糖中铅、镉、铬的脱除率和多糖保留率的影响, 采用正交试验优化脱除工艺, 达到同时降低海带多糖中铅、镉、铬含量的目的, 并最大程度保留海带多糖。通过有效降低海带多糖中重金属含量, 提高海带多糖产品的品质, 满足使用海带多糖开展精深加工的高端需求。
1 材料和方法 1.1 材料与仪器干海带购于济南七里堡市场(产自山东荣成), 未去头、尾, 未经过化学处理; 纤维素酶(10 000 U/g, 南宁东恒华道生物科技有限责任公司); 果胶酶(10 000 U/g, 南宁东恒华道生物科技有限责任公司); 硅胶(浅黄色粉末、粒径37~200 μm、水分含量3.27%、型号As-01, 无锡定象改性硅胶材料有限公司); 多元素(铅、镉、铬)标准溶液(国家有色金属及电子材料分析测试中心); 葡萄糖、氢氧化钠、盐酸、浓硫酸、苯酚(分析纯, 国药集团化学试剂有限公司)。
SHA-C型恒温振荡器(常州国华电器有限公司); TDL-5-A型台式离心机(上海安亭科学仪器厂); FDU-2110型冷冻干燥机(东京理化器械株式会社); Infinite M200 Pro型多功能酶标仪(帝肯(上海)实验器材有限公司); FE20型实验室pH计(梅特勒-托利多仪器(上海)有限公司); EX124ZH/AD型电子天平(奥豪斯仪器(常州)有限公司); KQ-400KDA型高功率数控超声波清洗器(昆山市超声仪器有限公司); DKB-8A型电热恒温水浴锅(上海精宏实验设备有限公司); C22-WH2236型电磁炉(广东美的生活电器制造有限公司); DHG-9070A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司); 极光6微波消解仪(上海屹尧仪器科技发展有限公司); 7900电感耦合等离子体质谱仪(美国安捷伦公司)。
1.2 实验方法 1.2.1 海带预处理购买的干海带搓掉泥沙和海盐, 剪碎后放入鼓风干燥箱中进一步烘干、粉碎, 过50目筛(孔径0.355 mm) 即得到海带粉末, 阴凉干燥处保存备用。
1.2.2 海带多糖提取称取适量海带粉末按照料液比1∶15 (g/mL)加入去离子水溶解, 混匀, 在400 W功率下超声处理1 h, 加入质量分数1%纤维素酶和质量浓度1%果胶酶, pH调至6, 60 ℃酶解2 h后于95 ℃加热灭酶20 min, 冷却至室温, 纱布过滤后8 000 r/min离心15 min, 收集上清液并浓缩, 加入4倍体积的95%乙醇过夜, 8 000 r/min离心15 min, 收集沉淀即为海带粗多糖, 45 ℃烘箱中干燥, 粉碎并研磨成粉末, 阴凉干燥处保存备用。
1.2.3 单因素试验pH对海带多糖中重金属脱除效果的影响。称取3.0 g海带多糖置于烧杯中, 加入100 mL去离子水, 在60 ℃恒温振荡器中振荡至海带多糖完全溶解。使用NaOH或HCl调节溶液pH, pH分别设置为3、5、7、9、11。硅胶用量为2.0 g, 在温度为60 ℃, 振荡转速为50 r/min的恒温振荡器中孵育2 h, 考察不同pH对海带多糖中重金属脱除效果的影响。
硅胶用量对海带多糖中重金属脱除效果的影响。称取3.0 g海带多糖置于烧杯中, 加入100 mL去离子水, 在60 ℃恒温振荡器中振荡至海带多糖完全溶解。pH设置为7, 硅胶用量分别为1.5、2.0、2.5、3.0、3.5、4.0 g, 在温度为60 ℃, 振荡转速为50 r/min的恒温振荡器中孵育2 h, 考察不同硅胶用量对海带多糖中重金属脱除效果的影响。
温度对海带多糖中重金属脱除效果的影响。称取3.0 g海带多糖置于烧杯中, 加入100 mL去离子水, 在60 ℃恒温振荡器中振荡至海带多糖完全溶解。pH设置为7, 硅胶用量为3.5 g, 在温度分别为30、40、50、60 ℃, 振荡转速为50 r/min的恒温振荡器中孵育2 h, 考察不同温度对海带多糖中重金属脱除效果的影响。
时间对海带多糖中重金属脱除效果的影响。称取3.0 g海带多糖置于烧杯中, 加入100 mL去离子水, 在60 ℃恒温振荡器中振荡至海带多糖完全溶解。pH设置为7, 硅胶用量为3.5 g, 在温度为60 ℃, 振荡转速为50 r/min的恒温振荡器中分别孵育1、2、3、4、5 h, 考察不同时间对海带多糖中重金属脱除效果的影响。
1.2.4 正交试验根据单因素试验结果进行pH、温度、时间3个因素的正交试验设计, 水平设置见表 1, 采用正交表L9(34)进行试验, 根据重金属的脱除率和海带多糖的保留率, 确定硅胶吸附海带多糖中重金属的最佳条件。
| 表 1 正交试验因素及水平表 |
 |
1.2.5 海带多糖中重金属元素的测定
按GB 5009.268-2016《食品安全国家标准食品中多元素的测定》[27]对铅、镉、铬进行检测。
重金属脱除率的计算:
| $ \text { 重金属脱除率 }=\frac{X_{0}-X_{t}}{X_{0}}, $ | (1) |
其中X0、Xt分别表示硅胶吸附前、吸附后海带多糖中铅、镉、铬的含量, 单位mg/kg。
海带多糖保留率的计算:
首先葡萄糖标准曲线的绘制。参考李琪等[28]的实验方法, 拟合得到线性回归方程y=0.006x-0.022 7, R2=0.990 5。
其次海带多糖含量的测定及保留率的计算。海带多糖含量的测定采用苯酚-硫酸法[29]。多糖的保留率计算公式如下:
| $ \text { 多糖保留率 }=\frac{X_{1}-X_{2}}{X_{2}}, $ | (2) |
其中X1、X2分别表示硅胶吸附海带多糖中重金属前后多糖的含量, 单位mg/mL。
1.3 数据处理实验数据采用“平均值±标准偏差”的形式表示, 所有实验设置3个平行。采用Excel 2016、IBM SPSS 22.0、Origin 2021等软件进行数据处理分析和图表绘制。
2 结果与分析 2.1 海带多糖中重金属元素的测定对重金属脱除前的海带多糖进行铅、镉、铬含量测定, 含量分别为(0.250±0.05) mg/kg、(1.22±0.01) mg/kg、(4.22±0.02) mg/kg。其中铅和镉的含量与文献[30]中铅和镉的含量相近。根据食品安全国家标准规定[31], 对于铅元素的限量要求为1.0 mg/kg, 测定结果显示海带多糖中铅的含量并未超出国家标准限值; 对于镉、铬元素并无关于海藻类的相关限定。根据樊林等[32]的研究方法, 海藻类镉、铬的限量标准可参考食品安全国家标准规定[31]中蔬菜及其制品镉、铬的限量要求和水产动物及其制品镉、铬的限量要求。镉的含量限值为≤0.1 mg/kg, 铬的含量限值为≤1.0~2.0 mg/kg。本研究的测定结果显示, 海带多糖中镉和铬的含量超出上述限值。有效脱除海带多糖中的重金属镉和铬, 对海带多糖的产业化应用具有重要意义。
2.2 单因素试验 2.2.1 pH对海带多糖中重金属脱除效果的影响不同pH条件可能会影响硅胶的吸附位点, 从而影响对重金属的吸附效果。同时, 酸碱条件还会影响重金属离子的化学状态。
如图 1(A)所示, 在pH 1~9范围内, 铅脱除率随着pH的增加而增加, 当pH=9时, 铅脱除率达到最大值, pH大于9后铅脱除率下降。这是由于在酸性溶液中, 溶液中的H+易于与硅胶中的配位原子N和S结合, 使得螯合配体处于质子化状态, 从而降低了硅胶与铅离子的螯合能力[33]。随着pH的升高, 硅胶中配位原子的质子化状态减弱, 硅胶与铅离子的螯合能力增强, 从而吸附量也升高, 可以提高铅脱除率[33]。但是当pH大于9时, 铅离子易形成亚铅酸盐沉淀物, 从而又使硅胶对铅离子的吸附量降低。因此出现了铅脱除率随着pH的增加先增加后降低的现象。综上所述, 脱除铅的适宜pH为5~9。
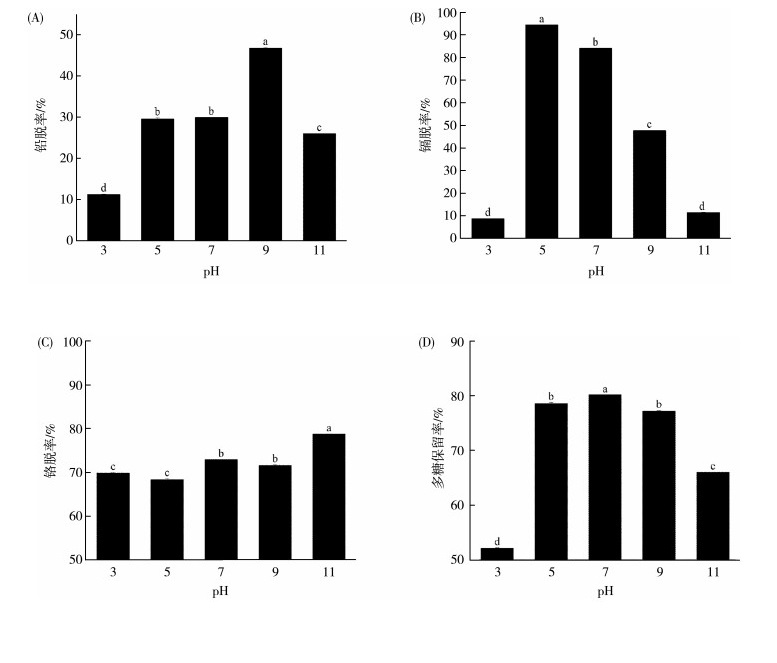 |
| 注:(A)铅脱除率; (B)镉脱除率; (C)铬脱除率; (D)多糖保留率; 图 2~图 4同。不同字母标识表示不同实验组间具有显著性差异(P<0.05)。 图 1 pH对海带酶解多糖中重金属脱除效果的影响 |
如图 1(B)所示, 当pH=5时, 硅胶对于镉的吸附效果达到最佳。这与苏国钧等[34]研究结果一致, 材料中的氨基在pH 5~8范围内对镉离子有良好的吸附作用。因此脱除镉的适宜pH为5~7。
如图 1(C)所示, 铬脱除率随着pH的升高而增加, 该规律与其他活性炭类物质吸附铬的规律相类似。当pH=11时, 铬脱除率最高。因此脱除铬的适宜pH为7~11。
多糖保留率检测结果表明(图 1(D)), pH=7时, 多糖保留率最高。已有研究表明, 多糖在高温和酸性环境中具有良好的化学稳定性, 而在碱性环境中稳定性较差[35], 这可能会影响其生物活性。
因此综合考虑脱除铅、镉、铬和多糖保留率的适宜pH范围, pH为7时是最佳条件, 正交试验中将选用pH为6~8。
2.2.2 硅胶用量对海带多糖中重金属脱除效果的影响以铅脱除率为指标时(图 2(A)), 硅胶用量从1.5 g增加到3.5 g时, 铅的脱除率稳中有升, 从10%上升至近30%。在硅胶用量为4.0 g时, 脱除率略有下降, 但是经单因素方差分析, 4.0 g硅胶用量和3.5 g硅胶用量对铅脱除率并没有显著性差异(P>0.05)。因此, 3.5 g硅胶用量为最佳条件。
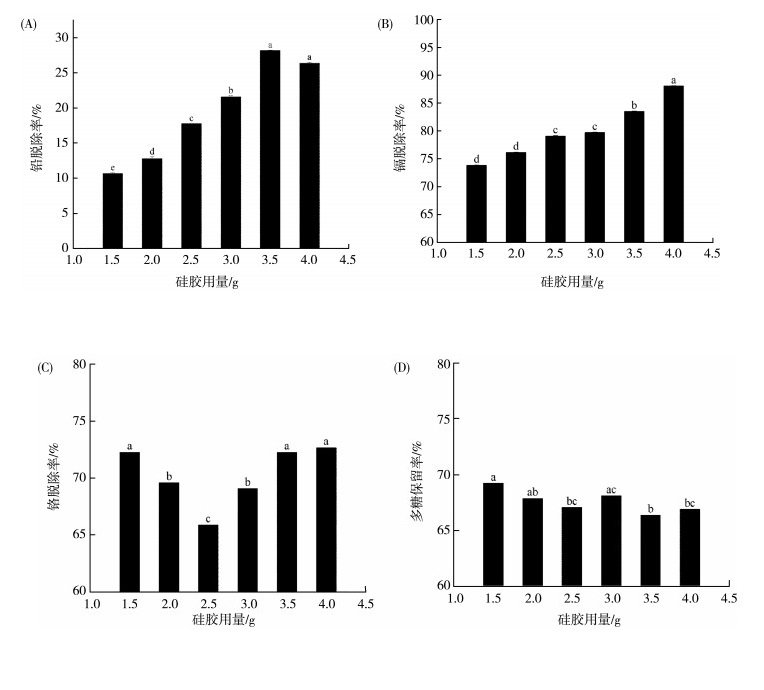 |
| 图 2 硅胶用量对海带酶解多糖中重金属脱除效果的影响 |
硅胶对镉的脱除效果比较明显, 如图 2(B)所示, 镉的脱除率随着硅胶用量的增加而上升, 当硅胶用量为3.5和4.0 g时, 镉脱除率均达到80%以上。
如图 2(C)所示, 随着硅胶用量的增加, 铬的脱除率呈现先下降后上升的趋势, 然后稳定在73%左右。当硅胶用量为2.5 g时, 铬的脱除率较低, 可能因为硅胶中的活性基团不稳定, 使得吸附量骤减, 但随着硅胶用量的增加, 硅胶中的结合位点越来越多, 对铬离子吸附量也逐渐增加。当硅胶用量为3.5 g时, 对铬的脱除达到较好的效果。
当硅胶用量为1.5 g时, 多糖保留率最高, 在硅胶用量为1.5~4.0 g范围内, 多糖保留率在65%~70%之间, 变化趋势不大。
综合考虑硅胶对铅、镉、铬的脱除率及多糖保留率的影响, 硅胶用量为3.5 g时效果较好, 因而正交试验中硅胶使用量为3.5 g。
2.2.3 温度对海带多糖中重金属脱除效果的影响在30~60 ℃温度范围内检测硅胶对重金属的吸附能力及海带多糖保留率, 如图 3(A)所示, 不同温度下, 无显著性差异(P>0.05)。所以最适温度范围为30~60 ℃。
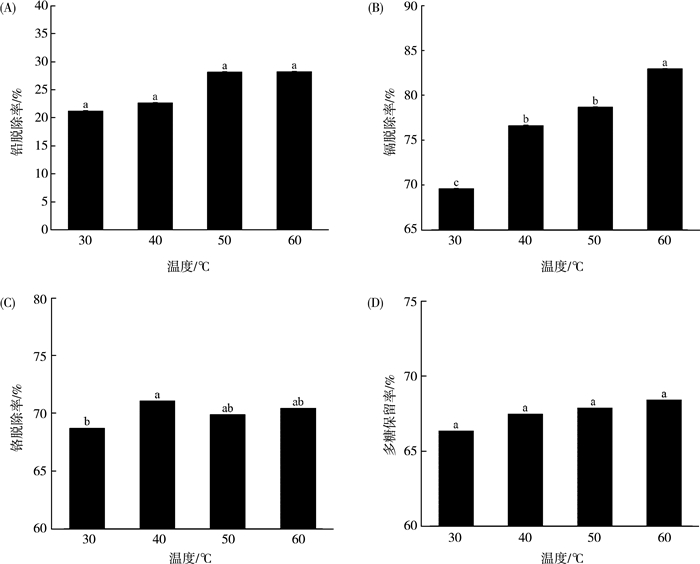 |
| 图 3 温度对海带酶解多糖中重金属脱除效果的影响 |
如图 3(B)所示, 随着温度的升高, 镉脱除率也随之升高, 在温度为60 ℃时, 硅胶吸附海带多糖中的镉离子达到最佳效果。
如图 3(C)所示, 当温度在30~60 ℃时, 铬离子脱除率在68%~72%之间, 硅胶吸附铬离子的效果无显著性差异(P>0.05)。
多糖保留率检测结果表明(图 3(D)), 温度对海带多糖保留率影响不显著(P>0.05)。
因此, 当温度为60 ℃时, 可以达到脱除海带多糖中铅、镉、铬的最佳效果且能最大程度的保留多糖。根据实验结果综合考虑, 在正交试验中, 选定较适宜的温度范围是50~70 ℃。
2.2.4 时间对海带多糖中重金属脱除效果的影响不同时间对海带多糖中重金属脱除率及海带多糖保留率的影响, 如图 4(A)所示, 当吸附时间在1~3 h, 硅胶对铅的吸附相对稳定, 当吸附时间为3 h时, 硅胶吸附铅离子达到最佳效果, 但是在吸附时间大于3 h后, 硅胶对铅的吸附量降低。因此对铅的吸附时间应该控制在1~3 h。
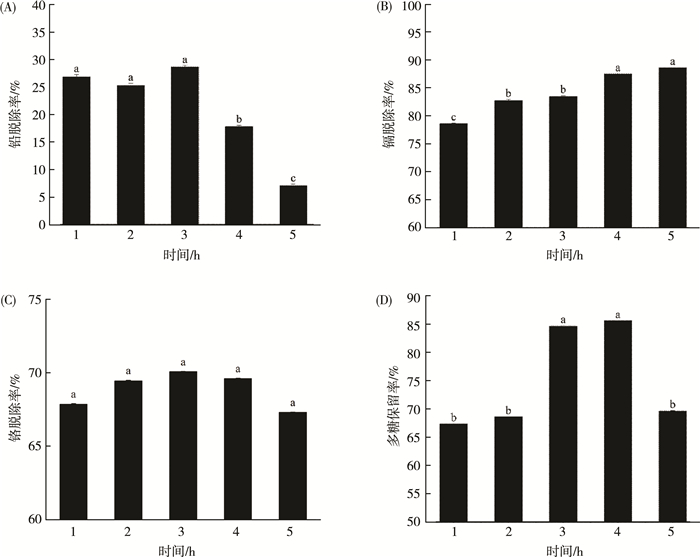 |
| 图 4 时间对海带酶解多糖中重金属脱除效果的影响 |
镉脱除率随着吸附时间的增加而升高(图 4(B)), 当吸附时间为4 h、5 h时, 镉离子脱除率最高。所以, 硅胶吸附镉离子的最佳时间为4~5 h。
如图 4(C)所示, 不同吸附时间下, 硅胶对铬离子脱除率无显著性差异(P>0.05)。所以对于铬的脱除时间选择为1~5 h。
根据图 4(D), 当吸附时间为3 h、4 h时, 能最大程度的保留海带多糖。
基于硅胶能同时兼顾吸附海带多糖中的3种重金属离子且有效保留海带多糖的目的, 在正交试验中, 选择吸附时间为3~4 h进行条件优化。
2.3 正交试验在单因素试验基础上, 采用L9(34)正交试验设计研究pH、温度、时间三因素对硅胶吸附海带多糖中重金属效果及海带多糖保留率的影响, 正交试验结果见表 2。
| 表 2 正交试验设计及评分结果 |
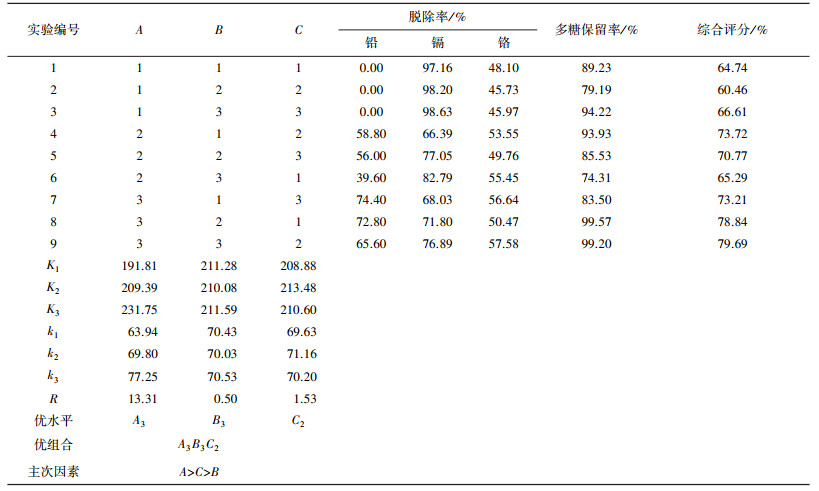 |
根据硅胶对各重金属的吸附效果和海带多糖保留率的影响, 采用综合指标分析法, 对铅脱除率、镉脱除率、铬脱除率、多糖保留率权重比例分别设置为20%、20%、20%、40%。综合评分=(铅脱除率/铅脱除率最大值×20%+镉脱除率/镉脱除率最大值×20%+铬脱除率/铬脱除率最大值×20%+多糖保留率/多糖保留率最大值×40%)。综合评分值越大, 表示有效脱除效果越佳。
根据计算得到的综合评分, 对试验结果进行直观分析和极差分析, 结果见表 2。由表 2可知, 极差R的波动幅度代表了各实验因素对硅胶吸附重金属效果的影响程度, 各实验因素中, 海带多糖中重金属有效脱除的最大影响因素是pH, 其次是时间, 影响最小的是温度。
2.4 验证实验经极差分析得到最佳组合A3B3C2, 但极差分析中吸附温度对硅胶吸附海带多糖中重金属及多糖保留率影响很小, R值为0.5。从节约能源的角度出发, 吸附温度确定为50 ℃。为了检验正交试验的可行性, 对组合A3B1C2进行海带多糖中重金属脱除的验证实验, 平行处理3次。结果表明, 该工艺经3次平行实验后得到的铅、镉、铬质量分数分别为0.017、0.033、1.297 mg/kg, 多糖的质量浓度为4.146 mg/mL, 海带多糖中的铅、镉、铬的脱除率分别可达到(93.33±0.92)%、(97.27±1.04)%、(69.27±0.76)%, 多糖保留率为(83.28±5.94)%, 综合评分为85.29。验证试验表明优化后的提取工艺稳定、合理、可行。通过实验得到的优化条件既可以达到最佳的脱除效果又能最大程度的保留海带多糖, 证明该工艺具有可行性。
3 结果本研究通过单因素实验和正交试验, 多指标综合优化了海带多糖中重金属脱除工艺条件, 由各指标加权得到综合评分。在pH为8、温度50 ℃、时间3.5 h的条件下, 对铅、镉、铬的脱除率分别可达到93.33%、97.27%、69.27%, 多糖保留率为83.28%, 脱除后铅、镉、铬的含量分别为0.017、0.033、1.297 mg/kg, 海带粗多糖品质得到提升。经过脱除工艺的优化, 镉、铬的含量达到较低的含量且较好的保留了海带多糖。此工艺条件简单、易于操作, 使海带多糖品质得到了良好的保证, 为海带多糖的高效利用和高品质开发提供重要的参考价值, 为开发基于海带多糖的新型功能食品提供理论依据。
| [1] |
谷怡静. 海带生物脱腥及多糖提取、抗氧化应用[D]. 无锡: 江南大学, 2022.
|
| [2] |
王玉涵, 魏溢, 姜胤秀, 等. NaHSO3/NaNO2法修饰海带多糖及抗肿瘤活性研究[J]. 黑龙江医药, 2021, 34(6): 1250-1254. |
| [3] |
LIU M, LIU Y X, CAO M J, et al. Antibacterial activity and mechanisms of depolymerized fucoidans isolated from Laminaria japonica[J]. Carbohydrate Polymers, 2017, 172: 294-305. DOI:10.1016/j.carbpol.2017.05.060 |
| [4] |
SUN T H, ZHANG X H, MIAO Y, et al. Studies on antiviral and immuno-regulation activity of low molecular weight fucoidan from Laminaria japonica[J]. Journal of Ocean University of China, 2018, 17(3): 705-711. DOI:10.1007/s11802-018-3794-1 |
| [5] |
WANG W, WU J D, ZHANG X S, et al. Inhibition of influenza A virus infection by fucoidan targeting viral neuraminidase and cellular EGFR pathway[J]. Scientific Reports, 2017, 7: 40760. DOI:10.1038/srep40760 |
| [6] |
HUANG Y, JIANG H, MAO X Z, et al. Laminarin and laminarin oligosaccharides originating from brown algae: Preparation, biological activities, and potential applications[J]. Journal of Ocean University of China, 2021, 20(3): 641-653. DOI:10.1007/s11802-021-4584-8 |
| [7] |
SHANG Q S, SHAN X D, CAI C, et al. Dietary fucoidan modulates the gut microbiota in mice by increasing the abundance of Lactobacillus and Ruminococcaceae[J]. Food & Function, 2016, 7(7): 3224-3232. |
| [8] |
ZHA X Q, ZHANG W N, PENG F H, et al. Alleviating VLDL overproduction is an important mechanism for Laminaria japonica polysaccharide to inhibit atherosclerosis in LDLr with diet-induced insulin resistance[J]. Molecular Nutrition & Food Research, 2017, 61(4): 1600456. |
| [9] |
XIAO B, HUANG H M, LI L X, et al. Trehalose inhibits proliferation while activates apoptosis and autophagy in rat airway smooth muscle cells[J]. Acta Histochemica, 2021, 123(8): 151810. DOI:10.1016/j.acthis.2021.151810 |
| [10] |
LI Q M, TENG H, ZHA X Q, et al. Sulfated Laminaria japonica polysaccharides inhibit macrophage foam cell formation[J]. International Journal of Biological Macromolecules, 2018, 111: 857-861. DOI:10.1016/j.ijbiomac.2018.01.103 |
| [11] |
吴金辉. 海带膳食纤维和多糖的制备、理化性质及生物活性研究[D]. 秦皇岛: 河北科技师范学院, 2022.
|
| [12] |
程晓芳, 袁丹丹, 张余慧, 等. 海带多糖的生理活性及其在食品中的应用研究进展[J]. 食品工业科技, 2019, 40(8): 361-367. DOI:10.13386/j.issn1002-0306.2019.08.060 |
| [13] |
CHEN Y F, HUANG W X, CHEN Y, et al. Influence of molecular weight of polysaccharides from Laminaria japonica to LJP-based hydrogels: Anti-inflammatory activity in the wound healing process[J]. Molecules, 2022, 27(20): 6915. DOI:10.3390/molecules27206915 |
| [14] |
陈露, 郑丽杰, 金佳颖, 等. 铜藻中有害元素的脱除工艺优化及脱除前后砷形态的变化[J]. 食品工业科技, 2020, 41(14): 179-185. DOI:10.13386/j.issn1002-0306.2020.14.029 |
| [15] |
张乾通. 舟山渔场主要海产品重金属污染现状分析与评价[D]. 杭州: 浙江大学, 2011.
|
| [16] |
NGAMBIA A, IFTHIKAR J, SHAHIB I I, et al. Adsorptive purification of heavy metal contaminated wastewater with sewage sludge derived carbon-supported Mg(Ⅱ)composite[J]. Science of the Total Environment, 2019, 691: 306-321. DOI:10.1016/j.scitotenv.2019.07.003 |
| [17] |
KHAN I, AFTAB M, SHAKIR S, et al. Mycoremediation of heavy metal (Cd and Cr)-polluted soil through indigenous metallotolerant fungal isolates[J]. Environmental Monitoring and Assessment, 2019, 191(9): 1-11. |
| [18] |
容琦, 袁利娜. 水产品中重金属脱除技术的研究进展[J]. 食品研究与开发, 2019, 40(13): 215-220. |
| [19] |
刘翼翔, 刘宗林, 籍保平, 等. 岩藻聚糖中重金属元素脱除方法的研究[J]. 食品科学, 2010, 31(20): 1-5. |
| [20] |
贾冬英, 郑洪彬, 汤华剑. 纸型海带食品的生产工艺研究[J]. 食品研究与开发, 2000, 21(2): 20-22. |
| [21] |
江洁, 陈兴才. 即食海带的脱腥与杀菌工艺[J]. 福建农林大学学报(自然科学版), 2007, 36(1): 106-109. |
| [22] |
姜玉花. 水产品酶解液中重金属脱除技术研究进展[J]. 化工管理, 2021(7): 62-63. |
| [23] |
张晓文, 邵柳逸, 连宾. 4种太湖水产品体内重金属富集特征及食用安全性评价[J]. 食品科学, 2018, 39(2): 310-314. |
| [24] |
宋杨, 刘雨霏, 汤梦瑶, 等. 贝壳基吸附材料对四种重金属吸附性能研究[J]. 食品工业科技, 2017, 38(6): 72-78. |
| [25] |
俞静芬, 凌建刚, 周安渊, 等. 海带脱腥工艺的研究[J]. 农产品加工(创新版), 2009(4): 20-21. |
| [26] |
杨南超. 靶向硅胶材料吸附剂及其应用: CN111939875A[P]. 2023-07-04.
|
| [27] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中多元素的测定: GB 5009.268-2016[S]. 北京: 中国标准出版社, 2017.
|
| [28] |
李琪, 王琤韡. 柠檬酸提取法中液料比对海带多糖提取率的影响及其保湿性研究[J]. 粮油与饲料科技, 2022(1): 17-19. |
| [29] |
孔庆龙, 余汪平, 郭冬梅, 等. 苯酚-硫酸法测定三七枸杞酒中多糖含量[J]. 食品安全质量检测学报, 2017, 8(6): 2267-2271. |
| [30] |
姜雪, 刘楠, 孙永, 等. 荣成鲜海带及其干、盐制品的营养成分分析[J]. 食品安全质量检测学报, 2018, 9(8): 1874-1880. |
| [31] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中污染物限量: GB 2762-2017[S]. 北京: 中国标准出版社, 2017.
|
| [32] |
樊琳, 娄永江, 陈小芳, 等. 响应面法优化海带中重金属的脱除工艺[J]. 食品与生物技术学报, 2015, 34(1): 94-101. |
| [33] |
白蓝, 刘媛, 李俊玲, 等. 硅胶螯合吸附剂制备及其铅离子吸附综合实验[J]. 实验室科学, 2018, 21(5): 14-17. |
| [34] |
苏国钧, 张高剑, 王千里. 氨基修饰桥联介孔材料的制备及其吸附性能研究[J]. 湘潭大学自然科学学报, 2014, 36(2): 59-62. |
| [35] |
何粉霞, 聂小伟, 陈志兵, 等. 海带多糖酶解辅助提取工艺的响应面优化及其稳定性研究[J]. 保鲜与加工, 2020, 20(5): 159-165. |
 2023, Vol. 37
2023, Vol. 37


