| 一种格瓦斯的制作及其中吡嗪类化合物的顶空-固相微萃取-气相色谱法检测研究 |
1b. 齐鲁工业大学(山东省科学院) 生物基材料与绿色造纸国家重点实验室,山东济南 250353;
2. 泰山学院 生物与酿酒工程学院, 山东泰安 271000;
3. 山东省分析测试中心, 山东济南 250014
1b. State Key Laboratory of Biobased Material and Green Papermaking(LBMP), Qilu University of Technology (Shandong Academy of Sciences), Jinan 250353, China;
2. College of Biology and Brewing Engineering, Taishan University, Taian 271000, china;
3. Shandong Anaiysis and Test Center, Jinan 250014, China
格瓦斯“KbaC”最早源于我国, 是一种用麦芽或面包屑, 由乳酸菌和酵母菌等菌种发酵酿制而成的清凉饮料[1], 它不仅色、香、味俱佳, 而且营养成分十分丰富。经分析测定, 格瓦斯饮料中含有多种糖类、有机酸、维生素E、泛酸和烟酰胺, 还含有大量的维生素B, 有微量酒精和CO2, 口感酸甜适口, 可清热解渴和代酒助兴, 儿童也可饮用, 是一种营养丰富的饮料[2]。格瓦斯具有天然发酵的醇香味, 乙醇含量低, 且富含人体所需的多种氨基酸、维生素, 具有促进人体消化、改善肠胃功能[3]、消除疲劳[4]、增加睡眠[5]等多种保健功效, 在我国北方一些城市曾作为一种最主要的夏季饮料[6]。
红枣的营养成分既全面又丰富, 含有多种具有保健作用的生物活性物质[7-8], 是我国食品中具有明显优势和国际竞争力的保健食品, 是集药、食、补三大功能为一体的保健食品[9]。红枣具有极高的营养价值, 富含蛋白质、生物多糖类物质、氨基酸(尤其是人体必需的8种氨基酸)、胡萝卜素、B族维生素、维生素C及钙、磷、铁等矿物质元素, 号称天然维生素药丸[10], 是中国的特色农产品和果品资源。
“黑参”由西洋参经热处理发生美拉德反应和水解反应制成, 具有极高的营养价值, 相较于西洋参, 黑参人参皂苷含量增加、燥性成分减少、颜色由浅黄色变为黑褐色、人参皂苷转化为稀有人参皂苷。
红枣黑参面包格瓦斯饮料是以烤面包干、麦芽汁、红枣汁和黑参为主要原料, 经乳酸菌、酵母菌混合发酵, 灭菌, 过滤等工艺制成的饮料, 兼有酵母菌和乳酸菌的双重发酵风味, 所以口味较独特。红枣黑参面包格瓦斯饮料综合了红枣、黑参、面包、麦芽汁的营养特性及乳酸菌、酵母菌发酵的优点, 不但酸甜适口, 而且还具有天然发酵的醇香味及较浓郁的麦芽味、烤面包味、红枣风味及黑参的焦甜香味, 其含有稀有人参皂苷、氨基酸、有机酸、还原糖、多种维生素等营养成分, 不仅色泽及口感俱佳, 还能增强人体消化功能和抗肿瘤的作用, 是保健的饮料佳品。
格瓦斯饮料传统生产工艺是二次发酵法, 即首先将面团发酵烤成面包, 然后把面包烤干、加水泡汁、糖化, 再利用酵母菌和乳酸菌等混菌发酵而成。目前, 格瓦斯的研究多集中在风味种类、发酵及生产工艺阶段, 尚未有关于其特定香气成分的研究。本实验是在此基础上, 通过改良发酵条件、发酵底物和混菌种类, 得出最佳的发酵产品。建立了顶空-固相微萃取(HS-SPME)-气相色谱法检测格瓦斯香气成分中的吡嗪类化合物的方法, 尤其是近期研究热点四甲基吡嗪(TMP)[11-12]。因此, 本实验对格瓦斯特定香气成分的测定分析有着重要的意义。
1 材料与方法 1.1 菌种及原料酿酒酵母、乳酸菌: 齐鲁工业大学生物工程学院微生物酶技术实验室;浓缩红枣汁: 河北沛然世纪生物食品有限公司;黑参: 山东省分析测试中心;干大麦芽粉: 齐鲁工业大学工程训练中心;糖化酶: 诺维信糖化酶(10 U/mL);面包片: 济南万达乐购超市所售大列巴;2-甲基吡嗪(2-MP)、2, 6-二甲基吡嗪(2, 6-DMP)、2, 3, 5-三甲基吡嗪(2, 3, 5-TMP)、四甲基吡嗪(TMP)均为色谱纯, 购于美国SigmaAldrich公司。
1.2 仪器与设备电热压力蒸汽灭菌器\灭菌锅, MJ3780D德强净化科技(山东)有限公司;恒温水浴锅, DK-8D上海精宏实验设备有限公司;糖度计, H1987河北朵麦信息科技有限公司;电子天平, BSA224S赛多利斯科学仪器(北京)有限公司;超净工作台, SW-CJ-1FD苏州安泰空气技术有限公司;培养箱, MJ-250郑州生元仪器有限公司;摇床, ZQZY-CS上海知楚仪器有限公司;酒精计, H1987河北朵麦信息科技有限公司;气相色谱仪, GC6890安捷伦公司;顶空萃取装置, Thermolyne;三种不同涂层萃取头, 75UM CAR/PDMS, 50/30 μm DVB/CAR/PDMS, 85 μm PA, 上海泉岛科贸有限公司。
1.3 培养基及发酵方法 1.3.1 培养基种子培养基, 8 °P麦芽汁培养基: 大麦麦芽粉加4倍水, 初温度在48 ℃左右进行糖化, 水浴50 min;逐渐升温至60 ℃, 水浴3 h;升温至70 ℃进行水浴, 用碘液试验检查至糖化完全为止, 调整糖液浓度为8 °P, 过滤后煮沸灭菌。
烤面包片制作工艺: 面包→切片→烘烤(85 ℃, 100 min)→粉碎。
发酵培养基1(F1)H:8 °P麦芽汁培养基(加与大麦麦芽质量比为0.01∶9的少量黑参)加1/80倍体积的浓缩红枣汁, 调整糖液浓度为3 °P、6 °P、9 °P, 煮沸灭菌。
发酵培养基2(F2):m(大麦麦芽)∶m(黑参)∶m(烤面包片)=1∶0.01∶9, 加4倍水, 按照50单位/g干物质加入糖化酶, 初温度在48 ℃左右进行糖化, 水浴50 min;逐渐升温至60 ℃, 水浴3 h;逐渐升至70 ℃进行水浴, 用碘液试验检查至糖化完全为止, 加水稀释至糖度为8 °P, 加1/80倍体积的浓缩红枣汁后调整糖液浓度为: 3 °P、6 °P、9 °P, 过滤后煮沸灭菌。
发酵培养基3(F3): m(烤面包片)∶m(黑参)=0.01∶9, 加4倍水, 按照每1 g干物质加入50单位糖化酶。48 ℃左右进行糖化, 水浴50 min;逐渐升温至60 ℃, 水浴3 h;逐渐升至70 ℃进行水浴, 用碘液试验检查至糖化完全为止, 加水稀释至糖度为8 °P, 加1/40倍体积的浓缩红枣汁, 调整糖液浓度为: 3 °P、6 °P、9 °P, 过滤后煮沸灭菌。
1.3.2 发酵方法 1.3.2.1 种子培养方法酵母菌种子培养: 酵母菌接入种子培养基, 36 ℃, 静置培养12 h。
乳酸菌种子培养: 乳酸菌接入种子培养基, 36 ℃, 静置培养36 h。
1.3.2.2 发酵方法将两种菌的种子液量按1∶1, 总接种量按2%接入含500 mL发酵培养基的无菌可乐瓶, 瓶口用灭菌瓶盖密封后, 22 ℃, 静置发酵2~4 d。
1.4 发酵条件对格瓦斯质量的影响实验试验设接种量、初始糖度、发酵温度和发酵时间等4个因素, 每个因素有3个水平。以感官品评等级为标准, 确定3个因素的最优组合后, 检测产品的酒精度, 同时对3种发酵培养基F1、F2和F3进行择优实验, 以确定生产格瓦斯的最佳工艺。实验因素水平设计见表 1, 感官品评标准见表 2。
| 表 1 发酵条件实验因素水平设计 |
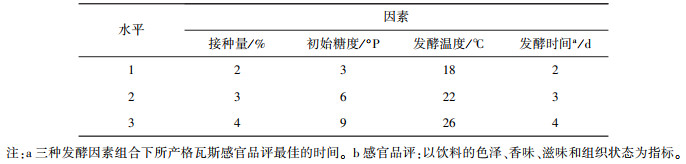 |
| 表 2 感官品评标准 |
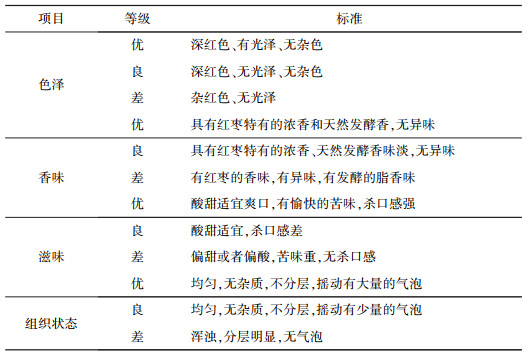 |
1.5 顶空-固相微萃取(HS-SPME)-气相色谱法的建立 1.5.1 顶空-固相微萃取条件
在20 mL装有磁力搅拌子的顶空瓶中加入8.0 mL样品, 3 g NaCl, 在60 ℃水浴、400 r/min条件下平衡10 min, 插入萃取头进行萃取, 萃取30 min取出固相微萃取仪(SPME)插入GC进样口解吸附5 min。
1.5.2 气相色谱条件色谱柱为: HP-INNOWAX毛细管柱(60 m×0.32 mm, i.d., 0.5 μm)。进样口温度为250 ℃, 分流比为20∶1, 检测器温度为250 ℃, 升温程序为: 50 ℃保持2 min, 以5 ℃/min升温至150 ℃, 再以15 ℃/min升温至220 ℃。载气为高纯氮气, 流速为1 mL/min。
1.5.3 萃取头的选择本研究对3种不同的萃取头(75 μm CAR/PDMS、50/30 μm DVB/CAR/PDMS、85 μm PA)进行萃取效率的考察, 比较不同萃取头对格瓦斯中吡嗪类物质的萃取效果。
1.5.4 吡嗪类化合物的定性及定量分析以4种色谱纯吡嗪类化合物为标样, 以其浓度为横坐标, 以其出峰面积为纵坐标, 外标法建立吡嗪类物质的标准曲线。根据GC-MS对所产格瓦斯中所含吡嗪类化合物进行定性、定量分析。
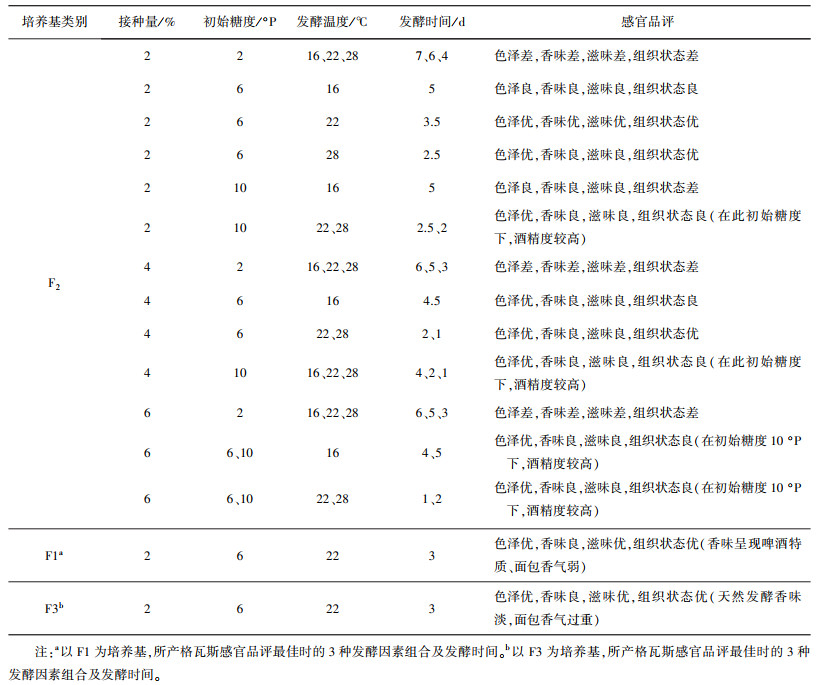
2 结果与分析 2.1 红枣面包格瓦斯最佳工艺条件的确定 2.1.1 发酵培养基对产格瓦斯质量的影响考察了F1、F2、F3等3种发酵培养基对所产格瓦斯感官品评的影响, 如表 3所示。以F1为发酵培养基, 以产格瓦斯感官品评最佳时的三种发酵因素为组合, 所产的格瓦斯香味都呈现啤酒特质, 面包发酵香几乎没有, 失去了传统格瓦斯的特点;同理, 以F3为发酵培养基所产格瓦斯天然发酵香味淡, 并呈现出过重的面包香味;当以F2为发酵培养基, 最佳单因素为组合时, 所产格瓦斯的感官品评达到最佳。
| 表 3 发酵条件对格瓦斯质量的影响 |
 |
2.1.2 发酵单因素试验
以F2为发酵培养基, 设定初始糖度为分别为3 °P、6 °P、9 °P, 发酵温度分别为18 ℃、22 ℃、26 ℃的条件下, 分别按2%、3%、4%的接种量进行发酵, 以感官品评为标准, 确定三个因素组合所产格瓦斯的质量, 结果如表 3。
初始糖度的影响: 当初始糖度为3 °P时, 所产格瓦斯的色泽、香味、滋味和组织状态都较差, 接种量和发酵温度两个因素对所产格瓦斯的感官品评作用不大;当初始糖度为6 °P时, 所产格瓦斯的色泽都为优, 其他感官品评方面受接种量和温度的影响, 接种量大于2%或温度为18 ℃和26 ℃时, 所产格瓦斯的香味、滋味和组织状态均较一般;当初始糖度为9 °P时, 所产格瓦斯的色泽优良, 香味、滋味和组织状态为良或差, 并且所产酒精度较高。因此, 取6 °P为最佳初始糖度。
接种量的影响: 当接种量为3%和4%时, 在其他任何因素下所产格瓦斯的香味和滋味都为良或差;接种量为2%时, 所产格瓦斯的感官品评各方面才能达到优。因此, 取2%为最佳接种量。
发酵温度的影响: 当发酵温度为18 ℃或26 ℃时, 在其他任何因素下所产格瓦斯的香味和滋味都为良或差;温度为22 ℃时, 所产格瓦斯的感官品评各方面才能达到优, 并且, 感官品评达到最佳的时间相对较短(3 d左右)。因此, 取22 ℃为最佳发酵温度。
因此, 最终确定最佳单因素工艺组合为: 接种量2%, 初始糖度6 °P, 发酵温度22 ℃, 发酵时间3 d。
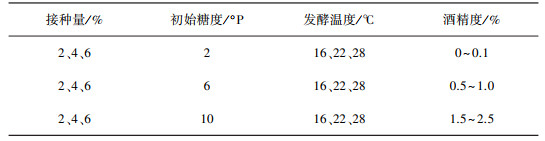
2.1.3 发酵单因素对格瓦斯酒精度的影响以F2为发酵培养基, 在各单因素的组合下, 所产格瓦斯的酒精度如表 4所示, 酒精度主要受初始糖度的影响。当初始糖度为3 °P时, 所产格瓦斯中几乎不含酒精;初始糖度为9 °P时, 所产格瓦斯中酒精含量在2%左右;初始糖度为6 °P时, 所产格瓦斯中酒精含量不高于1%, 符合传统格瓦斯酒精度1%左右的规定。
| 表 4 发酵条件对格瓦斯酒精度的影响 |
 |
2.2 格瓦斯中吡嗪类物质定性定量分析 2.2.1 萃取头的选择及其萃取条件
目前, 顶空固相微萃取-气相色谱法检测酒和饮料中的吡嗪类化合物已有相关的报道[13], 但是, 此技术用于格瓦斯中吡嗪类物质检测的研究很少。本研究主要选取3种萃取头对吡嗪类物质的萃取效果进行研究, 其结果如图 1所示。
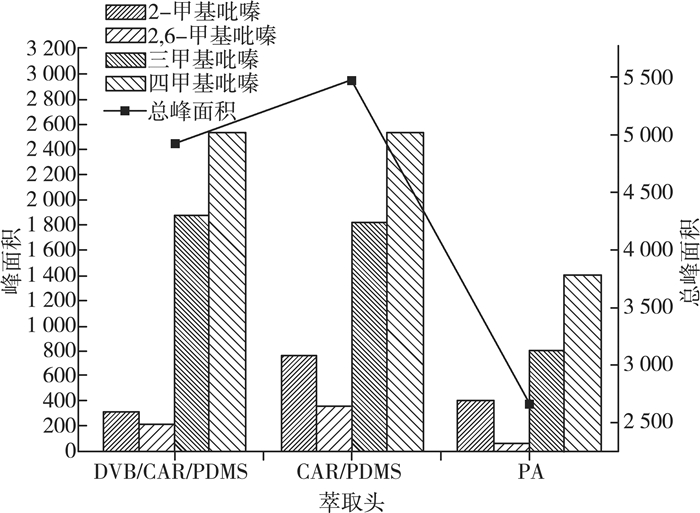 |
| 图 1 不同萃取头对吡嗪类提取的影响 |
根据实验结果分析, 萃取头50/30 μm DVB/CAR/PDMS对格瓦斯中吡嗪类物质的萃取效果最好, 萃取头85 μm PA萃取效果不理想, 因此, 选择50/30 μm DVB/CAR/PDMS作为吡嗪类物质的萃取头。由于不同的萃取条件均会影响萃取效果, 我们前期已经考察了萃取温度、时间及离子浓度对格瓦斯中吡嗪类物质提取的影响, 确定了相对较好的萃取条件见1.5.1所示。
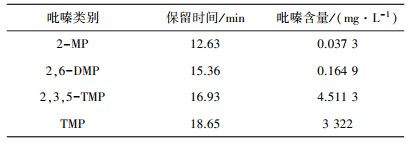
2.2.2 吡嗪类化合物的种类及含量的测定本研究选取由酵母菌和乳酸菌发酵饮料中含量相对较高的4中吡嗪类物质作为重点分析对象来建立标准曲线, 根据1.5.1中的萃取条件, 进行顶空固相微萃取。萃取结束后, 按照1.5.2中的气相色谱条件进行检测分析, 测定格瓦斯中4种吡嗪类物质的含量, 结果见表 5。
| 表 5 格瓦斯中4种吡嗪类物质含量的测定 |
 |
3 讨论
该实验以大麦麦芽、面包干、红枣汁、黑参为原料, 以感官品评等级为标准, 对发酵培养基中原料的配比以及接种量、初始糖度、发酵温度及发酵时间最优组合进行研究。确定了最优工艺为: 发酵培养基为F2;接种量为2%;初始糖度为6 °P;发酵温度为22 ℃;发酵时间为3 d。该条件下制作的红枣面包格瓦斯成品外观透明、色泽鲜明、有协调光泽;风味具有本果香、发酵香、柔协、浓郁持久、无异味、爽适, 具有独特的香味;尤其具有较强的杀口感, 摇动时有大量的气泡, 并且其酒精含量能控制在1%左右, 可成为当今新交规醉酒驾驶处罚实施后替代啤酒等酒类的一种重要饮料, 有很好的经济前景。
建立顶空-固相微萃取(HS-SPME)-气相色谱测定该格瓦斯中的吡嗪类物质。由于不同涂层萃取头具有不同大小的孔隙和对分析物有不同的亲和力, 并且, 涂层亲和力的大小遵循“相似相溶原理”。因此, 固相涂层的种类和性质在萃取过程中起决定作用, 所以选择合适涂层的萃取头是提高分析萃取效率和灵敏度的关键。本研究在已确定萃取温度、时间及离子浓度等相对较好的萃取条件和气相色谱条件的基础上, 主要针对3种不同萃取头对吡嗪类物质的萃取效果进行考察。实验结果表明: 1)以4种吡嗪的峰面积为指标, 75 μm CAR/PDMS萃取头表现出了较高的萃取效率, 并且检测出格瓦斯中TMP和2, 3, 5-TMP相对较高, 故该萃取头值得进行萃取条件的进一步优化。2)酵母菌跟乳酸菌混菌发酵格瓦斯能够生成吡嗪类物质, 但具体机理尚不清楚。推测其原因: 首先, 酵母菌跟乳酸菌都能发酵生成乙偶姻[14-15], 可以乙偶姻为前驱物质经过一系列反应生成吡嗪类物质[15];其次, 此混合菌能够在此发酵条件下直接生成吡嗪类化合物。因此, 酵母菌跟乳酸菌混菌发酵格瓦斯能够产生吡嗪类物质的具体机理可做进一步研究。
| [1] |
陈陶生. 发酵工业辞典[M]. 北京: 轻工业出版社, 1991.
|
| [2] |
刘宝家, 李素梅. 食品加工技术工艺和配方大全(下)[M]. 北京: 科学技术文献出版社, 1990.
|
| [3] |
卢大修. 格瓦斯饮料的制造[J]. 食品科学, 1982(6): 56-58. |
| [4] |
张素华, 孙长花, 薛凌燕. 花卉格瓦斯饮料的研制[J]. 食品与发酵工业, 2006, 32(7): 130-133. DOI:10.3321/j.issn:0253-990X.2006.07.034 |
| [5] |
蔡永明. 蜂蜜格瓦斯的研究报告[J]. 食品科学, 1986(6): 18-20. |
| [6] |
ROSEAH. 发酵食品[M]. 北京: 轻工业出版社, 1989.
|
| [7] |
李有起. 红枣中环磷酸腺苷的研究进展[J]. 食品研究与开发, 2012, 33(6): 230-237. DOI:10.3969/j.issn.1005-6521.2012.06.065 |
| [8] |
CYONG J C, HANABUSA K. Cyclic adenosine monophosphate in fruits of Zizyphus jujuba[J]. Phytochemistry, 1980, 19(12): 2747-2748. DOI:10.1016/S0031-9422(00)83955-2 |
| [9] |
王娟, 徐桂花. 苹果酒的营养价值分析及发展现状[J]. 中国食物与营养, 2006(8): 11-14. |
| [10] |
方强, 籍保平, 李博, 等. 营养素对苹果酒中结合SO影响的研究[J]. 食品科学, 2005, 26(2): 146-151. DOI:10.3321/j.issn:1002-6630.2005.02.031 |
| [11] |
吴建峰. 中国白酒中健康功能性成分四甲基吡嗪的研究[J]. 酿酒科技, 2007(1): 117-120. DOI:10.3969/j.issn.1001-9286.2007.01.034 |
| [12] |
杨涛, 李国友, 吴林蔚, 等. 中国白酒健康因子的研究及其生产菌选育和在生产中的应用(Ⅰ)中国白酒健康因子的研究[J]. 酿酒科技, 2010(12): 65-69. |
| [13] |
SALA C, MESTRES M, MART M, et al. Headspace solid-phase microextraction analysis of 3-alkyl-2-methoxypyrazines in wines[J]. Journal of Chromatography A, 2002, 953(1): 1-6. |
| [14] |
赵军. 混菌发酵中酵母菌生长状况及代谢产物分析[J]. 中国酿造, 2011(12): 145-147. |
| [15] |
庄名扬. 乙偶姻与美拉德反应[J]. 酿酒, 2010(3): 99-100. |
 2022, Vol. 36
2022, Vol. 36


