| 可同化有机碳AOC检测方法研究进展 |
饮用水生物安全已经成为水质安全一项基础性指标,对于国防工程中的长期贮存水更为重要[1]。生物安全最直接的体现是水质的生物稳定性。上世纪80年代,Rittmann和Snoeyink[2]首先提出了生物稳定性(Biological Stability)的概念,生物稳定性是一个动态的稳定过程,即细菌的消亡与再生动态平衡。Prest[3]等认为水的生物稳定性直接体现在微生物的群落结构变化上,可以通过控制因子的变化间接评价。目前多采用可同化有机碳(Assimilable Organic Carbon, AOC)为指标的间接评价。可同化有机碳(AOC)是水中最易被细菌吸收用来直接合成菌体的有机碳,是异养细菌再生长的直接物质能量来源[4]。
1 Van der Kooij检测法Kooij[5]等首创并改进了AOC的检测法。Kooij选用天然水中提纯得到的假荧光单胞菌(Pseudomonas brenneri, P17, ATCC49642)作为标准测试菌,乙酸钠为标准营养基质。将P17接种到不同浓度乙酸碳标准溶液中,培养至稳定期后平板计数,发现细菌生长曲线与乙酸碳浓度呈线性相关。为解决P17无法利用草酸的问题,Kooij引入螺旋菌(Herminiimonas sp., NOX, ATCC49643),得到P17与NOX菌落数对乙酸碳浓度的转换系数,分别为:Y=4.1 × 106 cfu/μg乙酸碳,Y=1.2 × 107 cfu/μg乙酸碳[5]。取1 L水样,对水样巴氏灭菌,然后分别接种P17和NOX菌液,接种浓度为50~500 cfu·mL-1,在15 ℃条件下培养5~25 d,将稳定期平板计数得到的菌落数换算为乙酸碳浓度。
Kooij奠定了AOC测定方法的基础,但该方法的主要问题是操作复杂、耗时较长。
2 AOC检测方法改进为简化操作、缩短周期,国内外学者从Kooij的检测方法出发,采用流式细胞术、ATP法等方法,在菌种选择、培养条件、计数方法等方面对AOC检测进行改进。
2.1 菌种选择不同水源水中微生物环境各异,AOC-P17与AOC-NOX构成比例不同,优势竞争菌群不同。P17与NOX作为测试菌在某些特种水质的表征效果不佳,如在我国一些地区的水样中并未发现P17与NOX的存在[6]。
Hammes等使用去AOC土著菌群作为测试菌,解决了P17与NOX比较的问题。具体做法为:在饮用水处理厂的活性炭过滤器单元后直接取样40 mL水过滤(0.22 μm,Millex-GP,Millipore),以除去颗粒状有机碳,用100 μL未过滤的水接种,并在30 ℃下进一步修正14 d,在无AOC的小瓶中培养;这些细胞随后通过离心提取(10 min,3 kg),重悬浮于高效液相色谱仪水中,以矿物质作为缓冲剂;将该溶液再培养7 d以确保所有残留的有机碳已经降解。进行必要的控制以验证接种液中无AOC。对于商业矿泉水和天然河水的第一动力学实验表明, 土著菌较P17与NOX具有更好的测试效果。
AOC可诱导海洋发光细菌(vibrio fischeri),致使其发光系统发光,且细菌的发光强度随接触时间与AOC浓度的变化呈正相关关系。CheckLight检测法利用发光菌的这一发光特性[7],对AOC检测方法进行了创新发展。将冻干处理(去有机碳源)后的细菌放置于待测水样中,通过发光强度可以检出不同类型AOC,检测灵敏度可达到微克级。该方法需通过对照实验确定细菌发光强度对乙酸碳浓度的转换系数,将结果转化为微克乙酸碳每升,使结果具有可比性。但是,高昂的费用、结果受水质影响波动较大等因素制约了Checklight检测法的推广应用。
赵鑫[8]等通过对再生水的AOC测定发现,从再生水中提取的土著细菌测定结果较P17与NOX更加符合。
2.2 培养条件Le Chevallier[9]等对Kooij的方法做出了改进,调整了部分培养条件:1)用40 mL硼硅酸盐玻璃瓶替代1 L无碳化玻璃瓶;2)培养温度为恒温25 ℃;3)接种浓度提高至1.0×104 cfu·mL-1。经过3~4 d培养,测试菌种到达生长稳定期。改进后的方法极大地缩短了AOC的检测时间,成为目前普遍采用的培养方法。
刘文君[10]等对分别接种、同时接种、先后接种三种接种方法进行对比研究,发现:分别接种得到的结果比真实值偏高,结果可比性差;同时接种作业量小,但平板计数难以有效对照,且P17、NOX之间的营养竞争对检测结果有影响;先后接种的周期较前两种方法周期延长,P17灭菌后部分被NOX利用,结果比实际值高。刘文君等人提出用巴氏消毒的方法代替原有尼龙膜过滤,杀死稳定期的P17,然后接种NOX,该方法操作相对复杂,若巴氏消毒不彻底对结果会有一定影响。刘文君等人测定的P17和NOX转换系数分别为:Y=1.4×106 cfu/μg乙酸碳,Y=1.8×107 cfu/μg乙酸碳,远高于Kooij的测定值。
白晓慧[11]等在培养温度、培养液量、接种浓度方面对AOC的测定方法进行了一定的优化改进:1)接种温度为28 ℃,接种液量取30 mL,接种时间P17取40 h、NOX取60 h;2)NOX可以利用草酸、乙酸两种营养物,提出AOC-NOX修正值计算公式:y=0.1337x+7.9414。该方法可使检测时间缩短1 d,且避免了缺氧、差值两方面的误差,提高了试验结果的准确性。
与平板计数方法和其各种改进不同,流式细胞术、ATP以及Checklight等检测方法将测试菌直接接种到待测水样,到达稳定期后对细菌进行计数。通过原水培养的方法,细菌的培养环境更加真实,其检测结果更加准确,对于一些P17与NOX检测受限的水样更具有普适性。
2.3 计数方法在细胞生物学与环境检测学的融合下,细菌计数方法得到极大提升,解决了传统实验室平板计数法无法计数不可培养细菌的问题[12]。
2.3.1 流式细胞术Hammes[13]等提出利用荧光染色技术与流式细胞术测定水样中的AOC,瑞士于2012年将流式细胞术作为测定水细胞数量的标准方法[14]。将稳定期水样中的细胞用荧光染色剂(SYBR Green Ⅰ)等分试样染色,并在37 ℃(±2 ℃)黑暗环境中培养13 min,以使染色剂达到最佳渗透和结合。然后用流式细胞仪分析样品,其中细胞被水动力聚焦在玻璃毛细管中,并用激光(488 nm)逐个扫描,通过激光的每个细胞会产生光散射,并根据所使用的荧光染料发射荧光,通过记录信号的强度,得到细胞总数以及样品中细胞浓度(如图 1所示,A、B分别为P17接种液细胞的二维散点图与峰值图;C、D分别为NOX接种液细胞的二维散点图与峰值图)。Hammes等人通过实验测得土著菌群对乙酸碳浓度的转换系数为1.0 × 107cells/μg乙酸碳。这种流式细胞术方法允许每秒检测数百个颗粒或细胞,且只需要非常小的样品体积(少至1 mL)进行分析,在计数上实现了绝对计数,使检测结果更加精确,计数时间缩短至10 min左右,更加高效。
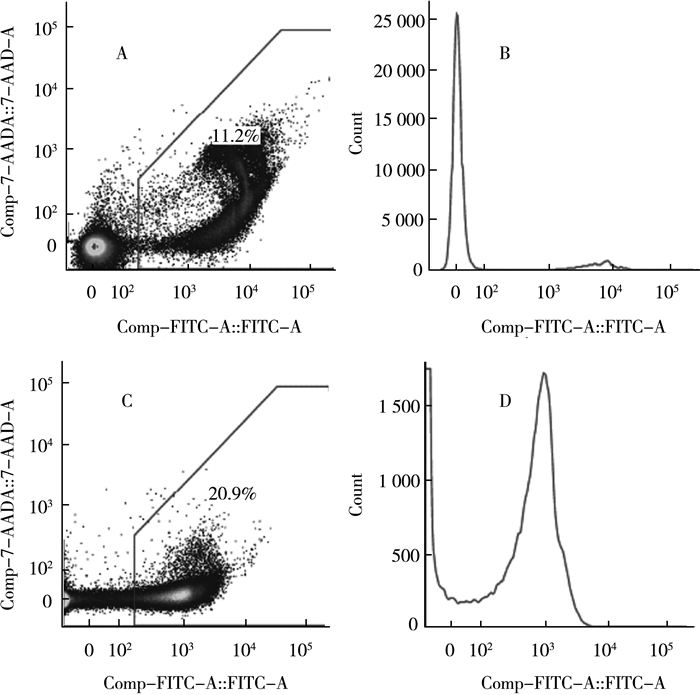 |
| 图 1 P17、NOX的二维散点图与峰值图 |
Gillespie[15]等利用SYBR PⅠ和Green Ⅰ结合染色的方法,通过流式细胞计数测定细胞总数(Total Cell Conceration,TCC)和活细胞浓度(Intact Cell Concentration,ICC)的浓度值,实现了消毒效能的快速直观评价。
2.3.2 ATP法ATP只存在于活细胞内,活细胞数与ATP值呈正相关。Le Chevallier[16]等人通过测定细菌ATP值间接转化为细菌数量,从而代替了平板计数。具体做法为:过滤器预先置于0.5 mL HEPES(N-2-羟乙基哌嗪-N'-2-乙磺酸)缓冲液(pH7.75)和0.5 mL含磷酸酶抑制剂的ATP释放剂, 涡旋10 s。在152.4 mm汞柱真空条件下,将待测水样通过0.22 μm无碳化滤膜消除ATP背景干扰。接触20 min后,取150 μL滤后水样置于聚丙烯试管中。将管放入光度计中。将荧光素萤光素酶(100 μL)注入样品中,延迟5 s后,记录光的完整积分(10 s测量)。借助生物发光仪与荧光色素-荧光色素酶试剂,参照ATP相对含量对发光强度标准曲线,间接得到细菌总数。实验表明,细胞总数与ATP值线性相关性为0.9~1.0,P17细胞与NOX细胞ATP平均含量分别为1.85 ×10-15 g和2.13 × 10-16 g。对比平板计数法结果,两种方法得到的结果相关系数为0.91。
ATP法简化了操作步骤、可使测定周期缩短2~4 d,同时避免检测过程中人为因素的干扰。该方法的缺点是AOC-NOX的检测值较实际值偏低。
目前,平板计数法与流式细胞术仍然是细菌计数中使用频率最高的两种方法。
3 AOC与生物稳定性的关系LeChevllier[17]等研究认为异养细菌在AOC值小于10 μg乙酸碳/L的条件下几乎不生长;AOC在10~20 μg乙酸碳/L(不加氯)的条件下,饮用水生物稳定。Hammes[18]等研究表明,在使用了氯消毒的管网系统中,当AOC低于100 μg乙酸碳/L时,大肠杆菌的数量大幅减少;当AOC降至50 μg乙酸碳/L时,大肠杆菌不再生长。Sharp[19]等通过对瑞士苏黎世地区的水厂18个月的跟踪调查发现,当水中AOC浓度在32 μg乙酸碳/L时,可以达到一个高水平的生物稳定。Nescerecka[20]等对纽约市Croton水库水质的研究表明,当AOC值分别为46 μg乙酸碳/L(夏季)与58 μg乙酸碳/L(冬季)时,水生物稳定。Hammes[21]等认为,基于保证水质生物稳定性的角度,综合考虑工艺实际,我国的饮用水AOC值整体应控制200 μg乙酸碳/L以下。梁涛[22]等通过对南方某供水管网的水质生物稳定性大数据分析评价认为,当AOC低于135 μg乙酸碳/ L时,HPC生长速率较低,与AOC正相关性显著,可以精确评价水体的稳定性。
国际上普遍认为,当AOC满足10~20 μg乙酸碳/L(不加氯)或者在50~100 μg乙酸碳/L(加氯)时,水质生物稳定。
4 总结展望从kooij提出的检测方法到后来许多学者提出的改进或者创新方法,在缩短检测周期、提高检测精度等方面都有了一定的进步。
1) AOC受原水水质影响较大,测试菌的产率系数在不同水质条件下波动较大[4, 10, 13]。细菌计数相较于AOC测试更加高效快捷,可靠的转换系数尤为重要,既保证了结果的准确性,也可以保证横向的可对比性。
2) 流式细胞术以及ATP等方法将在原水中接种培养测试菌替代了培养基培养,其培养环境更加真实,且计数更加准确。AOC的检测意义在于预测水样的生物稳定性以及其可能变质的情况。流式细胞术等方法可以使实时检测、动态监测水样中AOC及细菌变化成为一种可能。另外,绝对计数的实验成本需要变得更加低廉,使其能够在实际应用中得到推广。
3) 土著菌比P17与NOX对原水的适应性更强,如高浓度的铝和铜对P17有毒害作用,使用土著菌可使检测结果更加准确。同时,P17对AOC的生化作用以及铝、铜的毒理作用,对于AOC去除生物工艺也有一定的借鉴意义。
4) 在研究中,部分检测指标与AOC的变化呈现了较好的一致性,可以考虑相关指标作为补充或替代指标。比如Hammes等[21]臭氧氧化处理中有机酸含量的变化以及梁涛[22]在实验中UV254的变化都与AOC的变化呈现出良好的一致性。基于分子生物学的高通量测序等方法可研究遗传水平上的微生物物种多样性,准确分析微生物的种群结构和功能,更加全面地评价水质生物稳定性。
| [1] |
李圭白, 李星, 瞿芳术, 等. 试谈深度处理与超滤历史观[J]. 给水排水, 2017, 43(7): 1. |
| [2] |
RITTMANN B E, SNOEYINK V L. Achieving biologically stable drinking water[J]. Journal-American Water Works Association, 1984, 76(10): 106-114. DOI:10.1002/j.1551-8833.1984.tb05427.x |
| [3] |
PREST E I, HAMMES F, VAN LOOSDRECHT M C, et al. Biological stability of drinking water:controlling factors, methods, and challenges[J]. Frontiers in Microbiology, 2016, 7(5): 45. |
| [4] |
王占生, 刘文君, 张锡辉. 微污染水源饮用水处理[M]. 北京: 建筑工业出版社, 2016.
|
| [5] |
KOOIJ D V D, VISSER A, HIJNEN W A M. Determining the concentration of easily assimilable organic carbon in drinking water[J]. Journal-American Water Works Association, 1982, 74(10): 540-545. DOI:10.1002/j.1551-8833.1982.tb05000.x |
| [6] |
ZHANG J, LI W Y, WANG F, et al. Exploring the biological stability situation of a full scale water distribution system in south China by three biological stability evaluation methods[J]. Chemosphere, 2016(161): 43-52. |
| [7] |
LOU J C, CHEN B H, CHANG T W, et al. Real-time monitoring of assimilable organic carbon in raw drinking water[EB/OL]. (2004-03-05)[2018-03-22] http://www.checklight.co.il/pdf/case_studies/aoc-case-study.pdf, 2004.
|
| [8] |
ZHAO X, HU H, LIU S, et al. Improvement of the assimilable organic carbon (AOC) analytical method for reclaimed water[J]. Frontiers of Environmental Science & Engineering, 2013, 7(4): 483-491. |
| [9] |
LE CHEVALLIER M W, LOWRY C D, LEE R G. Disinfecting biofilms in a model distribution system[J]. Journal-American Water Works Association, 1990, 82(7): 87-99. DOI:10.1002/j.1551-8833.1990.tb06996.x |
| [10] |
刘文君, 王亚娟, 张丽萍, 等. 饮用水中可同化有机碳(AOC)的测定方法研究[J]. 给水排水, 2000, 26(11): 1-5. |
| [11] |
白晓慧, 朱睿宁, 张晓红. 饮用水中AOC测定的优化与改进[J]. 净水技术, 2008, 27(3): 48-50. |
| [12] |
杜立颖, 冯仁青. 流式细胞术[M]. 北京: 北京大学出版社, 2014.
|
| [13] |
HAMMES F A, EGLI T. New method for assimilable organic carbon determination using flow-cytometric enumeration and a natural microbial consortium as inoculum[J]. Environmental Science & Technology, 2005, 39(9): 3289-3294. |
| [14] |
SLMB. Determining the total cell count and ratios of high and low nucleic acid content cells in freshwater using flow cytometry[M]. Switzerland: Federal Office of Public Health, 2012.
|
| [15] |
GILLESPIE S, LIPPHAUS P, GREEN J, et al. Assessing microbiological water quality in drinking water distribution systems with disinfectant residual using flow cytometry[J]. Water Research, 2014(65): 224-234. |
| [16] |
LE CHEVALLIER M W, SHAW N E, KAPLAN L A, et al. Development of a rapid assimilable organic carbon method for water[J]. Applied & Environmental Microbiology, 1993, 59(5): 1526. |
| [17] |
LECHEVALLIER M W, BADCOCK T M, LEE R G. Examination and characterization of distribution system biofilms[J]. Water Appl Environ Microbiol, 1987(53): 2714-2724. |
| [18] |
HAMMES F, BERGER C, KöSTER O, et al. Assessing biological stability of drinking water without disinfectant residuals in a full-scale water supply system[J]. Aqua, 2010, 59(1): 11-13. |
| [19] |
SHARP R R, CAMPER A K, CRIPPEN J J, et al. Evaluation of drinking water biostability using biofilm methods[J]. Journal of Environmental Engineering, 2001, 127(5): 403-410. DOI:10.1061/(ASCE)0733-9372(2001)127:5(403) |
| [20] |
NESCERECKA A, RUBULIS J, VITAL M, et al. Biological instability in a chlorinated drinking water distribution network[J]. Plos One, 2014, 9(5): 96354. DOI:10.1371/journal.pone.0096354 |
| [21] |
HAMMES F, SALHI E, KöSTER O, et al. Mechanistic and kinetic evaluation of organic disinfection by-product and assimilable organic carbon (AOC) formation during the ozonation of drinking water[J]. Water Research, 2006, 40(12): 2275-2286. DOI:10.1016/j.watres.2006.04.029 |
| [22] |
梁涛. 可生物同化有机碳在给水处理单元过程中的变化规律[D]. 哈尔滨: 哈尔滨工业大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D257147
|
 2018, Vol. 32
2018, Vol. 32


