| SpyTag/SpyCatcher作用于多酶固定化系统的应用研究 |
固定化系统可以将作用酶附着在不溶性基质上, 提高酶稳定性同时又可以实现酶重复利用的作用[1]。将酶进行固定化可以解决酶在应用中遇到的一些固有缺点, 如成本高、稳定性差、不易恢复等[2]。因此, 一种实用、有效的固定化策略对酶的广泛应用具有重要意义。
随着多酶复合物不断研究, 相互作用多肽对系统已逐渐引起了广泛的关注, 作为一种相对成熟的体系, 可以实现多酶的自组装作用。SpyTag/SpyCatcher作为一组典型的相互作用多肽对, 来自于酿脓链球菌(Streptococcus pyogenes), 存在于CnaB2结构域中[3]。SpyTag/SpyCatcher间会自发地在赖氨酸和天冬氨酸侧链间形成共价异肽键[4]。依靠稳定的结合使其应用于多酶组装具有了广阔前景。同时, 发现SpyTag/SpyCatcher无论是与作用酶的C端还是N端亦或是在中间进行融合, 都不会影响SpyTag/SpyCatcher之间的特异性结合[5]。在不同的pH、温度以及缓冲条件下简单地混合, 就可以获得较高结合率[4]。说明SpyTag/SpyCatcher之间的相互作用很容易产生且不受外部因素影响。所以本实验利用SpyTag/SpyCatcher为多酶的固定化开辟了新的可能性。
麦芽寡糖基海藻糖合酶(MTSase)和麦芽寡糖基海藻糖水解酶(MTHase)作为一组生产海藻糖的成熟催化酶系统。MTSase作用于麦芽糊精的还原端, 将还原端两个葡萄糖分子之间的α-1, 4-糖苷键异构化为α-1, 1-糖苷键, 形成海藻糖基团, MTHase再特异性地切割海藻糖基团附近的α-1, 4-糖苷键, 获得海藻糖[6]。基于这两种作用酶的催化过程, 将SpyTag/SpyCatcher与这组作用酶结合, 组装形成多酶复合物, 实现比游离酶更高的海藻糖转化效率[7-8]。有研究显示SpyTag/SpyCatcher经常用于蛋白质的组装和构建新的蛋白质结构, 而不会对蛋白质表达造成影响[9]。因此, 利用成熟的MTSase和MTHase催化系统, 探索以SpyTag/SpyCatcher为媒介的多酶固定化体系具有理论与实践的双重支持。
纤维素是一种理想固定化载体的组成成分[10]。与二氧化硅纳米颗粒等载体相比, 它不仅便宜、稳定、可生物降解, 还能以不同形式来获得[11]。目前, 已经关注到了纤维素结合模块(CBM)与纤维素的相互作用, 并将其应用于酶的一步纯化固定化中[12]。CBM是对纤维素具有高亲和力的非催化结构模块, 具有廉价、不易受外界环境影响等优点且化学和物理性能稳定[13], 能够与生物催化剂或难降解的底物紧密且长期地结合, 促进底物的有效降解, 提高催化效果[14]。CBM是一个独立的折叠单元, 在与蛋白质进行融合时不会影响与纤维素间的吸附作用[15]。但是, CBM蛋白通常比较大, 当与其他蛋白进行融合时, 它们之间连接肽越长, 表达水平可能会受到影响, 引起酶活性降低。而SpyTag/SpyCatcher都是较小的蛋白, 所以在参与融合时不会对酶活性有影响。
实验采用环保型纤维微球作为CBM可吸附的固定化载体。将融合SpyCatcher的CBM吸附在纤维微球上, 经戊二醛交联得到稳定的SC-CBM固定化载体。利用SpyTag/SpyCatcher的特异相互作用和CBM吸附固定化的结合, 完成不同类型作用酶的一步纯化和固定化。只需将作用酶与SpyTag融合, 即可使SC-CBM固定化载体成为通用的载体形式。基于SpyTag/SpyCatcher的多酶固定化系统可应用于不同领域, 从而获得更高的潜在价值。
1 材料与方法 1.1 材料与仪器限制性内切酶Xho I和EcoR I: 美国纽英伦生物技术有限公司; 质粒小提试剂盒和无缝克隆试剂: 南京诺唯赞生物科技股份有限公司; Ni-柱蛋白纯化柱: 七海生物技术公司(上海); BCA蛋白浓度测定试剂盒: 博斯特生物技术公司(武汉); 蛋白电泳套装DYY-12:赛默飞世尔科技(中国)有限公司; 扫描电子显微镜Regulus 8220:日立(日本); 高效液相色谱仪: 安捷伦科技(中国)有限公司。
1.2 菌株与质粒MTSase和MTHase基因序列treY、treZ均来自嗜酸热硫化叶菌ATCC 33909(Sulfolobus acidocaldarius)(GenBankAHC51689.1和AHC51691.1);CBM基因序列来自热纤梭菌(Clostridium thermocellum)(GenBank MH049738.1);生工生物技术公司(中国)合成treY、treZ以及SpyCatcher与CBM的基因序列, 由质粒pUC57保存。pET-28a(+)表达载体: 本实验室提供; 大肠杆菌BL21(DE3): 南京诺唯赞生物科技股份有限公司。实验中的所有引物均由生工生物技术公司合成。
1.3 质粒构建及表达合成的pUC57- treY/pUC57- treZ为模板, 利用表 1中的引物spyTag-treY-F/spyTag-treY-R、spyTag-treZ-F/spyTag-treZ-R进行PCR扩增, 获得ST-treY和ST-treZ基因片段。将基因片段经无缝克隆连接到Xho I、EcoR I双酶切的pET28a(+)载体上, 如图 1所示, 获得pET-TY和pET-TZ表达载体。以合成的pUC57-SpyCatcher和pUC57-CBM为模板, 以相同的方式无缝克隆得到pET-CLC表达载体。获得的pET-TY、pET-TZ和pET-CLC表达载体在大肠杆菌BL21(DE3)中转化, 保存于甘油管中(甘油终浓度20%)。
| 表 1 实验涉及的引物 |
 |
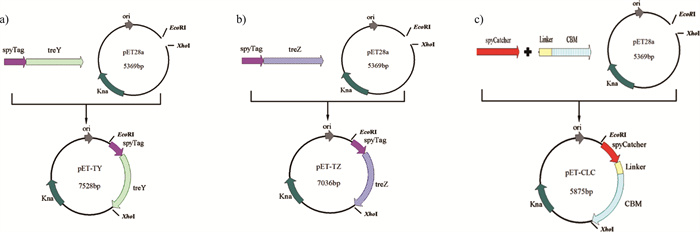 |
| 图 1 pET-TY、pET-TZ和pET-CLC表达载体构建示意图 |
1.4 蛋白纯化
在低温、8 000 r/min下离心10 min获得菌体, 经10 mmol/L磷酸钾缓冲液(pH 6.0)重悬后于超声波破碎仪20 min(工作程序: 4 s破碎, 6 s停歇)。破碎液离心取上清液过0.22~0.45 μm滤膜, 去除不溶性蛋白得粗酶液。采用亲和层析法纯化重组蛋白ST-treY、ST-treZ和SC-CBM[16]。Bradford法测定蛋白含量(以牛血清白蛋白为标准蛋白)[17], SDS-PAGE鉴定。
1.5 重组酶的酶学性质分析ST-treY和ST-treZ酶活测定分别采用了DNS法[18]和高效液相测定法[19]。ST-treY的酶活单位定义为pH 6.0, 60 ℃条件下, 每分钟消耗1 μmol麦芽六糖所需的酶量。ST-treZ的酶活单位定义为pH 6.0, 60 ℃条件下, 每分钟生成1 μmol海藻糖所需的酶量。与游离酶相比, 探讨重组酶的最佳温度和pH, 以及在最佳温度和pH条件下的稳定性。
1.6 SpyTag/SpyCatcher相互作用研究经纯化, SC-CBM与ST-treY/treZ分别以物质的量比1∶1在体外混合, pH 6.0, 25 ℃, 孵育24 h。通过形成的多酶复合物来探索SpyTag/SpyCatcher的相互作用。SDS-PAGE检测结合的形成, 通过ImageJ软件输出的平均灰度与光密度(OD)转化来实现量化。
1.7 固定化载体制备采用离子液体1-丁基-3-甲基咪唑氯化物(BmimCl)制备纤维微球[20]。将微晶纤维素95 ℃溶解在离子液体中, 均速搅拌, 以无水乙醇作为凝固浴, 采用挤压球法制备。通过1%戊二醛交联1 h。将微球与纯化的SC-CBM, 25 ℃下轻摇4 h得到SC-CBM固定化载体。测定吸附在纤维微球的SC-CBM蛋白含量确定载体回收率。回收率=(初始蛋白浓度-剩余蛋白浓度)/初始蛋白浓度×100%。
1.8 一步纯化固定化的条件优化首先经多次实验确定最佳生长量、IPTG添加量、诱导温度及诱导时间的发酵条件, 达到最佳表达水平后, 再利用SC-CBM固定化载体, 探究温度、时间、pH以及载体添加量对一步纯化固定化的影响, 优化固定化应用条件。固定化速率=(初始酶蛋白量-固定化后剩余的蛋白量)/总蛋白量×100%。而粗酶液中的固定化率定义为酶活的回收率, 酶活的回收率=(初始酶活性-固定化后剩余酶活性)/总酶活性×100%。
2 结果与讨论 2.1 pET-TY、pET-TZ和pET-CLC的成功表达如图 2a所示, 利用琼脂糖凝胶电泳技术验证了成功构建的pET-TY、pET-TZ和pET-CLC。由于重组酶C端融合了His标签, 因此使用Ni-柱进行纯化。采用SDS-PAGE法对ST-treY、ST-treZ和SC-CBM的纯化条带进行了验证。如图 2b所示, 反映了纯化前后的ST-treY、ST-treZ和SC-CBM蛋白条带, 大小分别约为87、66和35 kDa, 与理论值有2~5 kDa的偏差, 可能由于融合后蛋白质的修饰作用引起的。
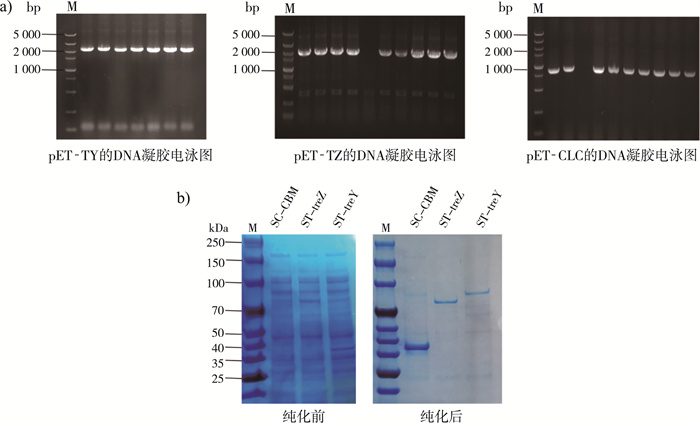 |
| 注: a)琼脂糖凝胶电泳验证图; b)纯化前后的SDS-PAGE凝胶电泳图。 图 2 pET-TY、pET-TZ和pET-CLC的表达验证图 |
2.2 酶活测定
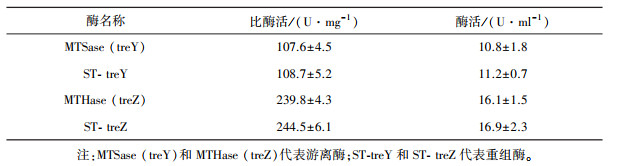
为了研究SpyTag与MTSase或MTHase的融合是否会引起酶活性的改变, 通过与游离酶进行比较, 绘制表 2融合SpyTag对MTSase/MTHase酶活的对比, 结果表明, 以麦芽六糖为底物测定ST-treY的比酶活为(108.7±5.2) U/mg, 以麦芽四糖海藻糖为底物测定ST-treZ的比酶活为(244.5±6.1) U/mg。相较于游离的MTSase或MTHase的比酶活(107.6±4.5)或(239.8±4.3) U/mg而言, 两者并没有明显的差异。这些结果与之前报道的结果保持一致[21], 表明了SpyTag的融合对作用酶的活性不会产生显著影响。
| 表 2 融合SpyTag对MTSase/MTHase酶活的对比 |
 |
2.3 重组酶的酶学性质分析
固定化技术可能会对酶的稳定性、催化性能产生影响[22]。所以探讨了固定化中融合SpyTag重组酶的酶学性质, 比较了游离酶和重组酶的最佳温度和pH, 测定了在最佳条件下的稳定性。
2.3.1 游离酶和重组酶的最佳温度比较游离酶与重组酶ST-treY和ST-treZ在不同温度下的相对酶活。定义最适温度下的酶活为100%。如图 3a所示, ST-treY和游离酶的相对酶活都是在65 ℃时达到最佳, 重组酶ST-treY的相对酶活性在45~60 ℃时比游离酶稍有升高。对于重组酶ST-treZ的最适温度, 如图 3b所示, 在75 ℃下与游离酶酶活相似, ST-treZ的相对酶活在60~70 ℃时比游离酶略有提升。因此, 融合SpyTag完成固定化的方法对作用酶的最佳温度没有显著影响, 且比游离酶在其他温度环境下会表现出更好的酶活性。
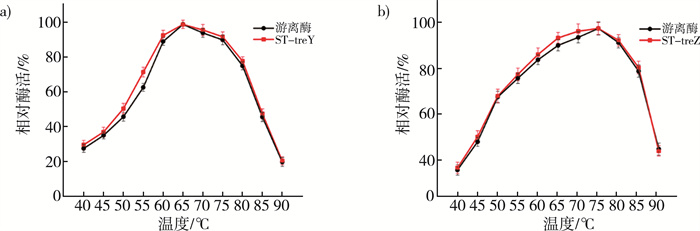 |
| 注: a)游离酶与ST-treY最佳温度对比图; b)游离酶与ST-treZ最佳温度对比图。 图 3 游离酶与重组酶的最佳温度 |
2.3.2 温度稳定性
海藻糖的最佳转化温度为60 ℃, 故将在该温度下对重组酶与游离酶的稳定性进行了比较。定义0 h时的酶活为100%。如图 4a所示, ST-treY的半衰期为11 d, 比游离酶的半衰期增加1 d。如图 4b所示, ST-treZ的半衰期为15 d, 游离酶的半衰期则为14 d。在生产海藻糖时, 重组酶与游离酶的半衰期仅有一天的差异, 说明这种融合SpyTag的固定化方式对温度的稳定性没有太大影响。
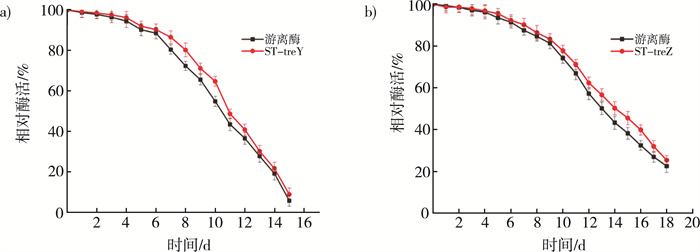 |
| 注: a)游离酶与ST-treY温度稳定性对比图; b)游离酶与ST-treZ温度稳定性对比图。 图 4 游离酶与重组酶的温度稳定性 |
2.3.3 游离酶和重组酶的最佳pH
比较不同pH条件下的游离酶、ST-treY和ST-treZ的相对酶活性, 定义最佳pH条件下的酶活为100%。如图 5a所示, 游离酶和ST-treY的最佳pH相同为pH 5.5, 而在其他pH条件下, ST-treY的相对酶活也高于游离酶。ST-treZ的最佳pH, 如图 5b所示, 与游离酶最佳pH相似, 为pH 6.0。因此, 融合SpyTag并不影响作用酶的最佳pH。
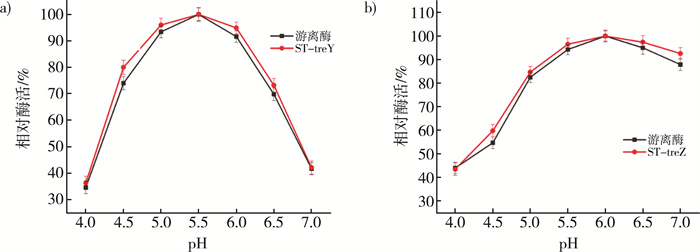 |
| 注: a)游离酶与ST-treY最佳pH对比图; b)游离酶与ST-treZ最佳pH对比图。 图 5 游离酶与重组酶的最佳pH |
2.3.4 pH稳定性
比较游离酶和重组酶的pH稳定性, 定义在某pH条件下, 0 h时的酶活为100%。如图 6中得出在pH≥5.0时, ST-treY和ST-treZ与游离酶的相对酶活无明显差异。而在pH < 5时, 两组重组酶的相对酶活都略高于游离酶。表明了融合SpyTag对作用酶的pH稳定性影响不大。
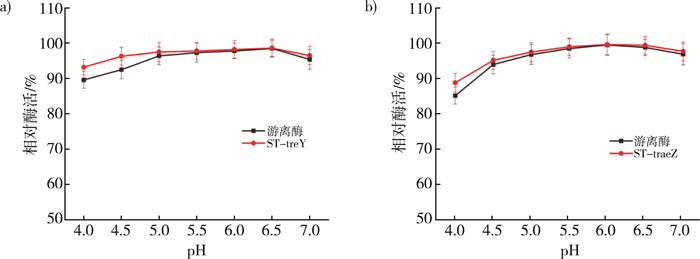 |
| 注: a)游离酶与ST-treY pH稳定性对比图; b)游离酶与ST-treZ pH稳定性对比图。 图 6 游离酶与重组酶的pH稳定性 |
2.4 SpyTag/SpyCatcher的相互作用
肽标签对于观察和分离蛋白质至关重要。与简单的蛋白融合相比, SpyTag/SpyCatcher可以阻止重组酶在包涵体中的表达, 而且SpyTag/SpyCatcher的体外偶联作用能快速形成不损伤蛋白质的强结构[23]。SpyTag基因融合的形式意味着重组酶和SpyCatcher之间通过自发的连接形成不可逆的共价键。在体外组装成多酶复合物, 探索SpyTag/SpyCatcher的相互作用效率。为了减少融合表达对SpyCatcher的影响, 在SpyCatcher和CBM之间引入了连接肽, 以减少肽键形成的影响。通过SpyTag/SpyCatcher自发形成的不可逆肽键完成体外组装。如图 7所示, SDS-PAGE验证了ST-treY/treZ与SC-CBM相互作用的结果, 1和2泳道观察到不同于其他的新条带, 分别为126和106 kDa, 证明ST-treY/treZ与SC-CBM的完成结合。利用梯度浓度SC-CBM纯酶(图 7泳道)进行SDS-PAGE, 采用Image J软件对灰度值进行分析, 得到OD值与蛋白质含量之间的线性关系。按照1∶1进行结合, 通过未结合的SC-CBM和ST-treY/treZ蛋白含量, 获得SC-CBM与ST-treY/treZ结合率分别为60.3%和63%。
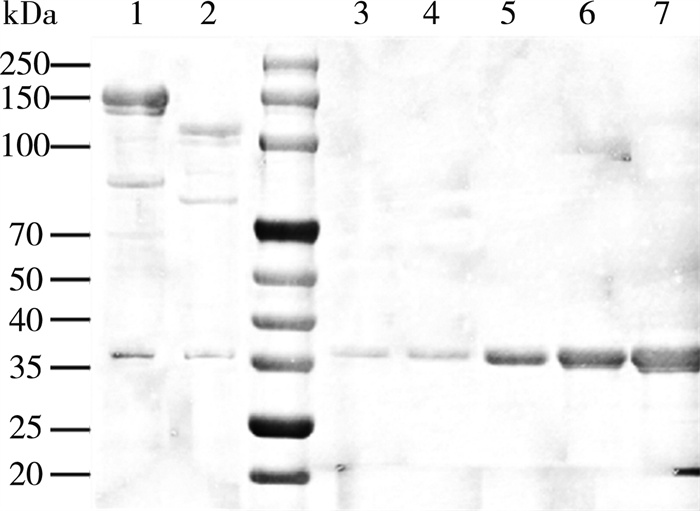 |
| 注: 泳道1为SC-CBM与ST-treY结合; 泳道2为SC-CBM与ST-treZ结合; 泳道3~7为SC-CBM纯酶浓度梯度(从左到右的浓度分别为28.26、56.52、113.04、226.08、452.16 μg/mL)。 图 7 SDS-PAGE电泳的灰度分析图 |
2.5 SC-CBM固定化载体
利用CBM吸附纤维素的功能, 将SC-CBM吸附在纤维微球得到SC-CBM固定化载体。但CBM和纤维微球的结合是可逆的, 当CBM沿着底物向前移动时, 在末端可能会发生脱落, 所以需戊二醛进行交联, 获得稳定的SC-CBM固定化载体。纤维微球吸附前初浓度为414.64 μg/mL, 通过测定微球吸附前后的蛋白质浓度的变化, 得到平均回收率约为79.8%。这与2019年Zhao等人的研究结果相符[15]。在此基础上, CBM和纤维微球的吸附效果, 为后续实验创造了可能。
2.6 一步纯化固定化条件优化通过SpyTag/SpyCatcher相互作用, 同时完成酶的纯化和固定化, 减少了复杂的纯化过程, 并直接将作用酶与固定化载体结合。如图 8所示, 扫描电子显微镜观察纤维微球, 表面粗糙、不均匀, 带有褶皱和微孔, 可以增加酶的附着面积, 从而促进作用酶的固定化效果。将SC-CBM固定化载体加入到ST-treY和ST-treZ重组酶, SEM表明, 与纤维微球的褶皱表面相比, 固定化后, 微球表面出现了大量的白色附着物, 形成鲜明对比。这也进一步说明了SpyTag/SpyCatcher作用与固定化系统的可行性。随着SC-CBM和ST-treY/ST-treZ的体外相互作用, 发现ST-treY和ST-treZ在相似的固定化条件下, 固定化速率是相同的。因此, 以ST-treY为例, 优化了一步纯化和固定化的条件。
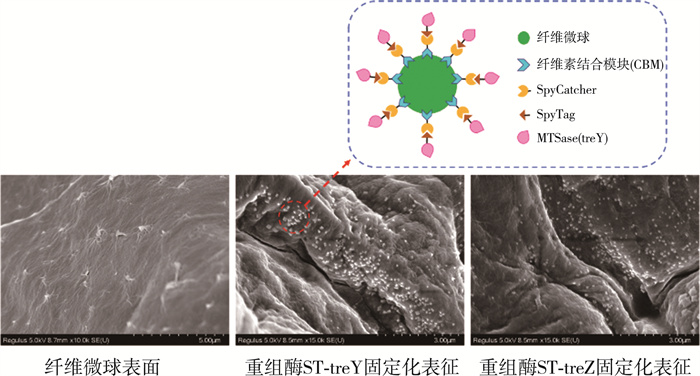 |
| 注: 虚线框为固定化后微球的组成模拟图。 图 8 固定化前后SEM对比图 |
2.6.1 一步纯化固定化的最优温度
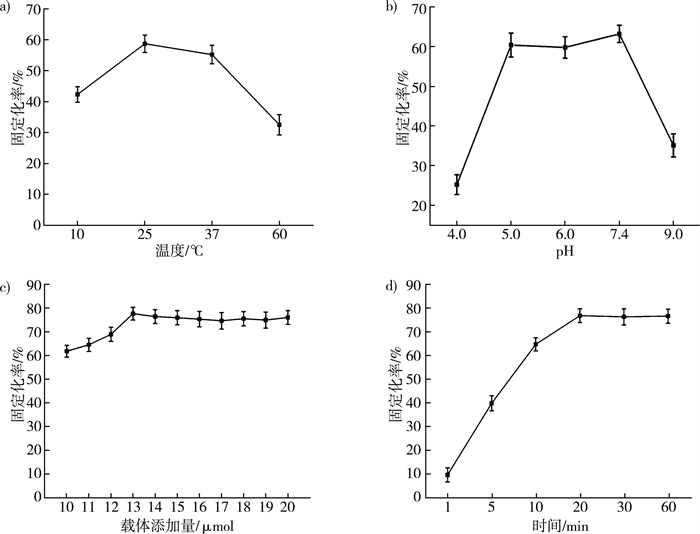
SpyTag/SpyCatcher肽键的形成会受温度的影响。研究了不同温度下ST-treY和固定化载体的固定化速率。从图 9a中表明, 重组酶的固定化速率随着温度的升高而提高, 在25 ℃时达到最高固定化率58.7%, 60 ℃时重组酶的固定化率下降至32.5%。所以一步纯化固定化的最优温度为25 ℃。
 |
| 图 9 一步纯化固定化条件优化 |
2.6.2 一步纯化固定化的最优pH
在SpyTag/SpyCatcher之间异肽键形成过程中, pH影响氨基酸的解离状态, 从而影响肽键形成的稳定性[24]。在最佳温度下, 对不同pH环境下的固定化速率进行了研究。如图 9b所示, pH过高或过低时, 都会影响固定效率, 当pH分别为5.0、6.0和7.4时, 固定化率普遍较高, 分别为60.4%、59.8%和63.2%。因此, 一步纯化固定化的最优pH为7.4。
2.6.3 一步纯化固定化的最佳载体添加量SpyTag/SpyCatcher形成肽键的理论比例为1∶1[4]。在最优温度和pH条件下, 通过加入10~20 μmol的SC-CBM固定化载体, 对固定化载体的添加量进行了优化。如图 9c所示, 随着载体添加量的增加, 固定化率逐渐上升, 但当添加量大于13 μmol时趋于稳定, 固定化率达77.4%。因此作用酶与固定化载体的最佳配比为1.0∶1.3, 高于理论值。造成这种偏差的原因可能是由于在固定化载体的制备中使用了戊二醛交联而破坏了SpyCatcher部分空间结构, 从而加大了固定化载体的添加量。
2.6.4 一步纯化固定化的最优作用时间固定化时间的长短也会影响固定化效果。基于以上研究, 探讨了不同的固定化时间。如图 9d所示, 固定时间为1~20 min时, 固定化速率逐渐增长, 但一旦超过20 min就基本稳定, 所以一步纯化固定化的最优作用时间为20 min, 此时固定化率76.8%。
2.6.5 粗酶液中的一步纯化固定化通过多次平行实验发现, ST-treY和ST-treZ最佳发酵条件相同。当生长量OD600在1.5~2.0时, ST-treY和ST-treZ酶活达最高约为(6.3±2.3)和(8.4±1.5) U/mL; 在最佳生长量条件下, IPTG添加量为0.2 mmol/L时, ST-treY和ST-treZ酶活达最高约为(8.5±3.7)和(10.2±2.4) U/mL; 基于以上条件, 当诱导温度为25 ℃时, ST-treY和ST-treZ酶活为(9.6±1.6)和(13.3±3.1) U/mL; 最后确定诱导时间为16 h时, ST-treY和ST-treZ酶活最高为(11.2±0.7)和(16.9±2.3) U/mL。依据最佳发酵条件来制取粗酶液, 将优化后的固定化条件应用于粗酶液中, 实现粗酶液中ST-treY和ST-treZ的纯化及固定化。当作用时间为1~40 min时, ST-treY和ST-treZ在粗酶液中的固定化率逐渐增加, 40 min后趋于稳定。此刻, ST-treY和ST-treZ在粗酶液中的一步纯化固定化率分别为69.6%和68.4%。
3 结论实验成功的将SpyTag/SpyCatcher应用于固定化系统中, 并对它们之间的相互作用以及一步纯化固定化条件进行了研究与优化, 固定化载体可以直接从发酵液或细胞裂解液中完成作用酶的固定, 使固定化率能够达到69.6%和68.4%。显示了利用SpyTag/SpyCatcher的固定化技术在工业规模生产中的可行性, 而且仅需融合SpyTag标签就能够获得一个通用的固定化载体, 还不会改变作用酶的酶学性质。使用SpyTag/SpyCatcher为媒介, 可大大减少酶的浪费和生产成本。未来, 基于SpyTag/SpyCatcher的固定化技术也将在生物学、食品、医学等领域具有一定的研究和应用价值。
| [1] |
CHAPMAN J, ISMAIL A, DINU C. Industrial applications of enzymes: recent advances, techniques, and outlooks[J]. Catalysts, 2018, 8(6): 238. DOI:10.3390/catal8060238 |
| [2] |
PESSINO V, CITRON Y R, FENG S, et al. Covalent protein labeling by SpyTag-SpyCatcher in fixed cells for super-resolution microscopy[J]. Chembiochem, 2017, 18(15): 1492-1495. DOI:10.1002/cbic.201700177 |
| [3] |
ZAKER B, FIERER J O, CELIK E, et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(12): 690-697. |
| [4] |
REDDINGTON S C, HOWARTH M. Secrets of a covalent interaction for biomaterials and biotechnology: SpyTag and SpyCatcher[J]. Current Opinion in Chemical Biology, 2015, 29: 94-99. DOI:10.1016/j.cbpa.2015.10.002 |
| [5] |
张文彬. SpyTag-SpyCatcher蛋白质组装体系[C]//2015年全国高分子学术论文报告会论文摘要集: 生物大分子, 苏州: 苏州大学, 2015.
|
| [6] |
JUNG D H, JUNG J H, SEO D H, et al. One-pot bioconversion of sucrose to trehalose using enzymatic sequential reactions in combined cross-linked enzyme aggregates[J]. Bioresource Technology, 2013, 130: 801-804. DOI:10.1016/j.biortech.2012.12.162 |
| [7] |
SHEN X, TANG S, XU Q, et al. SpyCatcher/SpyTag-mediated self-assembly of a supramolecular complex for improved biocatalytic production of trehalose[J]. Applied Biochemistry and Microbiology, 2019, 55(6): 596-602. DOI:10.1134/S0003683819060115 |
| [8] |
王腾飞, 宋龙祥, 刘洪玲. 一种同步分泌MTHase和MTSase重组枯草芽孢杆菌的构建及应用: CN111218467A [P]. 2020-06-02.
|
| [9] |
LIU Y, LIU D, YANG W, et al. Tuning SpyTag-SpyCatcher mutant pairs toward orthogonal reactivity encryption[J]. Chemical Science, 2017, 8(9): 6577-6582. |
| [10] |
JIANG Y, ZHANG X Y, YUAN H B, et al. Research progress and the biotechnological applications of multienzyme complex[J]. Applied Microbiology and Biotechnology, 2021, 105: 1-19. DOI:10.1007/s00253-020-10971-8 |
| [11] |
QIN Z, LIN S, QIU Y, et al. One-step immobilization-purification of enzymes by carbohydrate-binding module family 56 tag fusion[J]. Food Chemistry, 2019, 299: 125037. |
| [12] |
王珊. 通过CBM介导的纤维素固定化提高顺式环氧琥珀酸水解酶的稳定性[D]. 北京: 中国科学院大学, 2012.
|
| [13] |
VARNAI A, MAKELA M R, DJAJADI D T, et al. Carbohydrate-Binding Modules of Fungal Cellulases: Occurrence in nature, function, and relevance in industrial biomass conversion[J]. Advances in Applied Microbiology, 2014, 88: 103-165. |
| [14] |
SHOSEYOV O, SHANI Z, LEVY I. Carbohydrate binding modules: biochemical properties and novel applications[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 283-295. DOI:10.1128/MMBR.00028-05 |
| [15] |
ZHAO K, TANG F, SHI W, et al. One-step immobilization and purification of genetic engineering CBD fusion EndoS on cellulose for antibodies Fc-glycan remodeling[J]. Bioorganic Chemistry, 2019, 91: 103114. DOI:10.1016/j.bioorg.2019.103114 |
| [16] |
KHAN F, HE M, TAUSSIG M J. Double-hexahistidine tag with high-affinity binding for protein immobilization, purification, and detection on ni-nitrilotriacetic acid surfaces[J]. Analytical Chemistry, 2006, 78(9): 3072-3079. DOI:10.1021/ac060184l |
| [17] |
HAMMOND J B W, KRUGER N J. The bradford method for protein quantitation[J]. Methods in Molecular Biology, 1988, 32(32): 9-15. |
| [18] |
HU R, LIN L, LIU T, et al. Reducing sugar content in hemicellulose hydrolysate by DNS method: a Revisit[J]. J Biobased Mater Bioenergy, 2008, 2(2): 156-161. |
| [19] |
KIM H H, JUNG J H, SEO D H, et al. Novel enzymatic production of trehalose from sucrose using amylosucrase and maltooligosyltrehalose synthase-trehalohydrolase[J]. World Journal of Microbiology Biotechnology, 2011, 27: 2851-2856. |
| [20] |
HEINZE T, SCHWIKAL K, BATTHEL S. Ionic liquids as reaction medium in cellulose functionalization[J]. Macromolecular Bioscience, 2005, 5(6): 520-525. |
| [21] |
BAO J, LIU N, ZHU L, et al. Programming a biofilm-mediated multienzyme-assembly-cascade system for the biocatalytic production of glucosamine from chitin[J]. Journal of Agricultural and Food Chemistry, 2018, 66(30): 8061-8068. |
| [22] |
DENG M, ZHAO H, ZHANG S, et al. High catalytic activity of immobilized laccase on core-shell magnetic nanoparticles by dopamine self-polymerization[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 112: 15-24. |
| [23] |
GILBERT C, HOWARTH M, HARWOOD C R, et al. Extracellular self-assembly of functional and tunable protein conjugates from Bacillus subtilis[J]. ACS Synthetic Biology, 2017, 6(6): 957-967. |
| [24] |
SU L, WU S, FENG J, et al. High-efficiency expression of sulfolobus acidocaldarius maltooligosyl trehalose trehalohydrolase in Escherichia coli through host strain and induction strategy optimization[J]. Bioprocess and Biosystems Engineering, 2019, 42(3): 345-354. |
 2022, Vol. 36
2022, Vol. 36


