| 玉米秸秆酶解转化可发酵糖的工艺 |
随着石油等化石燃料资源的日益枯竭, 以纤维素乙醇为代表的生物质能源日益受到重视。与传统的化石燃料相比,生物质能源具有原料来源广泛、绿色环保、可再生等特点,应用前景广阔[1-2]。玉米秸秆是我国主要的秸秆资源,据统计,我国每年产生的玉米秸秆数量高达2.6亿吨,约占我国秸秆资源年产量的32%。庞大的玉米秸秆产量与相对较低的利用率形成鲜明的对比,选择合理的利用方式以提高资源利用率显得尤为重要[3]。
玉米秸秆主要由纤维素、半纤维素、木质素等成分组成,相对较高的纤维素含量为转化可发酵糖提供了物质基础。通过合理的的预处理方法及酶解,可有效提高玉米秸秆转化可发酵糖的效率,为高效转化乙醇、丁二醇等产品提供糖平台[4-5]。碱过氧化氢法是应用较为广泛的化学预处理方式,能有效破坏木质素与纤维素及半纤维素之间的联结,破除酶解的生物质壁障[6-8]。在碱过氧化氢法预处理的基础上对玉米秸秆进行水洗,以去除酶活抑制物;添加吐温20以降低木质纤维素对酶的非特异性吸附。并对两者联合酶解玉米秸秆的效果进行研究,以期有效提升玉米秸秆酶解转化率,为玉米秸秆转化可发酵糖奠定工艺基础。
1 材料与方法 1.1 实验材料 1.1.1 材料玉米秸秆采集自山东潍坊,经齿爪式粉碎机粉碎后过筛。
1.1.2 试剂硫酸,5M NaOH,H2O2。实验试剂均为分析纯。
1.1.3 酶纤维素酶(Cellic CTec2)及半纤维素酶(Cellic HTec2)均来自丹麦诺维信公司。
1.1.4 仪器设备德国赛多利斯pH计(PB-10);恒温振荡培养箱(MQD-B3NR);日本岛津液相色谱仪(LC-20A);高速离心机(iCen24);电热鼓风干燥箱(DHG-9075A);马弗炉(SX-2);恒温水浴锅(HWS-26);立式压力蒸汽灭菌器(LDZX-50KBS)。
1.2 实验方法 1.2.1 成分分析纤维素、半纤维素、木质素、还原糖及其他主要成分测定参照美国国家可再生能源实验室(NREL)的《Determination of Structural Carbohydrates and Lignin in Biomass》。
1.2.2 碱过氧化氢预处理称取3.0 g玉米秸秆于50 mL三角瓶中,称取0.3 g NaOH于烧杯中。向烧杯中加入少量蒸馏水,溶解,加水至设计底物浓度。搅拌均匀后加入盛有玉米秸秆样品的三角瓶,再加入H2O2溶液(添加量0.1 g/g玉米秸秆)。调节pH至11.7~11.9,置于30 ℃恒温振荡器中振摇24 h,每隔2 h用5 M NaOH调节pH,使pH保持在11.7~11.9范围内。
1.2.3 不同底物浓度玉米秸秆的酶解在碱过氧化氢预处理的基础上研究不同底物浓度下酶解效率的变化。设计底物浓度为5%、10%、15%、20%(W/V)。预处理结束后,添加72% H2SO4调节pH至5.2,按照实验设计的酶蛋白添加量(纤维素酶/半纤维素=0.77/0.23),分别加入一定量的纤维素酶和半纤维素酶(50 mg/g总蛋白/g纤维素,酶解温度50 ℃),置于50 ℃恒温振荡器中,170 rpm进行酶解24 h。酶解结束后,立即取出,沸水浴灭活5 min。取样1 mL于1.5 mL离心管中,12 000 r/min下离心3~5 min。取上清液,测定葡萄糖及木糖浓度。
1.2.4 酶解时间对玉米秸秆酶解效率的影响取15 g玉米秸秆于500 mL三角瓶中,按照1.2.2方法预处理24 h后参照1.2.3酶解方法进行酶解。分别于3 h、6 h、8 h、10 h、12 h、16 h、24 h、36 h、48 h、72 h时取样测定糖浓度并计算转化率。设置平行实验三组。
1.2.5 水洗对玉米秸秆酶解糖得率的影响设计底物浓度为20%。称取15.0 g玉米秸秆于300 mL三角瓶中,在上述实验条件下进行预处理。预处理结束后,于16层纱布上对玉米秸秆进行水洗,蒸馏水反复洗涤至洗液无色,挤压去除水分,取样测定含水量,并补水至原底物浓度。调节pH至5.2,按照设计加酶量加入ctec2与htec2进行酶解,并在酶解24 h、36 h、48 h、72 h、96 h时分别取样测定糖浓度,同时设置对照组(不进行水洗)实验。
1.2.6 添加吐温20酶解玉米秸秆准确称取15.0 g玉米秸秆于300 mL三角瓶中,按照1.2.3进行预处理,实验设计底物浓度为25%。预处理完毕,添加吐温20(浓度为2.5 g/L)。按照以上步骤进行酶解,并设置对照组实验。在酶解24 h、36 h、48 h、72 h、96 h时分别取样测定糖浓度,并计算转化率。
1.2.7 水洗并添加吐温20酶解玉米秸秆在水洗的基础上向预处理后玉米秸秆添加2.5 g/L吐温20,进行酶解,并在酶解24 h、36 h、48 h、72 h、96 h时分别取样测定糖浓度。
1.2.8 葡萄糖及木糖糖浓度测定葡萄糖及木糖糖浓度使用高效液相色谱进行测定,色谱柱为美国伯乐Aminex-87 H色谱柱。检测器为示差-折光检测器,流动相为0.005 mol/L H2SO4,柱温65 ℃,流速0.6 mL/min。通过建立标准曲线对糖浓度进行计算。
2 结果与讨论 2.1 成分分析采用NREL法进行成分分析的结果如图 1所示。玉米秸秆是传统的生物质能源生产原料,纤维素含量一般在35%左右,同时含有20%左右的半纤维素。实验测定的纤维素含量为35.8%,半纤维素含量为17.7%,与大多数研究相差不大[9]。较高的纤维素与半纤维素含量表明以玉米秸秆为原料转化可发酵糖是可靠的,但需要合理的预处理及酶解工艺。
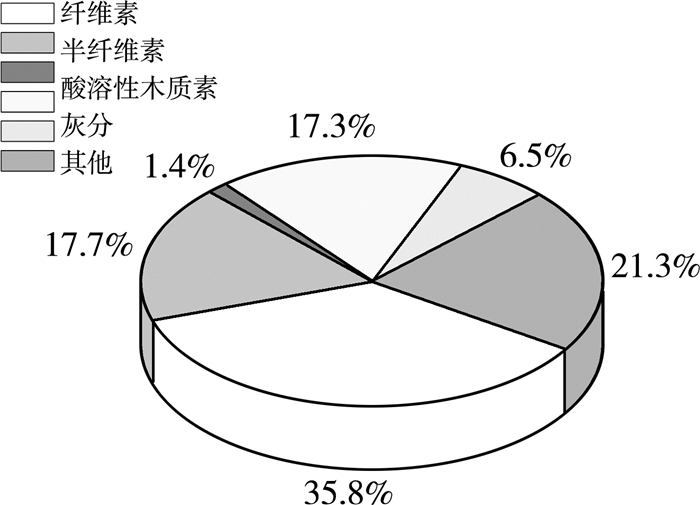 |
| 图 1 玉米秸秆的成分 |
2.2 不同底物浓度下玉米秸秆酶解糖得率
不同底物浓度下玉米秸秆酶解糖得率如图 2所示。在5%底物浓度下,玉米秸秆纤维素~葡萄糖、半纤维素~木糖转化率分别为83.3%、80.1%。随着底物浓度升高,转化率逐步下降,同时糖浓度逐步提高。在20%底物浓度下,纤维素~葡萄糖、半纤维素~木糖转化率分别为73.3%、71.3%,糖浓度分别高达54.8 g/L、26.9 g/L,较15%底物浓度下降幅度较小,糖得率较高。
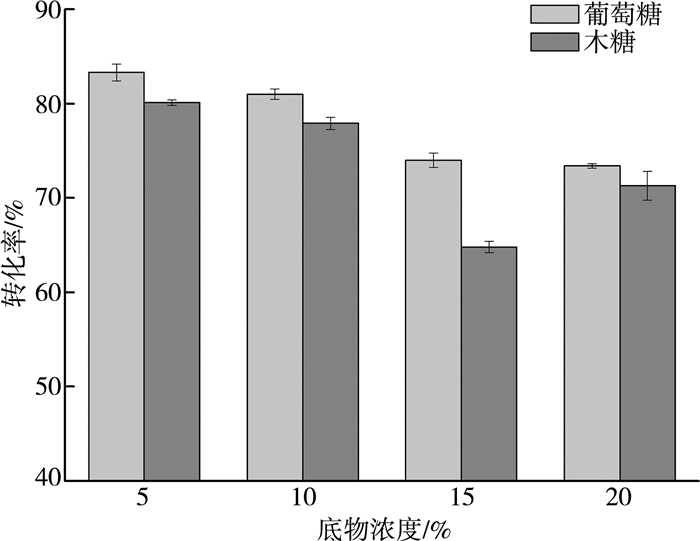 |
| 图 2 不同底物浓度下玉米秸秆酶解糖得率 |
2.3 时间对玉米秸秆酶解效果的影响
72 h内玉米秸秆酶解转化率变化趋势如图 3所示。酶解初期(0~3 h),随着液化的进行,酶解转化率迅速提高;6 h时,葡萄糖转化率与木糖转化率分别为60.1%、59.4%;6 h~12 h,转化率保持较高的增加速度,糖浓度逐步提高;12 h时葡萄糖转化率为71%,木糖转化率为65.1%;12 h~16 h,酶解效率增速放缓,并在16 h左右进入平台期;16 h~24 h糖浓度与转化率以缓慢的速度增长;24 h时葡萄糖与木糖糖浓度分别高达58.54 g/L、26.54 g/L,对应转化率为78.5%、70.5%;24 h后糖浓度与转化率水平趋于稳定状态。
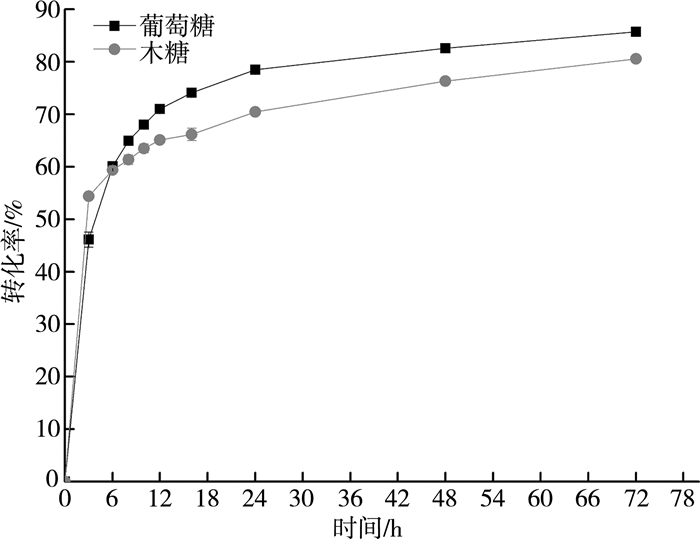 |
| 图 3 玉米秸秆酶解转化率与时间的关系 |
2.4 水洗对玉米秸秆酶解效率的影响
水洗对玉米秸秆酶解转化率的影响如图 4所示。水洗明显提升了玉米秸秆酶解糖转化率。酶解24 h,葡萄糖与木糖转化率较对照组分别提高4.82%、0.44%。随着酶解时间延长,糖转化率增速放缓,这与酶活抑制物浓度的逐步升高有较大关系。酶解96 h,水洗组较对照组葡萄糖与木糖转化率分别提升8.32%、7.12%,提升效果明显。表明通过水洗,以对香豆酸为代表的酶活抑制物得以去除[10-11];同时酶解转化率的提升也与水洗后明显提高的水分活度及传质效率有关。
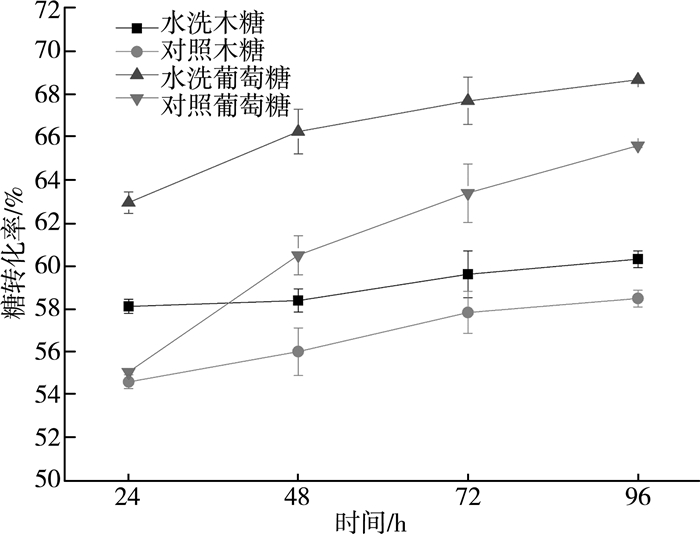 |
| 图 4 水洗对玉米秸秆糖转化率的影响 |
2.5 添加吐温20酶解玉米秸秆的效果
添加吐温20酶解玉米秸秆的转化率~时间曲线如图 5所示。添加2.5 g/L吐温20有效提高了玉米秸秆酶解纤维素~葡萄糖与半纤维素~木糖转化率。酶解24 h,吐温组葡萄糖转化率为66.8%,木糖转化率为58.1%,分别高于对照组8.7%、3.5%。吐温20对于酶解转化率的提升作用与其降低了木质纤维素对酶的非特异性吸附有关。Torny Eriksson等研究表明,吐温20能有效提高木质纤维素酶解效率,且其最适添加浓度为2.5 g/L。与其他非离子型表面活性剂相比,吐温20有效提升酶解效率的同时对环境友好,因而可作为木质纤维素酶解促进剂[12-13]。随着酶解时间的延长,酶解转化率增速逐步放缓,但吐温20对于酶解转化率的提升作用没有因此而减弱,表明吐温20降低木质纤维素非特异性吸附酶的作用不会随酶解时间的延长而消失,在酶解72 h后这种作用的效果基本趋于稳定。
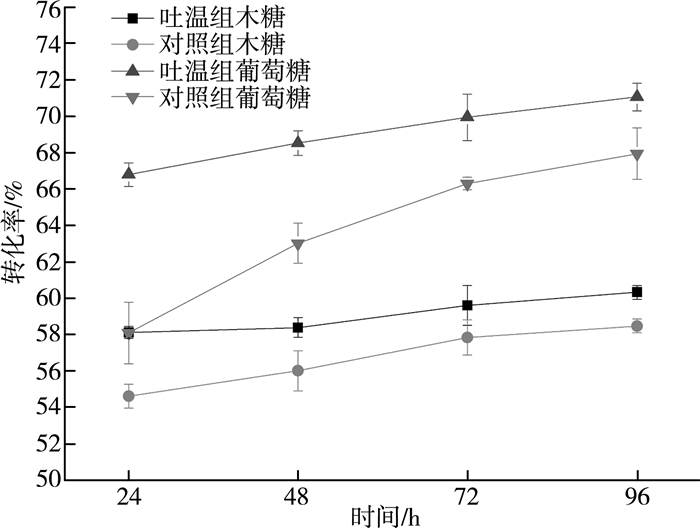 |
| 图 5 吐温20对玉米秸秆酶解糖转化率的影响 |
2.6 水洗联合吐温20酶解玉米秸秆
如图 6所示,经水洗并添加吐温20后玉米秸秆酶解效率明显提高,与对照组(单纯水洗组)相比,葡萄糖浓度与木糖浓度分别提高了3.7 g/L、1.0 g/L,相对提升8.7%、5.4%,表明对碱过氧化氢预处理玉米秸秆水洗后添加吐温20酶解的工艺是可行的。在去除酶活抑制物的同时有效降低了木质素对纤维素酶与半纤维素酶的非特异性吸附,两者结合能显著提高玉米秸秆酶解效率。
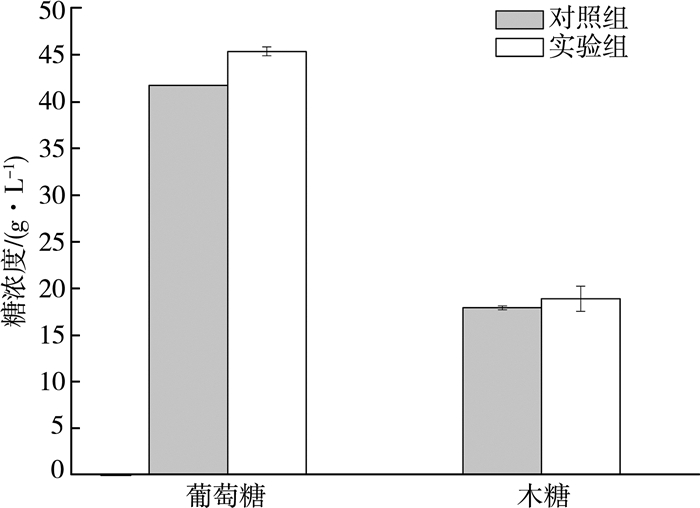 |
| 图 6 吐温20结合水洗对玉米秸秆酶解糖浓度的影响 |
3 结论
通过碱过氧化氢法预处理及酶解能有效实现玉米秸秆高效转化可发酵糖。在碱过氧化氢法预处理的基础上对20%底物浓度玉米秸秆进行水洗以及添加2.5 g/L的吐温20均能有效提高玉米秸秆酶解糖转化率,且这种提升效果在72 h后基本稳定。在水洗的基础上添加2.5 g/L吐温20能有效提高玉米秸秆酶解转化率,这为高效利用木质纤维素资源提供了一种有效的方法。
| [1] |
MEEHNIAN H, JANA A K, JANA M M. Effect of particle size, moisture content, and supplements on selective pretreatment of cotton stalks by daedalea flavida and enzymatic saccharification[J]. Biotech, 2016, 6(2): 1-13. |
| [2] |
BALAT M, BALAT H, ÖZ C. Progress in bioethanol processing[J]. Progress in Energy and Combustion Science, 2008, 34(5): 551-573. DOI:10.1016/j.pecs.2007.11.001 |
| [3] |
中华人民共和国农业部新闻办公室. 全国农作物秸秆资源调查与评价报告[R]. 北京: 农业部新闻办公室, 2010.
|
| [4] |
KUHN E M, O'BRIEN M H, CIESIELSKI P N, et al. Pilot-scale batch alkaline pretreatment of corn stover[J]. ACS Sustainable Chemistry & Engineering, 2015, 4(3): 944-956. |
| [5] |
DALE B E, ONG R G. Energy, wealth, and human development:Why and how biomass pretreatment research must improve[J]. Biotechnology Progress, 2012, 28(4): 893-898. DOI:10.1002/btpr.v28.4 |
| [6] |
ALVAREZ-VASCO C, ZHANG X. Alkaline hydrogen peroxide(AHP) pretreatment of softwood enhanced enzymatic hydrolysability at low peroxide loadings[J]. Biomass and Bioenergy, 2017(96): 96-102. |
| [7] |
LI Z, CHEN C H, LIU T, et al. Catalysis with CuⅡ(bpy) improves alkaline hydrogen peroxide pretreatment[J]. Biotechnology and Bioengineering, 2013, 110(4): 1078-1086. DOI:10.1002/bit.v110.4 |
| [8] |
OWOLABI A F, HAAFIZ M K, HOSSAIN M S, et al. Influence of alkaline hydrogen peroxide pre-hydrolysis on the isolation of microcrystalline cellulose from oil palm fronds[J]. International Journal of Biological Macromolecule, 2017(95): 1228-1234. |
| [9] |
何士成, 彭太兵, 孙曼钰, 等. 碱处理中温度对不同底物特性木质纤维素结构及酶解的影响[J]. 江苏农业科学, 2017, 45(21): 292-296. |
| [10] |
TIAN S, ZHU W, GLEISNER. R, et al. .Comparisons of SPORL and dilute acid pretreatments for sugar and ethanol productions from aspen[J]. Biotechnology Progress, 2011, 27(2): 419-427. DOI:10.1002/btpr.v27.2 |
| [11] |
GEORGIEVA T I, HOU X R, HILSTROM T, et al. Enzymatichydrolysis and ethanol fermentation of high dry matter wet-exploded wheat straw at low enzyme loading[J]. Applied Biochemistry and Biotechnology, 2008, 148(1-3): 35-44. DOI:10.1007/s12010-007-8085-z |
| [12] |
ERIKSSON T, BÖRJESSON J, TJERNELD F. Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose[J]. Enzyme and Microbial Technology, 2002, 31(3): 353-364. DOI:10.1016/S0141-0229(02)00134-5 |
| [13] |
ZHANG Y Q, XU X M, ZHANG Y Y, et al. Effect of adding surfactant for transforming lignocellulose into fermentable sugars during biocatalysing[J]. Biotechnology and Bioprocess Engineering, 2011, 16(5): 930-936. DOI:10.1007/s12257-011-0138-z |
 2018, Vol. 32
2018, Vol. 32


