| 带有手性侧基的α-苯乙胺分子印迹聚合物的分子识别性能 |
手性高分子作为功能高分子的一类,手性分离是其最重要的应用领域之一,几乎所有涉及手性高分子研究的文献中都会提到其用于手性识别或者分离这一重要功能[1-5]。而手性分子印迹聚合物作为一类具有特殊手性空穴的手性高分子,已经广泛应用于对特定手性结构分子的识别和拆分[6-10]。
到目前为止的研究工作几乎全部集中于如何获得手性空穴。一般认为,当聚合物结构中的特定基团可与被识别分子形成氢键或者其他强相互作用力时,或者高分子链上带有较大的位阻基团时,其分子识别能力较大[11-14],其前提是模板分子与被识别分子的结构相同或者相似。也就是说,由手性模板分子产生的具有记忆功能的分子印迹手性空穴对手性识别性能起着最为关键的作用。除了这种手性空穴以外,其他手性结构因素对其识别性能有无影响,例如在手性分子印迹聚合物的侧基上引入相同或者相反构型的手性基团后,是否也会影响其手性识别能力,更进一步说,两种手性因素之间是否存在相互影响,目前尚未见有关的研究报道。
选用手性α-苯乙胺的两种对映异构体分别作为模板分子,同时通过单体分子设计在高分子的侧基上也引入α-苯乙胺的手性结构,合成了既具有手性侧基又具有手性印迹空穴的双重手性高分子。通过它们对α-苯乙胺拆分性能的研究表明:手性印迹环境确实对手性识别性能起着最为关键的作用,但是高分子链上的手性结构因素也具有一定的作用,尤其是当模板分子的构型与高分子侧基上的结构单元构型相同时,对分离效果具有明显的叠加增效作用。这对于开发高效手性识别高分子材料具有重要的指导意义。
1 实验 1.1 试剂及仪器所有的化学试剂均为分析纯或者化学纯,用前无需特殊处理。U-301型紫外-可见分光光度计(日本日立有限公司)。
1.2 单体的合成取0.1 mol S-α-苯乙胺溶于30 mL乙酸乙酯中,在-1~3 ℃环境中恒温搅拌。同时分别缓慢滴加溶于30 mL乙酸乙酯的三乙胺和丙烯酰氯1 h,然后将其移到室温3 h。抽滤除去白色盐酸盐,将滤液用1 mol/L的HCl、5%碳酸氢钠溶液和饱和食盐水洗涤3次。将得到的溶液用无水硫酸镁除水后旋转蒸发得到白色固体(如图 1)。
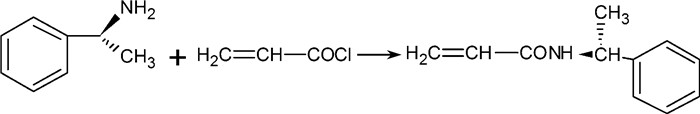 |
| 图 1 S-N-(1-苯乙基)丙烯酰胺制备方案 |
S-N-(1-苯乙基)丙烯酰胺、R-N-(1-苯乙基)丙烯酰胺及外消旋化的N-(1-苯乙基)丙烯酰胺分别由丙烯酰氯与相应的S-α-苯乙胺、R-α-苯乙胺以及消旋化的α-苯乙胺按照以上方法合成。
1.3 分子印迹聚合物的合成以S-(-)-α-苯乙胺为模板分子,S-N-(1-苯乙基)丙烯酰胺为分子骨架的分子印迹聚合物的合成。
取S-α-苯乙胺(2 mmol)和功能单体S-N-(1-苯乙基)-丙烯酰胺(8 mmol)溶于40 mL甲醇中并搅拌4 h,目的是为了形成模板分子-单体复合物。并且向溶液中加入交联剂乙二醇二甲基丙烯酸酯40 mmol和引发剂偶氮二异丁腈100 mg,抽真空,通氮气10 min,于水浴振荡箱中(65 ℃下)恒温反应24 h,得到白色块状聚合物,放入真空干燥箱干燥,将聚合物充分研磨后过200目筛,得到白色微细粉末状固体。在索氏提取器中用体积比为9:1的甲醇:乙酸溶液来抽提模板分子S-(-)-α-苯乙胺,反复抽提,检测流出液,确保模板分子S-α-苯乙胺已被抽提干净,之后再用乙腈抽提至中性,放入真空干燥箱干燥24 h,即可得到分子印迹聚合物,记为S/S。
按照同样的方法分别制备了以S-α-苯乙胺为模板分子,分别以R-N-(1-苯乙基)丙烯酰胺和消旋化N-(1-苯乙基)丙烯酰胺为单体的分子印迹聚合物(分别记为S/R、S/SR),以及以R-α-苯乙胺为模板分子,分别以S-N-(1-苯乙基)丙烯酰胺、R-N-(1-苯乙基)丙烯酰胺和消旋化为N-(1-苯乙基)丙烯酰胺为单体的分子印迹聚合物,分别记为R/S、R/R和R/RS。
以S-N-(1-苯乙基)丙烯酰胺和R-N-(1-苯乙基)丙烯酰胺为单体的空白分子印迹聚合物的制备方法除聚合时未加入模板分子,其他同上;后处理也不需要抽提操作,分别记为S和R。
1.4 印迹聚合物对α-苯乙胺的识别实验 1.4.1 动态吸附实验称取印迹聚合物0.5 g,加入盛有40 mL 1.0 mmol/L的S(或R)-α-苯乙胺的甲醇溶液的平底烧瓶中。每次吸取2 mL,分别测定20 min、40 min、60 min、80 min、100 min、150 min、200 min、300 min、400 min时溶液中S(或R)-α-苯乙胺的吸收值。并通过吸收值来计算出溶液中S(或R)-α-苯乙胺的浓度,从而得到不同时间内印迹聚合物对S(或R)-α-苯乙胺的结合量,绘制出各自的动态吸附曲线。
1.4.2 静态吸附实验准确称取分子印迹聚合物样品0.5 g于200 mL的平底烧瓶中,加入浓度为1 mmol/L的S(或R)-α-苯乙胺的甲醇溶液40 mL,在20 ℃恒温振荡12 h,离心并取上层清液2 mL。用紫外分光光度法测量此溶液的吸光度,可以根据结合前后溶液中S(或R)-α-苯乙胺的浓度变化,计算出聚合物对S(或R)-α-苯乙胺的结合量。吸附材料的识别能力我们采用分离因子α来表示, 可用式(1) 计算:
| $\alpha = K_{\rm{D}1}/K_{\rm{D}2}$ | (1) |
式(1) 中“1”代表模板分子,“2”代表竞争分子;α值越大,说明材料的选择性越强。
S(或R)-α-苯乙胺在聚合物和溶液两相中的分配系数(KD),通过式(2) 计算:
| $K_{\rm{D}} = c_{\rm{p}}/c_{\rm{s}}$ | (2) |
cp:分子印迹聚合物结合底物的浓度(μmol/g);cs:溶液中底物的平衡浓度(μmol/mL)。
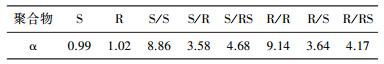
2 结果与讨论静态吸附试验计算得到的各个聚合物的α值列于表 1中。
| 表 1 各个聚合物对α-苯乙胺对映异构体拆分的α值 |
 |
各个聚合物对R-α苯乙胺和S-α苯乙胺的动态吸附曲线列于图 2~图 5中。
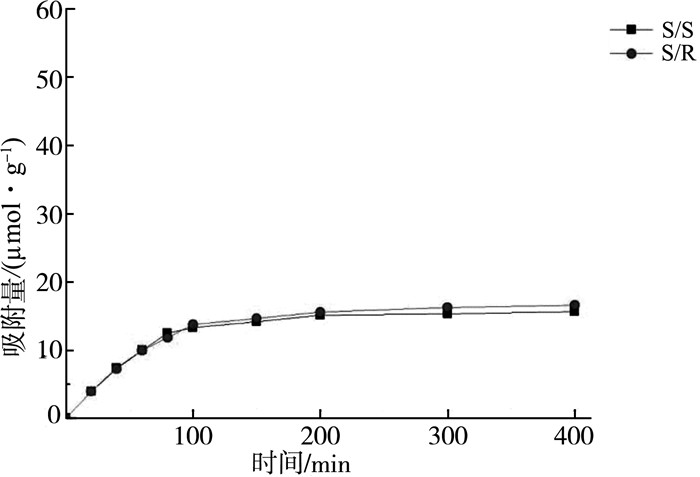 |
| 图 2 S构型单体空白聚合物的动态吸附曲线 |
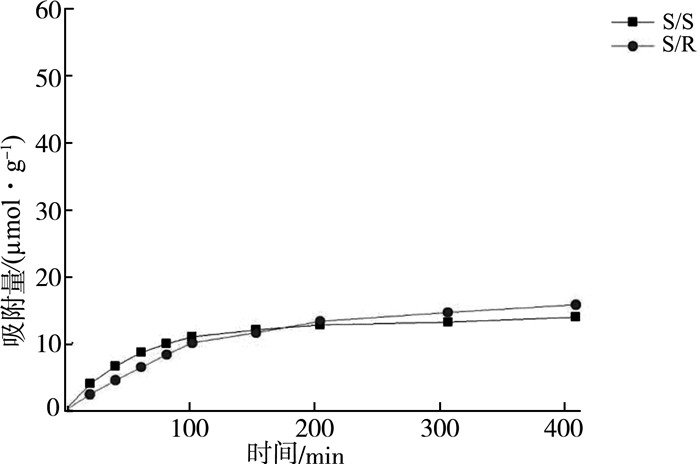 |
| 图 3 R构型单体空白聚合物的动态吸附曲线 |
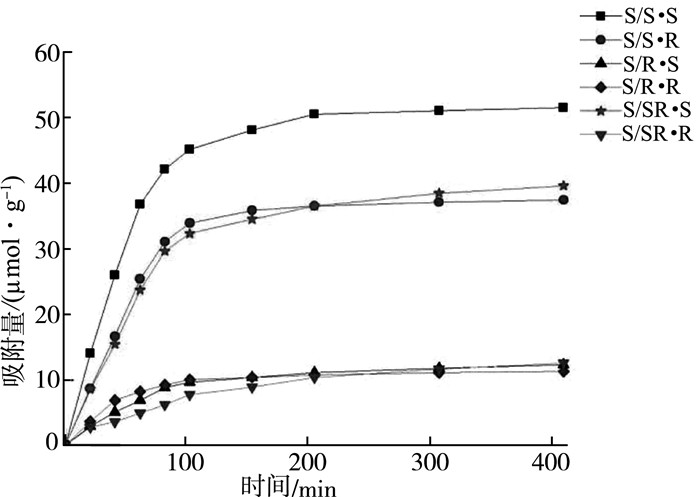 |
| 图 4 以S-α苯乙胺为模板的聚合物的动态吸附曲线 |
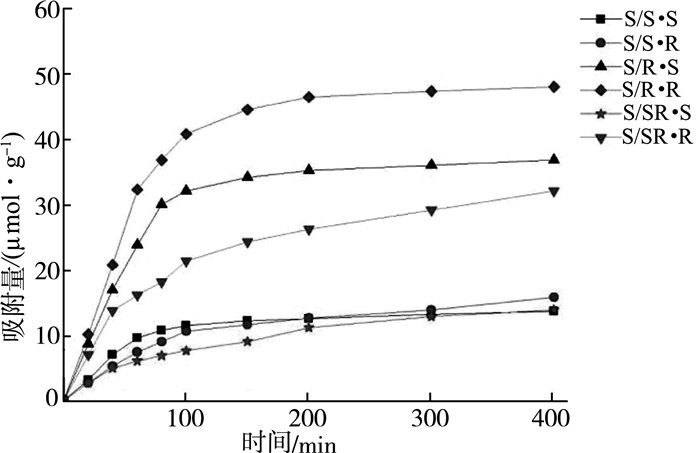 |
| 图 5 以R-α苯乙胺为模板的聚合物的动态吸附曲线 |
以上各图中,“/”后指的是相应的聚合物,“/”前指的是吸附相应构型的α-苯乙胺。如R/(S·R)指的是S·R聚合物对R-α苯乙胺的吸附。
首先,对于没有手性分子印迹存在的空白聚合物,无论单体构型如何,聚合物的α值均接近于1,也就是说,它们对两种构型异构体的吸附没有选择性。而从其动态吸附曲线来看,虽然它们对两种构型异构体有一定的吸附,但是吸附量也很低,这说明虽然有手性结构因素存在,但单纯的高分子侧基上的手性因素对分子识别能力并没有可以观察到的贡献。
从添加了模板分子的手性分子印迹聚合物的动态吸附曲线,可以明显看出以下两点:
1) 无论高分子侧基构型如何,所得聚合物对于与模板分子构型相反的苯乙胺的吸附没有表现出明显差别,不同时间的吸附值非常接近,都维持在较低的水平,但是其对与模板分子构型相同的异构体的吸附值却大大提高。
2) 当聚合物侧基构型与模板分子的构型相同时,其对相同构型的被吸附异构体的吸附值又表现出更加明显的增高。表现在静态吸附试验上,一方面手性分子印迹聚合物的吸附选择性非常高,可以实现对两种异构体的有效识别,而且模板分子构型对手性识别性能起着关键作用。另一方面,当聚合物侧基构型与模板分子构型相同时,其分子识别能力有明显的叠加增效作用,其α值非常高,这似乎与单纯空白聚合物实验的结论不相符。也就是说,此处的结果表明,高分子侧基的构型对手性识别能力也有一定的影响。
我们通过下面的示意图(图 6)分析其可能的原因。
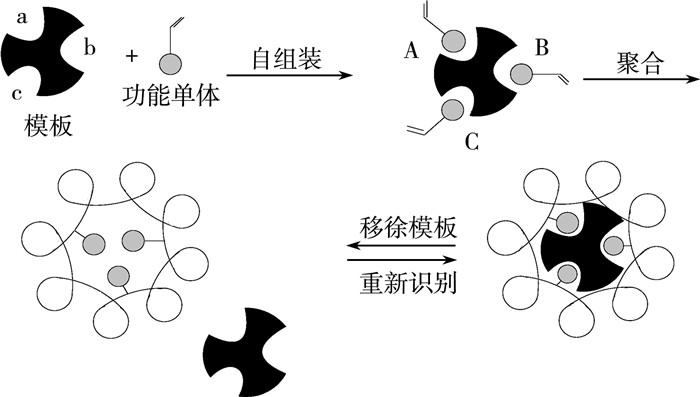 |
| 图 6 具有相同构型的模板分子与单体的聚合和分子识别原理图 |
当单体的构型与模板分子构型相同时,模板分子与单体表现出更强的亲和力,在这种亲和力的作用下,单体及其后续的聚合物都倾向于向着模板分子方向靠拢(这也与前述的“手性分子印迹聚合物对于模板分子构型相同的异构体的吸附值远远高于另一异构体”的结论相符)。类似于在模板分子诱导下,聚合物出现了择优排列,聚合物上的侧基或者侧基上的极性基团(如酰胺键)很可能朝向模板分子。当模板分子被除掉后,这种择优排列由于聚合物网状结构的固定作用而变为向着手性空穴的择优排列,加大了手性空穴的记忆效应。而当侧基构型与模板分子相反时,侧基或者其上的极性基团的空间排列是随机的,只有手性空穴起着手性识别作用。因此,相同构型的手性侧基只是增强了手性空穴的作用,其本身对吸附或者识别性能并不起作用。
3 结论对于手性聚合物的手性识别性能来说,侧基的构型对其影响很小,而由模板分子造成的手性空穴对手性识别性能起着关键的作用。当侧基构型与模板分子构型相同时,所得到的双手性聚合物的手性识别能力可以具有叠加增效作用,这对于开发更具高效分离效果的手性高分子材料具有重要的理论和现实意义。
| [1] |
SHEN J, OKAMOTO Y, Efficient separation of enantiomers using stereoregular chiral polymers[J]. , Efficient separation of enantiomers using stereoregular chiral polymers[J]. Chem Rev, 2016, 116(3): 1094-1138. DOI:10.1021/acs.chemrev.5b00317 |
| [2] |
LI J J, DU M, ZHAO Z Q, et al. Cyclopolymerization of disiloxane-tethered divinyl monomers to synthesize chirality-responsive helical polymers[J]. Macromolecules, 2016, 48(2): 445-454. |
| [3] |
WU D R, YIP S H, LI P, et al. From analytical methods to large scale chiral supercritical fluid chromatography using chlorinated chiral stationary phases[J]. J Chromatogr A, 2016(1432): 122-131. |
| [4] |
REUTHER J F, SIRIWARDANE D A, KULIKOV O V, et al. Facile synthesis of rod-coil block copolymers with chiral, helical polycarbodiimide segments via postpolymerization CuAAC "Click" coupling of functional end groups[J]. Macromolecules, 2016, 48(10): 3207-3216. |
| [5] |
LUO X L, CAO Y, WANG T, et al. Host-guest chirality interplay:A mutually induced formation of a chiral ZMOF and its double-helix polymer guests[J]. JACS, 2016, 138(3): 786-789. DOI:10.1021/jacs.5b12516 |
| [6] |
SUEDEE R, NAKLUA W, LAENGCHOKSHOI S, et al. Investigation of a self-assembling microgel containing an (S)-propranolol molecularly imprinted polymer in a native tissue microenvironment:part I.preparation and characterization[J]. Process Biochem, 2015, 50(4): 517-544. DOI:10.1016/j.procbio.2015.01.003 |
| [7] |
AHMADIA F, YAWARI E, NIKBAKHT M. Computational design of an enantioselective molecular imprinted polymer for the solid phase extraction of S-warfarin from plasma[J]. J Chromatogr A, 2014, 1338(7): 9-16. |
| [8] |
ZAIDI S A, CHEONG W J. Preparation of an open-tubular capillary column with a monolithic layer of S-Ketoprofen imprinted and 4-Styrenesulfonic acid incorporated polymer and its enhanced chiral separation performance in capillary electrochromatography[J]. J Chromatogr A, 2009(1216): 2947-2952. |
| [9] |
HAMDAN S, MOORE L, LEJEUNE J, et al. Ionic liquid crosslinkers for chiral imprinted nano GUMBOS[J]. J Colloid Interface Sci, 2016(463): 29-36. |
| [10] |
KUPAI J, ROJIK E, HUSZTHY P, et al. Role of chirality and macroring in imprinted polymers with enantiodiscriminative power[J]. ACS Appl Matrer Inter, 2015, 7(18): 9516-9525. DOI:10.1021/acsami.5b00755 |
| [11] |
DONG H X, ZHENG M X, OU Y L, et al. A chiral stationary phase coated by surface molecularly imprinted polymer for separating 1, 1'-Binaphthalene-2, 2'-diamine enantiomer by high performance liquid chromatography[J]. J Chromatogr A, 2015(1376): 172-176. |
| [12] |
LACOB B C, BODOKI E, FLOREA A, et al. Simultaneous enantiospecific recognition of several β-blocker enantiomers using molecularly imprinted polymer-based electrochemical sensor[J]. Anal Chem, 2015, 87(5): 2755-2763. DOI:10.1021/ac504036m |
| [13] |
BRUNKAN N M, GAGNéMR. Effect of chiral cavities associated with molecularly imprinted platinum centers on the selectivity of ligand-exchange reactions at platinum[J]. J Am.Chem Soc, 2000, 122(26): 6217-6225. DOI:10.1021/ja000462c |
| [14] |
KARFA P, ROY E, PATRA S, et al. A fluorescent molecularly-Imprinted polymer gate with temperature and pH as inputs for detection of alpha-fetoprotein[J]. Biosens Bioelectron, 2015(78): 454-463. |
 2016, Vol. 30
2016, Vol. 30


