| pH胁迫提高微生物次级代谢产物合成的研究进展 |
2. 齐鲁工业大学(山东省科学院) 微生物工程重点实验室, 济南 250353
2. Provincial Key Laboratory of Microbial Engineering, Qilu University of Technology(Shandong Academy of Sciences), Jinan 250353, China
目前已有超过2万种具有生物活性的微生物次级代谢产物[1], 微生物次级代谢物主要包括抗生素[2]、色素、毒素、生态竞争和共生效应物、信息素、酶抑制剂、免疫调节剂、受体拮抗剂、杀虫剂、抗肿瘤制剂和动植物生长促进剂等, 次级代谢产物常常在不同生物体的防御系统中发挥重要作用, 被广泛应用于农业、畜牧业、医药健康行业[3-6], 对人类的生产生活至关重要。微生物次级代谢产物正在发挥越来越重要的作用, 提升微生物次级代谢产物产量成为热门研究领域。
微生物次级代谢产物的形成受到营养物质、生长速率、反馈控制、酶失活和酶诱导的调节[7], 开发高产次级代谢产物菌株的遗传方法不断出现, 突变和基因重组等互补技术的结合能够使许多初级和次级代谢物以及蛋白质生物制药和酶的产量显著提高[8], 已被证明成功的有代谢工程、核糖体工程、组合生物合成和分子育种技术。面对市场日益增长的微生物次级代谢产物的需求, 发掘提高微生物发酵中次级代谢产物产量的新策略是十分必要的。研究表明, 酸性和碱性pH冲击[9](短时pH胁迫)、温度胁迫、盐胁迫以及氧化胁迫等都能够提高微生物次级代谢产物的产量。微生物发酵过程中, pH作为发酵过程关键因素之一, 对微生物生长和产物积累有较大影响。当微生物生长环境的pH与其最适pH有较大偏差时, 会导致pH胁迫的产生, pH胁迫作为一种发酵策略已被广泛接受, 并成功地用于改善微生物次级代谢产物产量。研究pH胁迫对微生物合成次级代谢产物的影响并揭示相关的作用机制, 有助于发酵生产工艺的改进和菌种的定向改造, 对提高微生物发酵中次级代谢产物产量具有十分重要的意义。
本文的目的是总结pH胁迫策略在微生物发酵领域的优势, 它不仅可以增强微生物对外界pH胁迫的耐受性, 还可以提高微生物的次级代谢产物合成能力。将pH胁迫作为环境压力对微生物进行适应性进化, 可以使微生物发生基因水平的突变, 提高微生物的胁迫耐受性和次级代谢产物的合成能力, 进一步开拓pH胁迫在微生物育种方面的应用。
1 微生物对pH胁迫的响应当微生物在胁迫环境下, 自身生理应激机制会及时响应, 以适应在逆境下带来的生长压力[10]。pH胁迫作为一种环境信号, 通过一系列信号转导系统传递启动相关基因的转录, 刺激微生物应答机制的产生。
1.1 微生物信号转导系统对pH胁迫的响应微生物利用复杂的调节网络对环境刺激或胁迫(如营养缺乏、盐休克、氧化应激、渗透应激、酸性胁迫和碱性胁迫)作出反应。当细胞膜受到外界环境的刺激时, 细胞壁接收到的应激信号通过信号转导系统的作用穿过细胞膜进入细胞内空间, 引起相关基因的转录和表达, 从而响应外界的环境刺激。细菌主要利用两种信号转导系统来感知和响应环境胁迫: 双组分系统(TCS)和胞外功能(ECF)σ因子。这两种系统在功能上是相似的, 因为它们通常通过膜蛋白(传感器激酶或抗σ因子)作为压力传感器和转录因子(响应调节器或σ因子)来调节基因表达。
pH胁迫作为一种环境信号, 可以通过一系列信号转导系统传递至细胞激起应答机制, TCSs和σ因子[11]是信号转导的组成部分, pH冲击后, TCSs和σ因子发生不同程度的转录或表达差异。PAN等[12]在pH冲击后发现6个与信号转导途径相关的基因(mprA、mprB、pepD、desK、desR、sigE)上调, 基因回补和过表达表明mprA、mprB和pepD对pls(ε-聚赖氨酸合成酶基因)有正调控作用。在MO等[13]的一项研究中, 酸性pH冲击后TCSs中CseC/CseB和VanS/VanR的转录大幅上调, 这两种TCSs与抗细胞壁水解的自我保护密切相关。JIANG等[14]发现S.hygroscopicus 5008在受到碱性pH冲击后, 细胞壁接收到的胁迫信号通过双组分系统传导, 并调控(ECF) σ因子, 从而引起下游基因的转录, 激活细胞防御系统。
不同的σ因子对应不同类型的环境胁迫, σ因子协调基因表达, 以响应各种环境和内源性信号, 通过激活与次级代谢物生物合成相关的基因, 在次级代谢物的合成中发挥重要作用。已有研究表明, 分枝杆菌的σ因子SigF和鼠伤寒沙门氏菌的RpoS是耐受酸性pH胁迫所必需的。为了深入研究pH冲击对σ因子的影响, KIM等[15]对pH冲击后S.coelicolor A3(2)中所有σ因子的转录水平进行了分析, pH冲击后多达43个σ因子的转录上调, 与放线菌素合成相关的σ因子基因如sigH、sigR、sigG、sigB、hrdD和hrdB都产生不同程度的上调。其中, HrdD可以识别actII-orf4的启动子, 该启动子可调节放线菌素的产生。
1.2 微生物次级代谢产物合成途径对pH胁迫的响应pH冲击作为环境胁迫的一种, 已经被多次应用于提高发酵过程中次级代谢产物的产量。表 1对pH胁迫下微生物发酵中次级代谢产物产量提升的相关典型案例进行了总结。微生物次级代谢产物的合成途径是十分复杂的, 其合成酶受多种调控因子的影响, pH胁迫对微生物发酵产生的影响最终体现在合成酶和调控因子基因的转录和表达上。PAN等[16]发现, pH冲击后S.albulus M-Z18的ε-聚赖氨酸合成酶的转录水平和酶活力水平都得到显著提升。KIM等[15]对S.coelicolor A3(2)进行酸性pH冲击后, 放线菌素合成与分泌明显提高, 研究发现, pH冲击后4个参与放线菌素生物合成的调控因子基因pkaG、afsR、afsS和actII-orf4的转录更早上调, 而且pH冲击显著增强了放线菌素生物合成基因簇的转录。在另外一项研究中, JIANG等[17]发现, pH冲击后S.hygroscopicus 5008表达差异显著的基因主要负责代谢、信号传导、以及信息存储和处理, 且大多数井冈霉素生物合成基因的转录水平得到加强;与代谢相关的表达差异显著的基因中负责编码细胞膜上阳离子转运atp酶的转录上调, 有利于营养吸收和次级代谢产物的分泌。此外, MO等[18]发现pH冲击后转录激活因子redD的转录水平增加, redD转录增强与S.coelicolor M511的十一烷基灵菌红素产量增加一致。pH冲击上调了微生物次级代谢产物调控因子的表达, 激活微生物次级代谢途径中沉默的基因簇, 使之转录和表达, 提高次级代谢途径的代谢活性。
| 表 1 pH胁迫对微生物次级代谢产物产量的影响 |
 |
2 适应性进化对微生物的影响
短期环境胁迫增强微生物对环境胁迫的耐受性, 提高微生物合成次级代谢产物的能力, 相关基因和转录因子的表达也大幅上调。但是短期环境胁迫中微生物发生的仅仅是表型上的变化, 基因型并没有发生变化。上文提到pH冲击作为一种特殊的短期环境胁迫可以提高微生物的菌体活性及合成次级代谢产物的能力, pH冲击后, 微生物的基因型并没有发生变化, 发生的表型变化并不具备遗传能力, 传代培养后菌体又恢复至原有的性状[18]。长期的环境胁迫可以使微生物发生基因突变, 这使通过环境胁迫改造微生物成为可能。
适应性实验室进化是生物学研究中常用的一种方法, 旨在深入了解在特定生长条件下, 微生物种群在长期选择过程中积累的分子进化的基本机制和适应性变化[19]。pH适应性进化即通过施加外源pH压力对微生物造成胁迫, 促使微生物发生突变, 通过筛选, 使得适应环境的突变得以保存且继续突变, 从基因水平提高微生物对于环境胁迫的耐受性以及发酵能力(图 1介绍了适应性实验室进化的基本流程)。适应性实验室进化相对于合理的工程策略和特定酶的定向修饰, 优势在于让许多不同的基因和调控区域同时发生非直觉的有益突变[20], 这为改造微生物提供了更多的可能。pH适应性进化在微生物发酵上的应用主要体现在提升微生物对环境胁迫的耐受性和提高发酵产物合成能力上。
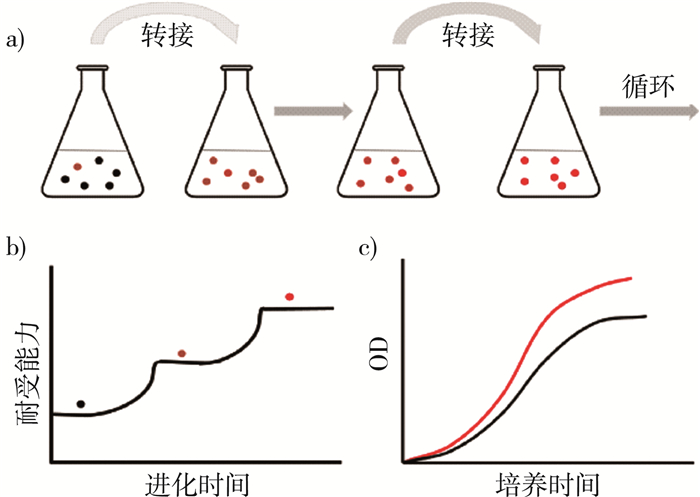 |
| 注: a)转接过程;b)耐受能力;c)菌体干重。 图 1 适应性实验室进化示意图 |
2.1 pH适应性进化提高微生物耐受性
当微生物处于一定的胁迫压力下, 如生物分子胁迫、非生物分子胁迫或特定的抑制剂等, 细胞就会做出应激反应, 从而导致细胞结构和生理特性的变化以及代谢失调的产生, 最终使得菌株生长受到明显的抑制。目前的研究表明, 适应性实验室进化技术能够克服上述不利影响, 从而增加工业或实验室中有价值的菌株在胁迫环境下的耐受性和稳定性[21]。表 2对pH胁迫适应性进化提高微生物耐受性的相关典型案例进行了总结。适应性进化技术为我们了解微生物菌株的耐受机制以及构建更健壮的微生物菌株提供了一个新的思路。
| 表 2 pH胁迫适应性进化提高微生物耐受性 |
 |
2.2 pH适应性进化提高微生物次级代谢产物合成能力
目前, 适应性进化的研究主要集中在提升微生物对于胁迫的耐受性, 通过适应性进化策略提高微生物次级代谢产物合成能力的研究甚少。SONG等[22]采用低温适应性实验室进化技术, 通过提高膜通透性来提高Glarea lozoyensis C的肺炎球菌素B0生产能力。进化菌株(ALE50)的肺炎球菌素B0产量达到2.131 g/L, 比起始菌株(ALE0)高出32%。此外, JIANG等[23]建立了常压室温等离子体物理诱变(ARTP)和H2O2驱动的适应性进化的组合策略。通过多轮ARTP和H2O2的交叉处理, 摇瓶中虾青素的产量达到65.9 mg/L, 与起始菌株相比, 增加了近4倍。在另一项研究, WANG等[24]通过适应性进化获得了一株利用甘油生产高透明度、低粘度黄原胶的突变株, 黄原胶产量达到11.0 g/L。研究发现, 进化菌株中与甘油代谢相关的基因(glpF、glpK、glpD和fbp)的转录水平均高于起始菌株。适应性进化不仅可以获得突变株, 通过与高通量DNA测序及适当的生物信息学工具相结合, 可以为接下来的基因工程提供新思路。
目前, ε-聚赖氨酸的产生菌主要为链霉菌, 其最适的生长pH偏中性。然而, 在ε-聚赖氨酸的生物合成过程中产生菌则面临着自发酸胁迫: 随着发酵过程的进行, 环境pH最终自发下降到3.0左右;而且, ε-聚赖氨酸合成的最适pH(pH 4.0)对产生菌而言也是一种酸胁迫环境。酸胁迫会引起胞内pH的下降, 导致一些对酸敏感的酶失活、造成细胞膜和胞内大分子的结构损伤, 最终引起细胞的死亡。因此, 提高ε-聚赖氨酸产生菌的酸耐受性, 有助于提高ε-聚赖氨酸的发酵产量。REN等[25]将从土壤中筛选到的S.diastatochromogenes T17为起始菌株, 对其进行酸性适应性进化, 得到耐酸性能提高的进化菌株AE44、AE51以及AE56。与原始菌株T17相比, 进化菌株在低pH条件下生长速度更快, 产孢能力更强, 菌体干重分别提高了32%、40%和60%(图 2)。摇瓶发酵中, AE44、AE51和AE56的ε-PL产量较原始菌株分别提高了48.98%、71.43%和95.92%, 进化菌株传代培养6代后, 发酵能力没有退化, 证明了进化菌株的遗传性能稳定(未发表数据)。该研究表明, 通过pH适应性进化从基因层次上提高微生物合成次级代谢产物的能力是可行的。
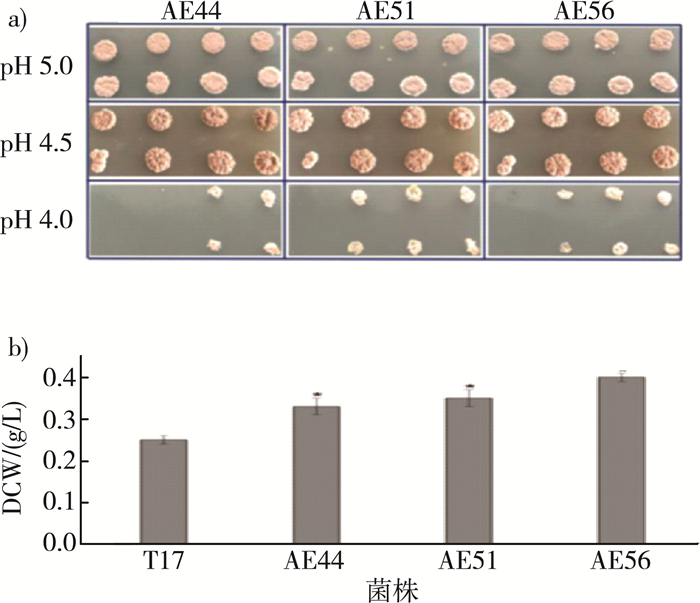 |
| 注: a)梯度酸胁迫下不同菌株菌落的差异;b)酸胁迫下不同菌株菌体干重的差异。 图 2 酸胁迫条件下不同菌株的生长情况[25] |
将pH适应性进化应用到提高微生物次级代谢产物合成能力领域中, 将进一步拓展pH胁迫在微生物发酵和育种方面的作用。通过高通量DNA测序与适当的生物信息学工具对pH适应性进化产生的突变进行识别, 通过基因工程将所需的突变引入到感兴趣的菌株中, 从而进行因果决定或表型改变, 将为分子育种技术提供新的方向。
3 总结pH胁迫作为一种环境应激源, 对工业微生物的生产和性能有重要影响, 在发酵生物技术中具有广阔的应用前景。本文较为系统地综述了pH胁迫策略在微生物发酵过程中产生的影响, 提高微生物菌体活性和微生物合成次级代谢产物的能力。此外, 本文还详细介绍了pH适应性进化提高微生物耐受性以及其他适应性进化提高微生物发酵中次级代谢产物合成的研究。
将pH适应性进化应用到提高微生物刺激代谢产物合成能力这一领域中, 将进一步拓展pH胁迫在微生物发酵和育种方面的作用。伴随着DNA测序、生物信息学和基因工程等技术的飞速发展, pH适应性进化所带来的非直觉的有益突变, 将为分子育种技术提供新的靶点和方向。我们相信, pH适应性进化一定会在提升微生物次级代谢产物合成能力这一领域发挥积极的作用。
| [1] |
赵江华, 房欢, 张大伟. 微生物次级代谢产物生物合成的研究进展[J]. 生物技术通报, 2020, 36(11): 141-147. |
| [2] |
YANG L Y, WANG J D, ZHANG J, et al. New nemadectin congeners with acaricidal and nematocidal activity from Streptomyces microflavus neau3 Y-3[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(20): 5710-5713. |
| [3] |
程举, 张孝龙, 赵江源, 等. 近年链霉菌次生代谢产物研究进展[J]. 中国抗生素杂志, 2015, 40(10): 791-800. DOI:10.3969/j.issn.1001-8689.2015.10.015 |
| [4] |
HE Y, WANG B, CHEN W, et al. Recent advances in reconstructing microbial secondary metabolites biosynthesis in aspergillus spp[J]. Biotechnology Advances, 2018, 36(3): 739-783. |
| [5] |
WEI X, TIAN G, JI Z, et al. A new strategy for enhancement of poly-γ-glutamic acid production by multiple physicochemical stresses in bacillus licheniformis[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(4): 709-713. |
| [6] |
KIM Y J, SONG J Y, MOON M H, et al. pH shock induces overexpression of regulatory and biosynthetic genes for actinorhodin productionin streptomyces coelicolor A3(2)[J]. Appl Microbiol Biotechnol, 2007, 76(5): 1119-1130. DOI:10.1007/s00253-007-1083-9 |
| [7] |
SUN X M, REN L J, JI X J, et al. Adaptive evolution of schizochytrium sp.by continuous high oxygen stimulations to enhance docosah exaenoic acid synthesis[J]. Bioresour Technol, 2016, 211: 374-381. DOI:10.1016/j.biortech.2016.03.093 |
| [8] |
PAN L, CHEN X S, WANG K F, et al. Mechanisms of response to pH shock in microbial fermentation[J]. Bioprocess and Biosystems Engineering, 2019, 43(3): 361-372. DOI:10.1007/s00449-019-02232-4 |
| [9] |
REN X D, CHEN X S, TANG L, et al. Physiological mechanism of the overproduction of ε-poly-L-lysine by acidic pH shock in fed-batch fermentation[J]. Bioprocess Biosyst Eng, 2015, 38(11): 2085-2094. DOI:10.1007/s00449-015-1448-x |
| [10] |
蒋晶. 碱性pH冲击对井冈霉素发酵的影响及其机制探讨[D]. 杭州: 浙江大学, 2017: 14-62.
|
| [11] |
YEO K J, KIM E H, HWANG E, et al. pH-dependent structural change of the extracellular sensor domain of the DraK histidine kinase from streptomyces coelicolor[J]. Biochemical & Biophysical Research Communications, 2013, 431(3): 554-559. |
| [12] |
潘龙. 低pH冲击促进小白链霉菌高效积累ε-聚赖氨酸的生理机制研究[D]. 无锡: 江南大学, 2020.
|
| [13] |
MO S, KIM J H, OH C H. Different effects of acidic pH shock on the prodiginine production in streptomyces coelicolor M511 and SJM1 mutants[J]. J Microbiol Biotechnol, 2013, 23(10): 1454-1459. DOI:10.4014/jmb.1307.07067 |
| [14] |
JIANG J, SUN Y F, TANG X, et al. Alkaline pH shock enhanced production of validamycin A in fermentation of streptomyces hygroscopicus[J]. Bioresour Technol, 2018, 249: 234-240. DOI:10.1016/j.biortech.2017.10.012 |
| [15] |
KIM Y J, MOON A N, SONG J Y, et al. Gene-expression analysis of acidic pH shock effects on two-component systems in streptomyces coelicolor[J]. Biotechnology and Bioprocess Engineering, 2009, 14(5): 584-590. DOI:10.1007/s12257-008-0260-8 |
| [16] |
PAN L, CHEN X, WANG K, et al. Understanding high epsilon-poly-L-lysine production by streptomyces albulus using pH shock strategy in the level of transcriptomics[J]. Journal of Industrial Microbiology & Biotechnology, 2019, 46(12): 1781-1792. DOI:10.1007/s10295-019-02240-z |
| [17] |
WANG J, YUAN H, WEI X, et al. Enhancement of poly-γ-glutamic acid production by alkaline pH stress treatment in bacillus licheniformis WX-02[J]. Journal of Chemical Technology & Biotechnology, 2016, 91(9): 2399-2403. |
| [18] |
LEE S, KIM P. Current status and applications of adaptive laboratory evolution in industrial microorganisms[J]. Journal of Microbiology and Biotechnology, 2020, 30(6): 793-803. DOI:10.4014/jmb.2003.03072 |
| [19] |
FLETCHER E, FEIZI A, BISSCHOPS M, et al. Evolutionary engineering reveals divergent paths when yeast is adapted to different acidic environments[J]. Metabolic Engineering, 2016, 39: 19-28. |
| [20] |
KARINA S, KUNKA A, JESSIE M, et al. Acid experimental evolution of the extremely halophilic archaeon halobacterium sp.3 NRC-1 selects mutations affecting arginine transport and catabolism[J]. Frontiers in Microbiology, 2020, 11: 535. DOI:10.3389/fmicb.2020.00535 |
| [21] |
MING H, XU D, GUO Z, et al. Adaptive evolution of lactobacillus casei under acidic conditions enhances multiple-stress tolerance[J]. Food Science and Technology Research, 2016, 22(3): 331-336. DOI:10.3136/fstr.22.331 |
| [22] |
SONG P, ZHANG K, ZHANG S, et al. Enhancement of pneumocandin B0 production in glarea lozoyensis by low-temperature adaptive laboratory evolution[J]. Front Microbiol, 2018, 9: 2788. DOI:10.3389/fmicb.2018.02788 |
| [23] |
JIANG G, YANG Z, WANG Y, et al. Enhanced astaxanthin production in yeast via combined mutagenesis and evolution[J]. Biochemical Engineering Journal, 2020, 156. |
| [24] |
WANG Z, WU J, ZHU L, et al. Activation of glycerol metabolism in xanthomonas campestris by adaptive evolution to produce a high-transparency and low-viscosity xanthan gum from glycerol[J]. Bioresource Technology, 2016, 211: 390-397. DOI:10.1016/j.biortech.2016.03.096 |
| [25] |
任喜东, 于超, 王晨莹, 等. 适应性进化提高淀粉酶产色链霉菌T17自发酸胁迫抗性的生理机制[J]. 食品科学, 2020, 41(12): 106-112. |
 2021, Vol. 35
2021, Vol. 35


