| 球孢白僵菌Ron1缺失突变体的转录组分析 |
酿酒酵母(Saccharomyces cerevisiae) Ndt80是减数分裂特异转录因子, 也是Ndt80家族最先被研究的蛋白, 在有性孢子形成缺陷突变株的遗传筛选中被鉴定[1]。自Ndt80蛋白的功能在酿酒酵母首次被鉴定以来, Ndt80蛋白家族在其他真菌中的功能也相继被鉴定。例如, 通过对粗糙脉孢菌(Neurospora crassa)菌丝融合后的非自我识别系统的遗传分析鉴定出了Ndt80家族转录因子VIB-1[2]。在构巢曲霉(Aspergillus nidulans)中, 通过对胞外蛋白酶对碳、氮和硫饥饿反应的调控遗传分析, 鉴定了Ndt80家族基因xprG[3]。近年来, Ndt80蛋白家族在人类病原真菌白色念珠球菌(Candida albicans)[4]、植物病原真菌稻瘟病菌(Magnaporthe oryzae)[5]等真菌中的生物学功能相继被报道。大多数真菌谱系中都存在编码Ndt80蛋白的基因, 但在许多担子菌门中并不存在。不同真菌中编码Ndt80蛋白的基因从0到7个不等[6]。在昆虫病原真菌白僵菌(Beauveria bassiana)中有3个编码Ndt80蛋白的基因, 目前只有一个被鉴定。Ndt80家族蛋白Ron1在球孢白僵菌侵染宿主的过程中的作用目前仍不清楚。球孢白僵菌是目前实际应用广泛的昆虫病原真菌, 其作为一种研究真菌与宿主互作的模式真菌也被广泛研究[7]。本文在球孢白僵菌中对Ndt80家族蛋白Ron1缺失突变体进行了转录组分析, 并依据Ndt80家族蛋白在致病真菌中的作用对Ndt80蛋白在昆虫病原真菌生物防治潜力的贡献进行分析与展望。
1 实验材料与方法 1.1 试验菌株本实验所用的野生型球孢白僵菌为本实验室所保存的Beauveria bassiana ARSEF 2860菌株(WT), 基因缺失菌株(ΔRon 1)在此菌株的基础上构建。
1.2 基因敲除本实验通过农杆菌(Agrobacterium tumefacien)介导的真菌转化的方法来构建BbRon 1基因的缺失突变体。具体方法参照Wang等[8]。
1.3 转录组测序球孢白僵菌在模仿真菌宿主表皮的几丁质培养基中培养五天后, 采用TRIzol法提取菌丝中的RNA并处理。首先, 利用DNA探针杂交rRNA, RNaseH选择性消化DNA/RNA杂交链, DNaseI消化掉DNA探针, 纯化后即得到所需RNA。然后, 用打断buffer把上述所得RNA片段化, 之后进行反转录, 再合成cDNA二链形成双链DNA。把合成的双链DNA末端补平并5’端磷酸化, 3’端形成突出一个“A”的粘末端, 再连接一个3’端有凸出“T”的鼓泡状的接头。所得产物通过特异的引物进行PCR扩增。扩增产物热变性后用桥式引物将单链DNA环化得到单链环状DNA文库并上机测序。测序得到的数据经过滤后比对到参考基因组上, 并对差异表达基因进行富集和聚类分析。
2 结果与分析 2.1 显著差异基因的数量对本实验中的6个样品(三个野生型菌株和三个BbRon 1基因缺失菌株)进行转录本对比发现, 共有4 864个差异表达基因(|Log2 FC|>1, Q≤0.001), 占球孢白僵菌基因总数的49.4%。其中上调基因1 036个, 下调基因3 828个, 如图 1所示。
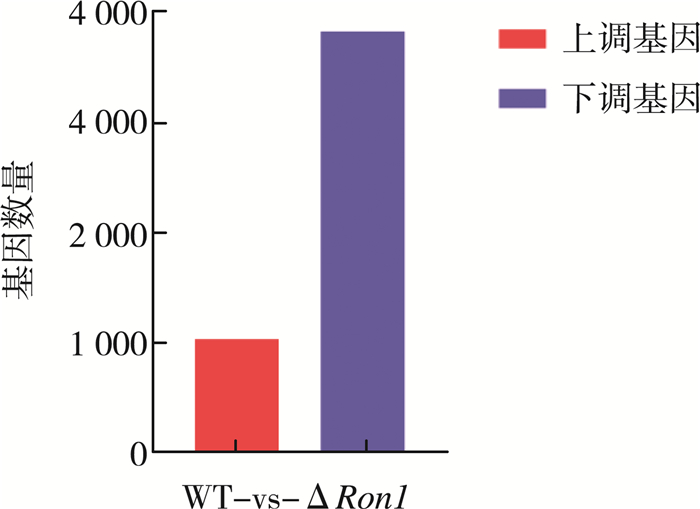 |
| 图 1 差异表达基因的数量 |
2.2 差异表达基因的聚类分析
根据分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)三大功能类将4 864个差异表达基因进行GO分类(Gene Ontology), 共有37个二级条目, 如图 2所示。其中, 注释为分子功能的差异表达基因分布在11个二级分类条目中。在这11个二级分类条目中, 催化活性(catalytic activity)条目包含的差异表达基因最多, 有1 891个。其次是结合(binding)、转运活性(transporter activity)和转录调控活性(transcription regulator activity)三个二级条目各有1 412、203和195个差异表达基因。注释为细胞组分的差异表达基因分布在12个二级分类条目中, 注释为膜(membrane)、膜的一部分(membrane part)和细胞(cell)条目的差异表达基因最多, 分别有1 218、1 176和946个。注释为生物过程的差异表达基因分布在最多的14个二级条目中, 其中代谢过程(metabolic process)、细胞过程(cellular process)和定位(localization)三个二级条目所包含的差异表达基因最多。
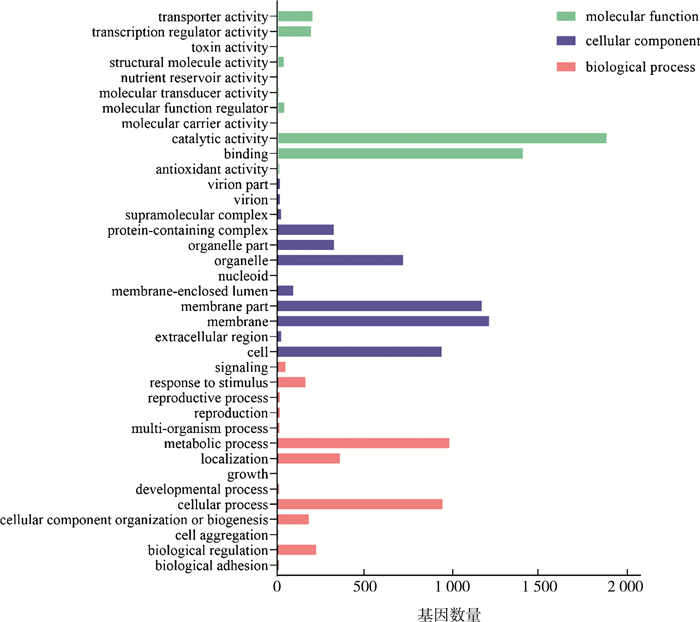 |
| 图 2 差异表达基因的GO分类 |
根据Kyoto Encyclopedia of Genes and Genomes (KEGG)注释结果以及官方分类, 我们将差异基因进行生物通路分类。一共可分为5大类, 分别是: 细胞过程(Cellular Processes)、环境信息处理(Environmental Information Processing)、遗传信息处理(Genetic Information Processing)、代谢(Metabolism)和有机系统(Organismal Systems)。如图 3所示, 差异表达基因主要分布在代谢分支中。其中碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)和脂质代谢(Lipid metabolism)是真菌生命活动所必须的。
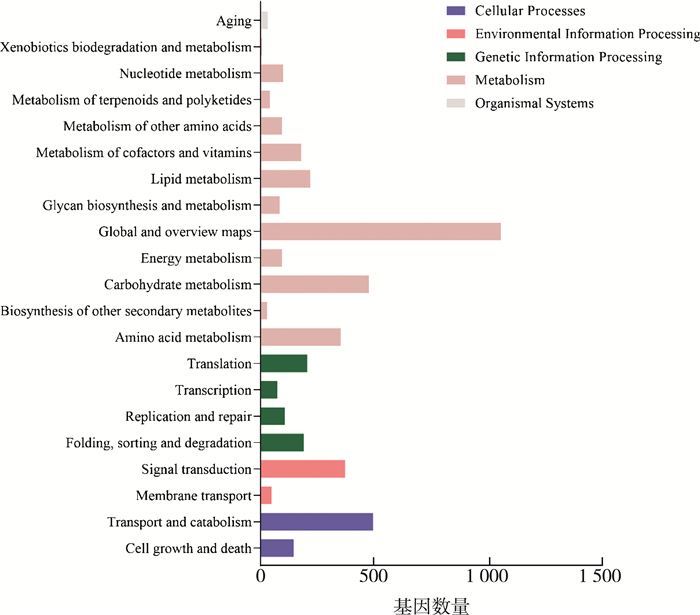 |
| 图 3 差异表达基因的KEGG分类 |
Ron 1的缺失导致大量的调控真菌代谢相关的基因的表达量下降, 这表明Ron 1在真菌各种代谢的过程中有着十分重要的作用。
3 讨论 3.1 Ron1参与真菌无性发育Ndt80家族蛋白在许多真菌中参与无性发育的调控。我们之前的研究发现, 在球孢白僵菌中编码Ndt80蛋白的基因BbTFO 1的缺失导致了分生孢子在前期产生的减少[8]。Dementhon等[9]研究发现粗糙脉孢菌Ndt80蛋白编码基因vib- 1的突变导致分生孢子稀疏, 气生菌丝的伸长受到阻碍。烟曲霉菌(Aspergillus fumigatus) Ndt80蛋白编码基因xprG缺失突变体产生的分生孢子梗更小, 分生孢子更少, 更脆弱[10]。然而, xprG在里氏木霉(Trichoderma reesei)中的同源基因Ron 1的敲除导致分生孢子的产量上升[11]。这表明Ndt80蛋白可能从正向或负向调控不同真菌的无性生殖。本实验中, 经过转录组分析发现, 在Ron 1缺失突变体中大量调控真菌无性孢子发育和成熟的基因表达水平都显著下降。这表明Ron 1在球孢白僵菌中参与调控真菌的无性发育。
3.2 Ron1参与真菌胞外水解酶的产生在很多Ndt80蛋白家族编码基因缺失的真菌中存在胞外水解酶产生的缺陷。在构巢曲霉中, 通过对胞外蛋白酶对碳、氮和硫饥饿反应的调控的遗传分析, 鉴定了Ndt80家族基因xprG[3]。人类病原真菌烟曲霉菌中, xprG的缺失导致在真菌蛋白酶产量的下降, 蛋白酶是真菌在宿主体内成功定殖必不可少的[10]。xprG在里氏木霉里的同源基因Ron 1并不参与胞外蛋白酶的产生。Hutchison等[12]研究发现粗糙脉孢菌中Ndt80蛋白vib-1在碳源和氮源匮乏的条件下参与调控蛋白酶的产生。在白色念珠球菌的三个编码Ndt80蛋白的基因中, 只有Ndt80参与调控蛋白酶的活性[13]。
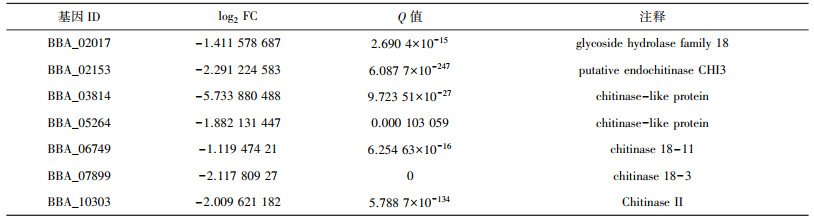
Ndt80蛋白不仅参与真菌胞外蛋白酶的产生, 在一些真菌中还参与调控其他胞外水解酶的产生, 例如纤维素酶和几丁质酶的产生。Xiong等[14]研究发现当有外界纤维素诱导时, Ndt80蛋白vib-1通过调控下游基因Cre-1的表达参与调控粗糙脉孢菌纤维素酶的产生。vib-1的敲除导致纤维素酶产生受到抑制进而难以降解植物细胞壁。在里氏木霉中, 对vib-1基因超表达使得真菌纤维素酶活性增加了3倍并且其他部分水解酶的活性也随之上升, 例如木聚糖酶[15]。Katz等[16]研究发现构巢曲霉Ndt80蛋白xprG能够调控几丁质酶基因ChiB的表达。在本研究中, 转录分析发现在球孢白僵菌Ron1缺失突变体中大量几丁质酶基因的表达量都显著下调, 如表 1所示。这表明在球孢白僵菌中, Ndt80家族蛋白Ron1参与了真菌几丁质酶的产生。
| 表 1 ΔRon 1菌株中下调的几丁质酶基因 |
 |
3.3 Ron 1参与N-乙酰氨基葡萄糖的代谢
在植物中, N-乙酰氨基葡萄糖以游离的形式存在或者在蛋白质的O-和N-糖基化后与GPI锚定连接[17]。在昆虫中, N-乙酰氨基葡萄糖大量存在于昆虫的角质层, 这些N-乙酰氨基葡萄糖大多以几丁质的形式存在。此外, 几丁质也是真菌细胞壁的主要成分。N-乙酰氨基葡萄糖也是脊椎动物组织细胞外基质中的一种糖。对于大多数病原真菌, N-乙酰氨基葡萄糖时其侵染宿主过程中的重要营养来源。
在子囊菌门中, 一般有一个Ndt80家族蛋白是N-乙酰氨基葡萄糖分解代谢途径基因的转录激活因子。Bhatt等[5]通过酵母单杂交实验在稻瘟病菌验证了转录因子Ndt80能够直接与N-乙酰氨基葡萄糖分解代谢基因MoDac、MoDeam和MoHex启动子前端的顺式作用元件结合来激活它们的表达。在里氏木霉中, Ndt80家族蛋白Ron1在N-乙酰氨基葡萄糖的诱导下激活N-乙酰氨基葡萄糖利用所需要的基因[11]。在白色念珠球菌中, Ron 1的缺失导致真菌无法在乙酰氨基葡萄糖为碳源的培养基上生长[18]。在本研究中Ron 1的缺失不仅导致几丁质酶的活性下降, 而且也导致参与乙酰氨基葡萄糖转运和代谢的基因转录水平下降, 如表 2所示。
| 表 2 ΔRon 1菌株中下调的N-乙酰氨基葡萄糖代谢相关基因 |
 |
3.4 Ron1参与真菌真菌毒力调控
近年来, Ndt80蛋白家族对真菌毒力的研究在人类机会病原真菌白色念珠球菌中被广泛报道。其中两种蛋白Ndt80和Rep1首次被鉴定为药物外排转运蛋白CDR1和MDR1的调节因子[18-19]。Ndt80基因的缺失使得白色念珠球菌对抗真菌药物的抗性降低, 进而使得它在宿主中的致病能力下降。此外, 白色念珠球菌从芽殖酵母(budding yeast)状态转换为菌丝生长的能力对真菌入侵宿主十分重要[20]。研究发现Ndt80和Ron 1的缺失会影响白色念珠球菌的丝状生长。这是由于CaNdt80能够激活菌丝生长特异性基因的表达[13]。在白色念珠球菌中, CaNdt80蛋白对真菌毒力的作用是Ndt80蛋白家族中唯一被直接测试的蛋白, Ndt80缺失突变体在小鼠感染模型中毒力显著降低[13]。在另一种动物病原真菌烟曲霉菌中, Ndt80样蛋白XprG的缺失在免疫正常的小鼠中并没有导致真菌毒力的下降[10]。在本实验中, Ron 1的缺失导致球孢白僵菌部分控制真菌毒素的基因表达量下降, 如BBA_08222 (log2FC=-3.274, Q=0.000 01)。这表明在球孢白僵菌中, Ron 1参与了真菌毒素的产生。
4 展望自从转录因子Ndt80的功能在酿酒酵母中被鉴定为有丝分裂特异调控因子以来, Ndt80蛋白家族在动物病原真菌和植物病原真菌中的作用也逐渐清晰。它们在有性繁殖、细胞凋亡、N-乙酰氨基葡萄糖传感和分解代谢、次级代谢以及产生胞外水解酶等方面发挥着重要作用。但是大部分Ndt80家族蛋白在昆虫病原真菌中的作用及其作用机制目前还没有被报道。
对于昆虫病原真菌, 决定其生物防治潜力的关键因素之一是真菌能否顺利水解并浸透由蛋白质、几丁质和脂质组成的宿主角质层。这些大分子物质经过进一步分解又是昆虫病原真菌侵染过程的营养来源。其中几丁质水解后产生的N-乙酰氨基葡萄糖被认为是刺激真菌菌丝生长的重要信号分子, 其分解代谢过程在部分真菌中已经被证明受到Ndt80家族蛋白Ron1的调控。之前的研究证明了Ndt80家族蛋白与胞外水解酶的产生密切相关, 但其具体作用机制并不清楚。通过转录组测序、酵母单杂和CHIP-seq等手段研究Ndt80在昆虫病原真菌侵染宿主过程中的作用机制, 对通过基因过程手段提高昆虫病原真菌的生防潜力具有重要意义。
| [1] |
XU L, AJIMURA M, PADMORE R, et al. NDT80, a meiosis-specific gene required for exit from pachytene in Saccharomyces cerevisiae[J]. Molecular & Cellular Biology, 1995, 15(12): 72-81. |
| [2] |
XIANG Q, GLASS N L. The control of mating type heterokaryon incompatibility by vib-1, a locus involved in heterokaryon incompatibility in Neurospora crassa[J]. Fungal Genetics & Biology, 2004, 41(12): 1063-1076. |
| [3] |
KATZ M E, MASOUMI A, BURROWS S R, et al. The Aspergillus nidulans xprF gene encodes a hexokinase-like protein involved in the regulation of extracellular proteases[J]. Genetics, 2000, 156(4): 1559. DOI:10.1093/genetics/156.4.1559 |
| [4] |
KYUNGHUN, MIN, AMY, et al. Genetic analysis of ndt80 family transcription factors in Candida albicans using new CRISPR-Cas9 Approaches[J]. mSphere, 2018, 3: e00545. |
| [5] |
BHATT D N, ANSARI S, KUMAR A, et al. Magnaporthe oryzae MoNdt80 is a transcriptional regulator of GlcNAc catabolic pathway involved in pathogenesis[J]. Microbiological Research, 2020, 239: 126550. DOI:10.1016/j.micres.2020.126550 |
| [6] |
KATZ M E. Nutrient sensing-the key to fungal p53-like transcription factors?[J]. Fungal Genetics and Biology, 2019(124): 8-16. |
| [7] |
钟少雄, 陈玉柳. 昆虫病原真菌的应用研究进展[J]. 福建农业科技, 2012(1): 58-61. DOI:10.3969/j.issn.0253-2301.2012.01.033 |
| [8] |
WANG J J, YIN Y P, SONG J Z, et al. A p53-like transcription factor, BbTFO1, contributes to virulence and oxidative and thermal stress tolerances inthe insect pathogenic fungus, Beauveria bassiana[J]. Plos One, 2021, 16(3): e0249350. DOI:10.1371/journal.pone.0249350 |
| [9] |
DEMENTHON K, IYER G, GLASS N L. VIB-1 is required for expression of genes necessary for programmed cell death inNeurospora crassa[J]. Eukaryotic Cell, 2006, 5(12): 2161-2173. DOI:10.1128/EC.00253-06 |
| [10] |
SHEMESH E., HANF B., HAGAG S., et al. Phenotypic and proteomic analysis of the Aspergillus fumigatus PrtT, XprG and XprG/PrtT protease-deficient mutants[J]. Frontiers in microbiology, 2017(8): 2490. |
| [11] |
KAPPEL L, GADERER R, FLIPPHI M, et al. The N-acetylglucosamine catabolic gene cluster in Trichoderma reesei is controlled by the Ndt80-like transcription factor RON1[J]. Molecular Microbiology, 2016, 99(4): 640-657. DOI:10.1111/mmi.13256 |
| [12] |
HUTCHISON E A, BUECHE J A, GLASS N L. Diversification of a protein kinase cascade: IME-2 is involved in nonself recognition and programmed cell death in Neurospora crassa[J]. Genetics, 2012, 192(2): 467-482. DOI:10.1534/genetics.112.142612 |
| [13] |
DECOUX M, TUDELA F, NIVOIS M, et al. Role of transcription factor CaNdt80p in cell separation, hyphal growth, and virulence in Candida albicans[J]. Eukaryotic Cell, 2010(9): 634-644. |
| [14] |
XIONG Y, SUN J, GLASS N L, et al. VIB1, a Link between glucose signaling and carbon catabolite repression, is essential for plant cell wall degradation by Neurospora crassa[J]. PLoS Genetics, 2014, 10(8): e1004500. DOI:10.1371/journal.pgen.1004500 |
| [15] |
ZHANG F, ZHAO X Q, BAI F W. Improvement of cellulase production in Trichoderma reesei Rut-C30 by overexpression of a novel regulatory gene Trvib-1[J]. Bioresource technology, 2017(247): 676-683. |
| [16] |
KATZ M E, BUCKLAND R, HUNTER C C, et al. Distinct roles for the p53-like transcription factor XprG and autophagy genes in the response to starvation[J]. Fungal Genetics & Biology, 2015(83): 10-18. |
| [17] |
VANHOLME B, VANHOLME R, TURUMTAY H, et al. Accumulation of N-acetylglucosamine oligomers in the plant cell wall affects plant architecture in a dose-dependent and conditional manner[J]. Plant Physiology, 2014, 165(1): 290-308. DOI:10.1104/pp.113.233742 |
| [18] |
CHEN C G, YANG Y L, TSENG K Y, et al. Rep1p negatively regulating MDR1 efflux pump involved in drug resistance inCandida albicans[J]. Fungal Genetics & Biology, 2009, 46(9): 714-720. |
| [19] |
CHEN C G, YANG Y L, SHIH H I, et al. CaNdt80is involved in drug resistance in Candida albicans by regulating CDR1[J]. Antimicrobial agents and chemotherapy, 2004, 48(12): 5-12. |
| [20] |
GULATI M, NOBILE C J. Candida albicans biofilms: development, regulation, and molecular mechanisms[J]. Microbes & Infection, 2016(18): 310-321. |
 2022, Vol. 36
2022, Vol. 36


