2. 中国科学院分子植物科学卓越创新中心;
3. 中国科学院大学
《中华人民共和国生物安全法》(以下简称《生物安全法》)中,“生物安全”是指“国家有效防范和应对危险生物因子及相关因素威胁,生物技术能够稳定健康发展,人民生命健康和生态系统相对处于没有危险和不受威胁的状态,生物领域具备维护国家安全和持续发展的能力。”识别、评估、防范和化解生物安全风险,对于保障人民生命健康、保护生物资源和生态环境、维护国家安全等具有重要的意义。
20世纪下半叶,新生的基因重组技术引发了生物技术的革命性变化并迅速向生命科学研究渗透,进而向产业转化拓展;同时,生命科学研究与生命健康领域的结合也日趋紧密。在此过程中,生物安全问题迅速凸显。发达国家在不断的探索与实践中,逐步制定并完善安全风险的评估与管理指南,建立起生物技术研发、转化及应用的治理体系;我国也在20世纪后期,开始关注并建立相应规范。21世纪以来,快速发展的合成生物学及其技术研发、产品应用的创新可能引发的生物安全问题,对各国已有的治理体系带来了新挑战。[1]在生物技术的很多领域,生物安全与生物伦理问题相互交织,伦理与安全治理缺一不可。本文仅聚焦合成生物学研发和转化阶段的生物安全问题和潜在的风险,分析讨论与之适应的治理策略,以期为我国的生物安全治理体系建设提供参考。
一、生物安全的概念界定与相应监管政策的制定随着生物技术的不断发展,人们对于生物安全问题的认知不断深入,逐步对生物安全、生物安保及其相关问题的共性及特征加以界定、区分,形成了各有侧重的监管策略。[2]
1. 生物安全概念的提出及界定美国国立卫生研究院(NIH)1976年出台的《重组DNA分子研究指南》(NIH Guidelines for Research lnvolving Recombinant DNA Molecules,以下简称《NIH指南》)对“生物安全”(biosafety)的定义是:“为了使病原微生物在实验室受到安全控制而采取的一系列措施”。[3]此后,该概念几经演变,世界卫生组织(WHO)在2004年发布的《实验室生物安全手册》(Laboratory biosafety manual)(第三版)中的定义取得多方共识,即“生物安全是为防止意外接触病原体和毒素或其意外释放而实施的控制原则、技术和做法”。《实验室生物安全手册》(第四版)于2021年更新,该版本中生物安全的防范对象从“病原体和毒素”扩展至“生物因子”(biological agents),即“为防止无意接触生物因子或其意外释放而实施的控制原则、技术和做法”,[4]其中,“生物因子”指有可能导致感染、过敏、毒性或以其他方式对人类、动物或植物造成危害的微生物、病毒、生物毒素、颗粒或其他传染性材料等。
与“生物安全”相比,“生物安保”因防御生物武器的要求,出现在早期的官方文件中。1955年,美国就召开了以“安保在生物战中的作用”为主题的会议。[5]20世纪80年代以后,“生物安保”(biosecurity)的含义从“生物防御”(biodefense)扩展至动物健康和农业等领域,例如美国农业协会将其定义为“保护人类、动物和环境健康免受生物威胁的战略、努力和计划等重要工作”。此后,随着生物技术的发展及各国/地区对该问题的重视,“生物安保”的概念因不同应用场景有不同的表述方式。[6]《生物武器公约》(The Biological Weapons Convention)将其定义为“建立和维持病原微生物、毒素和相关资源的安保和监管的机制”;[7]兽医和农业领域侧重“保护生物资源不受外来或入侵物种的侵害”;公共卫生领域在《实验室生物安全手册》(第三版)中定义为“保护微生物资产不被盗窃、丢失或转移,因为这可能导致这些病原体的不当使用,危害公共卫生”。[8]2006年,WHO发布针对实验室“生物安保”的指南,将其定义为“对实验室内宝贵生物材料的保护、控制和问责,以防止其未经授权的获取、丢失、盗窃、滥用、转移或故意释放”。经济合作与发展组织(OECD)从生物资源中心的管理要求出发,对生物安保的定义为“旨在防止病原体或其部分、产生毒素的生物体以及由生物资源中心持有、转移和/或提供的此类毒素的丢失、被盗、滥用、转移或故意释放的机构和个人的安保措施和程序”。[9]
总的来看,最早关注生物安全问题的是科学共同体,其强调“无意”“意外”接触或释放生物因子带来的风险;而早期关注生物安保问题的主要是政府部门,其强调“故意”“滥用”等主观因素导致的风险。[10]
2. 生物安全监管政策的制定及演变生物技术的发展、生物安全事件的影响,共同推动了生物安全/安保监管政策的制定和演变,分级分类监管策略的形成是其基础。20世纪70年代,重组DNA技术的形成及推广应用,引发了人们对新技术研究与应用可能存在的生物危害等问题的广泛争论。[11]其中,以重组DNA可能带来的安全问题及防范为主题的阿西洛马(Asilomar)会议影响深远。科学家、记者、律师和政府官员等各界人士参会讨论,提出了重组DNA实验研究的指导方针或准则,[12]同时指出,未来的研究和实践或许将表明多数潜在的生物危害比预想的程度和发生的可能性小。[13]此后,会议形成的指导方针递交至NIH,NIH于1976年出台首份针对生物技术安全管理的《NIH指南》。随着技术的发展与应用,《NIH指南》在不断更新,2013年增加了合成核酸分子的内容,2021年添加了针对SARS-CoV-2相关实验操作的安全规定。
我国最早的生物安全管理文件是1993年由国家科学技术委员会发布的《基因工程安全管理办法》(已废止),主要针对利用载体系统的重组体DNA技术,以及利用物理或化学方法把异源DNA直接导入有机体的技术进行管理。为规范生物技术研究开发活动,科学技术部于2017年印发《生物技术研究开发安全管理办法》,明确了从事生物技术研究开发活动各方的职责,并提出风险分级,实行分级管理。
19世纪90年代,欧美国家陆续报道了一些实验室感染事件。进入20世纪后,报道的实验室感染范围逐渐扩大。[14]WHO、美国政府机构先后发布实验室生物安全管理手册,用以指导实验室生物安全管理,减少实验室事故的发生。根据致病能力和传染的危险程度等因素,手册将病原微生物分为4类,规定了微生物实验室的级别界定方法和界定程序,正式将生物实验室分为1-4级,从而使生物安全实验室有了统一的标准和基本原则。与生物安全的分级分类监管策略相匹配,管制清单的提出是生物安保监管体系完善的重要措施。例如,21世纪初发生炭疽袭击事件后,美国先后颁布多部法案,加强对病原体的监管,并要求美国卫生与公共服务部(HHS)和美国农业部(USDA)提出生物制剂管制清单。我国第一版《病原微生物实验室生物安全管理条例》于2004年由国务院印发,同时配套实施了实验室生物安全有关的国家标准。随后,该管理条例在2014年和2018年进行了两次修订。
对农业转基因生物及产品的安全管理,美国主要基于其原有法规,分别由农业部(USDA)、环保署(EPA)和食品药品监督管理局(FDA)负责监管。例如,USDA主要在《植物保护法》(Plant Protection Act)规定下对转基因植物、兽用生物制品等进行监管。欧盟在发布关于有意向环境中释放转基因生物的“指令90/220”后,不断更新与转基因生物安全管理有关的指令,特别强调授权程序以及对人类和动物健康与环境风险的科学评估,尤其是涉及田间试验或投放市场的环节;2018年,欧盟将基因编辑技术纳入转基因安全管理中。我国农业部在1996年出台《农业生物基因工程安全管理实施办法》(已废止),对农业生物基因工程的审批、安全评价系统等做了规定。2001年,国务院发布的《农业转基因生物安全管理条例》指出,农业转基因生物安全是指防范农业转基因生物对人类、动植物、微生物和生态系统构成的危险或者潜在风险。此后,农业部和国家质检总局等机构相继制定有关农业转基因生物的标识、加工、进口等多个方面的规章制度(见图1)。
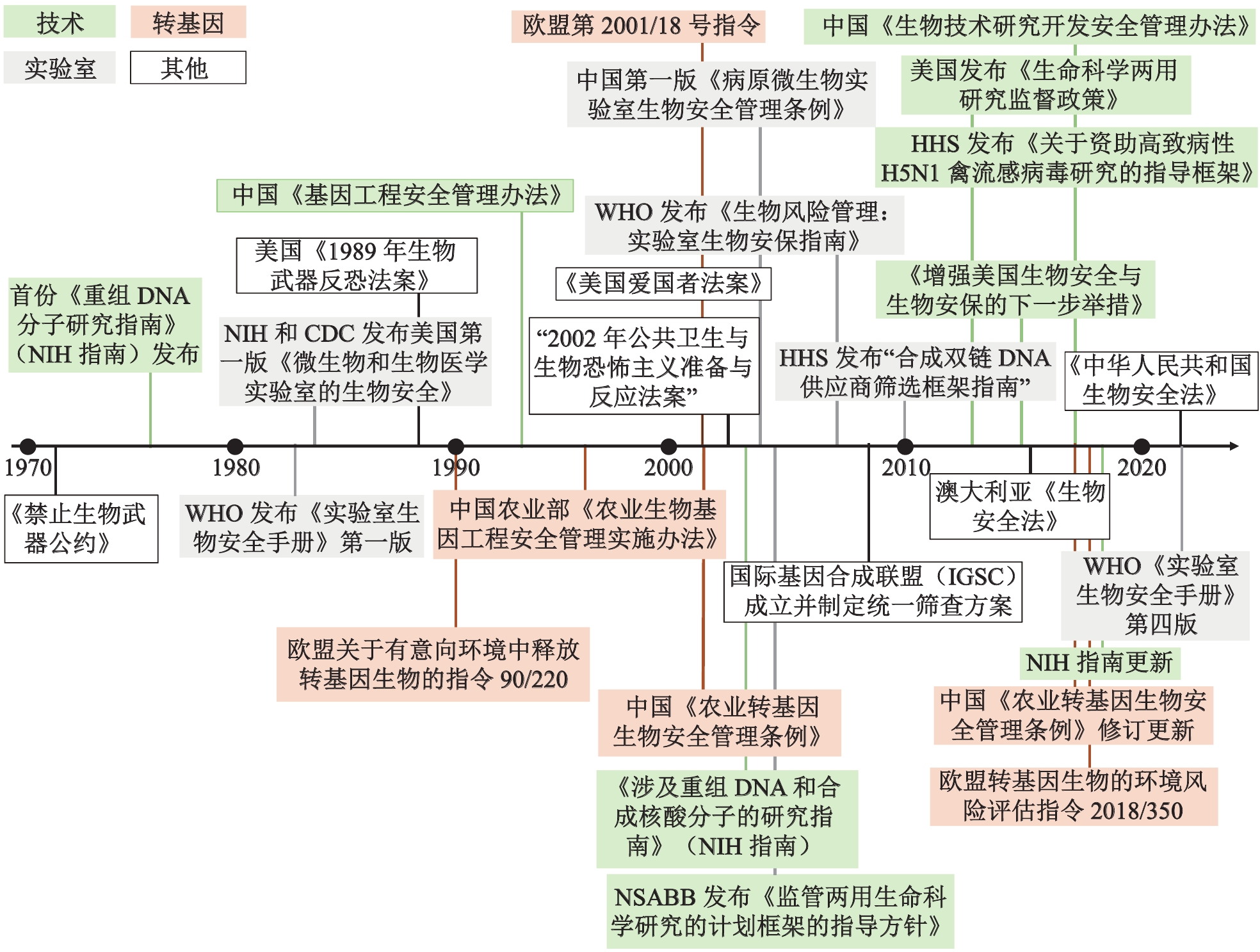
|
图 1 生物安全/安保监管政策的演变(列举) 注:CDC:美国疾病控制预防中心;HHS:美国卫生与公众服务部;NIH:美国国立卫生研究院;NSABB:美国国家生物安保科学顾问委员会;WHO:世界卫生组织。 |
21世纪初,工程科学研究思路和策略的引入,推动了学科会聚的合成生物学的形成。[15]合成生物学的发展及其与人工智能等技术的融合,极大拓展了对生物系统的设计和改造能力,有望将对生命系统的研究提升到“可定量、可预测、可合成”的新高度。[16]同时,合成生物学及其技术的高度“会聚”特征和极强的“赋能”潜力,也存在着一系列与生物安全/安保问题相关的复杂性和不确定性,为安全治理体系带来新的挑战。
1. 技术能力提升带来的不确定性风险与挑战从头合成或改造病原微生物等能力的提升,增加了偶发事故(生物安全)与生物恐怖袭击(生物安保)发生的可能性,提高了生物技术风险识别、评估与管理的难度。研究人员于2002年在试管中人工合成脊髓灰质炎病毒,在2005年利用基因组编辑技术重新构建了已灭绝的“西班牙”流感病毒株。此后,马痘病毒、埃博拉病毒、新冠病毒等陆续在实验室中合成;[17]高致病性禽流感H5N1病毒传播性和宿主特异性基因改造等功能获得性研究(GOF)[18]也陆续开展。这些实验室内进行的人工合成或改造研究,可能会带来病原体毒力提升或非致病病原体致病、病原体传播能力提升、病原体宿主改变、诊断措施无效、疫苗无效、抗生素耐药性、生物制剂或毒素武器化[19]等风险。如果生物安全监管政策未落实、措施不完善,将增加生物安全事故发生及生物恐怖袭击的可能性。因而,美国陆续出台了有关两用研究(DURC)的系列监管政策,《合成生物学时代的生物防御》(BiodefenseintheAgeofSyntheticBiology)报告将现有病原体的重新合成列为最紧迫的生物安保风险之一。[20]然而,现有监管体系重点覆盖政府资助的研究,[21][22]难以全面约束监管范围以外的研究;[23]即便是对于监管范围内的研究,目前准确评估其风险程度也有难度。
从头合成或改造医用、农用、环境用、工业用生物体,加大了相关产品安全性、稳定性的评价难度。其中的核心问题是原有产品安全性和稳定性评价指标体系面对这样一类“新产品”的时候,如何处理评价指标体系、标准与“新产品”的衔接问题。首先是能否与现有标准衔接。以利用合成生物学开发的细胞与基因治疗产品为例,其作为“活体药物”的安全性与稳定性评价,有着较小分子、单抗等“活性药物”更为复杂,与之对应的成瘤性/致瘤性/促瘤性、免疫原性和异质性评价等指标还不够明确,给“活体药物”安全评价带来了一定的困难。因此,必须在“衔接标准”上加以调整,如果调整过于复杂艰难,那就必须“突破”,形成新的管理类别、新的管理规范。第二,各指标相对应的测试方法或规程存在差距,已不适用“新产品”,需要补充或升级。例如,外源DNA残留测定标准操作规程,未能随着基因编辑等技术的发展而及时更新。第三,新技术的引入,有可能在生物安全和生物安保两个方面都带来挑战。对于可能对人类健康或环境形成正负两方面影响的“两用研究”的技术准入、产品准入机制不够完备,缺乏相应的“负面清单”。例如,在按蚊中设计基因驱动系统的研究,若在野生环境中释放可能持续繁衍[24]或进化成更具毒性的物种,[25]给生态环境和人类健康带来负面影响。针对这类环境释放后的潜在影响目前仍然存在争议,尚缺乏科学有效的评价方法或手段。
2. 信息开放共享带来的滥用谬用风险与挑战合成生物学引入工程化、标准化、模块化等理念,大幅提升了生物技术的兼容性和互操作性,提升了开放式创新的水平。一方面,随着生物实验室自动化水平不断提升,在标准化和自动化开发体系中,“生物积块”(BioBricks)等元件库的数据和材料的共享与分发主要采用开放生物材料转移协定(OpenMTA)协议,允许元件接收者对所接受的元件进行二次分发,并开发了与之相配套的一系列开源软件。[26]合成生物学的这些自动化平台以及开源元件、软件的开发利用,使得非法访问、远程操控甚至恶意使用成为可能。[27]另一方面,生物元件、基因线路、底盘细胞等在设计、测试等环节中产生大量数据,并实现了这些数据的开放共享,使获取及利用各类信息数据更加便捷、门槛更低,数据的安全、隐私及知识产权问题也更加突出。本文仅讨论数据滥用或谬用引发的生物安保风险。
目前,通过公开数据库获得基因序列信息后,利用合成生物学技术,可在短时间内合成基因组。若一些高致病性的病原体基因信息被滥用、谬用,可能引起生物武器威胁和生物恐怖袭击风险,其影响难以事先预料和控制。例如,2006年英国《卫报》记者经由DNA合成公司轻易地订购到一段天花病毒DNA,[28]引发了国际社会对DNA合成安全筛查的关注。国际基因合成联盟(IGSC)和美国HHS相继制定针对序列安全筛选的机制,并在两用研究政策报告中强调对敏感基因序列信息和知识的限制性共享。然而,随着桌面DNA合成仪等技术的发展,绕开合成企业的序列筛查体系,自行合成并组装致病病原体的风险仍然存在。[29]
3. 安全意识缺失带来的风险隐患与管理挑战合成生物学研发效率的提升、成本的降低,扩展了相关知识和数据的可及性,也使得更多的人员有机会参与其中。不同领域的人员涌入该领域,突破了科学与兴趣的界限,在促进大众创新的同时也带来了管理的新挑战。[30]例如,上文所讨论的生物元件开放共享使未来可能会有越来越多没有接受过生物学或遗传学基础教育,甚至都没有接受过高等教育的人们能够自行获取元件并制造生物系统。[31]随着这种DIY生物学(DIY-Bio)群体的流行,安全问题也受到关注。这种非专业化的群体通常不隶属于任何研究机构或组织,而是游离在科学共同体及机构审查和管理之外,此类生物安全风险会更加难以监测和管理。2020年,由开放慈善基金会(Open Philanthropy)资助支持的《社区生物安全手册》(Community Biology Biosafety Handbook)发布,[32]提出DIY实验室的共享要求,但并非强制遵守。
三、合成生物学的生物安全治理策略我国生命科学界自参加国际人类基因组计划以来,就重视其伦理、法律、社会问题(Ethical, Legal and Social Issues,ELSI)的研究,规范自己的行为,并向政府提供生物安全问题的咨询。我国政府部门也一直非常重视生物技术的安全监管,在生物安全实验室的分级管理和转基因作物(食品)的审批管理等方面,都出台了一系列的制度与规范。
合成生物学使能技术的发展,对我国生物安全治理能力提出了更高的要求。一方面,要提升科学监管的能力和水平,构建与其“赋能”潜质与风险水平相适应的、更具针对性和操作性的治理体系,既防范生物安全的风险,更能够有效发挥合成生物学技术“赋能”所带来的新技术新产品的作用。另一方面,要充分利用合成生物学“赋能”提供的生物安全新技术和新机遇。
1. 重视监管科学,提升生物安全监管能力和水平目前,合成生物学“赋能”人类的潜质正逐步显现。既要认识合成生物学技术的颠覆性,又要认识“赋能”形成的新技术和新产品与现有技术及产品之间的密切关系,有极强的可衔接性,还要剖析新技术带来的潜在风险与现有监管体系间的关系。只要能够衔接的,就直接衔接;对衔接中有不适应和难接口的点,做好调整适应工作;实在不能衔接的,就要勇于面对,有所突破,开辟新的监管领域。
密切关注合成生物学技术的特点、发展趋势及应用的变化,培养和建设识别不同技术、方法和产品的关键风险点的能力。要不断完善科学监管的能力,开发专业工具、标准和方法,增强对新技术、新产品监管判定的确切性和一致性,确保对合成生物学技术及成果转化或产品应用的安全进行科学而全面的评估及监管。同时提升对数据安全风险信息的获取、分析、研判、预警能力,不断及时补充或升级针对新兴技术和产品的安全评价方法、工具和程序等体系,动态更新两用研究(DURC)相关的评价方法和“负面清单”。根据不同的风险等级,制定相应的分类管理措施,进行科学有效的风险管理。[33]
2. 明确责任分工,构建完善的生物安全治理体系《生物安全法》已建立了国家安全领导机构统筹协调的机制,国家安全领导机构统筹相关部门,分工协作,构建起科学完备的治理体系。在《生物安全法》的框架下,应进一步明确政府管理机构、资助机构的责任与范围。对资助机构而言,特别需要完善针对“两用研究”的资助支持机制,在项目立项前对相关研究的潜在风险进行评估,建立对研究的实施及成果的传播进行监管。例如制定和完善跟踪检查和定期报告制度、实验方案或敏感信息等公开前的审核制度等;针对合成生物学研发活动中产生的生物数据及其储存、传播、利用等需要分类管理,既要防范生物数据被窃取、篡改、监视、毁损等风险,又要利用先进的数据与信息技术,形成高效安全的利用体系,建立与技术相匹配的数据评估、报告、信息共享、监测预警等安全管理系统。对研究机构而言,需要建立与所从事的生物技术研究、开发与应用活动相应的安全管理制度。例如,组建机构专业安全委员会,对合成生物学等新兴技术的安全问题进行评估审查,定期跟踪检查、报告等,使各项政策和措施可操作、可实施。
安全意识是管理生物安全风险的重要先决条件。一方面,要强化研究机构和相关企业科研人员的安全与风险防范意识,构建系统的生物安全/安保培训和教育机制,把相关的行为准则或指南,纳入科研人员和管理人员的科学教育、职业发展或认证认可的要求中,[34]营造负责任开展合成生物学创新的研发环境。[35]另一方面,要重视公众的参与,提供决策者、自然科学家、社会科学家、公众、媒体等公开讨论、对话的机会和平台;通过科学宣传生物安全的知识,树立公众的生物安全风险意识,遵守生物安全相关法规,并发挥公众的监督作用,促进生物安全治理体系的建立与完善。
3. 充分利用合成生物学使能技术,开发生物安全风险防控新策略合成生物学技术生物安全/安保风险的预防及管控,还应充分发展和利用先进技术,大力提升对生物技术的生物安全/安保风险的防控能力。[36]
目前,对生物安全/安保风险的防控通常采用物理隔离,即把人工改造的生物体通过各种方法局限在可控的空间范围内,阻止其扩散。利用合成生物学技术,可以使人工改造生命体在可控条件下进行复制和增殖、遗传信息的转移及环境适应,在技术层面实现人造生物体的完全生物性隔离。[37]例如,创建正交生物系统,可以预防人工合成生物与自然生物的遗传信息交换;拓展新密码子,以设计并产生不同于自然的新人工遗传系统,可以实现有效的生物隔离。[38]其次,对工程微生物的改造,也可以采用更安全和可靠的方式来防止其环境扩散。例如,在分子水平上为工程菌设置“门锁”和“钥匙”,只有在添加特定物质时才能诱导表达。[39]此外,开发提高筛查和监测能力的技术,利用专门的工具实现对可能存在安全问题的各种制剂及DNA片段的筛查。
| [1] |
Savadoriai L., Savio S., Nicotra E., et al. Expert and Public Perception of Risk from Biotechnology.
Risk Analysis, 2010, 24(5): 1289-1299.
|
| [2] |
田德桥编. 生物技术安全. 北京: 科学技术文献出版社. 2021.
|
| [3] |
NIH. Recombinant DNA research guidelines.
Federal Register, 1976, 41(131): 27902-27943.
|
| [4] |
World Health Organization. Laboratory biosafety manual, 4th edition. Geneva: World Health Organization, 2020. https://www.who.int/publications/i/item/9789240011311.[2022-09-09]
|
| [5] |
FAS. Background Brief History of Biosafety. 2011. https://pubs.fas.org/pir/2011fall/2011fall-bioagents.pdf.[2022-09-09]
|
| [6] |
World Health Organization. Biorisk management: laboratory biosecurity guidance. Geneva: World Health Organization, 2006. https://www.who.int/publications/i/item/biorisk-management-laboratory-biose-curity-guidance.[2022-09-09]
|
| [7] |
U. S. Department of State. U. S. Statement on enhanced pathogen security measures. https://2001- 2009.state.gov/t/ac/rls/rm/2003/26936.htm. [2022-09-09]
|
| [8] |
World Health Organization. Laboratory biosafety manual, 3th edition. Switzerland Geneva: World Health Organization, 2004. http://www.who.int/csr/resources/publications/biosafety/WHO_CDS_CSR_LYO_2004_11/en/. [2022-09-09]
|
| [9] |
Organization for Economic Co-operation and Development. OECD best practice guidelines on biosecurity for biological resource centres. Paris: Organization for Economic Co-operation and Development, 2007. http://www.oecd.org/document/36/0,3343,en_2649_34537_38777060_1_1_1_1,00.html.[2022-09-09]
|
| [10] |
ETH Zurich. International biodefense handbook. 2007.
|
| [11] |
Fredrickson DS. The recombinant DNA controversy: A memoir: Science, politics, and the public interest 1974-1981. Washington, DC: ASM Press. 2001
|
| [12] |
Berg P., Baltimore D., Brenner S., et al. Summary Statement of Asilomar Conference on Recombinant DNA Molecules.
PNAS, 1975, 72: 1981-1984.
DOI: 10.1073/pnas.72.6.1981. |
| [13] |
李建军, 唐冠男. 阿希洛马会议: 以预警性思考应对重组DNA技术潜在风险.
科学与社会, 2013, 3(2): 12.
|
| [14] |
李劲松. 实验室生物安全——现状、存在问题及相关法律法规. 2004年SARS与禽流感国际学术研讨会论文集. 2004, 61–65+441.
|
| [15] |
刘冲, 邓门佳. 新兴生物技术发展对大国竞争与全球治理的影响.
现代国际关系, 2020, 6: 1-10.
|
| [16] |
刘晓, 曾艳, 王力为等. 创新政策体系: 保障合成生物学科技与产业发展.
中国科学院院刊, 2018, 33(11): 1260-1268.
|
| [17] |
Dando M.. The Impact of the Development of Modern Biology and Medicine on the Evolution of Modern Biological Warfare Programmes in the Twentieth Century.
Defense Analysis, 1999, 15: 43-62.
DOI: 10.1080/713604665. |
| [18] |
Fouchier RAM. Studies on Influenza Virus Transmission between Ferrets: The Public Health Risks Revisited.
mBio., 2015, 6(1): e02560-14.
|
| [19] |
European Commission. Synthetic Biology: A NEST Pathfinder Initiative, Brussels, Belgium: European Commission, 2012.
|
| [20] |
National Academies of Sciences, Engineering, and Medicine. Biodefense in the Age of Synthetic Biology. Washington, DC: The National Academies Press. 2018.
|
| [21] |
United States Government Policy for Oversight of Life Sciences Dual Use Research of Concern. 2012. http://www.phe.gov/s3/dualuse/Documents/us-policy-durc-032812.pdf.[2022-09-09]
|
| [22] |
Recommended Policy Guidance for Departmental Development of Review Mechanisms for Potential Pandemic Pathogen Care and Oversight (P3CO). 2017. http://www.phe.gov/s3/dualuse/Documents/P3CO-FinalGuidanceStatement.pdf. [2022-09-09]
|
| [23] |
NRC. Dual Use Research of Concern in the Life Sciences: Current Issues and Controversies. Washington DC: National Academies Press. 2017.
|
| [24] |
王盼娣, 熊小娟, 付萍等. 基因驱动技术研究进展及风险管控.
中国油料作物学报., 2021, 43(1): 56-63.
|
| [25] |
Scudellari M. Self-destructing mosquitoes and sterilized rodents: the promise of gene drives.
Nature, 2019, 571(7764): 160-162.
DOI: 10.1038/d41586-019-02087-5. |
| [26] |
刘婉, 严兴, 沈潇等. 生物元件库国内外研究进展.
微生物学报., 2021, 61(12): 3774-3782.
|
| [27] |
Peccoud J, Gallegos JE, Murch R., et al. Cyberbiosecurity: From Naive Trust to Risk Awareness.
Trends in Biotechnology, 2018, 36: 4-7.
DOI: 10.1016/j.tibtech.2017.10.012. |
| [28] |
Randerson J. Revealed: the lax laws that could allow assembly of deadly virus DNA. [2006-06-14]. http://www.theguardian.com/world/2006/jun/14/terrorism.topstories3.[2022-09-09]
|
| [29] |
Garfinkle M, Knowles L. Synthetic Biology, Biosecurity, and Biosafety in Ronald Sandler, ed.
Ethics and Emerging Technologies. Boston:Northeastern University, 2014, : 533-534.
|
| [30] |
彭耀进. 合成生物学时代: 生物安全、生物安保与治理.
国际安全观察, 2020, 5: 29-57.
|
| [31] |
关正君, 裴蕾, 马库斯·施密特等. 合成生物学生物安全风险评价与管理.
生物多样性, 2012, 20(2): 138-150.
|
| [32] |
Armendariz A., D’haeseleer P., Gillum D., et al. Community Biology Biosafety Handbook. 2020.
|
| [33] |
袁志明. 合成生物学技术发展带来的机遇与挑战.
华中科技大学学报, 2020, 34: 5-7.
|
| [34] |
Rappert B., Chevrier MI, Dando MR. In-Depth Implementation of the BTWC: Education and Outreach. Bradford Review Conference Paper, Bradford: University of Bradford, 2006. https://core.ac.uk/display/6179. [2022-09-09]
|
| [35] |
马诗雯, 王国豫. 合成生物学的“负责任创新”.
中国科学院院刊, 2020, 35(6): 761-761.
DOI: 10.16418/j.issn.1000-3045.20200311001. |
| [36] |
周琪, 彭耀进. 这是生物技术的时代, 也是生物安全的时代.
工程研究——跨学科视野中的工程, 2020, 12(1): 7-9.
|
| [37] |
马延和, 江会锋, 娄春波等. 合成生物与生物安全.
中国科学院院刊, 2016, 31(4): 432-438.
DOI: 10.16418/j.issn.1000-3045.2016.04.007. |
| [38] |
Mandell D. J., Lajoie M. J., Mee M. T., et al. Biocontainment of genetically modified organisms by synthetic protein design.
Nature, 2015, 518: 55-60.
DOI: 10.1038/nature14121. |
| [39] |
Lopez G., Anderson JC.. Synthetic Auxotrophs with Ligand-Dependent Essential Genes for a BL21(DE3) Biosafety Strain.
ACS Synthetic Biology, 2015, 4: 1279-1286.
DOI: 10.1021/acssynbio.5b00085. |
2. Center for Excellence in Molecular Plant Science, Chinese Academy of Sciences;
3. University of Chinese Academy of Sciences
 2022, Vol. 12
2022, Vol. 12


