| 钾长石提钾技术进展 |
钾是农作物生长所必需的氮、磷、钾3种基本营养元素之一,在农作物体内起着至关重要的作用,是决定农作物产量的关键元素,同时钾离子又是植物各组织中最丰富的无机阳离子,因此农作物的正常生长离不开钾元素[1-2]。地壳上有三类含钾资源:可溶性钾盐矿、难溶性含钾矿物岩石和液态钾盐资源,如海水和盐湖卤水等。目前,可利用的钾矿资源主要是可溶性钾矿资源和难溶性含钾矿物资源两类。可溶性钾盐矿主要包括钾石盐、光卤石、硫酸钾、混合钾盐和液态钾盐。难溶性含钾岩石包括富钾正长岩、板岩、页岩和火山岩等[3]。
目前,全球钾资源丰富,已探明的钾资源大部分属于地下固体钾盐,仅有少部分为液态钾盐。全球钾盐资源已探明储量为95亿t(以K2O计),但钾矿资源在全球分布极度不均,探明储量92%的钾盐资源集中在加拿大、俄罗斯和白俄罗斯,而其他国家占比均很低,因而全球生产钾肥的企业也都集中在加拿大、俄罗斯和白俄罗斯等钾盐储量丰富的国家[4]。
全球90%以上的钾盐被用于制造钾肥[5]。我国是个农业大国,拥有近18亿亩耕地,是世界最大的钾肥消费国,每年对钾肥的需求量超过1 200万t,但每年国内钾肥总产量能不超过450万t[6],仍有60%左右的缺口,因此每年需要从国外进口大量的钾肥[7]。随着我国农业的不断发展,钾肥的需求量也日益增长,逐渐匮乏的钾盐资源无法满足农业需求,因此,为缓解我国钾资源供需矛盾,促进国民经济稳定增长,高效开发利用储量丰富的钾长石资源,研究提钾新技术具有极其重要的意义。
本文总结了利用焙烧浸出法、压热法、低温分解法和微生物法从钾长石中提取钾盐的技术,分析对比其提钾效果,并指出了今后利用钾长石提钾的研究方向。
1 国内钾资源简介我国可溶性钾资源匮乏,用于制造钾肥的可溶性钾资源仅占全球总储量的2.2%[6],且分布极不平衡,96.9%以上的资源分布在青海柴达木盆地和新疆的罗布泊盐湖, 处在西北和西南偏远地区,没有方便的交通条件,采矿困难,因而难以大规模开发利用。相比之下,我国难溶性钾矿资源较为丰富,据估计矿石总储量至少在200亿t以上,其中以钾长石为主要物相的富钾岩石更是遍布全国各地,总储量超过100亿t[3]。
钾长石(K2O·Al2O3·6SiO2)理论组成为K2O 16.9%,SiO2 64.7%,Al2O3 18.4%,密度为2.56 g/cm3,熔点为1 290 ℃[8]。钾长石是由钾、铝和硅三种元素构成稳定四面体网状结构的硅酸盐矿物[9],其同质多像变体分为透长石、正长石和斜微长石三种。钾长石的结构决定了其稳定的化学性质,除了氢氟酸外,常温常压下几乎不能被任何的酸或碱溶解[10]。我国钾长石资源很丰富,分布也十分广泛,因而,研究从钾长石中提钾具有重大意义。
2 钾长石提钾及其综合利用现状目前,难溶性钾矿综合利用的关键是在提取钾盐的同时,利用钾矿中含有的铝和硅等制备出高附加值产品,提高钾矿的综合利用率,确保提钾过程的经济性。我国对难溶性钾矿提钾的研究相较于国外起步较晚,自20世纪50年代开始探索从含钾矿石中提钾的工艺[4]。国内外各研究单位以及相关高校,曾先后研究不同的提钾技术,但基本都还处于试验和推广阶段,几乎没有已用于工业生产中的提钾技术。难溶性钾矿综合利用流程如图 1所示。
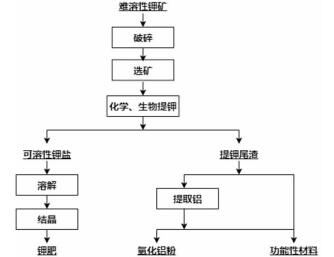 |
| 图 1 难溶性钾矿综合利用一般流程 Fig.1 General flowsheet of comprehensive utilization of insoluble potassium rock |
近年来,国内外对钾长石提钾的研究相对较多,主要处理工艺有焙烧浸出法、压热法、低温分解法和微生物法。
2.1 焙烧浸出法焙烧浸出法是在钾长石中加入助剂进行焙烧,破坏钾长石的矿物结构,将不溶性钾转化为可溶性钾盐,再利用溶剂将可溶性的钾盐浸出。根据加入焙烧助剂的不同,可分为碳酸盐焙烧法、硫酸盐焙烧法、硫酸盐—碳酸盐焙烧法和氯化物焙烧法等。
2.1.1 碳酸盐助剂焙烧碳酸盐焙烧采用的助剂主要有碳酸钠和碳酸钙。刘佳囡等[11]将辽宁某地的钾长石破碎、磨细和筛分,并与Na2CO3按摩尔比1:1置于坩埚中混合均匀,在875 ℃焙烧90 min。焙烧过程中发生的主要反应如下:
| $ {\rm{KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}} + 2{\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to {\rm{KAlSi}}{{\rm{O}}_{\rm{4}}} + 2{\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{3}}} + 2{\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow $ | (1) |
| $ {\rm{NaAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}} + 2{\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to {\rm{NaAlSi}}{{\rm{O}}_{\rm{4}}} + 2{\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{3}}} + 2{\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow $ | (2) |
| $ {\rm{Si}}{{\rm{O}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{3}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow $ | (3) |
待上述焙烧反应完成后焙烧熟料随炉冷却、取样。钾长石中的微斜长石(KAlSi3O8)和钠长石(NaAlSi3O8)与Na2CO3反应生成可溶性的Na2SiO3和不溶的霞石(KAlSiO4)。再经过碱溶焙烧熟料,过滤分离得Na2SiO3溶液和主要成分为霞石的焙烧渣。Na2SiO3溶液经碳酸化分解可制取白炭黑;而焙烧渣经酸浸得到含铝、钾和钠的酸性溶液,通过沉铝净化得Al(OH)3。含Na2SO4和K2SO4溶液循环到接近饱和浓度时,分步结晶可得Na2SO4和K2SO4晶体。
2.1.2 硫酸盐助剂焙烧Li等[12]研究了CaSO4助剂在钾长石焙烧法提钾过程中的行为。试验中将CaSO4和钾长石制成片状样品焙烧。结果表明,CaSO4中钙离子通过离子交换,将钾长石中的钾离子转化为水溶性的K2Ca2(SO4)3。同时从钾长石中分离出中间产物SiO2,与CaSO4反应后,分解为SO2和CaO·nSiO2。在CaSO4和钾长石质量比为3:1、温度1 200 ℃、压强6 MPa、焙烧时间2 h时,钾提取率和CaSO4分解率分别为62%和44%。试验中CaSO4分解会降低钾的提取率,因此需要加入大量的CaSO4,但是过量的CaSO4在分解过程中会产生大量的SO2和O2,影响反应物之间的接触,所以需控制CaSO4的用量。
2.1.3 硫酸盐—碳酸盐助剂焙烧Ren等[13]以焦炭和磷肥企业的固体废弃物——磷石膏为助剂,与钾长石混合焙烧制备硫酸钾。研究发现,钾长石(粒度为-0.074 mm)、磷石膏和焦炭质量比为2:7:3,在1 200 ℃下焙烧1 h后,再用浓度为2%的柠檬酸在固液比为1:4的室温条件下浸出4 h,钾的平均溶出率可达76.81%。汪碧容、石林等[14-15]系统地研究了钾长石—CaSO4—CaCO3体系焙烧提钾反应过程,认为可能的反应如下:
| $ {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \to {\rm{CaO}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow $ | (4) |
| $ {{\rm{K}}_{\rm{2}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{6}}}{{\rm{O}}_{{\rm{16}}}} \to {{\rm{K}}_{\rm{2}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{4}}}{{\rm{O}}_{{\rm{12}}}} + 2{\rm{Si}}{{\rm{O}}_{\rm{2}}} $ | (5) |
| $ {\rm{2CaO + Si}}{{\rm{O}}_{\rm{2}}} \to {\rm{C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}} $ | (6) |
| $ \begin{array}{l} {{\rm{K}}_{\rm{2}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{4}}}{{\rm{O}}_{{\rm{12}}}} + {\rm{CaS}}{{\rm{O}}_{\rm{4}}} + {\rm{5CaO}} \to \\ {{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} + {\rm{C}}{{\rm{a}}_2}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{7}}} + 2{\rm{C}}{{\rm{a}}_2}{\rm{Si}}{{\rm{O}}_{\rm{4}}} + {\rm{Si}}{{\rm{O}}_2} \end{array} $ | (7) |
| $ {\rm{C}}{{\rm{a}}_2}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{7}}} + {\rm{CaO}} \to {\rm{CaA}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}} + {\rm{C}}{{\rm{a}}_2}{\rm{Si}}{{\rm{O}}_{\rm{4}}} $ | (8) |
| $ {\rm{CaA}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}} + 2{\rm{CaO}} \to {\rm{C}}{{\rm{a}}_{\rm{3}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{6}}} $ | (9) |
| $ {\rm{CaO}} + {\rm{C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}} \to {\rm{C}}{{\rm{a}}_{\rm{3}}}{\rm{Si}}{{\rm{O}}_{\rm{5}}} $ | (10) |
研究结果表明,在1 500 ℃下焙烧2 h,矿物和助剂的最佳摩尔比为KAlSi3O8:CaSO4:CaCO3=1:1:14,此时钾浸出率为92.02%,产物的主要物相符合热力学分析结果,产物为硅酸二钙、铝酸三钙和K2SO4。
2.1.4 氯化物助剂焙烧Zhang等[16]以氯化钙和碳酸钙作为助剂进行钾长石提钾试验,认为焙烧过程中可能发生的反应有:
| $ {\rm{2KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + CaC}}{{\rm{l}}_{\rm{2}}} + 4{\rm{CaC}}{{\rm{O}}_{\rm{3}}} \to {\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{5}}}{\rm{ + }}5{\rm{CaSi}}{{\rm{O}}_{\rm{3}}} + {\rm{2KCl + 4C}}{{\rm{O}}_{\rm{2}}} $ | (11) |
| $ \begin{array}{l} {\rm{2KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + CaC}}{{\rm{l}}_{\rm{2}}} + 8{\rm{CaC}}{{\rm{O}}_{\rm{3}}} \to \\ {\rm{C}}{{\rm{a}}_{\rm{3}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{{\rm{12}}}}{\rm{ + }}2{\rm{C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}} + {\rm{2KCl + 8C}}{{\rm{O}}_{\rm{2}}} \end{array} $ | (12) |
| $ \begin{array}{l} {\rm{2KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + CaC}}{{\rm{l}}_{\rm{2}}} + 10{\rm{CaC}}{{\rm{O}}_{\rm{3}}} \to {\rm{CaA}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_8}{\rm{ + }}\\ 2{\rm{C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}} + 2{\rm{C}}{{\rm{a}}_3}{\rm{Si}}{{\rm{O}}_5} + {\rm{2KCl + 10C}}{{\rm{O}}_{\rm{2}}} \end{array} $ | (13) |
将钾长石与氯化钙和碳酸钙的混合物置于马弗炉中,在500~900 ℃下进行不同程度的焙烧,焙烧熟料粉碎后用水浸出。试验结果表明:以氯化钙—碳酸钙为助剂提取钾的最佳试验条件为:钾长石、氯化钙和碳酸钙的质量比为1:2:2,反应温度为750~800 ℃(在氯化钙熔点附近)。该工艺中试结果为,钾的溶出率基本都在82%左右,焙烧和浸出试验规模对钾溶出率影响不大。
2.1.5 氟化物助剂焙烧柴妮等[17]用磷石膏作为焙烧提钾助剂进行试验,其原理是利用助剂磷石膏中的主要杂质氟化钙和磷酸氢钙,焙烧后破坏钾长石的稳定结构,使钾离子分离出来,达到提钾的目的。该体系的最佳操作条件为:焙烧温度1 273 K,焙烧时间2 h。
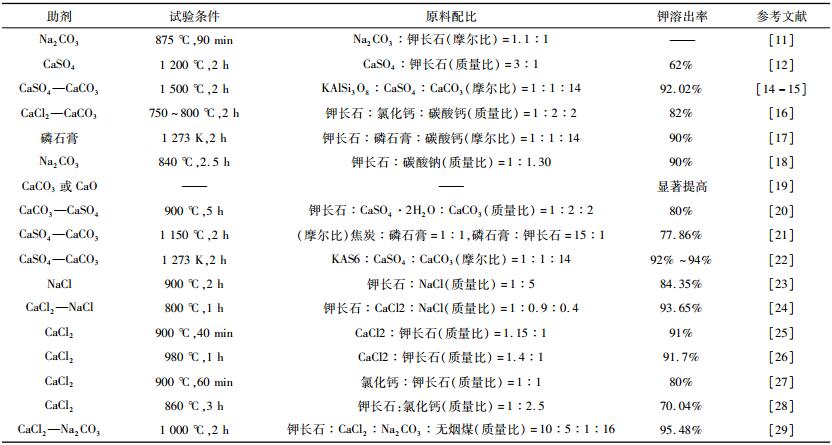
表 1列举了目前焙烧所用的焙烧助剂,并对助剂用量及其钾溶出率。由此可知,除了助剂种类及用量,焙烧温度和时间也显著影响钾的溶出率。
| 表 1 焙烧浸出法中所用的不同助剂及提钾效果 Table 1 Potassium extraction effect of different additives used the method of roasting and leaching |
|
综上所述,焙烧浸出法原料廉价易得,工艺流程较短,但在焙烧过程中需要消耗大量的能量,反应产生的烟尘会造成大气环境污染。此外,由于加入了大量的助剂,产生固废的量也很大,会对环境造成很大的压力。所以该工艺的经济性和环保性有待进一步解决。
2.2 压热法国外研究者从19世纪末就开始研究用压热法提取钾长石中的钾[30]。压热法是一种在温度为200~500 ℃、压力为0.3~6.1 MPa的条件下,利用CaCl2、Ca(OH)2、CaO和NaCl等分解钾长石,将反应物料放进压力反应器内进行提钾制备钾盐[31]。浓热的碱溶液虽然可以腐蚀钾长石,但是在常压下腐蚀速度较慢,因此为了满足工业生产的需要,采用压热法可以显著提高钾长石的反应速度。
蓝计香等[32]在加压反应釜中以消石灰为浸出剂浸出钾长石中的钾,研究发现该条件下提钾具有较好的选择性。赵恒勤等[33]采用高温高压水化学法研究了温度、时间、碱度和配料等对钾长石浸出效果的影响。研究发现,最佳浸出条件为:温度300 ℃,反应时间15 min,碱度(Na2Ok)115 g/L,配料αk=10以及石灰加量为C/S(钙硅摩尔比)=1.75,K2O的浸出率可达80%以上,Al2O3的浸出率可达75%以上。同时,推导出了该水化反应的机理为:
| $ \begin{array}{l} {{\rm{K}}_{\rm{2}}}{\rm{O}} \cdot {\rm{ + A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_3} \cdot 6{\rm{Si}}{{\rm{O}}_{\rm{2}}} + 12{\rm{Ca}}{\left( {{\rm{OH}}} \right)_{\rm{2}}} \to \\ {\rm{2KAl}}{{\rm{O}}_{\rm{2}}}{\rm{ + 6}}\left[ {2{\rm{CaO}} \cdot {\rm{Si}}{{\rm{O}}_{\rm{2}}} \cdot {\rm{0}}{\rm{.5}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right] + 9{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ | (14) |
试验结果证明,此法产生的浸出渣可以用来烧制水泥,实现物料的综合利用。该工艺的流程如图 2所示。
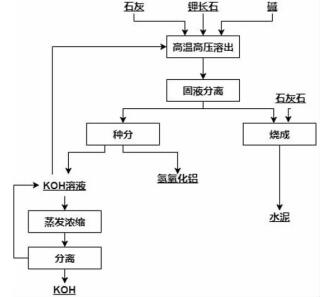 |
| 图 2 高温高压水化法工艺流程图[32] Fig.2 Process flowsheet of the method of high temperature and high pressure hydration |
孟姣等[34-35]用微波技术缩短矿物浸出时间、提高钾溶出率。研究发现,经微波加热预处理过的钾长石表现出更高的溶出率,且在一定范围内钾溶出率与微波功率呈正相关,微波可以破坏矿物表面结构,使矿物表面粗糙松散,从而增大了浸出反应的接触面积,并且这种破坏作用随着微波功率的提高而增强。研究发现,体系最佳溶出条件为:微波预处理功率800 W,预处理时间15 min,钾长石:NaOH:CaO(质量比)为2:9:1,反应温度200 ℃,反应时间3 h,此时钾最佳溶出率为77.6%,经物相分析得出反应后的主要产物为硅酸氢钙钠(NaCaHSiO4)等物质。
赵晶星等[36]研究了在NaOH体系下微波预处理辅助溶出钾长石,同样也证实了微波作用可以提高钾长石的溶出率。研究发现在NaOH体系下,最佳溶出工艺条件为:微波功率600 W,预处理时间15 min,反应温度180 ℃,反应时间180 min,钾离子最佳溶出率为92%左右,产物物相分析发现,产物主要组成为水羟方钠石[Na8Al6Si6O24(OH)2(H2O)2]。
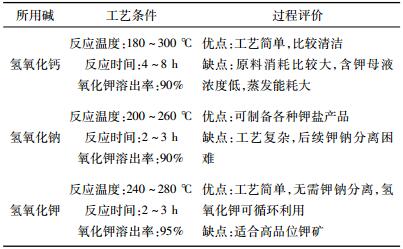
从上述结果可以看出,压热法无高温焙烧过程,不仅可以降低一定的能耗,而且对环保有利。常见的压热法提钾流程,在提钾的同时可对提钾尾渣进行综合利用,制备建筑材料或功能性材料,提高提钾经济性。但需要高温高压反应条件,对设备要求比较高,并且反应过程中会产生大量的废水,处理比较麻烦。采用氢氧化钙、氢氧化钠和氢氧化钾的压热法工艺条件如表 2所示。
| 表 2 3种压热法工艺条件和过程评价[37] Table 2 Comparison table of the three alkali usage processes |
|
2.3 低温分解法
低温分解法包括硫酸—氢氟酸分解法、硫酸加助剂分解法和钾长石—磷矿—无机酸分解法。这类方法的特点是钾长石与氢氟酸或添加剂和硫酸等助剂混合后在较低的温度下(200 ℃以下)进行提钾反应[38]。
2.3.1 硫酸—氢氟酸分解法彭清静[39]利用硫酸和氢氟酸分解钾长石,认为钾长石分解过程发生的化学反应为:
| $ \begin{array}{l} 2{\rm{KAlS}}{{\rm{i}}_3}{{\rm{O}}_8} + 24{\rm{HF}} + 4{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4} \to \\ {{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4}{\rm{ + A}}{{\rm{l}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 6{\rm{Si}}{{\rm{F}}_4} \uparrow + 16{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ | (15) |
由于硫酸的存在,加热时HF极易挥发,因此HF应采用滴加的方式,以减少挥发损失。研究发现,反应温度低于50 ℃时钾长石的分解率低,只有当温度高于70 ℃时反应才能较好地进行,反应速率在90 ℃时达到最大,若再升高反应温度会造成HF大量挥发,分解率反而会降低。研究得出钾长石分解的最佳工艺条件为:温度90 ℃、反应时间6~7 h、HF浓度为30%,此时钾的总收率可达85.4%。然而,氢氟酸剧毒,会严重危害工作人员身体健康,同时也会腐蚀设备。
尚亚伟等[37]将钾长石粉与一定量的氟硅酸和硫酸混合,在一定温度下反应,随后充分浸出。该法最佳工艺条件为:硫酸:氟硅酸:矿粉的原料质量比为1.2:1.4:1,氟硅酸和硫酸浓度分别为30%和70%,反应时间为2 h、浸出温度为90 ℃,此时钾的转化率高达99%。中试发现该工艺不仅在钾长石提钾方面效果显著,还适用于明矾石和富钾板岩等其他含钾矿石,具有较为可观的经济效益。
2.3.2 硫酸加助剂分解法长沙化学矿山设计研究院[40]从1989年就开始研究常压常温下钾长石的分解,并利用提钾尾渣联产铝盐及其他副产品,取得了一定的成果。其工艺特点是在常温常压下采用硫酸加助剂分解钾长石,并回收助剂实现助剂循环使用。除生产硫酸钾铵产品外,可同时生产铝产品、偏硅酸钠及白炭黑等副产品,以实现钾长石资源的综合利用,既可以制取钾盐产品,又确保了一定的经济效益。
薛彦辉等[41]提出利用天然含氟化合物低温分解钾长石,以降低生产成本。试验中采用萤石作为助溶剂,加入一定量的硫酸进行反应。反应机理为:
| $ \begin{array}{l} 2{\rm{K}}\left[ {{\rm{AlS}}{{\rm{i}}_3}{{\rm{O}}_8}} \right] + 12{\rm{Ca}}{{\rm{F}}_{\rm{2}}} + 16{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4}{\rm{ = }}6{\rm{Si}}{{\rm{F}}_4} \uparrow + \\ 12{\rm{CaS}}{{\rm{O}}_4}{\rm{ + }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4}{\rm{ + A}}{{\rm{l}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 16{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ | (16) |
用水吸收反应中生成的气体SiF4后循环利用可制得白炭黑,CaSO4分离后可以制得石膏,Al2(SO4)3可以制备聚合硫酸铝。研究发现钾长石—萤石—硫酸体系在不加热的条件下即可反应,但钾离子的溶出率较低,而当加热到150 ℃,恒温230 min,钾离子的溶出率高达99%。
2.3.3 钾长石—磷矿—无机酸分解法黄珂和孟小伟等[10, 42]在实验室中研究了由磷酸三钙、氟化钙、氧化镁和氧化钙组成的模拟磷矿对钾长石溶出作用,根据离子交换反应原理探讨了钾长石的低温分解过程。其反应机理为:磷矿与硫酸反应生成氢氟酸破坏钾长石后,钾长石中的钾离子被钙镁离子从矿物晶体中置换出来,从而实现提钾过程。研究发现最优的钾长石:磷矿质量比为0.8:1,其中磷矿:磷酸三钙:氟化钙质量比为1:0.5:0.1,氧化镁和氧化钙等比例添加。当用4 mL/g质量分数为70%的硫酸在160 ℃条件下反应4 h,钾溶出率可以达到74.1%。在研究中又提出用硫酸脲代替硫酸,此法虽然提钾效率有所降低,但有效地降低了反应温度,并且还起到固氟的作用,在降低能耗的同时也减少了对环境造成的污染。
徐畅等[43]将钾长石与浓硫酸按一定的固液比混合,送入微波消解器中进行提钾浸出。试验发现,钾的溶出率随着钾长石粒径的减小、硫酸质量分数的增大和反应温度的升高而增加。当硫酸过量时,钾的溶出率会逐渐趋于平稳,因为过低的pH会影响离子交换过程,最佳钾浸出率在83%以上。
低温分解法反应温度较低,所以能耗小,成本低,同时其产品附加值也相对较高,K2O的溶出率高,但是分解过程中使用的酸对设备的腐蚀性强,会增加生产过程的风险因素,对人体带来的危害也比较大,有待进一步优化。
2.4 微生物分解法微生物分解法就是利用微生物与钾长石之间的生物化学反应分解提取其中钾的方法。目前,已有多种微生物被应用于解钾研究,研究较多的微生物主要是硅酸盐细菌和一些霉菌,其中又以硅酸盐细菌为多。
硅酸盐细菌最早是被前苏联研究者亚历山大罗夫从土壤中分离出来的,20世纪60年代起,我国学者开始研究硅酸盐细菌,并分析其解钾机理。目前被广泛认同的硅酸盐细菌解钾机理有两种:一是含钾矿物的晶格会因为硅酸盐细菌的溶蚀作用而变形,甚至崩解,再加上代谢产物对钾的主动吸收作用,矿物颗粒会被逐渐降解,从而实现提取钾的目的;另一种观点认为硅酸盐菌株产生的葡萄糖、有机酸和许多胞外多糖可以溶解钾长石,从而使矿物中的钾和硅等元素被释放出来,以达到提钾的目的[3]。
连宾和傅平秋等[44]研究了硅酸盐细菌对钾长石的作用过程,推断硅酸盐细菌的解钾作用与许多因素有关:细菌—矿物复合体的形成、硅酸盐细菌对矿物表面的溶蚀作用、硅酸盐细菌破坏矿物的晶体结构作用、细菌—矿物复合体的吸附作用使微环境的改变、矿物本身的溶解作用以及细菌对钾离子的主动吸收作用等。硅酸盐细菌的解钾作用还与这些因素之间的协同作用有关。解钾过程中溶蚀作用优先发生在矿物颗粒表面较脆弱的地方,在矿物被溶蚀后,其比表面积增大,会进一步加速细菌的解钾作用,促进钾离子的释放。
王康林等[45]从合肥郊区玉米地里分离、纯化出硅酸盐细菌,分离筛选过程中发现该菌种必须在含有钾矿物营养成分的培养基上才能很好地生长。探究解钾效果的试验表明,自然条件下存在的硅酸盐细菌的解钾能力有限,经人工驯化后可提高解钾能力。
盛下放等[46]模拟了两种不同的硅酸盐细菌在天然土壤条件下的解钾过程。试验分别设置了干燥、湿润和淹水三种土壤条件,同时对比了接种细菌和未接种细菌两种情况下的研究结果,分析结果表明,处于干燥条件下的硅酸盐细菌不能维持正常生长,对矿物的解钾作用微乎其微,而湿润和淹水条件对细菌的解钾作用有利,且后两种情况下的解钾效果没有明显的差别。对比两种硅酸盐细菌的解钾效果发现,NBT菌株对矿物的解钾效果好于NFT-2菌株。最后该研究指出,硅酸盐细菌对钾矿的解钾作用与细菌的代谢活性有很大关系。
宋淼等[47]研究了草酸青霉对钾长石、黑云母和白云母的溶解性能影响,草酸青霉的培养和浸出试验结果表明,草酸青霉对黑云母和白云母的解钾效果优于钾长石。研究还指出,减小矿物颗粒和提高矿物浓度都可以明显的提高草酸青霉对钾矿的溶出作用,草酸青霉对矿石的作用主要是强化了矿物的风化作用。
采用微生物法提钾,工艺流程简单、提取过程环保,因而成本较低、对环境友好,但该法受限于微生物分解作用十分缓慢,寿命较短,并且K2O的溶出率较低等缺点,尚未工业化应用。这也表明了研究培育出对钾长石具有高效和稳定的提钾作用,同时繁殖力和生命力能满足需求的解钾微生物是该技术今后发展的方向。
3 结论由上述可看出,从钾长石中提取钾的关键是要先破坏钾长石稳定的晶体结构。焙烧浸出法、压热法、低温分解法和微生物法在钾长石提钾综合利用方面取得了一定的进展,但都处于试验阶段,尚未工业化应用。但是众多学者的研究已经证实了从难溶性钾矿中提钾的可行性,因此,从难溶性钾矿中提钾将会是解决我国可溶性钾矿不足的有效途径之一。
钾长石提钾尚未工业化的主要原因是钾长石分解困难,工艺过程能耗高,经济上不可行,同时对环境的影响也较大。因此,高效、低能耗和环保的提钾技术是今后重点研究方向。
生物解钾虽然具有能耗低、环保等优点,但是过程效率低、时间长、且受菌种生命周期影响严重,因此应着重培育解钾能力快、繁殖力和生命力强的微生物。
此外,从钾长石提钾会产生大量的尾渣,合理、经济和高效利用这些尾渣,开发以这些尾渣为原料制备高附加值产品的方法和技术,也是提高提钾工艺经济效益,给企业增收,和减少整个提钾工艺对环境造成污染的重要途径,同时也符合企业可持续发展策略和“黄河流域生态保护和高质量发展”的国家战略要求。
| [1] |
王晓丽, 高洪, 周萍. 难溶性含钾矿石中提钾技术的研究进展[J]. 广州化工, 2015, 43(4): 12-13, 24. |
| [2] |
庾莉萍. 积极解决我国钾资源短缺的问题[J]. 磷肥与复肥, 2007(6): 7-11. |
| [3] |
苏双青, 杨静, 马鸿文, 等. 非水溶性钾资源制取钾盐技术评价[J]. 化工矿物与加工, 2014, 43(2): 46-51, 53. |
| [4] |
商照聪, 刘刚, 包剑. 我国钾资源开发技术进展与展望[J]. 化肥工业, 2012, 39(4): 5-8, 49. |
| [5] |
马鸿文, 苏双青, 刘浩, 等. 中国钾资源与钾盐工业可持续发展[J]. 地学前缘, 2010, 17(1): 294-310. |
| [6] |
张素素, 高璐阳, 徐广飞, 等. 不溶性钾资源综合利用现状及前景分析[J]. 广东化工, 2019, 46(1): 98-99. |
| [7] |
程玉刚, 张忠辉, 兰尧中. 我国钾盐制钾肥开发利用现状[J]. 现代矿业, 2011, 27(2): 92-94. |
| [8] |
郑云霞.钾长石提钾过程研究[D].合肥: 合肥工业大学, 2013.
|
| [9] |
饶东生. 硅酸盐物理化学[M]. 北京: 冶金工业出版社, 1980.
|
| [10] |
黄珂.钾长石共酸提钾的研究[D].郑州: 郑州大学, 2012.
|
| [11] |
刘佳囡, 申晓毅, 张俊, 等. 钾长石综合利用工艺研究[J]. 矿产综合利用, 2015(6): 25-28. |
| [12] |
LU L, LI C, ZHANG GQ, et al. Decomposition behavior of CaSO4 during potassium extraction from a potash feldspar-CaSO4 binary system by calcination[J]. Chinese Journal of Chemical Engineering, 2018, 26(4): 838-844. DOI:10.1016/j.cjche.2017.10.001 |
| [13] |
REN XJ, XIA JP, ZI GQ, et al. Effect of leaching conditions on dissolution rate of potassium from K-feldspar calcined sample[C]. Switzerland: Advanced Materials Research, 2013: 911-915.
|
| [14] |
汪碧容, 石林. 钾长石-硫酸钙-碳酸钙体系的热分解体系研究[J]. 非金属矿, 2011, 34(2): 8-10. |
| [15] |
汪碧容, 石林. 钾长石-硫酸钙-碳酸钙体系的热分解过程分析[J]. 化工矿物与加工, 2011, 40(3): 12-15. |
| [16] |
ZHANG Y, ASSELIN E, LI ZB. Laboratory and pilot scale studies of potassium extraction from K-feldspar decomposition with CaCl2 and CaCO3[J]. Journal of chemical engineering of Japan, 2016, 49(2): 111-119. |
| [17] |
柴妮.磷石膏热分解钾长石的机理及其影响因素研究[D].广州: 华南理工大学, 2011.
|
| [18] |
范丽艳, 刘月娥, 甄卫军, 等. 高温煅烧哈密钾长石工艺及热分解动力学研究[J]. 非金属矿, 2013, 36(6): 10-12, 35. |
| [19] |
SAXENA ER, DATAR DS, Zaheer SH. Extraction of potash from felspar part VⅡ[J]. Transactions-Indian Ceramic Society, 1956, 15(2): 114-126. DOI:10.1080/0371750X.1956.10877712 |
| [20] |
BAKR MY, ZATOUT AA, MOUHAMED MA. Orthoclase, gypsum and limestone for production of aluminum salt and potassium salt[J]. Interceram, 1979, 28(1): 34-35. |
| [21] |
夏举佩, 任雪娇, 阳超琴, 等. 磷石膏、钾长石制备硫酸钾的新工艺初探[J]. 硅酸盐通报, 2013, 32(3): 486-489, 494. |
| [22] |
柯亮, 石林, 陈定盛. 钾长石-硫酸钙-碳酸钙体系提钾添加剂的实验研究[J]. 非金属矿, 2007(5): 12-14. |
| [23] |
韩磊, 谢燕. 贵州省钾长石提钾工艺初步研究[J]. 广州化工, 2014, 42(7): 79-81. |
| [24] |
胡天喜, 于建国. CaCl2-NaCl混合助剂分解钾长石提取钾的实验研究[J]. 过程工程学报, 2010, 10(4): 701-705. |
| [25] |
YUAN B, LI C, LIANG B, et al. Extraction of potassium from K-feldspar via the CaCl2 calcinati on route[J]. Chinese journal of chemical engineering, 2015, 23(9): 1557-1564. DOI:10.1016/j.cjche.2015.06.012 |
| [26] |
陈建, 马鸿文, 张盼, 等. 氯化钙助剂分解钾长石制备氯化钾研究评述[J]. 化工进展, 2016, 35(12). |
| [27] |
SAMANTRAY J, ANAND A, DASH B, et al. Production of potassium chloride from K-feldspar through roast-leach-solvent extraction route[J]. Transactions of the Indian Institute of Metals, 2019, 72(10): 2613-2622. DOI:10.1007/s12666-019-01730-z |
| [28] |
SONG JG, WANG XZ, XIAO SD, et al. Study on extracting potassium from potassium feldspar with molten salt leaching method[C]. Switzerland: Advanced Materials Research, 2012: 1078-1081.
|
| [29] |
曹磊.非水溶性钾矿熔浸提钾及副产品高值化技术研究[D].昆明: 昆明理工大学, 2018.
|
| [30] |
张爽.中低品位磷钾伴生矿低温酸浸提钾研究[D].武汉: 武汉工程大学, 2015.
|
| [31] |
国外从钾长石中提取钾盐和制造钾肥的研究概况[J].化工矿山技术, 1973(S1): 1-82.
|
| [32] |
蓝计香, 颜勇捷. 钾长石中钾的加压浸取方法[J]. 高技术通讯, 1994(8): 26-28. |
| [33] |
赵恒勤, 胡宠杰, 马化龙, 等. 钾长石的高压水化学法浸出[J]. 中国锰业, 2002(1): 34-36, 50. |
| [34] |
孟姣, 赵建海, 李文朴. 微波辅助条件下低温水热法分解钾长石[J]. 天津城建大学学报, 2017, 23(6): 428-432. |
| [35] |
孟姣, 赵建海, 史欢欢. 微波对钾长石在碱性条件下低温提钾性能的影响[J]. 无机盐工业, 2017, 49(12): 20-22, 52. |
| [36] |
赵晶星, 赵建海, 孟姣, 等. 低温条件下微波对钾长石溶出性能影响的微观机理分析[J]. 化工进展, 2016, 35(1): 34-39. |
| [37] |
尚亚伟.钾长石氟化学法提钾及综合利用中试技术研究[D].福州: 福州大学, 2015.
|
| [38] |
黎佳宜, 黎方正, 钱江涛. 钾长石综合利用研究进展及回收新工艺的提出[J]. 广东化工, 2015, 42(10): 119-120. |
| [39] |
彭清静. 用硫-氟混酸从钾长石中提钾的研究[J]. 吉首大学学报(自然科学版), 1996(2): 62-65. |
| [40] |
丁喻. 常压低温分解钾长石制钾肥新工艺[J]. 湖南化工, 1996(4): 5-6. |
| [41] |
薛彦辉, 周广柱, 张桂斋. 钾长石-萤石-硫酸体系中分解钾长石的探讨[J]. 化学与生物工程, 2004(2): 25-27. |
| [42] |
孟小伟, 王光龙. 钾长石湿法提钾工艺研究[J]. 无机盐工业, 2011, 43(3): 34-35. |
| [43] |
徐畅, 赵建海, 赵晶星. 微波协同条件下钾长石低温提钾工艺研究[J]. 无机盐工业, 2015, 47(7): 24-28. |
| [44] |
连宾, 傅平秋, 莫德明, 等. 硅酸盐细菌解钾作用机理的综合效应[J]. 矿物学报, 2002(2): 179-183. |
| [45] |
王康林, 韩效钊, 张雪琴, 等. 硅酸盐细菌的选育与解钾性能研究[J]. 化工矿物与加工, 2005(2): 25-27. |
| [46] |
盛下放, 冯阳. 不同条件下硅酸盐细菌对含钾矿物分解作用的研究[J]. 土壤, 2005(5): 110-112. |
| [47] |
宋淼, 彭云湘, Pedruzzi I, 等. 草酸青霉对含钾矿物风化及钾溶出的影响[J]. 微生物学通报, 2015, 42(7): 1410-1417. |
 2020
2020



