| 高钙高铁煤渣处置含砷污酸的除砷行为及机理 |
2. 昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室, 云南 昆明 650093
2. State Key Laboratory of Complex Nonferrous Metal Resources Cleaning Utilization, Kunming University of Science and Technology, Kunming 650093, China
砷是自然界中广泛存在的有毒有害元素之一,砷和砷的化合物通常存在于水资源和土壤中。砷不溶于水,其氧化物和砷酸盐形式的含砷化合物毒性较高,其中三价砷的毒性大于五价砷[1-3]。在氧化性和碱性环境中,五价砷是主要的砷形态,在还原性和酸性的条件下,如酸性的工业废水中,三价砷是主要的存在形式[4, 5]。一旦这些含有砷和含砷化合物的工业废水暴露于环境中,当地的环境和人类将会受到严重威胁[6-8]。在铜冶炼以及相关产品的生产过程中,会产生大量含有重金属元素的工业废水。这些工业废水具有成分复杂、酸度高、危险性大的特点。其中砷的致癌性和危险性较其他的重金属较高,需要进行特殊处理。
近些年来,含砷废水的处理已成为研究者们研究的热点。以污酸为代表的酸性含砷废水处置或者除砷方法可分为化学法和物理法,主要包括石灰石中和[9]、硫化法[10, 11]、混凝、电化学法[12]、吸附法[13, 14]和膜分离法[15, 16]。目前在工业上常用的除砷方法是石灰石中和法和硫化法,即使被冶炼厂使用,仍然面临许多挑战[17-19]。大量危险废物的产出、游离酸资源的浪费、高成本和二次污染限制了这些技术的进一步推广。因此,迫切需要一种高效除砷并实现工业废水回收的方法。物理和化学相结合的新型复合除砷方法表现出较强的优势[20]。化学沉淀是主要的除砷途径之一,在较高的pH值条件下,通过形成钙或铁的砷酸盐或亚砷酸盐来实现低成本除砷[21]。吸附剂具有高效率、可再生的优点,在之前的学者研究中发现含铁基吸附剂因其对砷的强亲和力而显示出很高的除砷潜能。其关键之处在于,中和沉淀和含铁化合物等深度净化除砷的共同作用。煤渣作为一种碱性且富含铁氧化物的固废,兼具化学中和沉淀和物理吸附作用,并且煤渣中含有Fe2O3,理论上可以起到中和污酸,提供三价铁离子的目的。因此,煤渣有望通过以废治废,成为一种良好的除砷药剂用于含砷废水处置[22],并有望成为一种低成本高效污酸除砷材料。
燃煤渣(简称煤渣)是工业固体废物的一种,火力发电厂、工业和民用锅炉及其他设备燃煤排出的废渣。20世纪以来,日本、丹麦等国煤渣已全部得到利用,而我国煤渣的利用率较低。煤渣弃置堆积,不仅占用土地,放出含硫气体污染大气,危害环境,甚至会自然起火。不过经过高温作用产生的煤渣,具有比表面积大[23]和表面能高的特点。煤中含有10%~30%的灰分,这些燃烧参与在渣中的灰分具有较强的吸附性,对工业废水中的重金属离子具有一定的物理吸附效果。其中,煤渣的主要成分为丰富的含铁氧化物和其他碱性氧化物,含铁氧化物可以为重金属离子提供丰富的吸附位点,铁氧化物和碱性氧化物在工业废水中溶解后,在一定程度上可以提高废水的碱度。因此,开展煤渣与污酸反应行为和机理的研究,对于突破污酸处置和煤渣综合利用具有重要意义。
基于此,本文开展了煤渣用于污酸除砷技术研究,将为含砷污酸无害化提供一种高效低成本处置方法。研究了不同加入量、反应时间和初始pH值对煤渣除砷形为的影响,并优化煤渣除砷的工艺条件。基于煤渣除砷效率和除砷容量,解析了煤渣和污酸反应行为。还利用SEM-EDS对含砷煤渣的微观形貌和表面信息进行分析,揭示了煤渣除砷机理。
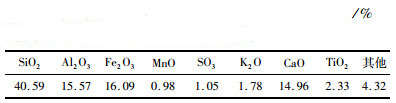
2 材料与方法 2.1 试验原料试验所用的污酸来自铜冶炼厂,是烟气制酸环节中对烟气进行洗涤所得到的废水,酸性较强。通过ICP对试验中所用的污酸元素进行检测,本试验选用的污酸中的元素含量如表 1所示,其主要含有64 g/L的硫酸,砷含量达到7 g/L,除此之外还含有丰富的重金属元素。高纯氩气(规格>99.99%)来自宏发得利气体有限公司,氢氧化钠(分子量为40,规格为分析纯)来自阿拉丁试剂有限公司,双氧水(规格为分析纯)来自北京化学试剂公司,自制蒸馏水(规格为分析纯)。煤渣来自于西南某地小型燃煤锅炉,主要成分包括硅、铝、铁、钙氧化物,如表 2所示。
| 表 1 污酸成分 Table 1 Chemical composition of waste acid |

|
| 表 2 煤渣的成分含量 Table 2 Composition of honeycomb cinde |
|
由表 2知煤渣由Ca、Fe、O等元素组成,主要成分为硅、钙、铝和铁氧化物,占煤渣总量的87.24%,还有含量少于2%的K2O、MnO的碱性氧化物。按照《固体废物腐蚀性测定,GB/T 15555.12—1995》对煤渣的腐蚀性进行了测试,其浸出液pH值达到12.44,碱性较强,具有一定的腐蚀性,已十分接近《GB 5085.1—2007》中对腐蚀性危险废弃物的鉴别值12.5,属于危险固体废弃物。
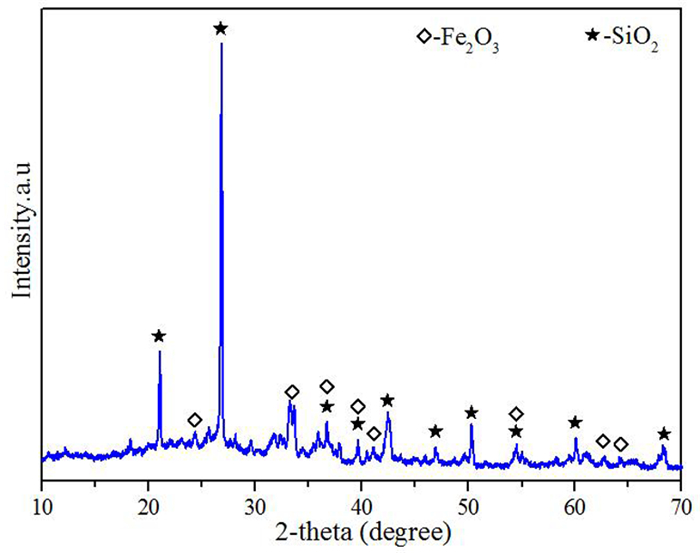
图 1为煤渣XRD图谱,结果显示煤渣主要是由赤铁矿相和少量硅氧化物相组成。其中石英石相的衍射峰强度较高的有两处、为煤渣的主要衍射峰;赤铁矿相的衍射峰相对强度较弱,部分衍射峰与赤铁矿重叠。煤渣中含有大量钙、铁氧化物以及pH较高,碱性较强[24],所以煤渣不仅可以中和污酸,还可以提供Fe3+和Ca2+,这就决定了它具有潜在的除砷能力[25]。煤渣作为大众固体废弃物,如果能二次利用,不仅为煤渣处置提供了途径,同时也降低了除砷成本。
 |
| 图 1 煤渣的XRD图 Fig.1 XRD pattern of honeycomb cinder |
2.2 检测仪器
上海一恒科学仪器有限公司DHG-9240A型号的电热恒温鼓风干燥箱,金坛市大地自动化仪器厂WHY-2型号的水浴恒温震荡箱,上海精密科学仪器有限责任公司PHS-3D型号的PH计,梅特勒-托多利仪器厂AL204-IC型号的电子天平,上海科导超声仪器有限公司SK3300HP型号的超声波清洗仪,外商独资重庆颐洋企业发展有限公司AWL-0501-UT型号的艾科浦微量无机型超纯水机,德国PQ 9000型电感耦合等离子体发射光谱仪(ICP-QES),日本日立公司制造的S-3400扫描电子显微镜。
2.3 试验方法量取1 L砷浓度为7 g/L的污酸放入2 L的烧杯中,加入80 mL过氧化氢溶液,置于水浴锅中,在温度80 ℃,搅拌速度为180 r/min的条件下,反应4 h,备用,进行污酸的氧化。用ICP对污酸的成分进行检测,主要测定污酸的酸度与其中的砷离子浓度。而后将煤渣放入磨矿机中进行研磨,使得其粒度在100~200目之间,通过控制变量法,改变反应的条件(加入量、时间、初始pH)进行反应。将反应后的溶液进行过滤,滤渣置于恒温干燥箱中,在60 ℃的条件下干燥12 h,滤液收集在离心管中进行稀释后检测。干燥后的固体进行XRD、SEM、EDS、浸出毒性等分析,将滤液分别稀释到10倍和100倍后用ICP检测其中的砷离子和铁离子。
(1) 煤渣加入量影响
用电子天平分别称取2 g、4 g、6 g、8 g、10 g、12 g的煤渣于100 mL的锥形瓶中,再使加入量筒加入50 mL的污酸,故煤渣与污酸固液比分别为40 g/L、80 g/L、120 g/L、160 g/L、200 g/L、240 g/L。在25 ℃的恒温震荡器中以180 r/min的震荡速度震荡12 h,反应完毕后将溶液进行过滤,用ICP进行剩余溶液砷浓度测量,滤渣送至电热恒温鼓风干燥箱在60 ℃下干燥12 h。
(2) 反应时间影响
用电子天平分别称取10 g的煤渣于100 mL的锥形瓶中,加入50 mL的污酸,煤渣与污酸固液比为200 g/L。在25 ℃的恒温震荡器中以180 r/min的震荡速度分别震荡1 h、2 h、4 h、6 h、9 h、12 h,反应完毕后将溶液进行过滤,滤液稀释后用ICP进行剩余砷浓度测量,滤渣送至电热恒温鼓风干燥箱在60 ℃下干燥12 h。
(3) pH值的影响
分别称取10 g的煤渣于100 mL的锥形瓶中,加入50 mL的污酸,煤渣与污酸固液比为200 g/L。之后再用过氧化氢溶液将pH分别调至1、3、5、7、9、12,在25 ℃的恒温震荡器中以180 r/min的震荡速度震荡9 h, 反应完毕后将溶液进行过滤,滤液稀释后用ICP进行剩余砷浓度测量,滤渣送至电热恒温鼓风干燥箱在60 ℃下干燥12 h。
以砷的去除率作为试验指标,考察煤渣加入量、反应时间和pH对污酸中砷去除率的影响,称取一定量的煤渣与污酸混合,在23 ℃的水浴恒温振荡器上以180 r/min的转速振荡,振荡反应一定时间后,去除用孔径为0.45 μm的微孔滤膜进行过滤,用ICP检测滤液中砷浓度,滤渣进行干燥装袋密封保存,按照式(1)计算砷的去除率:
| $ \text { 砷的去除率 }=\frac{\left(C_{0}-C\right)}{C_{0}} * 100 \% $ | (1) |
式中:C0为初始时污酸中的砷离子浓度,g/L;C为除砷后污酸中的砷离子浓度,g/L。
2.4 毒性浸出试验对本试验所得的含砷固体进行浸出毒性分析,通过分析,可以对煤渣除砷的方法进行改进并找出最佳除砷条件,根据《危险废物浸出毒性鉴别标准》(GB 5085.3—2007),As的浸出毒性标准值为5.0 mg/L。在1 L的去离子水中加入5.7 mL的冰醋酸,将pH调节至2.88±0.05,制备浸提剂,然后将除砷后的煤渣与浸提剂以固液比为1:20进行混合,在恒温水浴振荡箱中以转速为180 r/min振荡18 h,完成后用过滤装置进行过滤,收集滤液,用ICP测量滤液中砷的浓度。
3 结果与讨论 3.1 高钙高铁煤渣处置含砷污酸的反应行为 3.1.1 煤渣加入量的影响煤渣加入量影响污酸沉淀pH和接触反应面积,会对除砷效率产生重要影响。不同加入量的煤渣对污酸残余砷浓度及脱砷率的影响如图 2a所示。从整体趋势来看,脱砷率随着煤渣加入量的增加先上升而后逐渐趋于稳定,溶液残余砷浓度呈现下降趋势。理论上,煤渣加入量越大,除砷效果越好。但由于成本和技术上的限时,应确定一个最佳煤渣加入量。当煤渣加入量为200 g/L时,砷的去除率为98.31%;煤渣加入量为240 g/L时,砷的去除率为98.44%,脱砷率变化不大。此时,随着煤渣加入量从200 g/L增加到240 g/L,如图 2b所示,除砷煤渣中砷的毒物浸出浓度相对变化较小,但都低于《危险废物鉴别标准GB 5085.3—2007》规定的5 mg/L[26],属于一般固体废弃物。
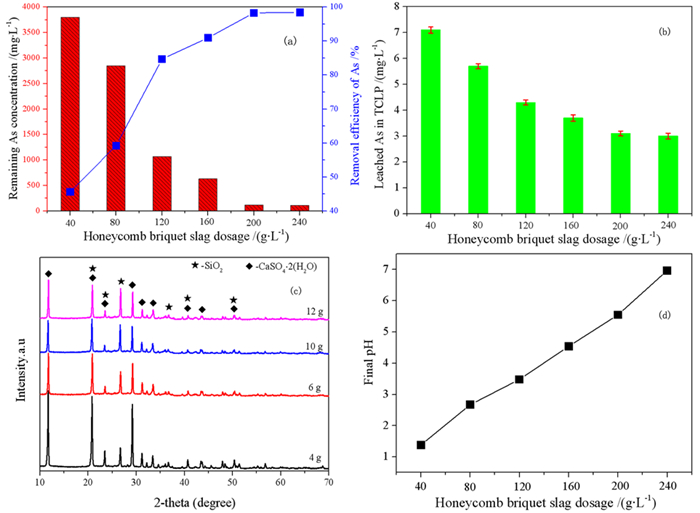 |
| 图 2 (a) 不同加入量条件下剩余溶液含砷量及砷脱除率; (b)不同加入量条件下沉砷反应结果TCLP; (c)不同加入量条件下的XRD; (d)不同加入量下最终pH值(温度为25 ℃,时间为12 h) Fig.2 (a) Arsenic content and arsenic removal rate of the remaining solution under different dosage conditions; (b) TCLP diagram of arsenic sinking reaction results under different dosage conditions; (c) XRD diagram under different dosage conditions; (d) final pH value under different dosage conditions, The temperature was 25 ℃ and the time was 12 h |
造成图 2a这种趋势的原因是由于煤渣是由铁氧化物和其他碱性氧化物组成[27],这就决定了煤渣可以通过化学沉淀和吸附[28, 29]来去除污酸中的砷。污酸中砷离子的浓度一定,当煤渣加入量较低时,可供砷离子进行反应与吸附的位点不多,所以砷离子能迅速聚集到煤渣表面进行反应,所以砷的去除率先呈现上升趋势。随着煤渣加入量的增加,溶液中砷酸根离子和煤渣反应接触面积增大,并且可提供更多的有效吸附位点,砷酸根离子和煤渣充分反应生成砷酸铁。同时,煤渣溶解在溶液中的Fe3+与碱性离子浓度增加,溶液中正电位浓度增大,促进砷酸铁离子和铁离子的共沉淀反应。煤渣加入量越多,反应越充分,除砷煤渣中砷的毒物浸出越小。当煤渣加入量达到一定水平时,溶液中砷酸根离子和煤渣的反应趋于饱和,反应驱动力下降,导致残余砷离子浓度相对变化较小,所以脱砷率逐渐趋于稳定。
图 2b显示在TCLP试验中浸出的砷浓度随着煤渣加入量的增加而逐渐降低。由图可知,当煤渣的加入量为40 g/L和80 g/L时浸出液中砷的浓度很高,这是由于这时的砷主要被吸附于沉淀物表面,生成的稳定含砷化合物较少;当煤渣加入量超过120 g/L时,生成的稳定含砷化合物增加,砷酸铁含量增加,大多数的砷被固定于沉淀物中,所得的浸出液中砷浓度均<5 mg/L。
煤渣主要是由钙、铁、硅氧化物组成,所以反应总能够释放钙离子、铁离子和硅离子。通过对煤渣与污酸反应后固体进行XRD检测,其结果如图 2c所示。由图 2c可知,除砷后煤渣产物主要含有石膏(CaSO4.2H2O)和二氧化硅(SiO2),从图中并没有看出任何能固定砷的化合物,说明形成的含砷固体产物不是晶型的,所以会有大量无定形砷酸钙,因此污酸中的砷离子会与石膏以共沉淀[30]的方式去除。通过观察可以发现随着煤渣加入量的增加,峰的强度在减小,峰形更平缓,表明当煤渣加入量较少时得到的石膏较为纯洁且结晶度高。此外,煤渣中铁离子在污酸中溶出后,在Fe3+存在下,五价砷能够与Fe3+形成无定形砷酸铁沉淀[31, 32],进而有效地将砷从污酸中去除。
图 2d显示的是不同煤渣加入量下最终的pH值变化,由图可见,在酸性条件下,煤渣中的铁氧化物会和酸根离子反应并释放铁离子,并且煤渣中碱性氧化物会发生水解,产生大量的OH-基团,溶液中的H+和OH-发生中和反应[33],导致pH值的增加。并且随着加入量的增加,pH值呈现上升趋势。在考虑煤渣加入量时,根据实际情况选择200 g/L时为最佳加入量,其除砷率达到98.31%。
3.1.2 反应时间的影响在煤渣加入量为200 g/L、反应温度为25 ℃的条件下进行脱砷反应,研究了不同反应时间下除砷效果与沉淀物的性质,如图 3所示。图 3a显示的是不同反应时间下残余砷含量与脱砷率,由图所示,在初期,溶液中的砷含量随着反应时间的增加逐渐降低,砷的去除率上升幅度也较大,曲线较为陡直,当反应时间为9 h时,砷的去除率达到了97.91%,溶液中含砷量为118.2 mg/L。在后期,砷的去除率的曲线上升比较平缓,砷的去除率基本维持在98.31%,溶液的含砷量为118.2 mg/L。反应时间对砷的去除率显示出“快速吸附,缓慢平衡”的规律。通过图 2b所示,溶液中砷酸根离子与煤渣的接触时间越长,除砷煤渣中砷的毒物浸出浓度越低,当反应时间超过4 h后,除砷煤渣的砷的浸出浓度低于5 mg/L[26]。这主要是由于短时间内煤渣通过吸附脱除砷,随着反应时间的增加,化学反应不断进行,形成稳定的化合物,所以毒性浸出较低。
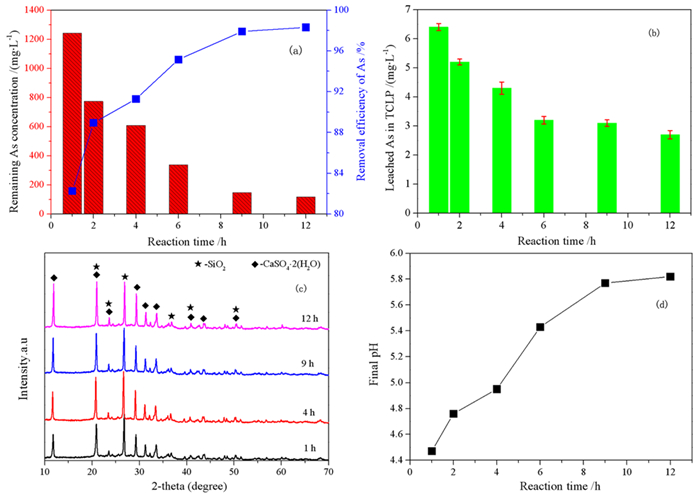 |
| 图 3 (a) 不同反应时间条件下剩余溶液含砷量及砷脱除率;(b)不同反应时间条件下的毒性浸出图(TCLP);(c)不同反应时间条件下的XRD图;(d)不同反应时间下最终pH值(煤渣加入量为10 g,温度为25 ℃) Fig.3 (a) Remaining AS concentration and removal efficiency of AS at different reaction time; (b) TCLP pattern at different reaction time; (c) XRD pattern at different reaction time; (d) Final pH at different reaction times, The addition amount of coal cinder was 10 g, the temperature is 25 ℃. |
研究表明,煤渣对砷酸根离子去除是化学沉淀法和吸附法的共同作用。起初,煤渣中的铁氧化物与H+反应,释放Fe3+,使得溶液中正电荷增加,Fe3+与砷酸根离子主要靠静电作用,快速吸附共沉淀,而且初始砷离子浓度与煤渣表面能相差较大,因而砷酸根离子吸附在煤渣表面,很快达到平衡;随着反应时间增加,H+浓度减小,砷酸铁及其他沉淀物附着在煤渣表面,Fe3+释放速度受限,砷酸根离子与Fe3+的作用能力降低,而吸附在煤渣表面的砷酸根离子与煤渣发生化学反应生成稳定的砷酸铁以及其他化合物。因此砷的去除主要通过化学沉淀法和吸附进行实现。
图 3c是不同反应时间下沉淀物的XRD图像,由图可知除砷后煤渣产物主要含有石膏(CaSO4.2H2O)和二氧化硅(SiO2),随着反应时间的延长,峰的强度增强,峰形也更加尖锐,说明此时沉淀物中的杂质不多,石膏的结晶度较好。同样由于石膏的存在,污酸中的砷离子会与石膏以共沉淀的方式去除,五价砷也能够与Fe3+形成无定形砷酸铁沉淀,进而有效地将砷从污酸中去除。
图 3d为反应时间对煤渣反应后污酸终点pH值的影响。如图 3d可见,随着反应时间的增加,污酸终点pH值先快速增加后趋于稳定。煤渣与污酸接触时间越长,越有利于铁氧化物在酸性条件下的溶解反应,碱性氧化物水解和电解越充分,污酸终点pH值变化越明显。当反应时间达到一定值后,溶液中H+浓度减少,酸碱中和反应驱动力减弱,污酸终点pH保持相对稳定。
3.1.3 pH的影响在砷沉淀的过程中,酸碱度对砷酸铁的合成和煤渣的溶解非常重要,因此研究酸碱度对砷的去除的影响。将pH调至1、3、5、7、9、12,反应温度为25 ℃,反应时间9 h。煤渣作为一种铁源,煤渣的溶解也是由砷沉淀驱动的,这可以保持溶液中相对稳定的pH值。生成砷的沉淀物,煤渣的溶解消耗和释放铁离子,是相互促进的机制,直至除砷率达到规定标准。
图 5a表明砷的去除效率受酸碱度的影响很大。砷酸铁的形成很大程度上取决于溶液的酸碱度。如图所示,除砷率随着pH的升高而降低,残余溶液中的砷含量呈现上升趋势。造成这种情况一方面是由于低pH值有利于煤渣的溶解,溶解出的Fe3+有利于与砷酸根离子反应形成无定形砷酸铁。另一方面,较高的pH值会抑制Fe3+从煤渣中释放,并导致Fe3+以碱性化合物的形式沉淀,抑制砷酸铁的形成。结果表明,当pH=0.98,除砷率达到了97.91%,剩余溶液中砷离子浓度未146.6 mg/L。相应的,对不同初始pH条件下的滤渣进行毒性浸出试验得到了图 4b,从图中可知,在pH=0.98时,获得的沉淀物在TCLP试验中具有最低的浸出砷浓度。
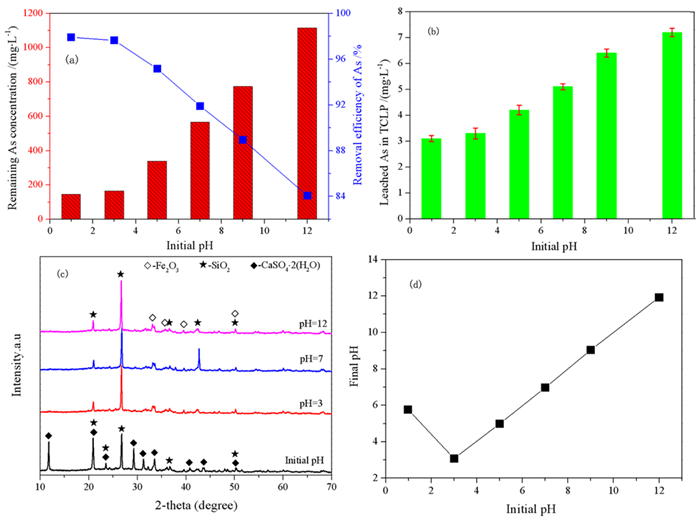 |
| 图 4 (a) 不同初始pH条件下剩余溶液含砷量及砷脱除率图;(b)不同反应时间条件下的毒性浸出图(TCLP);(c)不同初始pH下的XRD图;(d)不同pH下最终pH值(温度为25 ℃;反应时间为9 h) Fig.4 (a) Remaining AS concentration and removal efficiency of AS at different initial pH; (b) TCLP pattern at different initial pH; (c) XRD pattern at different initial pH; (d) The final pH at different pH(The temperature is 25 ℃; the reaction time was 9 h) |
 |
| 图 5 含砷沉淀物的SEM-EDS图 Fig.5 SEM-EDS diagram of arsenic-bearing precipitate |
对不同初始pH条件下的滤渣进行XRD分析,如图 4c。从图中可知,沉淀物的主要成分为Fe2O3、SiO2与石膏(CaSO4.2H2O)。在初始pH(pH=0.98)条件下,沉淀物中主要是SiO2与CaSO4.2H2O,随着pH的升高,SiO2的峰变得比较尖锐,CaSO4.2H2O的渐渐消失,且滤渣中出现Fe2O3。主要是由于随着pH的升高,一部分Fe2O3未能参加反应,并没有生成其他固体而是附着在砷酸铁或亚砷酸铁的表面形成沉淀,同时,溶液中的剩余砷含量也是逐步上升,除砷率逐渐下降。
图 4d是初始pH对煤渣反应后污酸中最终pH值的影响。由图知,随着初始pH在1~3时,污酸终点的pH下降,这是由于在pH=1~3时,铁氧化物在酸性条件下发生溶解,而碱性氧化物水解和电离不充分,所以pH值会下降。而后随着初始pH值的增加,污酸终点的pH值随着增加,这是由于当pH>3时,溶液酸度较低,铁氧化物溶解度较低,但是碱性氧化物的水解和电解会充分发生释放OH-,污酸的最终pH值增加。
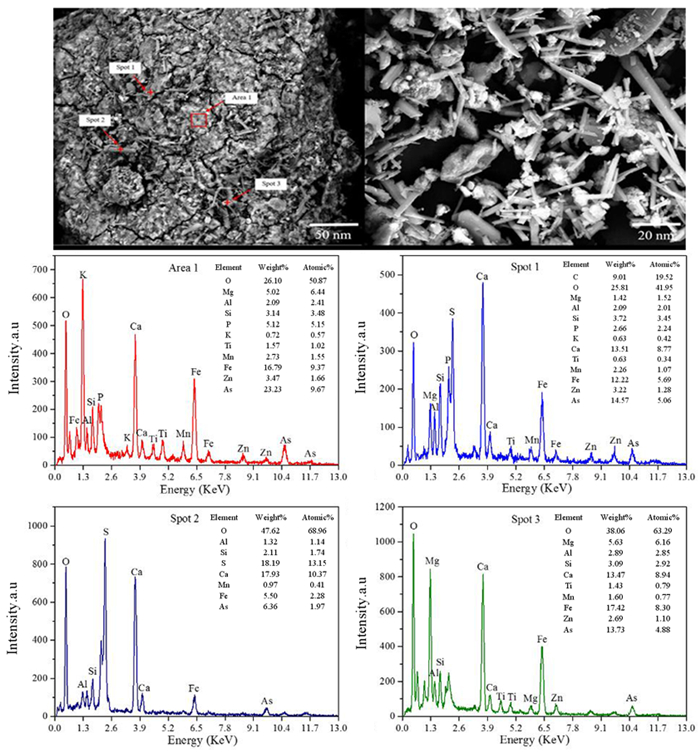
3.2 高钙高铁煤渣除砷机理为了阐明煤渣除砷机理,对除砷煤渣进行了SEM-EDS分析,研究除砷煤渣的微观形貌、元素组成。基于3.2煤渣除砷条件,选择室温、煤渣加入量为10 g、反应时间为12 h、pH=0.98时作为反应条件。
除砷后煤渣形貌以及除砷后煤渣组成如图 5所示。取样区域(Sampling Area 1)主要是一些从图中可以看出含砷沉淀物粒径分布相对均匀,呈现块状形式,有长条的棒状物和很多针状型小颗粒,细长型小颗粒大多依附在长条棒状物上。物质的原子组成为O(50.87%)、As(9.67%)、Fe(9.37%)、Si(3.48%)、Mg(6.44%),其中O、Fe、As、Mg和Si是该颗粒主要组成元素。对其进行物质成分计算分析,推测可能是以FeAsO4、SiO2、MgO形态存在。为获得As在除砷后煤渣中存在形式和分布规律,在SEM图谱所示趋于对不同结构和形状的颗粒进行了能谱打点分析。取样点1(Sampling point 1)是由小颗粒堆叠成的团聚物,原子组成分别为O(41.92%)、Ca(8.77%)、Fe(5.69%)、As(5.06%)、Si(3.45%),表示这些团聚物主要是由O、Ca、Fe和As组成,对其进行物相成分计算分析,发现是由FeAsO4、SiO2以及少量Ca3(AsO4)2组成;取样点2(Sampling point 2)成针状型,原子组成为O(68.96%)、S(13.15%)、Ca(10.37%)、Fe(2.28%)、As(1.97%)、Si(3.48%),表示这些针状型主要是由O、S、Ca、Si、Fe、As组成,对其进行物相成分计算分析,发现是由SiO2、CaSO4、FeAsO4、Ca3(AsO4)2除此之外还有少量的Fe2O3颗粒附着于FeAsO4颗粒表面。取样点3(Sampling point 3)的原子组成为O(63.29%)、Ca(8.94%)、Fe(8.30%)、As(4.88%)、Mg(6.16%), 表示主要是由O、Ca、Fe、As、Mg组成,对其进行物质成分计算分析,发现是由CaSO4、FeAsO4和Ca3(AsO4)2并且存在着大量的Fe2O3,这一部分Fe2O3附着在FeAsO4的表面,一起形成沉淀。经过对比发现Sampling point 1的As含量最大,进一步说明这些团聚物是除砷的主要沉淀物,可以推测主要物相为FeAsO4和硅酸盐,还有少量Ca3(AsO4)2。
所以根据上述分析,煤渣中的一部分Fe2O3溶解于污酸中,煤渣既中和了污酸也可以提供三价铁,溶解于溶液中的Fe2O3会和污酸中的硫酸发生反应生成砷酸铁,与此同时,由于煤渣中含有CaO,所以在试验过程中会有一部分Ca3(AsO4)2生成,但含量不高,且不稳定,为溶解的Fe2O3会被吸附于沉淀物表面,未能发挥其除砷的功效。
4 结论本文的试验思路是利用高铁高钙煤渣处置含砷污酸,以达到去除污酸中砷离子并且生成稳定含砷化合物的目的。试验通过三种变量(加入量、反应时间、初始pH)来研究高铁高钙煤渣去除污酸中砷的效果。
(1) 当煤渣与污酸固液比为为200 g/L时,反应温度为25 ℃,反应时间为12 h条件下,含砷污酸含砷量从7 g/L降低至118.2 mg/L,除砷效率可达98.31%。燃煤渣用于污酸除砷除砷能力最高可达82.52 mg/g,随着反应时间增加除砷效率和沉淀物稳定性明显提高,。初始pH=0.98时,除砷效果最好,并且随着pH升高显著下降。
(2) 煤渣中富含铁氧化物和其他碱性氧化物,煤渣通过离子交换吸附和化学共沉淀实现污酸除砷。在酸性条件下,煤渣中铁氧化物溶解释放大量铁离子与砷酸根离子发生离子交换吸附和共沉淀作用,形成较稳定的砷酸盐及衍生物。这些含砷颗粒附着在煤渣表面促进砷稳定化,降低除砷煤渣中砷的浸出。
| [1] |
ADAMCZUK A, KOLODYNSKA D. Equilibrium, thermodynamic and kinetic studies on removal of chromium, copper, zinc and arsenic from aqueous solutions onto fly ash coated by chitosan[J]. Chemical Engineering Journal, 2015, 274: 200-212. DOI:10.1016/j.cej.2015.03.088 |
| [2] |
WAN P, YUAN M, YU X, et al. Arsenate removal by reactive mixed matrix PVDF hollow fiber membranes with UIO-66 metal organic frameworks[J]. Chemical Engineering Journal, 2020, 382: 122921. DOI:10.1016/j.cej.2019.122921 |
| [3] |
CUONG D V, WU P-C, CHEN L-I, et al. Active MnO2/biochar composite for efficient As(Ⅲ) removal: Insight into the mechanisms of redox transformation and adsorption[J]. Water Research, 2020, 188: 116495. |
| [4] |
MANI P, KIM Y, LAKHERA S K, et al. Complete arsenite removal from groundwater by UV activated potassium persulfate and iron oxide impregnated granular activated carbon[J]. ChemospHere, 2021, 277: 130225. DOI:10.1016/j.chemosphere.2021.130225 |
| [5] |
ZENG Q, ZHONG H, HE Z, et al. Efficient removal of arsenite by a composite of amino modified silica supported MnO2/Fe-Al hydroxide (SNMFA) prepared from biotite[J]. Journal of environmental management, 2021, 291: 112678. DOI:10.1016/j.jenvman.2021.112678 |
| [6] |
GOSWAMI A, RAUL P K, PURKAIT M K. Arsenic adsorption using copper (Ⅱ) oxide nanoparticles[J]. Chemical Engineering Research and Design, 2012, 90(9): 1387-1396. DOI:10.1016/j.cherd.2011.12.006 |
| [7] |
HASSAN A F, ABDEL-MOHSEN A M, ELHADIDY H. Adsorption of arsenic by activated carbon, calcium alginate and their composite beads[J]. Int J Biol Macromol, 2014, 68: 125-130. DOI:10.1016/j.ijbiomac.2014.04.006 |
| [8] |
LI Y, QI X, LI G, et al. Double-pathway arsenic removal and immobilization from high arsenic-bearing wastewater by using nature pyrite as in situ Fe and S donator[J]. Chemical Engineering Journal, 2021, 410: 128303. DOI:10.1016/j.cej.2020.128303 |
| [9] |
DE KLERK R J, FELDMANN T, DAENZER R, et al. Continuous circuit coprecipitation of arsenic(Ⅴ) with ferric iron by lime neutralization: The effect of circuit staging, co-ions and equilibration pH on long-term arsenic retention[J]. Hydrometallurgy, 2015, 151: 42-50. DOI:10.1016/j.hydromet.2014.11.003 |
| [10] |
ZHANG S-L, JIA S-Y, YU B, et al. Sulfidization of As(Ⅴ)-containing schwertmannite and its impact on arsenic mobilization[J]. Chemical Geology, 2016, 420: 270-279. DOI:10.1016/j.chemgeo.2015.11.020 |
| [11] |
GIERE R, SIDENKO N V, LAZAREVA E V. The role of secondary minerals in controlling the migration of arsenic and metals from high-sulfide wastes (Berikul gold mine, Siberia)[J]. Applied Geochemistry, 2003, 18(9): 1347-1359. DOI:10.1016/S0883-2927(03)00055-6 |
| [12] |
KEMPAHANUMAKKAGARI S, DEEP A, KIM K-H, et al. Nanomaterial-based electrochemical sensors for arsenic- A review[J]. Biosensors & Bioelectronics, 2017, 95: 106-116. |
| [13] |
MALEKPOUR A, KHODADADI M. Albumin-functionalized magnetic nanoparticles as an efficient sorbent for removal of Pb(Ⅱ), Cd(Ⅱ), Cu(Ⅱ) and Cr(Ⅵ) ions from aqueous solutions[J]. Rsc Advances, 2016, 6(18): 14705-14711. DOI:10.1039/C5RA22600G |
| [14] |
SALDANA ROBLES A, SALDANA ROBLES N, SALDANA ROBLES A L, et al. Arsenic removal from aqueous solutions and the impact of humic and fulvic acids[J]. Journal of Cleaner Production, 2017, 159: 425-431. DOI:10.1016/j.jclepro.2017.05.074 |
| [15] |
SANCHEZ J, BUTTER B, CHAVEZ S, et al. Quaternized hydroxyethyl cellulose ethoxylate and membrane separation techniques for arsenic removal[J]. Desalination and Water Treatment, 2016, 57(52): 251619. |
| [16] |
ZHANG L, CHEN S, WANG L, et al. Application of Membrane Separation Technology in Wastewater Treatment of Iron and Steel Enterprise [M]//IKHMAYIES S, LI B, CARPENTER J S, et al. Characterization of Minerals, Metals, and Materials, 2017. 2017: 545-551.
|
| [17] |
ZHOU J, XU H, TONG Z, et al. Photo/pH-controlled host-guest interaction between an azobenzene-containing block copolymer and water-soluble pillar[6] arene as a strategy to construct the "compound vesicles" for controlled drug delivery[J]. Mater Sci Eng C Mater Biol Appl, 2018, 89: 237-244. DOI:10.1016/j.msec.2018.04.010 |
| [18] |
XI Y, ZOU J, LUO Y, et al. Performance and mechanism of arsenic removal in waste acid by combination of CuSO4 and zero-valent iron[J]. Chemical Engineering Journal, 2019, 375: 121928. DOI:10.1016/j.cej.2019.121928 |
| [19] |
XI Y, ZOU J, LUO Y, et al. Performance and mechanism of arsenic removal in waste acid by combination of CuSO4 and zero-valent iron[J]. Chemical Engineering Journal, 2019, 375: 121928. DOI:10.1016/j.cej.2019.121928 |
| [20] |
易求实. 三段石灰-铁盐法处理高砷洗气污酸废水[J]. 湖北第二师范学院学报, 2011, 28(8): 24-26. DOI:10.3969/j.issn.1674-344X.2011.08.009 |
| [21] |
OCINSKI D, JACUKOWICZ-SOBALA I, MAZUR P, et al. Water treatment residuals containing iron and manganese oxides for arsenic removal from water-Characterization of physicochemical properties and adsorption studies[J]. Chemical Engineering Journal, 2016, 294: 210-221. DOI:10.1016/j.cej.2016.02.111 |
| [22] |
邓凡政, 何家红. 煤渣除砷性能研究[J]. 环境科学与技术, 1995(3): 22-23, 17. |
| [23] |
李娟, 刘新春, 余志晟, 等. 煤渣吸附水中氟和砷的研究[J]. 中国科学院大学学报, 2014, 31(4): 471-479. |
| [24] |
SARKAR C, BASU J K, SAMANTA A N. Removal of Ni2+ ion from waste water by Geopolymeric Adsorbent derived from LD Slag[J]. Journal of Water Process Engineering, 2017, 17: 237-244. DOI:10.1016/j.jwpe.2017.04.012 |
| [25] |
JIN Z, ALI B S, TIANTIAN S, et al. Fe3O4 and MnO2 assembled on honeycomb briquette cinders (HBC) for arsenic removal from aqueous solutions[J]. Journal of hazardous materials, 2015, 286: 220-228. DOI:10.1016/j.jhazmat.2015.01.004 |
| [26] |
中国环境科学研究院固体废物污染控制技术研究所, 环境标准研究所. 危险废物鉴别标准浸出毒性鉴别[Z]. 中华人民共和国国家标准. 2007: 180p: A4
|
| [27] |
GUO Z, PAN J, ZHU D, et al. Mechanism of composite additive in promoting reduction of copper slag to produce direct reduction iron for weathering resistant steel[J]. Powder Technology, 2018, 329: 55-64. DOI:10.1016/j.powtec.2018.01.063 |
| [28] |
XIAO HONG G, TINGZHI S, JIANMIN W. Quantifying effects of pH and surface loading on arsenic adsorption on NanoActive alumina using a speciation-based model[J]. Journal of hazardous materials, 2009, 166(1): 39-45. DOI:10.1016/j.jhazmat.2008.10.121 |
| [29] |
CHUANYONG J, SUQIN L, XIAOGUANG M. Arsenic leachability and speciation in cement immobilized water treatment sludge[J]. Chemosphere, 2005, 59(9): 1241-1247. DOI:10.1016/j.chemosphere.2004.11.039 |
| [30] |
WANG S, ZHANG D, LI X, et al. Arsenic associated with gypsum produced from Fe(Ⅲ)-As(Ⅴ) coprecipitation: Implications for the stability of industrial As-bearing waste[J]. Journal of Hazardous Materials, 2018, 360: 311-318. DOI:10.1016/j.jhazmat.2018.08.017 |
| [31] |
CHAI L, YANG J, ZHANG N, et al. Structure and spectroscopic study of aqueous Fe(Ⅲ)-As(Ⅴ) complexes using UV-Vis, XAS and DFT-TDDFT[J]. Chemosphere, 2017, 182: 595-604. DOI:10.1016/j.chemosphere.2017.05.018 |
| [32] |
YANG J, CHAI L, YUE M, et al. Complexation of arsenate with ferric ion in aqueous solutions[J]. Rsc Advances, 2015, 5(126): 103936-103942. DOI:10.1039/C5RA21836E |
| [33] |
MARINKOV N, MARKOVA-VELICHKOVA M, GYUROV S, et al. Preparation and characterization of silicagel from silicate solution obtained by autoclave treatment of copper slag[J]. Journal of Sol-Gel Science and Technology, 2018, 87(2): 331-339. DOI:10.1007/s10971-018-4741-8 |
 2021
2021



