| 矿物催化臭氧氧化乙硫氨酯的效率和矿化行为研究 |
乙硫氨酯是硫化矿的优良捕收剂,广泛应用于硫化矿浮选[1]。但乙硫氨酯毒性较高,生物难以降解,当浮选废水外排进入到土壤和地下水中,残留的乙硫氨酯会对水生生物和动物产生负面影响,引起严重的环境污染[2-4]。矿物浮选耗水量大,为减小外排废水量和降低新水用量,浮选废水需回用于浮选流程,但浮选废水残留有多种浮选药剂及降解产物,直接回用于浮选流程会导致浮选药剂制度紊乱,降低药剂对矿物浮选的选择性,进而影响浮选指标。
当前,乙硫氨酯的去除方法主要有生物法[5]、絮凝沉淀法[6]、吸附法[7]、化学氧化法[8]和臭氧氧化法[9]等。生物降解技术廉价、环保,但降解时间长,部分浮选药剂还会抑制微生物活性,对其产生毒性。化学氧化可有效降解乙硫氨酯,但氧化剂在矿山运输、储存和使用存在重大的安全隐患。吸附是去除浮选药剂的一种高效、简单方法,但吸附剂(如活性炭)价格较高,增加废水处理成本,且吸附剂的再生增加废水处理的复杂性。
高级氧化技术可产生强氧化性羟基自由基(·OH),无选择性地氧化难降解有机污染物,实现其彻底的矿化。近年来,臭氧氧化法、光催化氧化法、过硫酸盐法、Fenton氧化法及光电氧化法等高级氧化法已应用于黄药、黑药、乙硫氨酯等浮选药剂的降解研究,表现出很高的降解效率。与光催化氧化不同,臭氧氧化法无需从水中分离超细催化剂颗粒;与过硫酸盐法和Fenton氧化法不同,臭氧氧化适用于碱性环境,无需将pH值加酸调到酸性,更无二次残渣。因此,臭氧氧化法是适用于碱性浮选废水的处理。但是,臭氧在水中溶解度较低,臭氧转化成·OH自由基的效率受多种因素影响,单一臭氧氧化对有机物矿化程度低。研究表明,固体催化剂(如活性炭、ZnO等)可催化臭氧分解,强化其氧化能力,构建出催化臭氧氧化体系[10-12]。天然黏土矿物和过渡金属氧化物被证明是较为高效的臭氧分解催化剂,而这些物质也是浮选废水中固体悬浮物的组成矿物,因此,当臭氧氧化法处理实际浮选废水时,上述矿物即为臭氧分解的天然催化剂,形成异相催化臭氧氧化体系,强化臭氧分解[13-17]。然而,已报道的臭氧氧化选矿药剂研究多使用纯水配置的模拟浮选废水,没有考虑浮选废水中残留矿物对臭氧氧化浮选药剂的影响。
因此,本文研究了浮选废水中残留矿物对臭氧氧化乙硫氨酯效率的影响,探讨了矿物催化臭氧氧化乙硫氨酯的动力学过程,通过测定COD和SO42-离子浓度,评价残留矿物对乙硫氨酯降解过程中碳和硫元素矿化的影响,测定溶液pH值和氧化还原电位(ORP),揭示水质变化规律。
1 试验部分 1.1 试验药剂及仪器乙硫氨酯捕收剂购自中国铁岭浮选试剂有限公司,为工业纯;纯矿物(黄铜矿、黄铁矿、方铅矿、闪锌矿、方解石、石英、蒙脱土和高岭土)由杭州为民地质标本厂提供,经人工挑选、粉碎,并磨细成44 μm占90%以上的矿物粉体;其它化学试剂如浓硫酸、重铬酸钾、硫酸银和硫酸汞均为分析纯,购自上海阿拉丁生化科技股份有限公司。
试验主要仪器有臭氧发生器(SW-004,青岛维斯特电子净化设备有限公司)、紫外分光光度计(UV-5500PC,上海精密仪器仪表有限公司)、Bante900-UK多参数水质分析仪(上海般特仪器有限公司)、6B-9型智能消解仪(江苏盛奥华环保科技有限公司)。
1.2 矿物催化臭氧氧化乙硫氨酯试验过程催化臭氧氧化乙硫氨酯的试验装置如图 1所示,主要由臭氧发生装置和柱式反应器组成,圆柱形反应器的有效容积为2 L,高度为1 150 mm,内径为50 mm,底部安装有多孔玻璃板分配O3气体,并分散悬浮矿物粉体。用去离子水配置100 mg/L的乙硫氨酯溶液2 L,调节初始pH值为10.0,倒入圆柱形反应器中,并加入矿物粉体,投加量为0.5 g/L,通入臭氧气体,臭氧投加量为2.065 mg/(min·L),降解时间为180 min。本研究中,矿物粉体投加量和臭氧投加量已经过前期条件试验优化,在该投加量下可取得较好的乙硫氨酯降解效果。按设定时间取出水样,测定乙硫氨酯、COD和SO42-浓度,并分析降解过程中乙硫氨酯溶液的pH值和ORP。
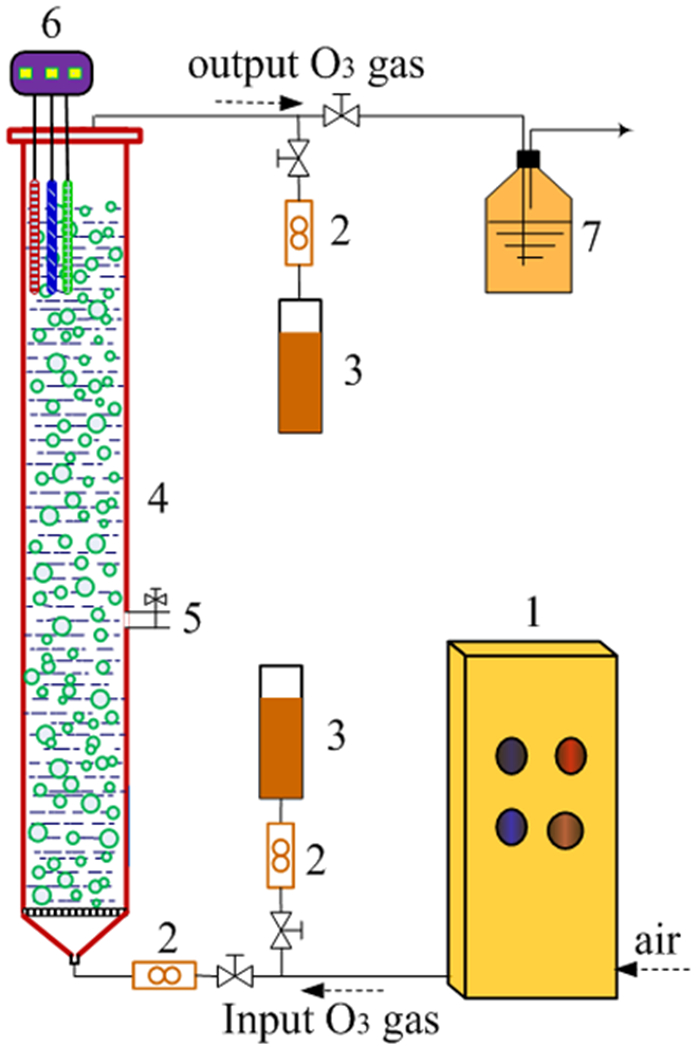 |
| 1.臭氧发生器;2.流量计;3.KI吸收液(测量O3浓度);4.圆柱形反应器;5.取样阀;6.多参数水质计;7.臭氧吸收瓶 图 1 矿物催化臭氧氧化乙硫氨酯的试验装置 Fig.1 Experimental setup for catalytic ozonation of O-isopropyl-N-ethyl thionocarbamate (Z-200) by minerals |
1.3 分析方法
乙硫氨酯浓度采用紫外可见分光光度法测定,测定波长为241 nm。乙硫氨酯溶液的COD采用快速消解紫外分光光度法测定,水样中SO42-浓度采用铬钡分光光度法(HJ/T-342-2007),水样的pH值和ORP采用多参数水质分析仪进行测定。
2 结果与讨论 2.1 硫化矿催化臭氧氧化乙硫氨酯当硫化矿投加量为0.5 g/L时,分别考察了黄铁矿、黄铜矿、方铅矿和闪锌矿催化臭氧氧化乙硫氨酯的效率,因乙硫氨酯是硫化矿的捕收剂,现对比了硫化矿对乙硫氨酯的吸附能力,结果如图 2和图 3所示。
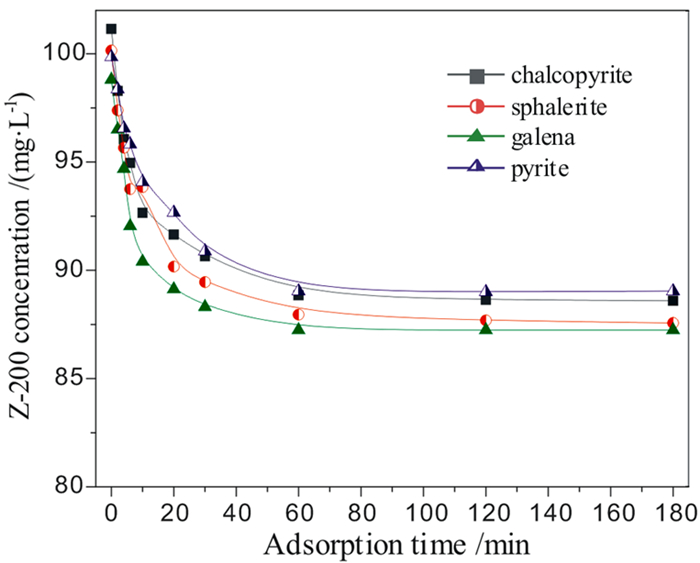 |
| 图 2 硫化矿吸附去除乙硫氨酯捕收剂 Fig.2 Adsorption removal of Z-200 collector by sulfide minerals |
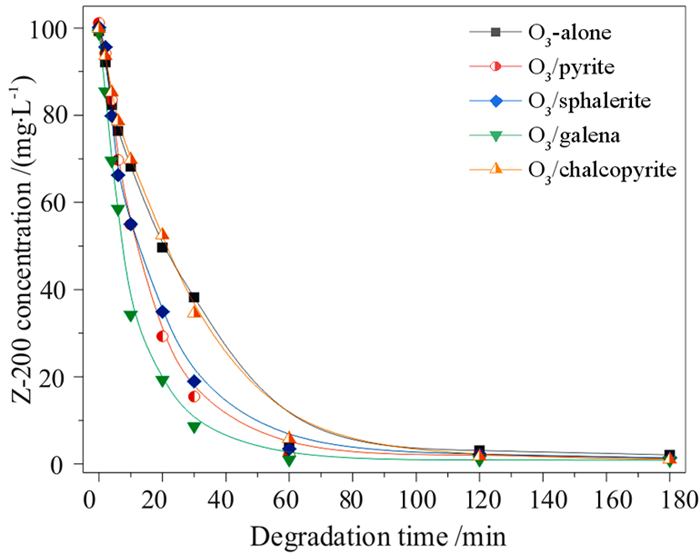 |
| 图 3 硫化矿催化臭氧氧化乙硫氨酯捕收剂 Fig.3 Catalytic ozonation of Z-200 collector by sulfide minerals |
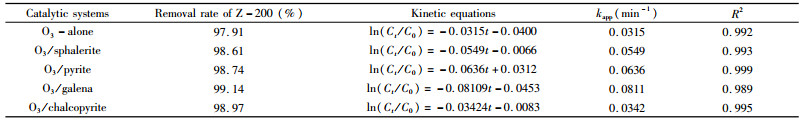
由图 2可见,黄铁矿、黄铜矿、方铅矿和闪锌矿吸附乙硫氨酯的去除率维持在12%左右,表明硫化矿对乙硫氨酯具有一定的吸附能力,与乙硫氨酯和硫化矿表面的金属原子反应形成化学吸附有关。由图 3可见,投加2.065 mg/(min·L)的臭氧后,乙硫氨酯的浓度快速下降,180 min后其去除率均超过97.9%,表明乙硫氨酯能被臭氧和其它氧化性物种分解;除黄铜矿化,硫化矿催化臭氧氧化对乙硫氨酯的去除率均明显高于单一臭氧氧化。将降解数据进行拟合,发现乙硫氨酯降解过程符合准一级反应动力学,其动力学方程和降解速率常数见表 1,可见,硫化矿均对臭氧氧化乙硫氨酯具有催化作用,特别是投加方铅矿后,降解速率常数由0.0315 min-1升高至0.0811 min-1,提高了1.57倍,4种硫化矿对催化臭氧氧化乙硫氨酯的效率具有以下顺序:方铅矿>黄铁矿>闪锌矿>黄铜矿。
| 表 1 硫化矿催化臭氧氧化乙硫氨酯捕收剂的去除率和动力学方程 Table 1 Removal rates and kinetic equations of catalytic ozonation of Z-200 collector by sulfide minerals |
|
在碱性介质中,臭氧通过链式反应式((1)~(6))可生成多强氧化性物种(·OH、·O2-等),能与乙硫氨酯迅速反应[19]。当加入硫化矿后,硫化矿表面吸附的羟基基团是臭氧分解的活性物种,促进臭氧分解[18];此外,硫化矿表面的金属原子或被臭氧氧化生成的金属氧化物,均是臭氧分解的催化物种,可促进吸附态O3分解,生成更多如·OH等活性物种,强化乙硫氨酯的降解。
| $ {{{\rm{H}}_2}{\rm{O}} \leftrightarrow {{\rm{H}}^ + } + {\rm{O}}{{\rm{H}}^ - }} $ | (1) |
| $ {{{\rm{O}}_3} + {\rm{O}}{{\rm{H}}^ - } \to \cdot {\rm{H}}{{\rm{O}}_2} + \cdot {\rm{O}}_2^ - } $ | (2) |
| $ { \cdot {{\rm{H}}_2}{\rm{O}} \to {{\rm{H}}^ + } + \cdot {\rm{OH}}_2^ - } $ | (3) |
| $ {{{\rm{O}}_2} + \cdot {\rm{O}}_2^ - \to \cdot {\rm{O}}_3^ - + {{\rm{O}}_2}} $ | (4) |
| $ { \cdot {\rm{O}}_3^ - + {{\rm{H}}^ + } \to \cdot {\rm{H}}{{\rm{O}}_3}} $ | (5) |
| $ { \cdot {\rm{H}}{{\rm{O}}_3} \to \cdot {\rm{OH}} + + {{\rm{O}}_2}} $ | (6) |
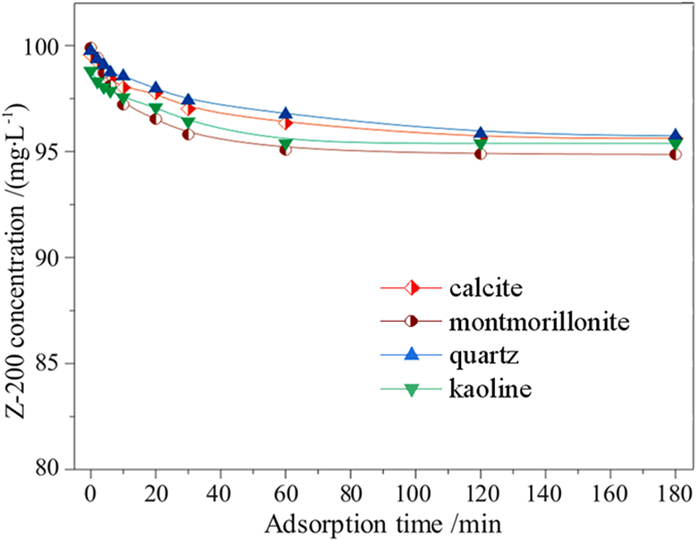
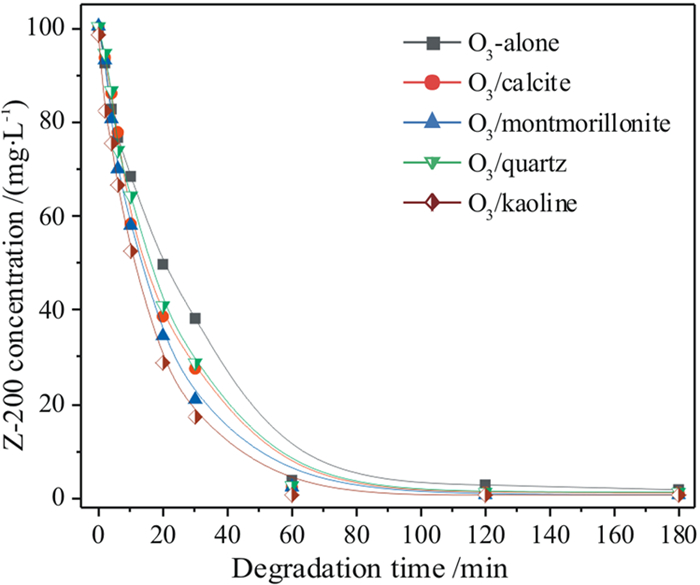
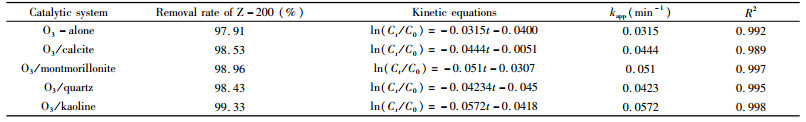
当非金属矿物投加量为0.5 g/L时,分别考察了方解石、蒙脱土、石英和高岭土催化臭氧氧化乙硫氨酯的效率,同时比较了非金属矿对乙硫氨酯的吸附能力,结果如图 4和图 5所示,将降解数据按准一级反应动力学拟合,其降解速率常数及动力学方程见表 2。
 |
| 图 4 非金属矿吸附去除乙硫氨酯捕收剂 Fig.4 Adsorption removal of Z-200 collector by non-metallic minerals |
 |
| 图 5 非金属矿催化臭氧氧化乙硫氨酯捕收剂 Fig.5 Catalytic ozonation of Z-200 collector by nonmetallic minerals |
| 表 2 非金属矿催化臭氧氧化乙硫氨酯捕收剂的去除率和动力学方程 Table 2 Removal rates and kinetic equations of catalytic ozonation of Z-200 collector by non-metallic minerals |
|
由图 4可见,方解石、蒙脱土、石英和高岭土吸附乙硫氨酯的去除率维持在8%左右,虽然蒙脱土和高岭土属于层状硅酸盐矿物,具有较大比表面积,但其表面亲水,矿物表面也缺少能与乙硫氨酯反应的金属离子,对乙硫氨酯吸附能力较弱。由图 5可见,往臭氧体系中投加非金属矿,对乙硫氨酯的氧化分解均有催化作用,特别是投加0.5 g/L的高岭土,降解速率常数由0.0315 min-1升高至0.0572 min-1,提高了0.82倍,非金属矿物催化臭氧氧化的能力顺序为高岭土>蒙脱土>方解石>石英。
臭氧氧化有机污染物主要有两种途径:(1)臭氧分子因自身强氧化性而直接氧化有机物;(2)臭氧分解生成强氧化性物种(如·OH),间接氧化有机物[20-22]。本文中乙硫氨酯溶液初始pH值为10.0,属于碱性介质,乙硫氨酯的氧化主要是由臭氧分解产生强氧化性物种来贡献。但是,在常压、常温下臭氧于水中的溶解度较低,溶液中强氧化性物种含量较低。当非金属矿物投到O3体系后,因矿物表面强烈亲水,表面含有大量羟基基团,成为催化分解吸附态O3分子的活性位,将O3分子催化转化成·OH自由基;同时,非金属矿物提供了O3分子在固/液界面的吸附活性位,促进气相中O3向溶液中转移,提高乙硫氨酯溶液中O3溶解量,进而产生更多·OH自由基[23-25]。因此,投加非金属矿物后臭氧氧化乙硫氨酯的效率明显提高。
2.3 催化臭氧氧化乙硫氨酯的COD去除和有机硫矿化乙硫氨酯降解后会生成多种中间产物,可进一步矿化成CO32-、SO42-、H2O等无机物质,本文测定了降解过程中溶液COD和SO42-离子浓度,以表征乙硫氨酯中有机碳和硫元素的矿化情况。为了定量描述乙硫氨酯中有机硫元素的矿化程度,计算了硫的矿化率[19]:
| $ \gamma = \frac{{147}}{{n \times {M_{{\rm{anion }}}}}} \times \frac{{{C_{{\rm{anion }}}}}}{{{C_0}}} \times 100\% $ | (7) |
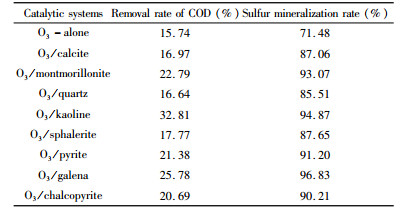
式中,γ为乙硫氨酯分子中有机硫的矿化率,n为乙硫氨酯分子中S原子数,Manion为SO42-离子的分子量,Canion (mg/L)为SO42-离子浓度,C0 (mg/L)为乙硫氨酯的初始浓度。表 3列出矿物催化臭氧氧化乙硫氨酯180 min后COD去除率和硫矿化率。
| 表 3 O3-alone和O3/矿物体系降解乙硫氨酯捕收剂的COD去除率和硫的矿化率 Table 3 Removal rates of COD and sulfur mineralization rates of Z-200 degradation by O3-alone and O3/minerals |
|
图 6是降解180 min后COD去除率和SO42-离子浓度,可见,单一臭氧氧化乙硫氨酯,COD去除率和硫矿化率只有15.74%和71.48%,当投加0.5 g/L矿物作为催化剂时,COD去除率上升到16.97%~32.81%,硫矿化率上升到85.51%~96.83%,表明8种矿物均对乙硫氨酯中有机碳和有机硫的矿化有催化作用,在硫化矿和非金属矿物中,方铅矿和高岭土分别具有最强的催化作用,特别是加入高岭土后,COD去除率增加了1.08倍,硫矿化率从71.48%增加到96.87%,表现出明显的催化臭氧氧化作用。
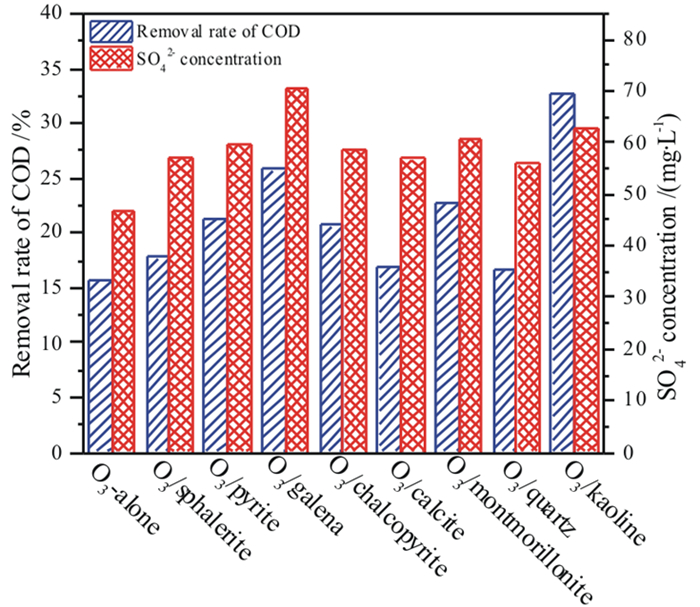 |
| 图 6 矿物催化臭氧氧化乙硫氨酯捕收剂的COD去除率和SO42-浓度 Fig.6 Removal rates of COD and SO42- concentrations in the catalytic ozonation of Z-200 collector by minerals |
图 7比较了O3、O3/方铅矿和O3/高岭土分别降解乙硫氨酯时SO42-浓度变化情况,可见,随着降解时间的延长,三种氧化体系中SO42-浓度不断上升,表明乙硫氨酯中有机硫能被氧化成最高阶的无机硫物种(SO42-离子),转化成稳定、无害的无机硫产物。往O3体系中加入方铅矿和高岭土后,SO42-离子浓度快速增加,表明方铅矿和高岭土作为臭氧分解的催化剂,能强化乙硫氨酯及中间产物分子中有机硫向SO42-离子的转化,使得乙硫氨酯矿化更为彻底。
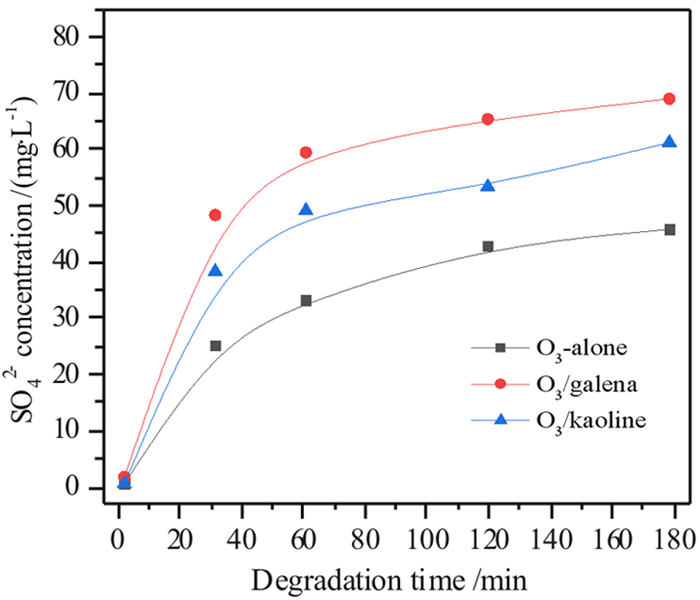 |
| 图 7 O3-alone、O3/方铅矿和O3/高岭土降解乙硫氨酯捕收剂的SO42-浓度变化 Fig.7 The changes of SO42- concentration in the degradation of Z-200 collector by O3-alone, O3/galena and O3/kaoline |
2.4 降解过程中pH值和ORP变化规律
臭氧氧化分解乙硫氨酯捕收剂时,随着乙硫氨酯及中间产物的氧化,溶液pH值及氧化还原电位(ORP)也会有相应变化,当浮选废水经臭氧氧化处理返回到浮选流程中时,溶液pH值和ORP会对矿物浮选产生较大影响。因此,本文研究了O3、O3/方铅矿和O3/高岭土降解乙硫氨酯过程中pH值和ORP的变化规律,结果如图 8所示,可见,随着降解时间的延长,溶液pH值不断下降,180 min后,O3、O3/方铅矿和O3/高岭土体系的pH值分别降低到8.046、7.725和7.836,式(1)~(6)的O3链式分解反应表明,OH-离子会不断被消耗,H+离子不断从H2O中解离出来,导致pH值不断降解。此外,乙硫氨酯被·OH自由基氧化,会转化成羧酸类有机物,也会降低pH值。在O3体系中加入方铅矿和高岭土后,矿物表面的羟基基团作为吸附态O3分解的催化剂,会不断被消耗,加速H2O的解离反应,导致H+离子的累积。因此,O3/方铅矿和O3/高岭土体系的pH值比单一O3体系的pH值更低。
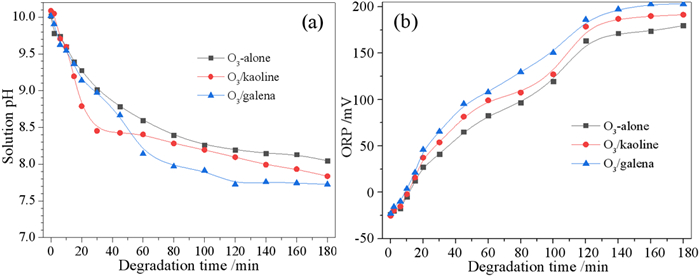 |
| 图 8 O3、O3/方铅矿和O3/高岭土降解乙硫氨酯过程中溶液pH (a)和ORP (b)的变化 Fig.8 The changes of solution pH (a) and ORP (b) in the degradation of Z-200 collector by O3-alone, O3/galena and O3/kaoline |
高级氧化法降解有机污染物,ORP值是表征能被·OH自由基等氧化性物种氧化的有机物浓度的指标,即ORP值越大,则表示溶液中可被氧化的有机物浓度越低。由图 8(b)可见,O3、O3/方铅矿和O3/高岭土体系降解乙硫氨酯后,ORP值上断上升,180 min后,ORP值从-23.1 mV增加到179.6 mV、202.9 mV和191.3 mV,ORP值的增加表明乙硫氨溶液中能与·OH自由基反应的有机物浓度变低,此与图 5中COD去除率增加相一致。在O3体系中投加方铅矿和高岭土,因方铅矿和高岭土可催化分解臭氧而生成更多强氧化性物种,提高了O3/方铅矿和O3/高岭土体系对乙硫氨酯及中间产物分解的能力,导致ORP值变得更大。浮选过程中矿浆ORP值与捕收剂存在形态和矿物表面氧化等有关,浮选废水经臭氧氧化处理后返回到浮选流程,需考虑ORP升高对矿物浮选的影响。
3 结论(1) 浮选废水中残留矿物多具有催化臭氧氧化作用,可提高臭氧氧化乙硫氨酯的效率,乙硫氨酯降解符合准一级反应动力学规律,按乙硫氨酯的降解速率常数排序,硫化矿强化臭氧氧化的能力顺序:方铅矿>黄铁矿>闪锌矿>黄铜矿,非金属矿强化臭氧氧化的顺序:高岭土>蒙脱土>方解石>石英。
(2) 臭氧氧化乙硫氨酯的COD去除率和硫的矿化率只有15.74%和71.48%,投加0.5 g/L矿物后,COD去除率上升到16.97%~32.81%,硫的矿化率上升到85.51%~96.83%,矿物催化臭氧氧化作用可强化中间产物分解,其中方铅矿和高岭土对乙硫氨酯中间产物分解的强化作用再明显。
(3) 随着乙硫氨酯的降解,溶液pH值从10.0下降到7.7~8.0,ORP值从-23.1 mV上升到约180~200 mV。
| [1] |
Chen S H, Xiong P, Zhan W, et al. Degradation of ethylthionocarbamate by pyrite-activated persulfate[J]. Minerals Engineering, 2018, 122: 38-43. DOI:10.1016/j.mineng.2018.03.022 |
| [2] |
Cheng H, Lin H, Huo H X, et al. Continuous removal of ore flotation reagents by an anaerobic-aerobic biological filter[J]. Bioresource Technology, 2012, 114: 255-261. DOI:10.1016/j.biortech.2012.03.088 |
| [3] |
Molina G C, Cayo C H, Rodrigues M A S, et al. Sodium isopropyl xanthate degradation by advanced oxidation process[J]. Minerals Engineering, 2013, 45: 88-93. DOI:10.1016/j.mineng.2012.12.001 |
| [4] |
Chen S H, Gong W Q, Mei G J, et al. Primary biodegradation of sulfide mineral flotation collectors[J]. Minerals Engineering, 2011, 24: 953-955. DOI:10.1016/j.mineng.2011.01.003 |
| [5] |
Chen S H, Gong W Q, Mei G J, et al. Quantitative structure-biodegradability relationship of sulfide mineral flotation collectors[J]. International Journal of Mineral Processing, 2011, 101: 112-115. DOI:10.1016/j.minpro.2011.09.001 |
| [6] |
Fu P F, Feng J, Yang T W, et al. Comparison of alkyl xanthates degradation in aqueous solution by the O3 and UV/O3 processes:Efficiency, mineralization and ozone utilization[J]. Minerals Engineering, 2015, 81: 128-134. DOI:10.1016/j.mineng.2015.08.001 |
| [7] |
Rezaei R, Massinaei M, Zeraatkar M A. Removal of the residual xanthate from flotation plant tailings using modified bentonite[J]. Minerals Engineering, 2018, 119: 1-10. |
| [8] |
Silvester E, Truccolo D, Fu P H. Kinetics and mechanism of the oxidation of ethyl xanthate and ethyl thiocarbonate by hydrogen peroxide[J]. Journal of the Chemical Society, Perkin Transactions, 2002, 2(9): 1562-1571. |
| [9] |
Grzegorz B, André F. Wastewater treatment by means of advanced oxidation processes at basic pH conditions:A review[J]. Chemical Engineering Journal, 2017, 320: 608-633. DOI:10.1016/j.cej.2017.03.084 |
| [10] |
Miriam B, Rubí R, Gabriela R, et al. Ozonation of indigo carmine catalyzed with Fe-pillared clay[J]. International Journal of Photoenergy, 2013, 10: 1-7. |
| [11] |
Dariush S, René R, Abdelkrim A. Advances in catalytic oxidation of organic pollutants-prospects for thorough mineralization by natural clay catalysts[J]. Applied Catalysis B:Environmental, 2015, 174: 277-292. |
| [12] |
Jung H, Choi H. Catalytic decomposition of ozone and para-chlorobenzoic acid (pCBA) in the presence of nanosized ZnO[J]. Applied Catalysis B:Environmental, 2006, 66: 288-294. DOI:10.1016/j.apcatb.2006.03.009 |
| [13] |
Kasprzyk-Hordern B, Ziolek M, Nawrocki J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment[J]. Applied Catalysis B:Environmental, 2003, 46: 639-669. DOI:10.1016/S0926-3373(03)00326-6 |
| [14] |
Behera S K, Mishra D P, Ghosh C N, et al. Characterization of lead-zinc mill tailings, fly ash and their mixtures for paste backfilling in underground metalliferous mines[J]. Environmental Earth Sciences, 2019, 78: 394. DOI:10.1007/s12665-019-8395-9 |
| [15] |
Quinteros J, Wightmana E, Johnson N W, et al. Evaluation of the response of valuable and gangue minerals on a recovery, size and liberation basis for a low-grade silver ore[J]. Minerals Engineering, 2015, 74: 150-155. DOI:10.1016/j.mineng.2014.12.019 |
| [16] |
Lei C, Yan B, Chen T, et al. Comprehensive utilization of lead-zinc tailings, part 1:Pollution characteristics and resource recovery of sulfur[J]. Journal of Environmental Chemical Engineering, 2015, 3: 862-869. DOI:10.1016/j.jece.2015.03.015 |
| [17] |
Ikhlaq A, Brown D R, Kasprzyk-Hordern B. Mechanisms of catalytic ozonation on alumina and zeolites in water:formation of hydroxyl radicals[J]. Applied Catalysis B:Environmental, 2012, 123: 94-106. |
| [18] |
齐飞.铝氧化物催化臭氧氧化水中嗅味物质的效能与机理研究[D].哈尔滨: 哈尔滨工业大学, 2008. http://d.wanfangdata.com.cn/Thesis/D272029
|
| [19] |
Fu P F, Lin X F, Li G, et al. Degradation of thiol collectors using ozone at a low dosage:Kinetics, mineralization, ozone utilization, and changes of biodegradability and water quality parameters[J]. Minerals, 2018, 8: 477. DOI:10.3390/min8110477 |
| [20] |
孙贤波, 赵庆详, 曹国民, 等. 高级氧化法的特性及应用[J]. 中国给水排水, 2002, 18(5): 33-35. DOI:10.3321/j.issn:1000-4602.2002.05.010 |
| [21] |
Camel V, Bermond A. The use of ozone and associated oxidation processes in drinking water treatment[J]. Water Research, 1998, 32(11): 3208-3222. DOI:10.1016/S0043-1354(98)00130-4 |
| [22] |
Hoigné J, Bader H. Rate constants of reaction of ozone with organic compounds[J]. Water Research, 1983, 17(2): 173-185. DOI:10.1016/0043-1354(83)90098-2 |
| [23] |
刘玥.硅酸盐催化剂制备及其催化臭氧氧化水中氯代硝基苯[D].哈尔滨: 哈尔滨工业大学, 2011. http://d.wanfangdata.com.cn/Thesis/D263810
|
| [24] |
翟旭.纳米ZnO催化臭氧氧化去除饮用水中二氯乙酸的效能与机理[D].哈尔滨: 哈尔滨工业大学, 2010. http://d.wanfangdata.com.cn/Thesis/D269227
|
| [25] |
申亚东.蒙脱土基改性催化剂的制备及催化臭氧化效能研究[D].哈尔滨: 哈尔滨工业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10213-1017863160.htm
|
 2020
2020



