| Fe3+与水玻璃组合抑制剂对萤石和方解石浮选分离的影响 |
2. 冶金矿产资源高效利用与造块湖北省重点实验室, 湖北 武汉 430081;
3. 长沙矿冶研究院有限责任公司, 湖南 长沙 410012
2. Hubei Key Laboratory for Efficient Utilization and Agglomeration of Metallurgic Mineral Resources, Wuhan 430081, China;
3. Changsha Research Institute of Mining and Metallurgy Limited Liability Company, Changsha 410012, China
萤石是所有工业类矿物含氟量最高的,常被用来制备氢氟酸[1]。萤石资源不可再生,十分宝贵,在矿业领域内被称为“第二稀土”[2]。萤石常与石英、方解石等多种矿物共生。根据矿石组成的不同,萤石矿的分类有以下五种,即多金属伴生萤石矿、石英-萤石矿、重晶石-萤石矿、方解石-萤石矿和硫化矿-萤石矿[3]。其中方解石-萤石矿由于矿物表面都含有Ca2+的活性位点,使其可浮性相似,浮选分离比较困难[4]。萤石和方解石在物理化学性质方面有许多相似的地方,例如两种矿物晶格含有相同的金属阳离子Ca2+;采用脂肪酸类药剂作捕收剂时都很容易上浮;两种含钙矿物会在溶液中发生部分溶解,产生少量F-和CO32-,F-会与方解石发生反应,同时CO32-也会在萤石表面发生反应,使得两种含钙矿物表面离子相互转化,且在浮选过程中,矿浆pH值对两种矿物相互转化有较大影响,从而增加了萤石和方解石的分离难度[5, 6]。
水玻璃常被用作含钙矿物浮选的抑制剂,随着实际生产中萤石原矿品位的降低,水玻璃的单独使用往往难以达到较好的分离效果。研究表明,在浮选体系中加入金属离子可以增强药剂的选择性[7, 8],如张波[9]采用Cu2+、Fe3+作为活化剂对萤石进行活化后,萤石浮选回收率都有了较高的提升。Deng[10]等人则发现Fe2+可作为助抑剂,用来增强水玻璃对方解石的选择性抑制效果。Feng[11]将Pb2+与水玻璃预先混合形成盐化水玻璃,在Pb2+与水玻璃之比为1:3时,该盐化水玻璃对方解石的抑制性能显著提高。以上研究表明,金属离子可以提高水玻璃的选择性,从而实现含钙矿物的分离。
本文以萤石和方解石为研究对象,在浮选试验中将Fe3+与水玻璃组合,探究该组合抑制剂对两种含钙浮选分离的影响,并通过吸附量测定、表面动电位测试、溶液化学计算研究了组合抑制剂的抑制机理。
1 试验样品制备及研究方法 1.1 试验样品、药剂与设备试验前分别从湖南柿竹园和江西香炉山选取纯度较高的萤石和方解石块矿。两种矿样分别进行人工锤碎,进一步挑选结晶良好的矿物颗粒。磨矿试验采用陶瓷球磨机进行,磨矿后筛分出+38-74 μm粒级矿样,为浮选试验制备原料。+74 μm返回再磨,多次循环防止过磨,-38 μm粒级则继续磨至-5 μm左右,为原料性质分析以及机理分析做准备。
图 1为两种矿物的X射线衍射(XRD)分析结果。由图 1可知,两种矿物的特征峰明显,基本无杂峰,说明制备的单矿物矿样纯度较高。经化学分析,萤石纯度为99.1%,方解石纯度98.3%,纯度均>95%,符合浮选及机理分析试验的原料要求。试验过程中使用的药剂如表 1所示。试验过程中使用的仪器设备如表 2所示。
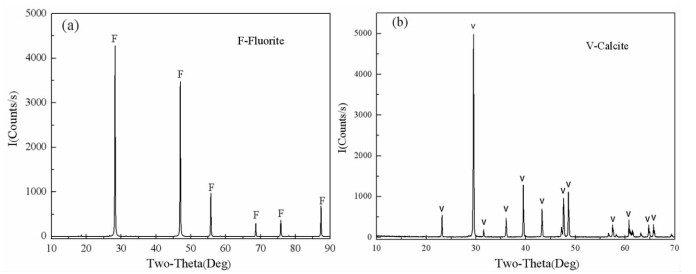 |
| 图 1 萤石(a)、方解石(b)的X射线衍射图谱 Fig.1 X-ray diffraction pattern of fluorite(a) and calcite(b) |
| 表 1 试验所用药剂一览表 Table 1 List of agents used in the test |

|
| 表 2 试验所用设备一览表 Table 2 List of instruments and equipment used in the test |

|
1.2 浮选试验
取2.0 g矿样放入40 mL浮选槽内,将转速调为1 680 r/min,加入去离子水35 mL后开始搅拌,加入pH调整剂搅拌调浆2 min,加入抑制剂搅拌4 min,加捕收剂搅拌3 min,浮选刮泡4 min。浮选得到的精矿和尾矿分别进行烘干、称重并计算其回收率。试验流程如图 2所示。
 |
| 图 2 浮选流程 Fig.2 Flotation flow |
1.3 吸附量测定
配置不同浓度的油酸钠溶液,分别测出其紫外吸光度,绘制油酸钠标准曲线。称取2 g矿样,按浮选相同条件加入去离子水以及各种药剂,静置一段时间后,取上清液离心分离并测出吸光度,通过油酸钠标准曲线得出其质量浓度,由式式τ=304.44(c0-c)V/m计算油酸钠在矿物表面的吸附量τ。
1.4 Zeta电位测量称取50 mg矿样,按浮选相同的条件加入去离子水,然后进行调浆、加药,搅拌过程采用磁力搅拌器进行,搅拌后静置,将上清液取出后注入表面动电位的样品池进行测量。样品需进行三次测量,计算平均值作为最终结果。
2 结果与讨论 2.1 水玻璃用量对萤石和方解石浮选回收率的影响图 3所示为在pH值为8.0、油酸钠用量为1.5×10-4 mol/L的条件下,水玻璃用量对两种矿物浮选回收率的影响。
 |
| 图 3 水玻璃用量对两种矿物浮选回收率的影响 Fig.3 Effect of sodium silicate dosage on flotation recovery of two kinds of minerals |
由图 3可以看出,在水玻璃用量为0 mg/L时,两种矿物的可浮性相近,随着水玻璃用量的增加,两种矿物的浮选回收率呈下降趋势。且在相同用量条件下,萤石回收率都低于方解石。试验结果表明,萤石和方解石的浮选都会受到水玻璃的抑制,相对于方解石,水玻璃对萤石产生更强的抑制效果,仅采用水玻璃做抑制剂难以达到两种含钙矿物的分离。
2.2 Fe-水玻璃的对萤石和方解石浮选行为的影响 2.2.1 Fe-水玻璃质量比对萤石和方解石浮选回收率的影响本小节引入FeCl3·6H2O作为辅助试剂,浮选前,在去离子水中将水玻璃与FeCl3·6H2O按不同质量比混合,制备出组合抑制剂Fe-水玻璃。图 4所示为在Fe-水玻璃用量为75 mg/L、pH值为8.0、油酸钠用量为1.5×10-4 mol/L时,Fe-水玻璃质量比对两种矿物浮选回收率的影响。
 |
| 图 4 Fe-水玻璃质量比对两种矿物浮选回收率的影响 Fig.4 Effect of mass ratio of Fe-sodium silicate on flotation recovery of two kinds of minerals |
由图 4可以看出,萤石在Fe-水玻璃质量比为0:1至9:1的范围内都有着较好的可浮性。在Fe3+与水玻璃之比为5:1时,萤石浮选回收率为77.92%。对于方解石,浮选回收率随着Fe-水玻璃质量比的增加先略微增加后迅速下降最终趋于平缓,在Fe3+与水玻璃之比为5:1时,方解石的浮选回收率仅为6.36%。试验结果表明,与水玻璃体系相比,Fe-水玻璃体系中Fe3+的加入对萤石浮选的影响很小,而在Fe-水玻璃质量比为5:1至9:1的范围内对方解石的浮选都产生较强的抑制作用,实现了两种矿物的选择性浮选分离。
2.2.2 Fe-水玻璃用量对萤石和方解石浮选回收率的影响图 5所示为在Fe-水玻璃质量比为5:1、pH值为8.0、油酸钠用量为1.5×10-4 mol/L的条件下,Fe-水玻璃用量对两种矿物浮选回收率的影响。
 |
| 图 5 Fe-水玻璃用量对两种矿物浮选回收率的影响 Fig.5 Effect of the amount of Fe-sodium silicate on the flotation recovery of two kinds of minerals |
由图 5可以看出,对于萤石,在Fe-水玻璃用量为75 mg/L之前,萤石保持着较高的回收率,在Fe-水玻璃用量为75 mg/L之后,浮选回收率开始呈快速下降的趋势;对于方解石,仅在Fe-水玻璃用量为25 mg/L之前浮选回收率较高,在Fe-水玻璃用量为25 mg/L之后,浮选回收率迅速下降。试验结果表明,在一定Fe-水玻璃用量下,萤石的可浮性都较好,而方解石在较低用量条件下就被强烈抑制。在Fe-水玻璃用量为75 mg/L时,两种矿物的浮选回收率差距很大,实现了选择性分离。
2.2.3 pH对萤石和方解石浮选回收率的影响图 6所示为在Fe-水玻璃用量为75 mg/L、Fe-水玻璃质量比为5:1、油酸钠用量为1.5×10-4 mol/L的条件下,pH对两种矿物浮选回收率的影响。
 |
| 图 6 pH对两种矿物浮选回收率的影响 Fig.6 Effect of pH on flotation recovery of two kinds of minerals |
由图 6可以看出,对于萤石,在pH值为7.0~10.0范围内回收率都较高;对于方解石,在pH值为7.0~11.0范围内回收率都很小。试验结果表明,在Fe-水玻璃体系中,萤石在一定pH条件下都保持着较好的可浮性,而方解石在整个pH范围内都被强烈抑制,在pH值为7.0~10.0时,萤石和方解石可以实现较好的分离,其中pH为8.0时分离效果最好。
结合图 4-6可以看出,在Fe-水玻璃体系中,在抑制剂用量较低的条件下,与水玻璃体系相比,Fe3+的加入使得水玻璃对方解石的抑制作用显著提高,而对萤石的抑制作用减弱,选择性的抑制了方解石的浮选。
2.3 吸附量测定结果水玻璃以及Fe-水玻璃用量对萤石和方解石表面油酸钠吸附量的影响如图 7(a)、(b)所示。
 |
| 图 7 水玻璃用量(a)和Fe-水玻璃用量(b)对两种矿物表面油酸钠吸附量的影响 Fig.7 Effects of sodium silicate dosage (a) and Fe-water glass dosage (b) on NaOL adsorption on two kinds of minerals surface |
由图 7(a)可以看出,萤石和方解石表面油酸钠在的吸附量随着水玻璃用量的增加都呈逐渐下降的趋势。在相同用量条件下,油酸钠在萤石表面的吸附量都小于方解石。结合萤石和方解石在油酸钠和水玻璃存在下的浮选性能,可以推断水玻璃的抑制行为主要是由于水玻璃的吸附会覆盖两种矿物表面的活性位点,阻碍油酸钠的后续吸附,从而抑制矿物的浮选。
由图 7(b)可以看出,萤石和方解石表面油酸钠的吸附量随着Fe-水玻璃用量的增加都逐渐下降。在相同用量条件下,方解石表面油酸钠的吸附量都小于萤石。在Fe-水玻璃的体系中,与水玻璃体系相比,Fe3+与水玻璃混合后的产物在方解石表面发生较强的吸附作用,阻碍了捕收剂油酸钠的吸附,降低了方解石表面的疏水性,抑制了方解石的浮选。
2.4 Zeta电位测量结果为了分析Fe-水玻璃、水玻璃对两种矿物表面Zeta电位的影响,分别测量了水玻璃、Fe3+以及Fe-水玻璃与两种矿物作用前后Zeta电位的变化,结果如图 8(a)、(b)所示。
 |
| 图 8 不同溶液中pH对萤石(a)和方解石(b)表面Zeta电位的影响 Fig.8 Effect of pH on the Zeta potential of fluorite (a) and calcite (b) in different solutions |
由图 8(a)可以看出,萤石的零电点为7.3,随着pH的增加,萤石的Zeta电位持续下降。当只有水玻璃存在时,萤石Zeta电位呈负向变化,说明萤石表面吸附了带负电荷的硅酸钠组分。当只有Fe3+存在时,Zeta电位正向移动,说明萤石表面吸附了Fe3+。而在Fe-水玻璃体系中,萤石Zeta电位负向移动,但与水玻璃体系相比,表面电位负移程度很小,这可能是由于Fe3+和水玻璃在萤石表面都发生了吸附,或者是Fe3+与水玻璃的在溶液中发生反应,生成的产物在萤石表面有较弱的吸附作用。
由图 8(b)可以看出,方解石的零电点为8.1。结合图 8(a)、(b),可以得出,在加入相同药剂的溶液中,方解石Zeta电位的变化与同条件下萤石Zeta电位的变化趋势是一致的。值得注意的是,当溶液中加入Fe-水玻璃时,方解石表面电位的负移程度(Δζ)比相同溶液条件下萤石的负移程度大得多,可以推断,在Fe-水玻璃体系中,Fe3+与水玻璃会同时吸附在方解石表面,且其吸附量比同条件下萤石的吸附量大,或者是Fe3+与水玻璃在溶液中发生反应,反应物在方解石表面产生强烈的吸附作用,阻碍了捕收剂油酸钠的后续吸附,对方解石产生较强的抑制作用。
2.5 浮选溶液化学计算结果为了进一步研究组合抑制剂的吸附机理,本小节计算了Fe3+和水玻璃的水解组分分布。Fe3+与水玻璃在溶液中随着pH值的不同会发生不同程度的水解。水解反应如下[12]:
| $ \text{F}{{\text{e}}^{3+}}+3\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{Fe}{{(\text{OH})}_{3(~\text{S})}}\quad \log {{K}_{\text{sp}}}=38.8 $ | (1) |
| $ \text{F}{{\text{e}}^{3+}}+\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{FeO}{{\text{H}}^{2+}}\quad \log {{\beta }_{1}}=11.81 $ | (2) |
| $ \text{F}{{\text{e}}^{3+}}+2\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{FeOH}_{2}^{+}\quad \log {{\beta }_{2}}=22.3 $ | (3) |
| $ \text{F}{{\text{e}}^{3+}}+3\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{FeO}{{\text{H}}_{3(\text{aq})}}\quad \log {{\beta }_{3}}=32.05 $ | (4) |
| $ \text{F}{{\text{e}}^{3+}}+4\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{FeOH}_{4}^{-}\quad \log {{\beta }_{4}}=34.3 $ | (5) |
| $ \text{Si}{{\text{O}}_{2(~\text{s},\text{amorphous})}}+2{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{Si}{{(\text{OH})}_{4}}\quad \log {{K}_{1}}=-2.7 $ | (6) |
| $ \text{Si}{{(\text{OH})}_{4}}\rightleftharpoons \text{SiO}(\text{OH})_{3}^{-}\quad \log {{K}_{2}}=-9.43 $ | (7) |
| $ \text{Si}(\text{OH})_{3}^{-}\rightleftharpoons \text{Si}{{\text{O}}_{2}}(\text{OH})_{2}^{2-}+{{\text{H}}^{+}}\quad \log {{K}_{3}}=-12.56 $ | (8) |
Fe3+的水解组分分布可由式(1)~(5)计算得出,其中Fe3+的初始浓度为2.3·10-4 mol/L(Fe-水玻璃质量比5:1时Fe3+的浓度),水玻璃的水解组分分布可由式(6)~(8)计算得出。溶液化学计算结果如图 9(a)、(b)所示。
 |
| 图 9 Fe3+(a)和水玻璃(b)的水解组分图 Fig.9 Hydrolysis composition of Fe3+ (a) and sodium silicate (b) |
由图 9(a)可以看出,Fe3+在水溶液中发生水解反应,溶液中会存在Fe3+、FeOH2+、Fe(OH)2+、Fe(OH)3(aq)、Fe(OH)3(s)和Fe(OH)4-这六种含铁组分。在不同的溶液pH条件下含铁组分的优势组分都不相同。由图 9(b)可以看出,水玻璃溶液中含有三种不同的含硅组分,分别是pH < 9.4时的Si(OH)4,pH为9.4~12.6时的SiO(OH)3-以及pH>12.6时的SiO2(OH)22-,随pH的不同,溶液中含硅组分的优势组分也会发生改变。Fe3+与水玻璃混合后,随着溶液中OH-的消耗,H+浓度随之上升,迫使水玻璃的水解反应(7)、(8)向左进行,进而生成更多的Si(OH)4,Si(OH)4是抑制方解石浮选的有效组分[13, 14]。随着溶液中Si(OH)4含量的增加,SiO(OH)3-、SiO2(OH)22-含量减少,SiO(OH)3-、SiO2(OH)22-是抑制萤石浮选的有效组分[15]。此外,Fe3+与水玻璃在溶液中会发生反应,生成Fe-水玻璃的聚合物,该聚合物会强化对方解石的抑制[16],Fe3+的水解组分与水玻璃的水解组分的反应式如下所示:
中性及弱碱性条件下:
| $ \begin{matrix} \text{F}{{\text{e}}^{3+}}+3\text{Si}{{(\text{OH})}_{4}}\rightleftharpoons \\ \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+3{{\text{H}}^{+}} \\ \end{matrix} $ | (9) |
| $ \begin{matrix} \text{FeO}{{\text{H}}^{2+}}+3\text{Si}{{(\text{OH})}_{4}}\rightleftharpoons \\ \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+2{{\text{H}}^{+}}+{{\text{H}}_{2}}\text{O} \\ \end{matrix} $ | (10) |
| $ \begin{matrix} \text{Fe}(\text{OH})_{2}^{+}+3\text{Si}{{(\text{OH})}_{4}}\rightleftharpoons \\ \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+{{\text{H}}^{+}}+2{{\text{H}}_{2}}\text{O} \\ \end{matrix} $ | (11) |
碱性条件下:
| $ \begin{matrix} \text{Fe}{{(\text{OH})}_{3(\text{aq})}}+3\text{SiO}(\text{OH})_{3}^{-}\rightleftharpoons \\ \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+3\text{O}{{\text{H}}^{-}} \\ \end{matrix} $ | (12) |
| $ \begin{matrix} \text{Fe}(\text{OH})_{4}^{-}+3\text{SiO}(\text{OH})_{3}^{-}\rightleftharpoons \\ \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+4\text{O}{{\text{H}}^{-}} \\ \end{matrix} $ | (13) |
聚合反应:
| $ \begin{matrix} \text{Si}{{(\text{OH})}_{3}}\text{OFe}{{\left[ \text{OSi}{{(\text{OH})}_{3}} \right]}_{2}}+\text{nSiO}(\text{OH})_{3}^{-}\rightleftharpoons \\ \text{Fe}{{\left[ \text{SiO}{{(\text{OH})}_{3}} \right]}_{3}}\left[ \text{SiO}{{(\text{OH})}_{3}} \right]_{\text{n}}^{\text{n}-1} \\ \end{matrix} $ | (14) |
由上述分析可以得出,与水玻璃体系相比,在Fe-水玻璃体系中,Fe3+的加入会使溶液中Si(OH)4增多,且Fe3+的水解组分与水玻璃水解组分在溶液中会发生反应,生成Fe-水玻璃聚合物,Si(OH)4和Fe-水玻璃聚合物选择性吸附在方解石表面,从而抑制方解石的浮选。而Si(OH)4的增加会导致抑制萤石的水玻璃的水解组分SiO(OH)3-和SiO2(OH)22-含量减少,萤石的可浮性提高。
3 结论(1) 浮选试验结果表明,与水玻璃相比,Fe-水玻璃对方解石产生较强的抑制作用,而对萤石浮选影响较小,实现了两种矿物的浮选分离。
(2) 机理检测结果表明,在Fe-水玻璃体系中,Fe3+的加入会使溶液中Si(OH)4增多,且溶液中会生成Fe-水玻璃聚合物,Si(OH)4以及Fe-水玻璃聚合物在方解石表面发生选择性吸附作用,阻碍了油酸钠的后续吸附,抑制了方解石的浮选。
| [1] |
ZHANG C, SUN W, HU Y, et al. Investigation of two-stage depressing by using hydrophilic polymer to improve the process of fluorite flotation[J]. Journal of Cleaner Production, 2018, 193(20): 228-235. |
| [2] |
王文利, 白志民. 中国萤石资源及产业发展现状[J]. 金属矿山, 2014(3): 1-9. DOI:10.3969/j.issn.1671-8550.2014.03.001 |
| [3] |
曹钊, 屈奇奇, 曹永丹, 等. 不同类型萤石矿浮选工艺技术现状与进展[J]. 金属矿山, 2017(7): 8-12. DOI:10.3969/j.issn.1001-1250.2017.07.002 |
| [4] |
邓湘湘, 廖德华. 萤石选矿技术研究现状[J]. 怀化学院学报, 2015, 34(11): 100-102. |
| [5] |
ZENG X, XU L, TIAN J, et al. Effect of a CA depressant on flotation separation of celestite from fluorite and calcite using SDS as a collector[J]. Minerals Engineering, 2017, 111: 201-208. DOI:10.1016/j.mineng.2017.06.019 |
| [6] |
FA K, NGUYEN A V, MILLER J D. Interaction of calcium dioleate collector colloids with calcite and fluorite surfaces as revealed by AFM force measurements and molecular dynamics simulation[J]. International Journal of Mineral Processing, 2006, 81(3): 166-177. DOI:10.1016/j.minpro.2006.08.006 |
| [7] |
XU L, WU H, DONG F, et al. Flotation and adsorption of mixed cationic/anionic collectors on muscovite mica[J]. Minerals Engineering, 2013, 41: 41-45. DOI:10.1016/j.mineng.2012.10.015 |
| [8] |
YANG B, WANG D, WANG T, et al. Effect of Cu2+ and Fe3+ on the depression of molybdenite in flotation[J]. Minerals Engineering, 2019, 130: 101-109. DOI:10.1016/j.mineng.2018.10.012 |
| [9] |
张波, 李解, 张雪峰, 等. Cu2+, Fe3+对萤石浮选的活化作用机制[J]. 稀有金属, 2016, 40(9): 963-968. |
| [10] |
DENG R, YANG X, HU Y, et al. Effect of Fe(Ⅱ) as assistant depressant on flotation separation of scheelite from calcite[J]. Minerals Engineering, 2018, 118: 133-140. DOI:10.1016/j.mineng.2017.12.017 |
| [11] |
FENG B, GUO W, XU H G, et al. The combined effect of lead ion and sodium silicate in the flotation separation of scheelite from calcite[J]. Separation Science and Technology, 2017, 52(3): 567-573. DOI:10.1080/01496395.2016.1260590 |
| [12] |
王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科学技术出版社, 1988: 336-337.
|
| [13] |
DONG L Y, JIAO F, QIN W Q, et al. Effect of acidified water glass on the flotation separation of scheelite from calcite using mixed cationic/anionic collectors[J]. Applied Surface Science, 2018, 444: 747-756. DOI:10.1016/j.apsusc.2018.03.097 |
| [14] |
FENG B, LUO X P, WANG J Q, et al. The flotation separation of scheelite from calcite using acidified sodium silicate as depressant[J]. Minerals Engineering, 2015, 80: 45-49. DOI:10.1016/j.mineng.2015.06.017 |
| [15] |
杨晓峰. 白钨矿与含钙脉石分离抑制剂的遴选及作用机理研究[D]. 昆明: 昆明理工大学, 2015.
|
| [16] |
WEI Z, HU Y H, HAN H S, et al. Selective flotation of scheelite from calcite using Al-Na2SiO3 polymer as depressant and Pb-BHA complexes as collector[J]. Minerals Engineering, 2018, 120: 29-34. DOI:10.1016/j.mineng.2018.01.036 |
 2020
2020


