| 氧化预处理技术在铜钼硫化矿浮选分离中的研究进展 |
钼作为一种重要的稀有金属和战略储备资源,它具有优异的性能,如高熔点和良好的热硬度等,被广泛应用于航空航天、机械制造、冶金、船舶、电子、化工等行业[1]。辉钼矿(MoS2)是钼提取的主要来源,除了极少数以单一矿床存在,其他大部分广泛与硫化铜矿物伴生,而黄铜矿为最常见的硫化铜矿物,全球钼产出量的大约50%来自斑岩型铜钼矿石[2]。但是我国铜钼矿的开发利用存在一系列问题,如矿石品位低、粒度细、共伴生成分多、分离困难等。随着社会的发展,对铜、钼等矿产的需求日益增加。因此,实现高效、绿色、低成本的铜钼分离已成为铜钼矿利用亟待解决的技术问题[3]。
铜钼矿石通常通过抑铜浮钼方式浮选分离黄铜矿和辉钼矿,因此需要选择性优异且效果好的抑制剂。虽然一些传统的无机抑制剂[4]、有机低分子抑制剂[5]或组合抑制剂[6]对铜钼分离有一定的效果,但普遍存在用量大、污染环境、选择性差、处理成本高等问题。常用的黄铜矿抑制剂见表 1。
| 表 1 常用的黄铜矿抑制剂 Table 1 Common chalcopyrite inhibitors |

|
针对现在铜钼分离存在的问题,国内外研究人员提出了一些新的分离工艺,包括充氮气浮选法[7]、超导磁选技术[8]、氧化预处理—浮选技术[9]等。充氮气浮选是为了减少抑制剂跟氧的反应,因为铜钼分离常用的抑制剂大部分都是还原剂,很容易氧化失效增大抑制剂的消耗。以氮气代替空气作起泡介质,从而减少抑制剂用量,但是充氮气浮选法存在制备氮气占地面积大、工艺复杂、成本高等缺点。超导磁选法是将超导技术应用于磁选领域的一种新磁选方法,根据矿物比磁化系数分类,辉钼矿属于非磁性矿物,黄铜矿属于弱磁性矿物,因此辉钼矿和黄铜矿具有理论上磁选分选的可能性,但是超导磁选法存在分离效率低、处理量低的缺点。氧化预处理—浮选技术是利用氧化剂或特殊氧化方式预处理铜钼混合矿,使得黄铜矿表面被亲水氧化产物覆盖而受到抑制,然后实现铜钼矿物浮选分离的目的。由于两种矿物表面性质不同,氧化预处理可能会在黄铜矿和辉钼矿表面产生不同类型的氧化产物,从而改变矿物表面的润湿性,扩大它们之间的可浮性差异,进而可以通过浮选方式有效分离铜钼混合矿。氧化预处理使用的氧化剂或氧化方式不会对环境产生污染,可以选择性地抑制黄铜矿,替代传统抑制剂,减少对环境的污染,是实现铜钼硫化矿绿色高效分离的重要途径。
1 铜钼硫化矿表面特性矿物的表面特性与矿物的浮选行为息息相关[10-12]。矿物的化学组成、晶体结构、接触角、表面电位和表面成分[13-15]的差异,导致不同矿物表面性质不同,以及矿物的复杂多样性和浮选行为的差异[16-17]。
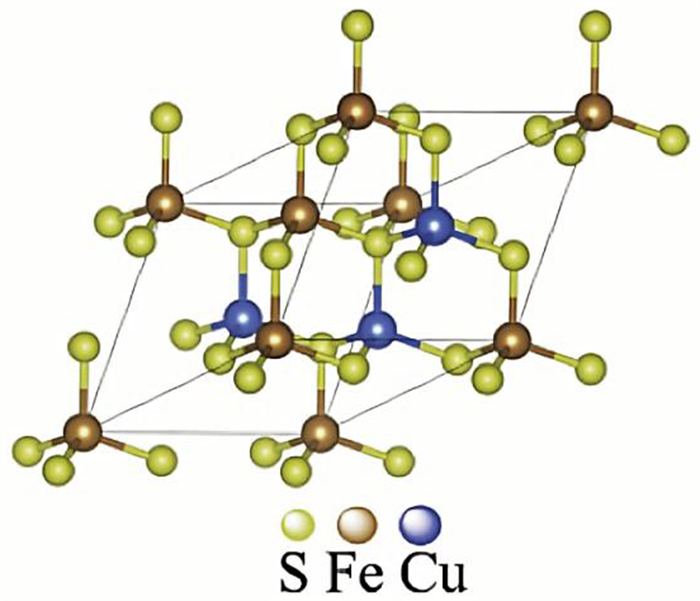
1.1 黄铜矿的表面特性黄铜矿晶体具有D2d12=I42d的空间对称结构,属于四方晶系脉,阳离子在结构中有序分布。在黄铜矿晶体中,每个硫原子和两个Cu、两个Fe金属原子形成四面体配位,每个金属原子和四个硫原子也形成四面体配位[18-19],如图 1所示。黄铜矿晶体既有共价键也有离子键,是一种混合半导体。黄铜矿具有较高的晶格能、较强的抗氧化性,因此具有良好的自然可浮性。CuFeS2理论组成是Fe 30.52%、Cu 34.56%和S 34.92%,其中每种元素的化合价是Cu为+l价、Fe为+3价、S为-2价[20],因此黄铜矿氧化后的表面产物类型可能是+2价氧化铜或铜的氢氧化物、+3价氧化铁或铁的氢氧化物以及硫酸盐(SO42-)或单质硫[21]。
1.2 辉钼矿的表面特性
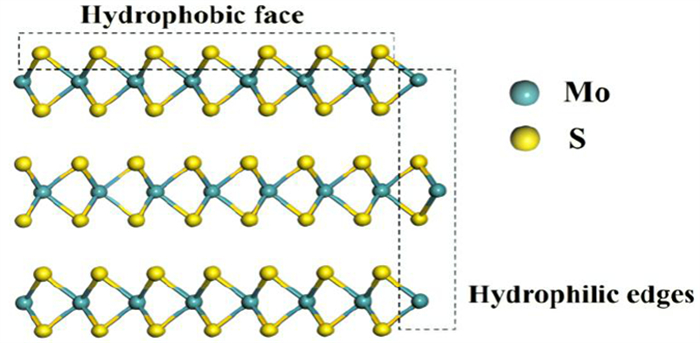
辉钼矿(MoS2)通常为鳞片状,其中含钼59.94%、硫40.06 %。辉钼矿的表面性质与晶体结构密切相关,辉钼矿是一种典型的各向异性矿物,属于六方晶系或三方晶系,自然界最常见的晶体结构是2H型,它具有完整的解理,显示出三棱柱配位多面体层。晶胞内钼原子配位数为六,它与硫原子形成二方柱,六个硫原子形成方柱的中心[22],如图 2所示。辉钼矿晶体是由有分子键相联结构的许多单层MoS2组成。而单层MoS2的上下层为硫原子层,由钼原子层在中间隔开,同一钼网面内,相邻钼原子之间由金属键连接;在同一个硫网平面内,相邻的硫原子通过共价键连接,相邻的钼原子和硫原子通过离子键连接[23]。
 |
| 图 2 辉钼矿的晶体结构[23] Fig.2 Crystalline structure of molybdenite |
辉钼矿的“面”和“棱”具有不同的性质,其中“面”具有很强的疏水性,“棱”具有很强的亲水性[24]。从图 2可以看出,辉钼矿层和层之间由弱的分子键结合,夹层中硫离子和钼离子之间则以强的离子键结合。因此,在辉钼矿破碎过程中,较易沿着弱的分子键断裂,暴露出非极性晶体表面(其接触角约为80°),形成高度疏水的片状解离面,这是辉钼矿可浮性较好的主要原因。破碎后的辉钼矿表面特性由暴露的表面键能性质决定。分子键断裂形成的层面具有低表面键能、较好的疏水性和抗氧化性;而S-Mo-S离子键断裂形成的端面具有较强的亲水性且易氧化[14, 25],断裂的亲水性端面接触角较小,范围在0~48 °之间。
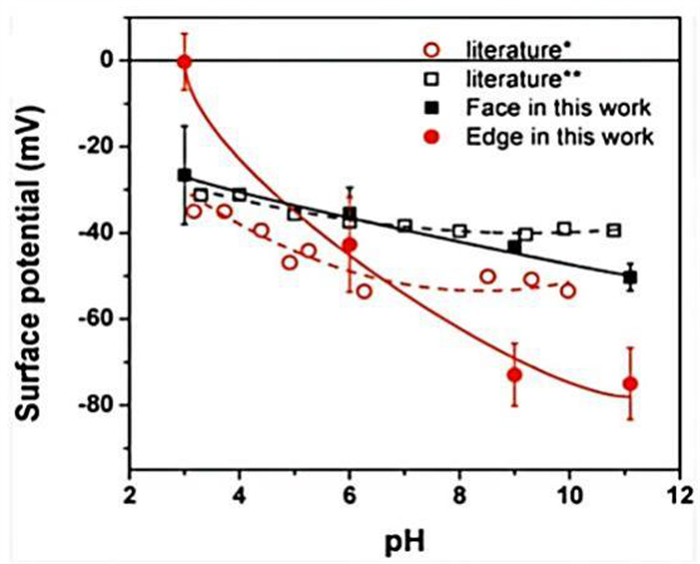
表面电位是影响辉钼矿表面特性的另一个关键因素,由于辉钼矿的各向异性结构,层面和端面(棱)电荷会有所不同。Lu等人[26]报告了辉钼矿层面和端面(棱)的电位,如图 3所示。在pH值为3~11的范围内,层面和端面(棱)均带负电。端面(棱)的零电点在pH 3左右,层面的零电点低于pH 3.0。此外,由于氢氧化物离子的吸附,两种表面电位均随pH值的升高而降低,端面的电位下降速度要快于层面。这是由于Mo原子被氧化成的HMoO4-/MoO42-离子极易吸附在端面上导致的。棱是影响辉钼矿表面电位的主要原因[22],因此棱面比越大,辉钼矿表面电位的负值越大。
 |
| 图 3 辉钼矿在10 mmol/L NaCl溶液中的表面和端面的表面电位[26] Fig.3 Surface potentials of face and edge plane of molybdenite in 10 mmol/L NaCl solution |
2 铜钼硫化矿表面氧化机理 2.1 黄铜矿表面氧化机理
自20世纪80年代以来,许多学者开始使用现代电化学测试的方法来研究黄铜矿氧化作用机理。他们检测了黄铜矿的阳极极化曲线,发现从静息电位开始,主要出现了两个不同的电化学响应,第一个响应出现在开路电位+740 mV vs.Ag/AgCL,称为钝化区,如式(1)~(3)所示[27],而随着电位继续升高出现了第二个区域,被认为是后钝化区[28-31],在钝化区,铁比铜更容易从矿物表面溶解,黄铜矿表面转化为富铜硫化物(CuS,S0,Cul-xFe1-yS2-x)[32-33]。
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} \to 1/2{\rm{CuS}} + 1/2{\rm{CuS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;\;{\rm{F}}{{\rm{e}}^{2 + }} + {{\rm{S}}^0} + 4{{\rm{H}}^ + } + 6{\rm{e}} \end{array} $ | (1) |
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} \to 0.75{\rm{CuS}} + 0.25{\rm{C}}{{\rm{u}}^{2 + }} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;\;{\rm{F}}{{\rm{e}}^{2 + }} + 1.25{{\rm{S}}^0} + 2.5{\rm{e}} \end{array} $ | (2) |
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_2} \to {\rm{C}}{{\rm{u}}_{1 - {\rm{x}}}}{\rm{F}}{{\rm{e}}_{1 - {\rm{y}}}}{{\rm{S}}_{2 + {\rm{x}}}}{\rm{C}}{{\rm{u}}^{2 + }} + {\rm{yF}}{{\rm{e}}^{2 + }} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;2\left( {{\rm{x}} + {\rm{y}}} \right){\rm{ }}{{\rm{e}}^ - }\left( {{\rm{y}} \gg {\rm{x}};{\rm{x}} + {\rm{y}} \approx 1} \right) \end{array} $ | (3) |
而这些中间体的产生被认为是阻碍黄铜矿持续氧化的原因,因为生成的这层中间体的氧化溶解速率明显低于黄铜矿原始界面。当外加电位升高并进入后钝化区时,如式(4)~(6)所示,钝化层被破坏,黄铜矿主体开始氧化,其示意图如图 4所示。
| $ {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} \to {\rm{ C}}{{\rm{u}}^{2 + }} + {\rm{F}}{{\rm{e}}^{3 + }} + 2{{\rm{S}}^{\rm{0}}} + 5{\rm{e}} $ | (4) |
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} + 8{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{u}}^{2 + }} + {\rm{F}}{{\rm{e}}^{3 + }} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;2{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 17{{\rm{H}}^ + } + 17{\rm{e}} \end{array} $ | (5) |
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{u}}^{2 + }} + {\rm{F}}{{\rm{e}}^{2 + }} + 2/3{\rm{ }}{{\rm{S}}^{\rm{0}}} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;1/{\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}^{\rm{4}}} + 3{{\rm{H}}^{\rm{ + }}} + 7{\rm{e}} \end{array} $ | (6) |
 |
| 图 4 在缩合模型下有钝化层存在时黄铜矿浸出的离子变换过程[28] Fig.4 Ion transformation process of chalcopyrite leaching in the presence of passivation layer under condensation model |
从图 4可以看出,在有氧化剂的浸出过程中(自然状态下的氧气是最常见的氧化剂),O2失去电子并被还原成H2O,同时黄铜矿中的硫会被氧化成单质硫;当氧化电位足够高时,硫的氧化产物是SO42-。与此同时矿物中的铁也会以离子的形式溶解在浸出体系中,随着电位和浸出条件的变化,会在Fe2+和Fe3+两种状态下相互转化从而影响浸出进程。铜则以离子形式进入溶液相完成浸出。在浸出过程中,黄铜矿浸出的副反应产物或反应中间体将覆盖黄铜矿的表层,这些反应中间体作为钝化层阻碍了黄铜矿原始界面与浸出剂之间的接触,使矿物难以持续浸出,然而该钝化层的化学本质尚未得到证实。
在不同的氧化环境和不同的暴露时间下,黄铜矿表面的氧化产物也有所不同。例如在空气环境中,抛光的黄铜矿表面将在短时间内形成Fe3O4/FeOOH和富铜硫化物Cu5FeS4/Cu2S。随着暴露时间的增加,在4 min内黄铜矿的断裂面将产生大量羟基铁,铁浓度升高而铜和硫的浓度降低,硫的价态不会发生明显变化[34]。当黄铜矿暴露超过10 d时,断口上会生成SO42-和Cu2+,可能发生的反应如下:
| $ {\rm{Cu}}{{\rm{S}}_{\rm{2}}} + 2x{{\rm{O}}_{\rm{2}}} \to x{\rm{CuS}}{{\rm{O}}_{\rm{4}}} + {\rm{C}}{{\rm{u}}_{1 - x}}{{\rm{S}}_{2 - x}} $ | (7) |
相比于空气环境中,黄铜矿在溶液中的氧化速度更快一些。在酸性环境中,黄铜矿表面的溶解会促进硫的氧化和铁氧化物的溶解。黄铜矿在酸性条件下的氧化将会发生以下反应[35]:
| $ {\rm{CuFe}}{{\rm{S}}_{\rm{2}}} + {{\rm{O}}_{\rm{2}}} + 4{{\rm{H}}^{\rm{ + }}} \to {\rm{C}}{{\rm{u}}^{{\rm{2 + }}}} + {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (8) |
| $ {\rm{CuFe}}{{\rm{S}}_2} + 4{\rm{F}}{{\rm{e}}^{3 + }} \to {\rm{C}}{{\rm{u}}^{2 + }} + 5{\rm{F}}{{\rm{e}}^{2 + }} + 2{{\rm{S}}^{\rm{0}}} $ | (9) |
Harmer等人[36]研究了pH 1.0、85 ℃条件下黄铜矿表面产物层随时间的变化,并提出了3步反应机理:(1)Cu和Fe被释放到溶液中,S2-聚合生成Sn-;(2)金属阳离子没有释放到溶液中,但是表面S2-和其他短链多硫化物将会重新生成并进一步氧化,形成单质硫S0;(3)金属阳离子的释放。
同样,在碱性环境下,Hua[37]也建立了黄铜矿表面氧化在弱碱性条件下的3步反应机理(如图 5所示):(1)第一个氧化步骤涉及Fe3+的释放,分别形成Fe氧化物和缺铁的CuFe1-xS2层。(2)黄铜矿中更多的Fe3+离子移动到固体/电解质界面,形成FeOOH顶层;随后形成由铜硫化物(CuS、CuS2、CuSn)、S0和FeOOH颗粒组成的抗氧化膜。(3)可能导致重新形成含有S2-的中间层和其他短链多硫化物剥离后的顶层。并且Hua还总结了黄铜矿在不同pH值和不同电位下的氧化和钝化机理。在强酸性电解液中,钝化层由S0(高电位)或CuSn(低电位)组成。在中性电解液中,钝化效果不太明显。在弱碱性电解液中,钝化层由含FeOOH(高电位)的S0和含FeOOH(低电位)的CuSn组成。相反,在强碱性电解液中,钝化层中仅存在FeOOH。
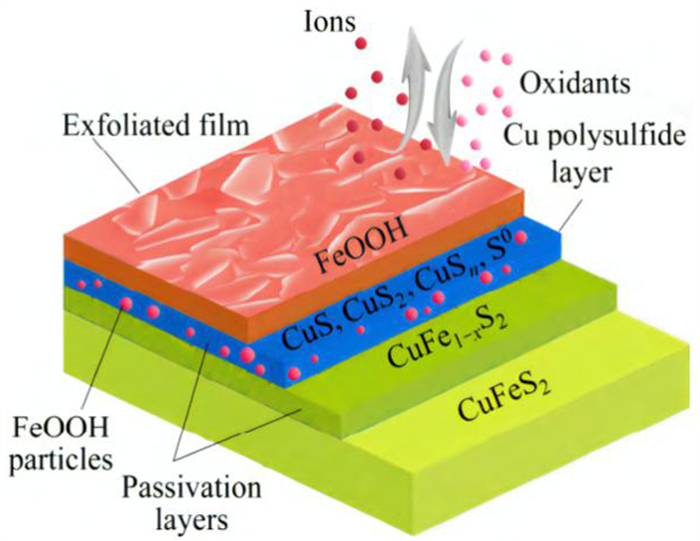 |
| 图 5 黄铜矿表面界面反应面模型[37] Fig.5 Chalcopyrite surface reaction surface model |
综上所述,对于黄铜矿的氧化,无论是在空气、酸性或中性条件下,在氧化过程中,黄铜矿副反应产物或反应中间产物会覆盖于黄铜矿表面层,形成一层钝化层阻碍了黄铜矿原始界面持续氧化。黄铜矿在不同的氧化环境和不同的暴露时间下,形成的钝化层也会有所不同,但是到目前为止关于钝化层的成分与性质现在仍存在许多争议,主要有三种观点:(1)铁的氢氧化物沉淀类;(2)单质硫类;(3)铜的聚硫化物类。黄铜矿氧化时形成的钝化层会直接影响黄铜矿表面的润湿性,与黄铜矿的可浮性密切相关。因此合理控制黄铜矿的氧化,对于黄铜矿的浮选极为重要。
2.2 辉钼矿表面氧化机理与其他硫化矿相比,辉钼矿较难氧化[38],目前关于辉钼矿的氧化机理研究主要集中在层面和端面氧化差异及可浮性差异。
Wang等人[39]通过检测开路电位(OCP)来研究辉钼矿的层面和端面氧化。图 6a显示了辉钼矿在0.1 mol/L氯化钠溶液中pH值为9和11时,层面和端面的初始OCP。在pH值为9时,层面的初始OCP为41 mV(Ag/AgCl),高于端面的-90 mV(Ag/AgCl)。当pH值增加到11时,层面和端面初始OCP分别降低到-17 mV和-121 mV。无论是在pH值为9,pH值为11,端面初始OCP比表面初始OCP都低,这表明在氧化还原反应[40]期间,端面比层面更容易失去电子,阳极和阴极反应可能为:
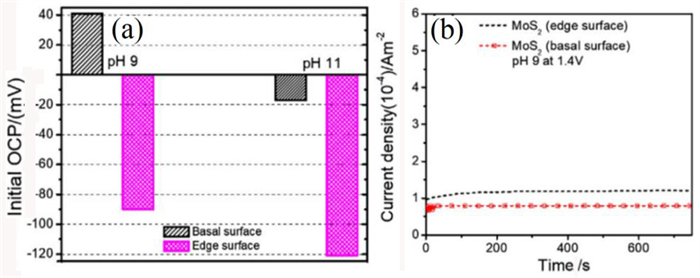 |
| 图 6 (a) 在pH 9和pH 11的0.1 M NaCl中MoS2层面和端面电极的初始OCP(mV)[39];(b)在辉钼矿电极上以1.4 V电压在10 s内进行800 s恒电位试验的结果[41] Fig.6 (a) Initial OCP (mV) of MoS2 basal and edge electrodes in 0.1 M NaCl at pH 9 and pH 11;(b) results of potentiostatic experiments performed on molybdenite electrodes at 1.4 V for 800 s |
阴极反应为:
| $ {{\rm{O}}_2} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}} + 4{\rm{e}} \to 4{\rm{O}}{{\rm{H}}^ - } $ | (10) |
阳极反应为:
| $ {\rm{Mo}}{{\rm{S}}_{\rm{2}}} + 8{\rm{O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_4}^{2 - } + 2{{\rm{S}}^{\rm{0}}} + 4{{\rm{H}}_{\rm{2}}}{\rm{O}} + 6{\rm{e}} $ | (11) |
上述结果说明,端面比层面更容易氧化。Miki等人[41]进行的电位极化研究也表明,在电位扫描过程中,端面比层面更导电,更容易氧化,如图 6b所示。因此,对于辉钼矿的氧化,更倾向于端面氧化,这可能是辉钼矿荷负电的主要原因之一。
Lu等人[26]报道了在碱性条件下,辉钼矿层面和端面都会带负电荷,且端面的负电荷相对大于层面。因为与疏水层面相比,辉钼矿端面在含有O2和OH-的溶液中更容易氧化形成MoO42-和HMoO4-,如式(12)和(13)所示:
| $ \begin{array}{l} 2{\rm{Mo}}{{\rm{S}}_2} + {\rm{ }}9{{\rm{O}}_2} + 10{\rm{O}}{{\rm{H}}^ - } \to 2{\rm{HMo}}{{\rm{O}}_{\rm{4}}}^ - + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;4{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 4{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ | (12) |
| $ {\rm{HMo}}{{\rm{O}}_4}^ - + {\rm{O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_{\rm{4}}}^{2 - } + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (13) |
辉钼矿氧化生成HMoO4-通常发生在pH值为2~6的范围内,随着pH值增加,HMoO4-转变成MoO42-越多。因此,MoO42-是辉钼矿端面在碱性条件下的主要氧化产物[42],如图 7所示。同样Fuerstenau等人[38]也表明辉钼矿可以发生以下氧化反应,如式(14)和(15)所示:
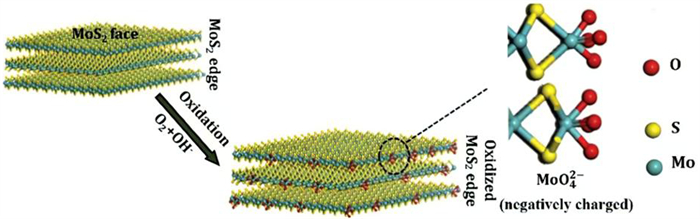 |
| 图 7 辉钼矿氧化示意图[42] Fig.7 Schematic diagram of molybdenite oxidation |
| $ {\rm{Mo}}{{\rm{S}}_{\rm{2}}} + 8{\rm{O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_{\rm{4}}}^{2 - } + {\rm{2S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 4{{\rm{H}}_{\rm{2}}}{\rm{O}} + 6{{\rm{e}}^ - } $ | (14) |
如果溶液中含有溶解氧,可能会发生以下反应:
| $ 2{\rm{Mo}}{{\rm{S}}_{\rm{2}}} + 7{{\rm{O}}_{\rm{2}}} \to 2{\rm{Mo}}{{\rm{O}}_{\rm{3}}} + 4{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } $ | (15) |
综上所述,对于辉钼矿的氧化,它的层面和端面的性质不同,两者的氧化也有很大的差异。以分子键断裂形成的层面为非极性面,具有低表面键能、较好的疏水性和抗氧化性;而S-Mo-S离子键断裂形成的端面为极性面,易氧化且具有较强的亲水性。端面暴露出钼原子,亲氧亲水,极易生成MoO42-和HMoO4-,这些离子会吸附在其表面,导致辉钼矿疏水性大大降低。因此,辉钼矿磨矿过程中,在保证矿物充分解离的同时还要避免过磨,降低辉钼矿棱面比,防止可浮性显著降低。
3 铜钼硫化矿表面氧化对浮选行为的影响在硫化矿浮选分离过程中,矿物氧化产生的疏水性和亲水性物质会影响矿物表面的物理化学性质,进而影响硫化矿的浮选行为。在浮选过程中,矿物颗粒在气泡表面的黏附以及随后随气泡上升的稳定性将由矿物颗粒表面疏水性和亲水性物质的比例控制,矿物表面可能同时存在许多疏水性和亲水性物质,改变这些物质的比例可能会对矿物的浮选行为产生重大影响[19]。当矿物被氧化时,其氧化深度和氧化产物类型的不同将显著影响矿物的浮选行为[43]。
3.1 黄铜矿表面氧化对浮选行为的影响黄铜矿在溶液环境中会发生表面氧化,如果是适当氧化,将产生疏水的单质硫S0和多硫化物Sn2-,使其能够实现无捕收剂浮选或降低捕收剂的消耗;如果氧化过度,将会产生亲水性的金属氧化物和硫氧酸根(S2O32-和SO42-等),从而抑制黄铜矿的浮选[44]。如果黄铜矿只是被轻微氧化,如在N2气氛下制备的新鲜黄铜矿的样品则几乎能够完全上浮,但是黄铜矿在空气中氧化3周后最大回收率仅为36.4%,这说明其表面生成了大量亲水性物质[45]。
实际上,表面氧化对硫化矿可浮性的影响可能受氧化后矿物表面亲水性和疏水性物质比例控制。Fairthorne [46]等人发现,黄铜矿在酸性或碱性条件下被氧化时,表面铁原子会优先被氧化和溶解,使矿物表面形成富硫和缺金属的产物,溶液中检测到的铁离子浓度高于亚铜离子的浓度(z>y),其反应可用式(16)表示。溶解的金属离子最后在黄铜矿表面形成氢氧化物吸附或沉淀,从而使黄铜矿的表面电位从负转变成正,具体的化学反应由式(17)和式(18)表示。
| $ {\text{CuFe}}{{\text{S}}_2} \rightleftharpoons {\left( {{\text{CuS}}} \right)_{1 - y}}{\left( {{\text{FeS}}} \right)_{1 - z}}{({{\text{S}}^{2 - }})_{y + Z + y}}{\text{C}}{{\text{u}}^ + } + z{\text{F}}{{\text{e}}^{3 + }} $ | (16) |
| $ {\text{C}}{{\text{u}}^{2 + }} + n{{\text{H}}_{\text{2}}}{\text{O}} \rightleftharpoons {\text{Cu}}{\left( {{\text{OH}}} \right)_n}^{\left( {2 - n} \right) + } + n{{\text{H}}^ + } $ | (17) |
| $ {\text{F}}{{\text{e}}^{3 + }} + n{{\text{H}}_{\text{2}}}{\text{O}} \rightleftharpoons {\text{Fe}}{\left( {{\text{OH}}} \right)_n}^{\left( {3 - n} \right) + } + n{{\text{H}}^ + } $ | (18) |
然后,表面的亲疏水性以及黄铜矿浮选由这两个过程控制,即黄铜矿中的铁和铜溶解后留下一个疏水性金属缺乏、富硫的疏水表面,然后以铁和铜氢氧化物形式重新沉淀形成亲水的表面。这些金属氢氧化物的形成和沉淀动力学可能会控制表面亲疏水性。
3.2 辉钼矿表面氧化对浮选行为的影响辉钼矿独特的晶体结构使其具备良好的天然可浮性,但表面氧化依然会影响辉钼矿的浮选行为。氧化后,辉钼矿接触角减小,导致亲水性增加,可浮性降低[38]。尤其是粒径较小的辉钼矿,在浮选过程中容易与介质中的O2发生氧化反应,进而改变其表面性质,对辉钼矿的浮选行为产生不利影响。
辉钼矿断裂时主要沿夹层解离,这种鳞片状的解离表面具有天然的疏水性,较难被氧化,因此具有良好的可浮性。然而当辉钼矿过粉碎时,晶体边缘的棱数量会相对增加,因为这种晶棱为极性表面,很容易氧化且具有亲水性[12],这将会导致辉钼矿的可浮性降低[47]。
辉钼矿作为各向异性矿物,表面和端面的润湿性不同,表面润湿性是影响矿物浮选行为的关键因素。表面润湿性可以通过表面接触角来估计,表面接触角是表面氧化程度的函数。如图 8a所示[48]。辉钼矿表面是疏水的,端面是亲水的。据报道,疏水表面的接触角约为70°[49],相反,亲水性端面的接触角较小,范围为0~48°[41]。图 8b为不同pH值条件下,辉钼矿表面和端面接触角的变化趋势,可以看出,随着pH值的增加,矿物表面接触角仅略有减小[26, 42]。这归因于表面稳定性强,不易氧化,形成的钼酸盐(MoO42-)少[42];而以S-Mo-S离子键断裂形成的辉钼矿的端面,因具有高表面能则相对容易氧化,氧化产物MoO42-越多,其接触角越低。图 8c显示了不同粒度等级的辉钼矿矿物的测量接触角,并且随着粒度的减小而减小[50]。这可以解释为较小的辉钼矿颗粒具有较高的棱面比,这导致相对于端面区域面积大,表面面积较小。因此,辉钼矿的整体接触角随着粒度的减小而减小,氧化难易随着粒度的减小而变易,可浮性随着粒度的减小而减小。
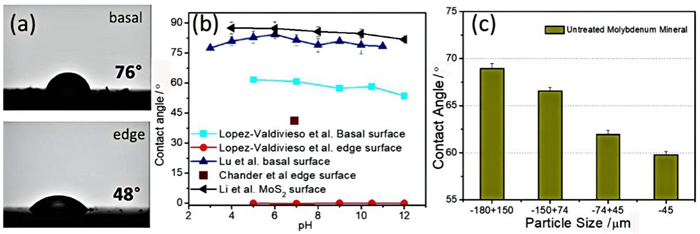 |
| 图 8 (a) 辉钼矿表面和端面接触角图像[48](接触角使用座滴法测量);(b)先前研究中的表面和端面的接触角[48](接触角使用座滴法测量);(c)不同粒径的辉钼矿的接触角[50](接触角是用压片法测量的) Fig.8 (a) Image of water contact angle of molybdenite basal and edge plane[48](contact angle was measured using a sessile drop method); (b) contact angle ofbasal and edge plane from previousstudies [48]; (c) contact angle of molybdenite of different particle size[50] (contact angle was measured using a pressed pellet method) |
4 铜钼硫化矿氧化浮选分离
大量文献表明,硫化矿选择性浮选分离的难易程度取决于表面氧化的程度[51],而表面氧化在很大程度上取决于矿物类型,黄铜矿相对于辉钼矿更易氧化,且二者产生的表面氧化产物也有所不同。由于这些原因,通过氧化处理对铜钼硫化矿选择性分离变得越来越重要。各种氧化剂,如次氯酸钠(NaClO)、臭氧(O3)、过氧化氢(H2O2)和类Fenton试剂等和一些其他氧化方式已被用于选择性分离硫化矿物中。这些氧化方式处理相对简单、效益高,对人类和环境的危害较小,对铜钼硫化矿浮选分离有着重要意义。
4.1 氧化剂处理H2O2、O3和NaClO为铜钼硫化矿氧化预处理浮选中最为常见的氧化剂。黄鹏亮等人[9]研究了使用NaClO和H2O2作为氧化剂对铜和钼浮选分离的影响,试验结果表明,NaClO和H2O2氧化处理均能选择性抑制黄铜矿,对辉钼矿的可浮性几乎没有影响,且分离效果均优于传统的硫化钠抑制剂。Zeta电位、接触角测量和XPS分析结果表明,NaClO和H2O2氧化处理均可选择性地使黄铜矿表面亲水,这是因为经过氧化处理后,黄铜矿表面形成了亲水性的铜的氢氧化物和氧化物。Hirajima等人[52]采用O3和H2O2研究了CuFeS2和MoS2的选择性浮选分离,指出亲水性氧化产物为CuO、Cu(OH)2、FeOOH和Fe2(SO4)3,它们沉积在黄铜矿表面降低了其表面疏水性;另一方面,辉钼矿表面的氧化产物(如MoO3)易溶解到溶液中,所以辉钼矿表面保持疏水性。此外浮选试验表明,O3处理比H2O2处理具有更低的分离选择性,主要是因为O3氧化性更强,也会导致辉钼矿表面氧化程度较高,从而亲水性增加。
芬顿(Fenton)试剂指的是由二价铁盐和双氧水(H2O2/Fe2+)组成的氧化体系。当双氧水和二价铁盐混合时,双氧水在二价铁的催化下释放出大量的·OH,而·OH是非常有效的非选择性氧化剂,因此氧化作用非常强。然而,传统的芬顿试剂有许多缺点,如pH范围小,热量释放量大、修复效果差等。研究人员改进了芬顿试剂,称之为类芬顿试剂。类芬顿试剂[53]催化剂基本上是铁金属化合物,如赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、水铁矿、针铁矿(α-FeOOH)、纤铁矿(γ-FeOOH)、混合元素氧化物和钢渣。Wisnu等人[54]在H2O2水溶液中添加FeSO4制成了类Fenton试剂,FeSO4可在碱性条件下产生各种氧化产物(即鳞片藻、铁氢化物和针铁矿)。因此它可以作为催化剂,在碱性条件下使用可强化H2O2氧化作用。Wisnu等人[54]用类芬顿试剂处理研究了CuFeS2和MoS2的选择性浮选分离,接触角结果表明与之前Hirajima等人[52]使用H2O2水溶液相比,在较低浓度的H2O2水溶液中,类Fenton试剂可以改变黄铜矿的表面疏水性,黄铜矿表面被强烈氧化,但是辉钼矿表面依旧保持疏水性。使用原子力显微镜(AFM)和X射线光电子能谱(XPS)进行的表面表征表明,使用类Fenton试剂进行氧化处理后,黄铜矿表面覆盖了一层更厚的氧化产物,即CuO、Cu(OH)2、FeOOH、Fe2(SO4)3。另一方面,在使用不同浓度的H2O2水溶液和类Fenton试剂进行氧化处理后,辉钼矿表面只是被轻微氧化。这种现象可能是由于辉钼矿表面的氧化产物(即MoO2和MoO3)溶解造成的,黄铜矿和辉钼矿表面氧化机理如图 9所示。
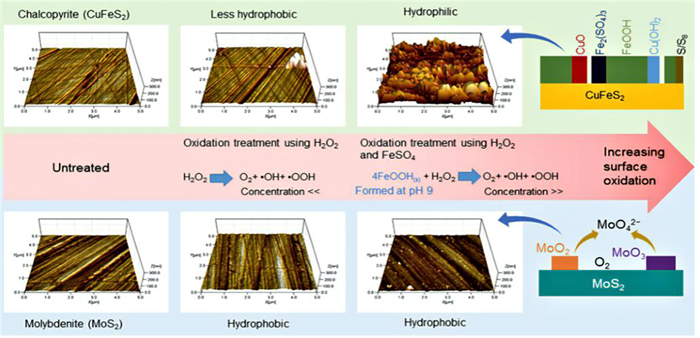 |
| 图 9 黄铜矿和辉钼矿表面氧化机理示意图[54] Fig.9 schematic diagram of surface oxidation mechanism of chalcopyrite and molybdenite |
高铁酸盐[55](K2FeO4或Na2FeO4)具有高稳定性、氧化能力、选择性和无毒副产物等特点,在整个pH范围内都具有强氧化性。目前,关于高铁酸盐在矿物浮选分离中应用的文献尚不多见。Liao等人[56]用高铁酸盐(Ⅵ)作为抑制剂浮选分离辉钼矿和黄铜矿。在单矿物和人工混合矿浮选试验的基础上进行了实际矿石浮选试验,结果表明高铁酸盐对黄铜矿有较强的抑制作用,对辉钼矿的抑制作用较小。高铁酸盐能够作为选择性抑制剂用于黄铜矿和辉钼矿的浮选分离,pH值范围为4~9,药剂浓度相对较低。此外,XPS分析表明,在黄铜矿氧化过程中,高铁酸盐可能被还原为Fe3+,黄铜矿表面的Cu和Fe金属离子被溶解。这些离子在溶液中与氢氧根离子反应,形成相对较厚的氧化产物层,增加黄铜矿的亲水性,但是高铁酸盐对辉钼矿的表面性质和可浮性影响不大。高铁酸盐与黄铜矿反应见式(19)~(21):
| $ 4{\rm{Fe}}{{\rm{O}}_{\rm{4}}}^{2 - } + {\rm{ }}10{{\rm{H}}_{\rm{2}}}{\rm{O}} \to 4{\rm{Fe}}{\left( {{\rm{OH}}} \right)_3} \downarrow + {\rm{ }}3{{\rm{O}}_2} \uparrow + {\rm{ }}8{\rm{O}}{{\rm{H}}^ - } $ | (19) |
| $ {\rm{Fe}}{{\rm{O}}_4}^{2 - } + {\rm{ }}3{\rm{F}}{{\rm{e}}^{2 + }} + {\rm{ }}4{\rm{O}}{{\rm{H}}^ - } + {\rm{ }}4{{\rm{H}}_{\rm{2}}}{\rm{O}} \to 4{\rm{Fe}}{\left( {{\rm{OH}}} \right)_3} \downarrow $ | (20) |
| $ \begin{array}{l} {\rm{Fe}}{{\rm{O}}_{\rm{4}}}^{2 - } + {\rm{ }}3{\rm{C}}{{\rm{u}}^ + } + {\rm{ O}}{{\rm{H}}^ - } + {\rm{ }}4{{\rm{H}}_{\rm{2}}}{\rm{O}} \to \\ \;\;\;\;\;3{\rm{Cu}}{\left( {{\rm{OH}}} \right)_2} \downarrow + {\rm{ Fe}}{\left( {{\rm{OH}}} \right)_3} \downarrow \end{array} $ | (21) |
H2O2、NaClO、类Fenton试剂和高铁酸盐(Ⅵ)都属于氧化剂,虽然这些氧化剂都能抑制黄铜矿浮选,取得较好的铜钼分离效果,但是也存在一些缺点,比如H2O2、NaClO具有腐蚀性,且易失效,保存困难;此外,高铁酸盐和类Fenton试剂产生的铁离子会在辉钼矿表面发生吸附,从而降低辉钼矿可浮性;且这类氧化剂使用pH范围小,在碱性溶液中很容易生成氢氧化铁的沉淀物,减弱氧化试剂的作用,造成试剂浪费,难以在工业上推广应用。
4.2 等离子体处理等离子体主要由电子、自由基、离子和中性粒子组成[57],具有导电性。等离子体的产生主要是由于空气分子在电场作用下的加速和能量积累,当气体分子的能量高于原子的能量时,电子和原子之间通过非弹性碰撞发生电离现象,最终形成等离子电子。等离子体有许多优点:导电性好、能量高、化学性质活泼、易于反应[58]。等离子体可以产生氧基氧化剂(·OH、·O、H2O2、O3和其他活性分子),这些物质有很强的氧化作用,可以直接或间接应用于污染物的去除。
日本九州大学Hirajima等人[59]使用等离子体氧化黄铜矿和辉钼矿,然后在pH 9的条件下清洗矿物表面。原子力显微镜(AFM)测试结果表明,未经等离子体处理的黄铜矿表面光滑,处理后表面有许多小尖峰。用氧气鼓泡的溶液清洗后,黄铜矿表面许多细小的尖峰依旧存在。对于辉钼矿,经过等离子体处理的表面上有许多尖峰。清洗后,辉钼矿的表面变得更加光滑。通过XPS分析表面产物,确认等离子体处理后,氢氧化铜、氢氧化铁和硫酸铁出现在黄铜矿的表面,后续清洗后只有硫酸铁消失;而辉钼矿经等离子体处理后出现氧化钼,经洗涤后消失。黏附力和接触角测量表明,等离子体处理使黄铜矿和辉钼矿的表面亲水,只有辉钼矿在清洗后变得疏水。浮选试验证实了这个结果,等离子体处理后两种矿物均显示出较低的可浮性,在pH 9的条件下用氧气鼓泡的溶液清洗矿物表面后,只有辉钼矿上浮,而黄铜矿依旧不可浮。
等离子体对黄铜矿和辉钼矿进行浮选预处理,需要等离子体发生器,设备昂贵,增加了成本;并且当该工艺应用于黄铜矿和辉钼矿的混合物时,辉钼矿显示出较低的可浮性,这是因为黄铜矿表面溶解的铁离子也会在辉钼矿表面沉淀,增加了其表面亲水性。
4.3 浸泡预处理和微波预处理黄铜矿在溶液中的氧化程度远高于在空气中的氧化程度[60],且溶液中存在的溶解氧和电解质,会加速矿物表面氧化溶解。随着淡水资源短缺问题越来越严重,越来越多的选矿厂将海水、回水和高浓度电解质的地下水用于浮选,不少科研人员尝试通过浸泡预处理和微波预处理实现黄铜矿和辉钼矿的浮选分离。
傅佳丽等人[61]采用纯水和海水浸泡预处理的方式进行了黄铜矿和辉钼矿浮选分离试验。接触角和XPS分析结果表明:无论是纯水还是海水浸泡预处理都使黄铜矿表面发生氧化,降低了黄铜矿的可浮性,其中海水浸泡预处理后黄铜矿表面氧化程度更高。纯水处理后辉钼矿的表面也被氧化,亲水性增加,但海水浸泡处理后辉钼矿的表面疏水性增加。铜钼混合矿浮选分离试验结果表明,经海水浸泡处理后黄铜矿回收率由84.1%下降到16.2%,而辉钼矿回收率由67.2%上升到79.4%,表明采用海水浸泡处理的方式可以实现两种矿物的高效分离。
王志杰等人[62]分别在纯水和海水中使用微波预处理黄铜矿和辉钼矿,然后进行了浮选试验。结果表明:无论是纯水还是海水,微波预处理都可以促进黄铜矿的氧化,降低其可浮性,但是微波预处理对辉钼矿浮选却没有明显的影响。接触角测试结果表明:在纯水和海水中,使用微波预处理黄铜矿会使其表面接触角降低,但对于辉钼矿接触角无明显变化,甚至在海水中处理辉钼矿,其表面接触角不仅没有减小反而增加了一些。
综上而言,浸泡预处理、微波预处理在海水的效果比纯水的效果好,但是尽管如此,两者的预处理时间都过长,效率不高,导致在工业上难以应用。
4.4 热预处理众所周知,硫化铜矿物的表面在暴露于空气中时会缓慢氧化。因此,空气中的热预处理可以促进黄铜矿的氧化。此外,铜钼混合精矿中捕收剂沸点较低(大多低于180 ℃),在高温下易于去除。
Tang等人[63]尝试采用热预处理方法分离辉钼矿和黄铜矿,在250 ℃下对矿物进行热预处理。浮选试验证明,未经处理的辉钼矿和黄铜矿在有无捕收剂存在的情况下均具有良好的可浮性。经过热预处理后,黄铜矿失去了其自然可浮性,甚至不能通过添加黄药捕收剂回收,但辉钼矿仍保持良好的可浮性。在不添加抑制剂的情况下,对混合矿或铜钼混合精矿均有效地实现了铜钼浮选分离。XPS分析表明,热处理后黄铜矿的氧化程度增加,黄铜矿表面的FeOOH、CuO和Cu(OH)2等亲水性物质也增加。这不仅使黄铜矿失去了天然的可浮性,而且阻止了捕收剂在其表面的吸附。总的来说,辉钼矿在热预处理过程中被轻微氧化,并且辉钼矿在浮选过程中很容易上浮。
热预处理虽然可以达到不错的铜钼分离效果,但是能耗较大。在实际处理中,通过热预处理对硫化矿进行加热干燥,无疑会造成能源的巨大消耗,而且温度不易控制,温度过低黄铜矿氧化不充分,造成黄铜矿上浮,温度过高辉钼矿会过度氧化,造成辉钼矿可浮性下降。
4.5 外控电位处理外控电位是向浮选体系中添加外加电极,因为硫化矿颗粒与电极两者之间的静电位不同,矿物颗粒与电极发生碰撞或短暂接触,所以会在电极与矿物颗粒之间发生电荷转移,使得矿物颗粒表面发生电化学反应,从而在矿物表面生成了一些疏水性或亲水性氧化产物,改变矿物的表面性质,进而实现不同矿物的浮选分离。
恰图里亚[64]考察了在-0.8~+0.8 V (v.s Ag/AgCL)范围内,使用外加电极电化学处理后黄铜矿和辉钼矿的浮选行为。研究发现,阳极处理黄铜矿后,其表面出现疏水性S0,使得黄铜矿可浮性提高,阴极处理后黄铜矿的可浮性变差,而辉钼矿在整个电位范围内均具有良好的可浮性。宋坤[65]利用自制的外控电位浮选槽,探究了外控电位处理黄铜矿和辉钼矿的分离效果。在pH值为11、外控还原电位-800 mV (v.s Ag/AgCL)的条件下对多宝山铜钼混合精矿进行浮选分离试验,获得钼回收率80.57%、铜回收率10.19%的良好效果,这使外控还原电位下浮选分离黄铜矿和辉钼矿成为可能。
外控电位存在着局限性。由于硫化矿浮选矿浆体系中成分复杂,各种成分都可能在电极或矿物表面发生吸附,电极表面吸附层的形成增加了矿物颗粒与电极直接接触的难度;同时这种吸附层的电阻远大于电解槽中电极吸附水分子层的电阻,矿物表面反应开始时,取代吸附层比取代水分子层需要更多的能量,导致矿物表面的电化学反应难以实现。
综上所述,虽然各种氧化预处理的氧化方式或氧化剂不尽相同,但是它们的氧化机理都基本相似。在这些氧化体系内,都使黄铜矿可浮性变差,主要是因为黄铜矿氧化后,表面形成了一层亲水的氧化产物[即CuO、Cu(OH)2、FeOOH、Fe2(SO4)3],可能发生的反应如式(17)~(23)所示:
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_2} + 17\cdot{\rm{OH}} + 4{\rm{O}}{{\rm{H}}^ - } \to {\rm{Cu}}{\left( {{\rm{OH}}} \right)_2} + {\rm{ }}\\ \;\;\;\;\;\;\;\;\;\;\;\;{\rm{FeOOH}} + 2{\rm{S}}{{\rm{O}}_4}^{2 - } + 9{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array} $ | (17) |
| $ \begin{array}{l} {\rm{CuFe}}{{\rm{S}}_2} + 8{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{u}}^{2 + }} + {\rm{F}}{{\rm{e}}^{3 + }} + {\rm{ }}\\ \;\;\;\;\;\;\;\;2{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 16{{\rm{H}}^ + } + 17{\rm{e}} \end{array} $ | (18) |
| $ {\rm{F}}{{\rm{e}}^{3 + }} + {\rm{3O}}{{\rm{H}}^ - } = {\rm{Fe}}{\left( {{\rm{OH}}} \right)_3} $ | (19) |
| $ {\rm{F}}{{\rm{e}}^{3 + }} + 3{\rm{O}}{{\rm{H}}^ - } = {\rm{FeOOH}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (20) |
| $ 2{\rm{F}}{{\rm{e}}^{3 + }} + 3{\rm{S}}{{\rm{O}}_4}^{2 - } = {\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{(S}}{{\rm{O}}_{\rm{4}}})_3} $ | (21) |
| $ 2{\rm{C}}{{\rm{u}}^{2 + }} + {{\rm{O}}_2} = 2{\rm{CuO}} $ | (22) |
| $ {\rm{C}}{{\rm{u}}^{2 + }} + {\rm{2O}}{{\rm{H}}^ - } = {\rm{Cu}}{\left( {{\rm{OH}}} \right)_2} $ | (23) |
对于辉钼矿,由于其高电阻相比于黄铜矿很难氧化,可能发生的反应如式(24)~(27)所示:
| $ {\rm{Mo}}{{\rm{S}}_{\rm{2}}} + 18\cdot{\rm{OH}} + {\rm{6O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_4}^{2 - } + 2{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 12{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (24) |
| $ {\rm{Mo}}{{\rm{S}}_{\rm{2}}}{\rm{ + 18\cdot{\rm{OH}} + 4O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_{\rm{3}}} + 2{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 11{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (25) |
| $ {\rm{Mo}}{{\rm{S}}_{\rm{2}}}{\rm{ + 12}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Mo}}{{\rm{O}}_{\rm{4}}}^{2 - } + 2{\rm{S}}{{\rm{O}}_{\rm{4}}}^{2 - } + 24{{\rm{H}}^ + } + 18{\rm{e}} $ | (26) |
| $ {\rm{Mo}}{{\rm{O}}_{\rm{3}}}{\rm{ + 2O}}{{\rm{H}}^ - } \to {\rm{Mo}}{{\rm{O}}_{\rm{4}}}^{2 - } + {{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (27) |
可知,辉钼矿表面氧化产物的低浓度可能是由于在碱性条件下钼氧化物溶解为钼酸盐离子(MoO42-)导致表面氧化率低;另一方面是辉钼矿的导电率较低,难以氧化。所以辉钼矿氧化前后表面性质无明显变化,以至于氧化前后辉钼矿浮选回收率变化不大。
5 结论与展望黄铜矿和辉钼矿的表面性质相似,具有良好的可浮性。采用表面氧化的方式增加黄铜矿与辉钼矿的表面性质差异,进行铜钼硫化矿浮选分离极具优势和潜力。虽然国内外选矿科研人员在铜钼硫化矿氧化预处理方面做了大量研究工作,取得了诸多的研究成果,但仍存在一些问题。例如等离子体和热处理需要额外设备,操作复杂,设备昂贵;用H2O2、O3和NaClO等氧化剂处理,具有一定的腐蚀性和危险性,且易失效;高铁酸盐(Ⅵ)和类Fenton试剂在弱碱性溶液中很容易生成氢氧化铁沉淀物;浸泡预处理时间过长,难以在工业上运用;外控电位中矿物与电极直接接触或吸附的难度大,只有小部分矿物能实现表面的电化学反应。
因此研发绿色高效的选择性氧化剂或开发新的氧化方式,进一步扩大黄铜矿和辉钼矿之间的表面性质差异,实现两种矿物高效分离仍然是现在面临的重要难题。解决这一系列问题需要后续进一步深入开展理论研究和技术攻关。
| [1] |
贾红秀, 高丽梅, 姜威. 钼市场30年回顾与展望[J]. 中国钼业, 2006, 30(1): 42-47. JIA H X, Gao L M, JIANG W. Review of the 30 year's molybdenumm market and itsprospect[J]. China Molybdenum Industry, 2006, 30(1): 42-47. DOI:10.3969/j.issn.1006-2602.2006.01.012 |
| [2] |
LIU G Y, LU Y P, ZHONG H, et al. A novel approach for preferential flotation recovery of molybdenite from a porphyry copper-molybdenum ore[J]. Minerals Engineering, 2012, 36-38: 37-44. DOI:10.1016/j.mineng.2012.02.008 |
| [3] |
朱龙刚, 李宇宏. 铜钼分离研究现状与进展[J]. 矿山机械, 2015, 43(11): 16-20. ZHU L G, LI Y H. Research status and progress of copper-molybdenum separation technology[J]. Mechanical Mining, 2015, 43(11): 16-20. |
| [4] |
张村. 硫化铜钼矿的新型抑制剂及其机理研究[D]. 赣州: 江西理工大学, 2017. ZHANG C. Research on the new Inhibitor of sulfide copper-molybdenum mine and its mechanism[D]. Ganzhou: Jiangxi University of Science and Technology, 2017. |
| [5] |
赵镜, 张文钲, 王广文. 巯基乙酸钠抑制黄铜矿机理的研究[J]. 有色金属, 1988(3): 44-47. ZHAO J, ZHANG W Z, WANG G W. Study on the mechanism of sodium mercaptoacetate inhibiting chalcopyrite[J]. Nonferrous Metals, 1988(3): 44-47. |
| [6] |
吴康平, 余乐. 新型组合抑制剂在铜钼分离浮选中的应用[J]. 现代矿业, 2018, 34(1): 164-166. WU K P, YU L. Application of novel combination inhibitor in copper-molybdenum separation flotation[J]. Modem Mining, 2018, 34(1): 164-166. DOI:10.3969/j.issn.1674-6082.2018.01.031 |
| [7] |
黄济存. 氮气在铜钼分选上的作用[J]. 有色矿山, 1994(1): 61-63. HUANG J C. Effect of nitrogen on separation of copper and molybdenum[J]. Nonferrous Mines, 1994(1): 61-63. |
| [8] |
刘磊, 吕良, 马瑛, 等. 含铜钼精矿超导磁分离试验研究[J]. 矿产保护与利用, 2017(1): 55-58. LIU L, LV L, MA Y, et al. Study on superconducting magnetic separation dealing with fine molybdenum concentrate containing copper[J]. Conservation and Utilization of Mineral Resources, 2017(1): 55-58. |
| [9] |
黄鹏亮, 杨丙桥, 胡杨甲, 等. 氧化预处理对铜钼浮选分离效果的影响[J]. 矿冶工程, 2021, 41(3): 46-56. HUANG P L, YANG B Q, HU Y J, et al. Influence of oxidation pretreatment on chalcopyrite-molybdenite flotation separation efficiency[J]. Mining and Metallurgical Engineering, 2021, 41(3): 46-56. DOI:10.3969/j.issn.0253-6099.2021.03.011 |
| [10] |
张力先, 高玉武. 矿物表面特性与可浮性关系综述[J]. 黄金学报, 2000, 2(1): 30-33. ZHANG L X, GAO Y W. Summarization of relation between surface properties and float-ability of minerals[J]. Gold Journal, 2000, 2(1): 30-33. |
| [11] |
肖策环. 微细粒黄铜矿表面特性与可浮性关系研究[D]. 赣州: 江西理工大学, 2016. XIAO C H. The study on the relationship between the surface characteristics and flotability of micro fine chalcopyrite[D]. Ganzhou: Jiangxi University of Science and Technology, 2016. |
| [12] |
吕建业, 沈耀平, 张洪恩. 辉钼矿表面特性及其可浮性的研究[J]. 有色金属, 1992(4): 4-8. LV J P, SHEN Y P, ZHANG H E. Study of surface properties of pyromorphite and its floatability[J]. Nonferrous Metals: Mineral Processing Section, 1992(4): 4-8. |
| [13] |
尚新华. 氧化对黄铜矿无捕收剂浮选的影响[J]. 现代矿业, 1988(1): 12-17. SHANG X H. Effects of surface oxidation on sulphide mineral flotation[J]. Modern mining, 1988(1): 12-17. |
| [14] |
柯家骏. 辉钼矿晶面特性工艺矿物学的研究[J]. 化工冶金, 1981(4): 37-43. HE J J. Study of the process mineralogy of the crystalline surface properties of pyromorphite[J]. Chemical Metallurgy, 1981(4): 37-43. |
| [15] |
吕建业. 辉钼矿的表面特性及其浮选行为的研究[D]. 沈阳: 东北大学, 1989. LV J Y. Study of surface properties of pyromorphite and its flotation behavior[D]. Shenyang: Northeastern University, 1989. |
| [16] |
HUAI Y, PLACKOWSKI C, PENG Y. The surface properties of pyrite coupled with gold in the presence of oxygen[J]. Minerals Engineering, 2017, 111: 131-139. DOI:10.1016/j.mineng.2017.06.013 |
| [17] |
RAO M Y, NATARAJAN K A. Influence of galvanic interaction between chalcopyrite and some metallic materials on flotation[J]. Minerals Engineering, 1988, 1(4): 281-294. DOI:10.1016/0892-6875(88)90018-0 |
| [18] |
聂庆民. 黄铜矿表面性质及CN-在其表面吸附的密度泛函理论研究[D]. 赣州: 江西理工大学, 2017. NIE Q M. Density Functional Theory study on the surface properties of chalcopyrite and the adsorption of CN-on its surface[D]. Ganzhou: Jiangxi University of Science and Technology, 2017. |
| [19] |
牛晓鹏. 方铅矿, 黄铜矿和黄铁矿表面氧化与可浮性研究[D]. 北京: 中国科学院大学, 2019. NIU X P. Correlation of surface oxidation of galena, chalcopyrite and pyrite with their floatability[D]. Beijing: University of Chinese Academy of Sciences, 2019. |
| [20] |
YANG Y. The effect of microorganisms on the surface properties of chalcopyrite[D]. Adelaide: Flinders University, 2014.
|
| [21] |
邓久帅. 黄铜矿流体包裹体组分释放及其与弛豫表面的相互作用[D]. 昆明: 昆明理工大学, 2013. DENG J S. Release of chalcopyrite fluid inclusion components and their interactions with relaxation surfaces [D]. Kunming: Kunming University of Science and Technology, 2013. |
| [22] |
CASTRO S, LOPEZ-VALDIVIESO A, LASKOWSKI J S. Review of the flotation of molybdenite. Part I: Surface properties and floatability[J]. International Journal of Mineral Processing, 2016, 148: 48-58.
|
| [23] |
李万青. 海水浮选辉钼矿作用机理研究[D]. 武汉: 武汉理工大学, 2019. LI W Q. The fundamental mechanisms of seawater on the flotation of molybdenite [D]. Wuhan: Wuhan University of Technology, 2019. |
| [24] |
魏桢伦, 李育彪. 辉钼矿晶面各向异性及其对浮选的影响机制[J]. 矿产保护与利用, 2018(3): 31-36. WEI Z L, LI Y B. Anisotropy of molybdenite surface and its effects on flotation mechanism[J]. Conservation and Utilization of Mineral Resources, 2018(3): 31-36. |
| [25] |
谢小燕, 邱显扬, 罗传胜, 等. 辉钼矿可浮选性及其捕收剂的研究进展[J]. 中国钼业, 2013, 37(5): 29-32. XIE X Y, QIU X Y, LOU C S, et al. Research progress on floatbility of molybdenite and its collectors[J]. China Molybdenum Industry, 2013, 37(5): 29-32. DOI:10.3969/j.issn.1006-2602.2013.05.006 |
| [26] |
LU Z, LIU Q, XU Z, et al. Probing anisotropic surface properties of molybdenite by direct force measurements[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2015, 31(42): 11409-11418. |
| [27] |
赵晋宁. 酸性条件下黄铜矿氧化钝化过程的电化学研究[D]. 广州: 华南理工大学, 2013. ZHAO J N. Electrochemical study of the chalcopyrite oxidation and passivation in the acid mediums[D]. Guangzhou: South China University of Technology, 2013. |
| [28] |
蔡长江. 黄铜矿的氧化及其钝化研究[D]. 广州: 华南理工大学, 2014. CAI C J. The oxidation and passivation of chalcopyrite[D]. Guangzhou: South China University of Technology, 2014. |
| [29] |
GUO H. Electrochemistry and flotation of enargite and chalcopyrite[D]. Kingston: Queen's University at Kingston, 2004.
|
| [30] |
PRICE DW, WARREN GW. The influence of silver ion on the electrochemical response of chalcopyrite and other mineral sulfide electrodes in sulfuric acid[J]. Hydrometallurgy, 1986, 15(3): 303-324. DOI:10.1016/0304-386X(86)90063-0 |
| [31] |
WARREN GW, SOHN HJ, WADSWORTH ME, et al. The effect of electrolyte composition on the cathodic reduction of CuFeS2[J]. Hydrometallurgy, 1985, 14(2): 133-149. DOI:10.1016/0304-386X(85)90030-1 |
| [32] |
何卓起, 俞瑞, 贺政, 等. 硫化矿浮选外加电场预处理理论基础的探讨[J]. 有色金属, 1998(4): 46-50. HE Z Q, YU R, HE Z, et al. Theoretical basls of external electrical fleld pretreatment for sulflde flotation[J]. Nonferrous Metals, 1998(4): 46-50. |
| [33] |
BIEGLER T, SWIFT D A. Anodic electrochemistry of chalcopyrite[J]. Journal of Applied Electrochemistry, 1979, 9(5): 545-554. DOI:10.1007/BF00610940 |
| [34] |
A N, BUCKLEY, WOODS. An X-ray photoelectron spectroscopic study of the oxidation of chalcopyrite[J]. Australian Journal of Chemistry, 1984, 37(12): 2403-2413. DOI:10.1071/CH9842403 |
| [35] |
HIROYOSHI N, HIROTA M, HIRAJIMA T, et al. A case of ferrous sulfate addition enhancing chalcopyrite leaching[J]. Hydrometallurgy, 1997, 47(1): 37-45. DOI:10.1016/S0304-386X(97)00032-7 |
| [36] |
HARMER SL, THOMAS JE, FORNASIERO D, et al. The evolution of surface layers formed during chalcopyrite leaching[J]. Geochimica Et Cosmochimica Acta, 2006, 70(17): 4392-4402. DOI:10.1016/j.gca.2006.06.1555 |
| [37] |
HUA XM, ZHENG YF, XU Q, et al. Interfacial reactions of chalcopyrite in ammonia-ammonium chloride solution[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(3): 556-566. DOI:10.1016/S1003-6326(18)64688-6 |
| [38] |
CHANDER S, FUERSTENAU D W. On the naturalfloatability of molybdenite[J]. AIME, 1972, 252: 62-69. |
| [39] |
WANG J, XIE L, LU Q, et al. Electrochemical investigation of the interactions of organic and inorganic depressants on basal and edge planes of molybdenite[J]. Journal of Colloid and Interface Science, 2020, 570(3). |
| [40] |
CHANDER S, FUERSTENAU DW. Electrochemical flotation separation of chalcocite from molybdenite[J]. International Journal of Mineral Processing, 1983, 10(2): 89-94. DOI:10.1016/0301-7516(83)90035-2 |
| [41] |
MIKI H M H, HIRAJIMA T, SUYANTARA GPW, SASAKI K. Electrolysis oxidation of chalcopyrite and molybdenite for selective flotation[J]. Materials Transactions, 2017, 58(5): 761-767. DOI:10.2320/matertrans.M-M2017807 |
| [42] |
LI Y, CLEMENT L, SONG S, et al. The fundamental roles of monovalent and divalent cations with sulfates on molybdenite flotation in the absence of flotation reagents[J]. RSC Advances, 2018, 8(41): 23364-23371. DOI:10.1039/C8RA02690D |
| [43] |
李晖. 硫化矿物的浮选电化学和浮选行为探析[J]. 石化技术, 2016, 23(3): 82. LI H. Flotation electrochemistry and flotation behavior of sulfide ineral[J]. Petrochemical Technology, 2016, 23(3): 82. DOI:10.3969/j.issn.1006-0235.2016.03.066 |
| [44] |
HARADA T, KUNIYOSHI N. Effects of surface oxidation on sulphide mineral flotation[J]. Flotation, 1984, 31(1): 55-66. DOI:10.4144/rpsj1954.31.55 |
| [45] |
LUTTRELL G H, YOON R H. The collectorless flotation of chalcopyrite ores using sodium sulfide[J]. International Journal of Mineral Processing, 1984, 13(4): 271-283. DOI:10.1016/0301-7516(84)90048-6 |
| [46] |
FAIRTHORNE G, FORNASIERO D, RALSTON J. Effect of oxidation on the collectorless flotation of chalcopyrite[J]. International Journal of Mineral Processing, 1997, 49(1/2): 31-48. |
| [47] |
ZHENLUN W, YUBIAO L, LINGYUN H. New insight into the anisotropic property and wettability of molybdenite: A DFT study[J]. Minerals Engineering, 2021, 170: 107058. DOI:10.1016/j.mineng.2021.107058 |
| [48] |
XIE L, WANG J, HUANG J, et al. Anisotropic polymer adsorption on molybdenite basal and edge surfaces and interaction mechanism with air bubbles[J]. Frontiers in chemistry, 2018, 361. |
| [49] |
LI Y, YANG X, FU J, et al. New insights into the beneficial roles of dispersants in reducing negative influence of Mg2+ on molybdenite flotation[J]. RSC Advances, 2020, 10(46): 27401-27406. DOI:10.1039/D0RA05556E |
| [50] |
HE T, HUI L, JIN J, et al. Improving fine molybdenite flotation using a combination of aliphatic hydrocarbon oil and polycyclic aromatic hydrocarbon[J]. Results in Physics, 2019, 12: 1050-1055. DOI:10.1016/j.rinp.2018.12.010 |
| [51] |
HONG G, JUNHYUN C, HAN Y, et al. Relationship between surface characteristics and floatability in representative sulfide minerals: Role of surface oxidation[J]. Materials transactions, 2017, 58(7): 1069-1075. DOI:10.2320/matertrans.M2017014 |
| [52] |
HIRAJIMA T, MIKI H, SUYANTARA G, et al. Selective flotation of chalcopyrite and molybdenite with H2O2 oxidation[J]. Minerals Engineering, 2017, 100: 83-92. DOI:10.1016/j.mineng.2016.10.007 |
| [53] |
HUANG H H, LU M C, CHEN J N. Catalytic decomposition of hydrogen peroxide and 2-chlorophenol with iron oxides[J]. Water Research, 2001, 35(9): 2291-2299. DOI:10.1016/S0043-1354(00)00496-6 |
| [54] |
WISNU S, TSUYOSHI H, HAJIME M, et al. effect of fenton-like oxidation reagent on hydrophobicity and floatability of chalcopyrite and molybdenite[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2018, 554: 34-48. |
| [55] |
SHARMA V K. Potassium ferrate(Ⅵ): an environmentally friendly oxidant[J]. Advances in Environmental Research, 2002, 6(2): 143-156. DOI:10.1016/S1093-0191(01)00119-8 |
| [56] |
LIAO R, FENG Q, WEN S, et al. Flotation separation of molybdenite from chalcopyrite using ferrate(Ⅵ) as selective depressant in the absence of a collector[J]. Minerals Engineering, 2020, 152: 106369. DOI:10.1016/j.mineng.2020.106369 |
| [57] |
GUO H, JIANG N, WANG H, et al. Pulsed discharge plasma induced WO3 catalysis for synergetic degradation of ciprofloxacin in water: Synergetic mechanism and degradation pathway[J]. Chemosphere, 2019, 230: 190. DOI:10.1016/j.chemosphere.2019.05.011 |
| [58] |
HAO Z, MA D, QIU R, et al. Non-thermal plasma technology for organic contaminated soil remediation: A review[J]. Chemical Engineering Journal, 2016, 313: 157-170. |
| [59] |
HIRAJIMA T, MORI M, ICHIKAWA O, et al. Selective flotation of chalcopyrite and molybdenite with plasma pre-treatment[J]. Minerals Engineering, 2014, 66: 102-111. |
| [60] |
GREENLEE L F, LAWLER D F, FREEMAN B D, et al. Reverse osmosis desalination: water sources, technology, and today's challenges[J]. Water Research, 2009, 43(9): 2317-2348. |
| [61] |
傅佳丽, 李育彪, 王洪铎, 等. 浸泡预处理对铜钼硫化矿浮选分离的影响机理[J]. 金属矿山, 2020, 49(2): 29-32. FU J L, LI Y B, WANG H Z, et al. Mechanisms of soaking pre-treatment on flotation separation of copper-molybdenum sulfide Ore[J]. Metal Mine, 2020, 49(2): 29-32. |
| [62] |
王志杰, 李育彪, 王洪铎, 等. 微波预处理对铜钼硫化矿海水浮选的影响机理[J]. 金属矿山, 2020, 49(2): 19-23. WANG Z J, LI Y B, WANG H Z, et al. Effect of microwave pretreatment on cu-mo Sulfide mineral flotation in sea water[J]. Metal Mine, 2020, 49(2): 19-23. |
| [63] |
TANG X, CHEN Y, LIU K, et al. Selective flotation separation of molybdenite and chalcopyrite by thermal pretreatment under air atmosphere[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 583: 123958. DOI:10.1016/j.colsurfa.2019.123958 |
| [64] |
邓玉珍. 电化学处理及矿物浮选[J]. 国外金属矿选矿, 1996, 33(2): 35-39. DENG Y Z. Electrochemical treatment and mineral flotation[J]. Metallic Ore Dressing Abroad, 1996, 33(2): 35-39. |
| [65] |
宋坤, 宋永胜, 张其东, 等. 外控电位法浮选分离黄铜矿和辉钼矿[J]. 工程科学学报, 2019, 41(7): 857-863. SONG K, SONG Y S, ZHANG Q D, et al. Flotation separation of chalcopyrite and molybdenite by externally controlled potential method[J]. Chinese Journal of Engineering, 2019, 41(7): 857-863. |
 2022
2022