| 还原浸出—除杂—活性氧化镁沉淀工艺从刚果金某氧化铜钴矿中回收钴 |
2. 厦门紫金矿冶技术有限公司, 福建 厦门 361101
2. Xiamen Zijin Mining and Metallurgy Technology Co. Ltd, Xiamen 361101, Fujian, China
钴是一种重要的金属资源,钴因具有很好的耐高温、耐腐蚀和磁性等性能而被广泛用于航空航天、机械制造、电气电子、化学和陶瓷等工业领域,是制造高温合金、硬质合金、陶瓷颜料、催化剂和电池的重要原料之一[1-3],尤其是目前电动汽车等行业快速发展导致钴动力电池领域对钴的需求猛增。钴资源多伴生于铜钴矿、镍钴矿、砷钴矿和黄铁矿矿床中,独立钴矿物极少,陆地资源储量较少,海底锰结核是钴重要的远景资源[4-7]。
本研究针对刚果(金)科卢韦齐某低品位氧化铜钴矿,采用硫酸还原浸出铜钴[8-12]、浸出液萃取分离铜钴、萃余液除杂、第一段沉钴和第二段沉钴等工序回收钴,考察了不同浸出条件、不同除杂条件及不同沉钴条件对钴提取的影响,为类似矿石的开发提供借鉴。
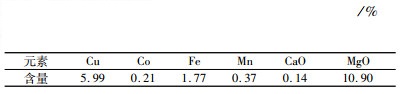
2 原料、药剂及试验方法 2.1 样品性质分析| 表 1 样品多元素分析 Table 1 Multi-element analysis of sample |
|
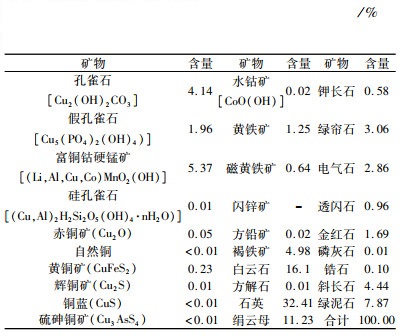
| 表 2 样品的矿物组成与含量/% Table 2 Mineral composition of samples |
|
从表 1和表 2可以看出,样品中可回收的有价元素为铜和钴,金属矿物以含铜金属氧化物和褐铁矿为主,其次为黄铁矿和铜硫化物等。铜矿物主要为孔雀石、假孔雀石和富铜钴硬锰矿,少量的黄铜矿和辉铜矿,微量硅孔雀石、赤铜矿、铜蓝、硫砷铜矿和自然铜等。含钴矿物主要为富铜钴硬锰矿及少量的水钴矿。除铜和钴矿物外,其他金属矿物主要是褐铁矿和黄铁矿,微量的闪锌矿和方铅矿。
2.2 药剂试验所用药剂如表 3所示,试验用水为自来水。
| 表 3 主要试验药剂 Table 3 Main reagents |

|
2.3 试验方法
孔雀石和硅孔雀石等铜氧化矿物能与酸反应生成铜离子而进入溶液,三价钴氧化物需在酸性条件进行还原浸出,本试验采用硫酸和焦亚硫酸钠浸出铜和钴,浸出液采用萃取—反萃—电积法回收铜,钴留在萃余液中,采用石灰石和石灰除去铜萃余液中的铜铁等杂质,除杂后溶液采用活性氧化镁进行第一段沉钴,得到氢氧化钴产品,第一段沉钴后残液采用石灰进行第二段沉钴,第二段沉钴后溶液返回浸出工序。
2.3.1 铜和钴浸出称取定量细磨至-0.074 mm含量65%的样品倒入烧杯中,按矿浆质量浓度33%加入自来水,开启搅拌,加入硫酸控制终点pH值在1.5~1.8,过程中按不同方式加入焦亚硫酸钠,反应一定时间后取出过滤,渣液分别送检。
化学反应方程式如下:
| $ {\rm{C}}{{\rm{u}}_2}{\left( {{\rm{OH}}} \right)_2}{\rm{C}}{{\rm{O}}_3} + 2{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} = 2{\rm{CuS}}{{\rm{O}}_4} + {\rm{C}}{{\rm{O}}_2} \uparrow + 3{{\rm{H}}_2}{\rm{O}} $ | (1) |
| $ \begin{array}{l} \;\;\;\;\;\;{\rm{CuSi}}{{\rm{O}}_3} \cdot 2{{\rm{H}}_2}{\rm{O}} + {{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} = \\ {\rm{CuS}}{{\rm{O}}_4} + {\rm{Si}}{{\rm{O}}_2} \cdot n{{\rm{H}}_2}{\rm{O}} + \left( {3 - n} \right){{\rm{H}}_2}{\rm{O}} \end{array} $ | (2) |
| $ \begin{array}{l} 4{\rm{Co}}{\left( {{\rm{OH}}} \right)_3} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} + {\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_5} = \\ \;\;\;\;4{\rm{CoS}}{{\rm{O}}_4} + {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} + 9{{\rm{H}}_2}{\rm{O}} \end{array} $ | (3) |
浸出液萃取铜后取一定量萃余液倒入烧杯中,加入定量石灰石乳液搅拌反应一定时间后,再加入石灰乳液,继续反应一定时间后过滤,渣液分别送检。
除杂主要化学反应式如下:
| $ {\rm{CaC}}{{\rm{O}}_3} + {{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} + {{\rm{H}}_2}{\rm{O}} = {\rm{CaS}}{{\rm{O}}_4} \cdot 2{{\rm{H}}_2}{\rm{O}} \downarrow + {\rm{C}}{{\rm{O}}_2} \uparrow $ | (4) |
| $ \begin{array}{l} \;\;\;\;\;{\rm{A}}{{\rm{l}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 3{\rm{CaC}}{{\rm{O}}_3} + 9{{\rm{H}}_2}{\rm{O}} = \\ 2{\rm{Al}}{\left( {{\rm{OH}}} \right)_3} \downarrow + 3{\rm{CaS}}{{\rm{O}}_4} \cdot 2{{\rm{H}}_2}{\rm{O}} \downarrow + 3{\rm{C}}{{\rm{O}}_2} \uparrow \end{array} $ | (5) |
| $ 2{\rm{FeS}}{{\rm{O}}_4} + {{\rm{O}}_2} + {\rm{S}}{{\rm{O}}_2} = {\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} $ | (6) |
| $ \begin{array}{l} \;\;\;\;{\rm{F}}{{\rm{e}}_2}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_3} + 3{\rm{CaC}}{{\rm{O}}_3} + 9{{\rm{H}}_2}{\rm{O}} = \\ 2{\rm{Fe}}{\left( {{\rm{OH}}} \right)_3} \downarrow + 3{\rm{CaS}}{{\rm{O}}_4} \cdot {{\rm{H}}_2}{\rm{O}} \downarrow + 3{\rm{C}}{{\rm{O}}_2} \uparrow \end{array} $ | (7) |
| $ \begin{array}{l} {\rm{MnS}}{{\rm{O}}_4} + 2{\rm{CaC}}{{\rm{O}}_3} + {{\rm{O}}_2} + {\rm{S}}{{\rm{O}}_2} + 4{{\rm{H}}_2}{\rm{O}} = \\ {\rm{Mn}}{{\rm{O}}_2} \downarrow + 2{\rm{CaS}}{{\rm{O}}_4} \cdot 2{{\rm{H}}_2}{\rm{O}} \downarrow + 2{\rm{C}}{{\rm{O}}_2} \uparrow \end{array} $ | (8) |
| $ {\rm{CaO}} + {{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} + {{\rm{H}}_2}{\rm{O}} = {\rm{CaS}}{{\rm{O}}_4} \cdot 2{{\rm{H}}_2}{\rm{O}} \downarrow $ | (9) |
活性氧化镁用自来水配制成质量浓度为20%的乳液,除杂后液倒入烧杯中,搅拌状态下缓慢向除杂后的溶液中加入活性氧化镁乳液,搅拌一定时间后过滤,渣液分别送检。
沉钴主要化学反应式如下:
| $ {\rm{MgO}} + {\rm{CoS}}{{\rm{O}}_4} + {{\rm{H}}_2}{\rm{O}} = {\rm{MgS}}{{\rm{O}}_4} + {\rm{Co}}{\left( {{\rm{OH}}} \right)_2} \downarrow $ | (10) |
| $ 3{\rm{CoS}}{{\rm{O}}_4} + {\rm{MgO}} + {{\rm{H}}_2}{\rm{O}} = {\rm{C}}{{\rm{o}}_3}{\left( {{\rm{OH}} \cdot {\rm{S}}{{\rm{O}}_4}} \right)_2} \downarrow + {\rm{MgS}}{{\rm{O}}_4} $ | (11) |
| $ {\rm{MnS}}{{\rm{O}}_4} + {\rm{MgO}} + {{\rm{H}}_2}{\rm{O}} = {\rm{Mn}}{\left( {{\rm{OH}}} \right)_2} \downarrow + {\rm{MgS}}{{\rm{O}}_4} $ | (12) |
| $ {\rm{MgO}} + {{\rm{H}}_2}{\rm{O}} = {\rm{Mg}}{\left( {{\rm{OH}}} \right)_2} $ | (13) |
试验条件:磨矿细度-74 μm含量70%,搅拌浸出,矿浆质量浓度33%,加入硫酸控制终点pH值在1.5~1.8,反应时间5 h后过滤,加入一定量的自来水进行洗涤。
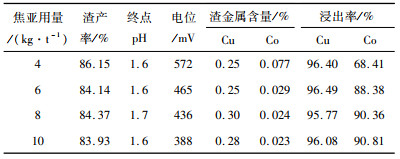
3.1.1 焦亚硫酸钠用量的影响硫酸加入30 min后加入焦亚硫酸钠,不同焦亚硫酸钠用量对铜钴浸出率的影响如表 4所示。
| 表 4 焦亚硫酸钠用量试验结果 Table 4 Testresults ofsodium metabisulfite dosage |
|
从表 4可知,随着焦亚硫酸钠用量的上升,铜浸出率变化不大,均在95%以上,钴浸出率逐渐升高,推荐焦亚硫酸钠用量8 kg/t矿为宜。
3.1.2 焦亚硫酸钠添加方式的影响固定焦亚硫酸钠用量8 kg/t,开展不同焦亚硫酸钠添加方式下Co的浸出效果试验,添加方式分为以下六种:(1)硫酸在试验开始时一次性加入,焦亚硫酸钠在试验开始时一次性加入;(2)硫酸在试验开始时一次性加入,焦亚硫酸钠在试验进行至30 min时加入;(3)硫酸在试验开始时一次性加入;焦亚硫酸钠分两次平均加入,分别在试验30和60 min;(4)硫酸分两次平均加入,分别在试验开始时和60 min;焦亚硫酸钠分两次平均加入,分别在试验第30和90 min;(5)硫酸分三次平均加入,分别在试验开始时、30 min和60 min,焦亚硫酸钠分三次平均加入,分别在试验60、80和100 min;(6)硫酸分三次平均加入,分别在试验30、60和90 min;焦亚硫酸钠分三次平均加入,分别在试验开始时、20和40 min。结果如表 5所示。
| 表 5 焦亚硫酸钠不同添加方式试验结果 Table 5 Testresults of different addition methods of sodium metabisulfite |

|
从表 5可知,不同的焦亚硫酸钠添加方式对Cu的浸出率无明显影响,Cu浸出率均达到95%以上;添加方式2的Co浸出率最高,达到90.37%,比焦亚硫酸钠与硫酸同时加入浸出率增加3.27百分点。
3.1.3 浸出时间的影响试验条件:焦亚硫酸钠用量8 kg/t,添加方式为上述方式(2),考察不同浸出时间下铜钴浸出率,结果如表 6所示。
| 表 6 不同浸出时间试验结果 Table 6 Testresults ofdifferent leaching time |

|
从表 6可知,随着浸出时间的延长,浸出矿浆pH有所上升,铜浸出率相差不大,铜浸出率均在95%以上,钴浸出率略有上升,浸出时间以5 h左右为宜,钴浸出率为90.38%。
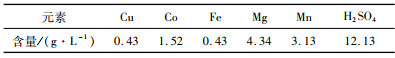
3.2 铜萃余液除杂浸出液经萃取铜后得到的萃余液多元素分析结果如表 7所示,由于铜、铁和锰的沉淀pH低于或与钴的沉淀pH相近,为了确保后续沉钴工序得到合格的氢氧化钴产品,需去除萃余液中的铜、铁和锰等杂质。
| 表 7 萃余液多元素分析 Table 7 Multi-element analysis of raffinate |
|
石灰石价格较低,且不容易由于碱度过大造成钴被共沉淀,但如果全部采用石灰石调节pH值,pH超过4.5以后,石灰石容易添加过量,因此采用石灰石与石灰配合中和除铁沉铜,先加入石灰石,将pH调节至3.5~4.0,石灰石用量20 kg/m3萃余液,然后继续加入少量石灰,将pH值调节至5.5~5.8,石灰用量2.2 kg/m3萃余液。试验结果如表 8所示。
| 表 8 不同反应时间除铁沉铜试验结果 Table 8 Testresults for removing iron and copper in different reaction times |
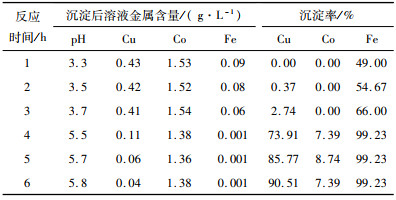
|
从表 8可知,石灰石加入后,随着反应进行,铁去除率逐步升高,铜沉淀率略有增加,钴基本不沉淀;反应3 h左右,pH值可达到3.7,此时铁含量为0.06 g/L;石灰加入后,随着反应进行,铜沉淀率逐步升高,石灰加入3 h后溶液中铜含量可降低至0.04 g/L,铜沉淀率90.51%,铁沉淀率99.23%,钴沉淀率7.39%。沉淀渣返回浸出工序回收铜钴,铁部分浸出,未浸出部分与原矿浸出渣一起外排。
3.3 钴的沉淀选用氧化镁作为沉钴药剂,与石灰相比,此时得到的沉淀产品钴含量更高,与钠系化合物相比,镁离子可用石灰从最终外排的废水中沉淀下来,因此对环境和尾矿坝影响较小。除杂后沉钴原液多元素分析结果见表 9。
| 表 9 除杂后溶液多元素分析 Table 9 Multi-element Analysis of Liquid after Impurity Removal |
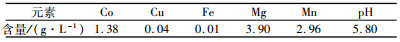
|
3.3.1 活性氧化镁加乳化时间的影响
试验条件:取一定量沉钴原液,按MgO/Co质量比1加入活性氧化镁干粉或用自来水配制成20%(质量浓度)乳液加入,常温下搅拌5 h后过滤,滤渣洗涤烘干后送测钴含量。试验结果如表 10所示。
| 表 10 活性氧化镁加入方式影响试验结果 Table 10 Testresults of activated magnesium oxide adding methods |
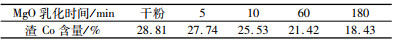
|
从试验结果可以看出,氧化镁乳化时间越长,活性越差,沉淀产品钴含量越低,而干粉在实际生产中加入容易造成结团等,因此建议氧化镁乳化5 min之内加入为宜。
3.3.2 活性氧化镁用量的影响氧化镁用量对氢氧化钴品质和沉淀率的影响如表 11所示。
| 表 11 活性氧化镁用量影响试验结果 Table 11 Testresults ofactivated magnesium oxide Dosage |
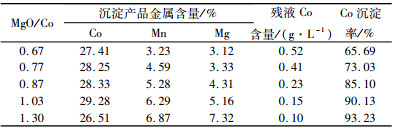
|
从表 11可知,随着MgO用量增加,沉钴后残液钴含量逐渐降低,钴渣钴品位先升高后降低,当MgO用量与Co质量比为1.03时,可得到钴品位高于29%的钴渣,氧化镁过量时,氢氧化钴产品中锰和镁含量都大幅上升,生产上应控制合适的氧化镁用量。
3.3.3 沉钴反应时间的影响试验条件:搅拌沉钴中MgO/Co质量比1.03。反应时间对钴沉淀率及钴渣品质影响如表 12所示。
| 表 12 沉钴反应时间试验结果 Table 12 Testresults ofcobalt precipitation reaction time |
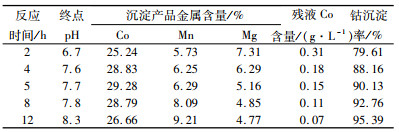
|
随着反应时间的延长,沉淀钴渣Co品位降低,Mn品位升高,Mg品位稍微有所减低。反应时间以4~5 h为宜,钴沉淀率90.13%。
沉钴后残液中还含有一定量的钴,可采用较便宜的石灰第二段沉钴,第二段沉钴渣返回中和系统回收钴。
4.4 全流程综合条件试验根据以上优化试验结果,综合试验条件如下:
(1) 铜和钴的浸出:磨矿细度-74 μm含量70%,搅拌浸出,矿浆质量浓度33%,加入硫酸控制终点pH值在1.5~1.8,硫酸加入30 min后加入焦亚硫酸钠,焦亚硫酸钠用量8 kg/t矿,反应时间5h。
(2) 铜萃余液除杂:浸出液铜萃取后采用石灰石+石灰配合除杂,常温下搅拌反应6 h,控制终点pH在5.8左右。
(3) 钴沉淀:铜萃余液除杂后采用活性氧化镁沉钴,活性氧化镁乳化5 min之内加入,MgO用量与Co质量比为1.03,沉钴时间5 h。
综合试验条件下获得的氢氧化钴渣产品多元素分析结果如下表 13所示。
| 表 13 氢氧化钴渣多元素分析 Table 13 Multi-element analysis of cobalt hydroxide |

|
该产品可达到粗氢氧化钴二级品标准(《中华人民共和国有色金属行业标准YS/T 1152—2016》)。
4 结论本研究开发了还原浸出—除杂—活性氧化镁沉淀工艺回收刚果金某铜钴矿中的钴金属,当磨矿细度-74 μm含量70%,矿浆质量浓度33%,加入硫酸控制终点pH值在1.5~1.8,硫酸加入30 min后加入焦亚硫酸钠,焦亚硫酸钠用量8 kg/t矿,搅拌浸出5 h,钴浸出率90.38%;浸出液采用目前成熟的肟类萃取剂进行萃取—反萃—电积,萃取剂质量浓度约20%,反萃液硫酸度约170 g/L,电流密度约280 A/m2,得到A级阴极铜产品,萃余液采用石灰石+石灰配合除杂,常温下搅拌反应6 h,控制终点pH在5.8左右,石灰加入3 h后溶液中铜可降低至0.04 g/L,铜沉淀率90.51%,铁沉淀率99.23%,钴沉淀率7.39%,沉淀渣返回浸出工序回收铜钴;除杂后溶液采用活性氧化镁沉钴,活性氧化镁乳化5 min之内加入,当MgO用量与Co质量比为1.03,沉钴时间5 h,钴沉淀率90.13%,氢氧化钴沉淀符合行业二级品标准要求。
| [1] |
李明. 刚果(金)氧化铜钴矿冶炼工艺综述[J]. 有色冶金设计与研究, 2012, 33(1): 16-18. DOI:10.3969/j.issn.1004-4345.2012.01.005 |
| [2] |
梁新星, 胡磊, 欧阳全胜. 铜钴矿研究进展及发展趋势[J]. 湖南有色金属, 2014, 30(3): 42-45. DOI:10.3969/j.issn.1003-5540.2014.03.012 |
| [3] |
姜超, 李辉. 刚果(金)某铜钴矿硫酸浸出试验研究[J]. 有色矿冶, 2021, 37(4): 41-44. DOI:10.3969/j.issn.1007-967X.2021.04.011 |
| [4] |
郭双华. 从某低品位氧化铜钴矿石中直接浸出铜钴[J]. 湿法冶金, 2021, 40(3): 190-192. |
| [5] |
石玉臣, 张恩普, 张骄, 等. 刚果(金)某难处理氧化铜钴矿硫酸浸出试验研究[J]. 有色金属工程, 2021, 11(5): 45-51. DOI:10.3969/j.issn.2095-1744.2021.05.008 |
| [6] |
曹耀华, 王威, 刘红召, 等. 从某铜钴氧化矿石中浸出铜钴试验研究[J]. 湿法冶金, 2020, 39(6): 478-482. |
| [7] |
刘芳斌, 姚刚, 谢添. 刚果(金)氧化钴矿浸出动力学研究[J]. 中国有色冶金, 2020, 49(4): 90-95. |
| [8] |
陈学文. 粗磨条件下铜钴矿物学特性及浸出工艺实证研究[J]. 湖南有色金属, 2020, 36(2): 19-24+77. DOI:10.3969/j.issn.1003-5540.2020.02.005 |
| [9] |
张兴勋. 从非洲某铜钴矿石中浸出铜钴试验研究[J]. 湿法冶金, 2019, 38(4): 259-262. |
| [10] |
王明燕, 肖仪武, 祁小军. 刚果(金)某氧化铜钴矿工艺矿物学特性及对浸出工艺的影响[J]. 矿产保护与利用, 2020, 40(1): 118-123. |
| [11] |
李超, 覃忠祥, 宋振纶, 等. 刚果(金)某氧化钴矿还原酸浸试验[J]. 金属矿山, 2019(4): 93-96. |
| [12] |
于文圣. 从刚果(金)某铜钴氧化矿石中直接还原浸出铜钴[J]. 湿法冶金, 2019, 38(2): 88-91. |
 2021
2021

