| 真空热还原法制备金属锂的研究进展 |
金属锂及其化合物广泛应用于冶金、电子、能源电池、热核聚变及航空航天等领域,已经成为一种对国民经济和国防建设具有重大意义的战略资源,被称为“工业味精”和“21世纪的能源金属”。
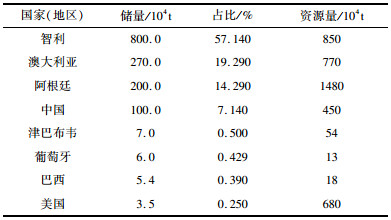
锂矿资源的分布如表 1所示,中国的锂矿资源储量居世界前列,仅次于智利、阿根廷和澳大利亚。单从储量角度看,我国拥有较为丰富的锂资源,但是由于地理位置偏远以及矿石禀赋较差等因素,我国的锂辉石矿开采难度较大、成本高,导致我国锂矿石资源严重依赖进口。我国是全球第一大锂盐生产国和消费国,但原料主要依赖于进口锂辉石精矿,且进口渠道单一,对外依存度曾达到70%左右[1-4]。同时,我国锂工业还存在着生产工艺落后、污染严重以及生产成本高等问题。据统计,我国矿石提锂的成本为全球最高[4]。因此,研发新型锂系列产品制备工艺,降低生产成本,对于我国锂工业发展具有重要意义。
| 表 1 2019年世界已探明锂矿储量与资源量概况[1] Table 1 Overview of the world's proven reserves and resources of lithium ore in 2019 |
|
金属锂的制备方法主要有熔盐电解法和真空热还原法两大类,熔盐电解法是当前工业生产金属锂的主要方法,1893年,Guntz提出在450 ℃下电解含有等量氯化钾和氯化锂的熔体,制得金属锂,奠定了电解法生产金属锂的基础[5]。经过改进,熔盐电解法主要是以熔融的LiCl 45%-KCl 55%为电解质,在390~450 ℃下,直流电解,在阴极得到金属锂。
热还原法也是一种传统的金属锂制备方法,1894年,瓦连用镁还原氢氧化锂,制得金属锂,开创了热还原法制备金属锂的先河,之后锂冶金工作者从未间断对热还原法炼锂的研究工作。有学者分别用钙和钠还原氯化锂,但是结果并不理想。1930年,J·Roer和J·Broos用锆还原铬酸锂,得到金属锂,但是生产率较低,成本较高。1936年,M·Jonnson申请了用铝还原锂辉石制取金属锂的专利。1937年,美国矿务局提出以碳为还原剂生产金属锂[5]。
与熔盐电解法相比,真空热还原法具有以下优势:(1)熔盐电解法的原料为高纯氯化锂,由碳酸锂提纯后氯化制备,成本较高,而热还原法以氧化锂熟料为还原物料,可由碳酸锂或氢氧化锂热分解制备,成本较低;(2)熔盐电解法电解质会挥发,阳极气体氯气污染环境、腐蚀设备,而热还原法无腐蚀性气体产生,过程清洁;(3)熔盐电解法由于钾、钠的析出电位较低,会优先析出进入金属锂中,而真空热还原法所得金属锂产品纯度高,主要是由于饱和蒸气压差异,能够避免杂质钾、钠混入金属锂中。随着真空冶金技术装备的不断进步,在镁冶金领域,真空热还原法已经基本取代熔盐电解法,成为工业镁冶炼的主要方法,这为真空热还原法炼锂提供了坚实的理论基础和技术储备。在金属锂供不应求的形势下,对金属锂制备工艺进行创新优化就显得尤为重要,真空热还原法炼锂也成为锂行业的一个重要研究方向。
本文对国内外热还原法制备金属锂的工艺和研究现状进行了综述,主要涉及碳热还原法和以铝硅系还原剂为代表的金属热还原法。并介绍了一种以氢氧化锂合成的Li5AlO4富锂熟料为原料,铝热还原制备金属锂,副产高白氢氧化铝的新工艺。
1 碳热还原法1937年美国矿务局首先提出用炭粉做还原剂,制备金属锂,基本原理如式(1)所示:
| $ {\rm{2L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + }}{{\rm{C}}_{{\rm{(s)}}}}{\rm{ = C}}{{\rm{O}}_{{\rm{2(g)}}}}{\rm{ + 4L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (1) |
该工艺还原剂廉价,但反应温度高,生成的锂蒸气易与CO发生反应,导致产品纯度低。陈为亮[6]对真空碳热还原炼锂进行了研究,先将活性炭粉、氧化钙以及碳酸锂混合、压团,置于真空炉中,加热,制得氧化锂熟料。然后将制得的氧化锂熟料与活性炭粉混合压团,进行真空热还原,在20 Pa和1 150 ℃的条件下还原120 min,制得纯度为54.34%的锂,再进行真空蒸馏,得到了纯度99.9%以上的高纯锂,从而验证了碳热还原制备金属锂的可行性,该工艺的基本流程见图 1。
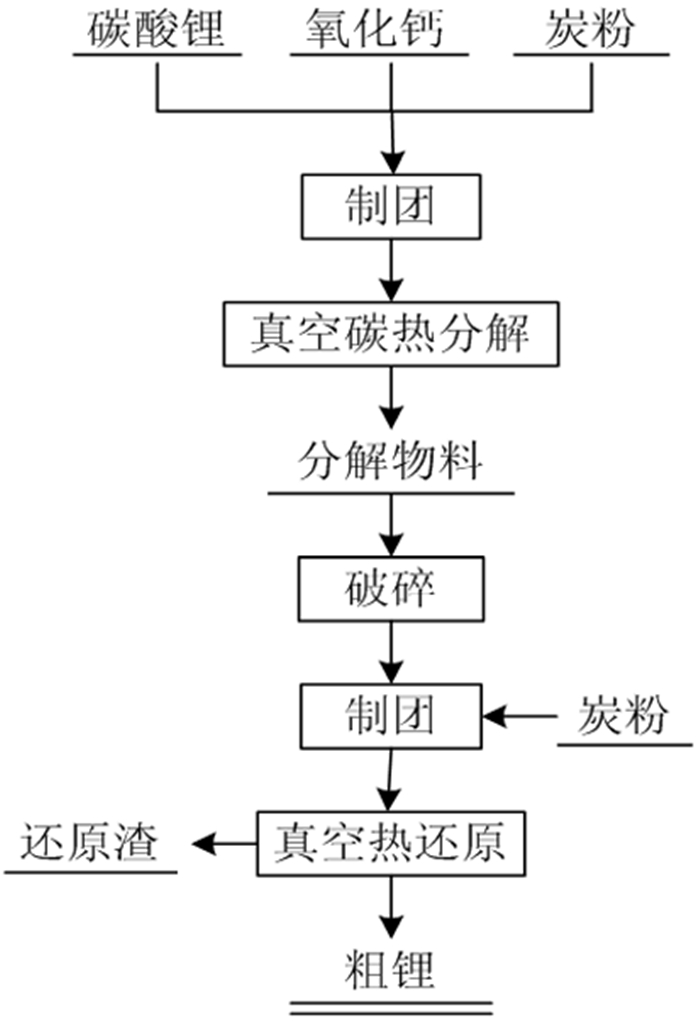 |
| 图 1 真空碳热还原法流程[6] Fig.1 Flow chart of vacuum carbon thermal reduction method |
真空碳热还原法原料廉价,成本相对较低,产渣量也较少,约为0.532 kg/kg-Li,但是生成的金属锂易与副产物CO、CO2等发生反应,导致还原后的产物纯度不高。由于碳热还原反应温度高,二次反应容易生成碳化物、氧化物和碳酸盐等杂质,Kroll和Schlechten等提出以碱金属的碳化物代替碳进行热还原制备金属锂。林智群[7, 8]等用碳化钙代替碳粉,采用如图 2的工艺路线,通过优化条件制得了纯度为98.28%的金属锂,原理如式(2)所示:
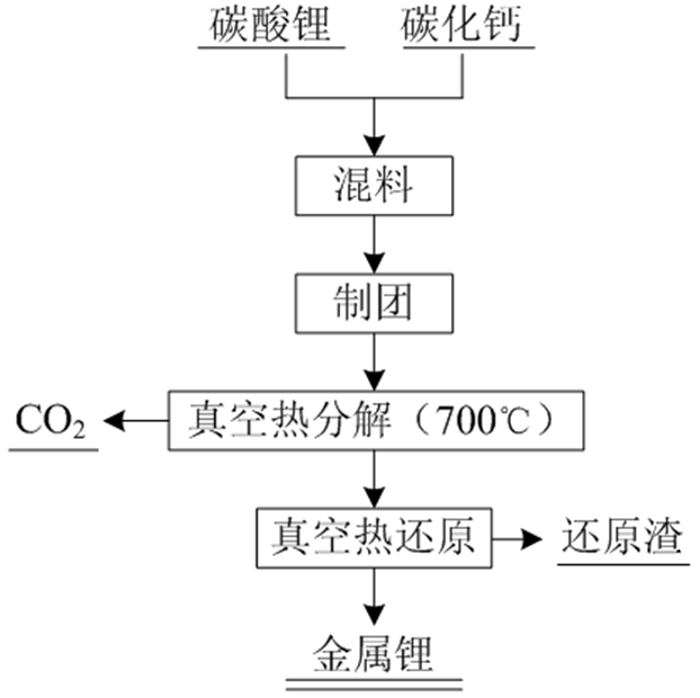 |
| 图 2 真空碳化钙热还原法流程[2] Fig.2 Flow chart of vacuum calcium carbide thermal reduction method |
| $ {\rm{3L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + Ca}}{{\rm{C}}_{{\rm{2(s)}}}}{\rm{ = Ca}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 2C}}{{\rm{O}}_{{\rm{(g)}}}}{\rm{ + 6L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (2) |
相对于真空碳热还原法,真空碳化钙热还原法流程简单,还原温度较低,只需一次配料、压团,过程中不需要额外添加物料,就可以直接制得粗锂,缩短了工艺周期,降低了能耗。但是,还原剂碳化钙成本相对较高,保存条件较为苛刻,且产物中碳的含量仍然较高,可能是在真空高温的条件下,碳化钙分解生成碳在高温下与金属锂发生反应生成碳化锂,二次反应的问题仍然未得到有效解决。碳热还原法制备金属锂,虽然具备还原剂成本低这一显著优势,但是从热力学角度来看,其还原温度较高,且极易发生二次反应,金属锂的纯度偏低,工业应用难度极大。
2 硅热还原法金属热还原主要是用金属为还原剂,真空热还原制备金属锂,常用的金属有铝、硅、铁、镁、钙、钡及相关合金等,传统方法的主要步骤分为碳酸锂热分解制备氧化锂以及氧化锂的真空热还原,还原原理如式(3)所示。
| $ {\rm{L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + }}{{\rm{M}}_{{\rm{(s)}}}}{\rm{ = M}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 2L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (3) |
式(3)中,M表示金属还原剂,MO表示金属的氧化物。
硅热还原法是以硅为还原剂,高温下还原氧化锂制备金属锂的方法。Kroll[9]以碳酸锂为原料,氧化钙为添加剂,先制备氧化锂物料,然后硅热还原制得金属锂,通过试验发现在950~1 000 ℃可以达到合适的金属锂回收率。同时,将碳酸锂、氧化钙和硅混合制团后,直接真空加热分解,再升温还原,结果发现产物氧化较为明显。Smeets[10]以氧化锂和锂辉石为原料,加入氧化钙压块、还原,发现了基本相同的规律。Stauffer[11]利用硅铁还原锂辉石,氧化钙/锂辉石达到2.3时,还原率可达87%,并进行了10 kg级的扩大试验,还原温度在1 150 ℃时,回收率为80%~85%,得到金属锂纯度为85%~90%。日本的小林正夫也进行了硅热法炼锂的研究,并设计了竖式和卧式两种真空还原炉,锂回收率达到90%左右[12]。
本课题组曾系统地研究了以碳酸锂为原料,硅铁为还原剂,氧化钙为添加剂的真空热还原工艺,具体工艺路线如图 3所示。在单因素和正交试验结合的基础上,分析了还原温度、还原时间、还原剂过量率、制团压力及物料粒度对金属锂还原率的影响规律。确定了最优条件为真空度4 Pa、还原温度1 020 ℃、还原时间180 min、制团压力30 MPa、物料粒度小于80 μm、还原剂过量系数50%,在最优条件下,金属锂的还原率达到97.83%,纯度99.24%,还原渣的主要成分为Ca2SiO4、CaO及未反应完全的FeSi[13]。还原机理如式(4)所示。
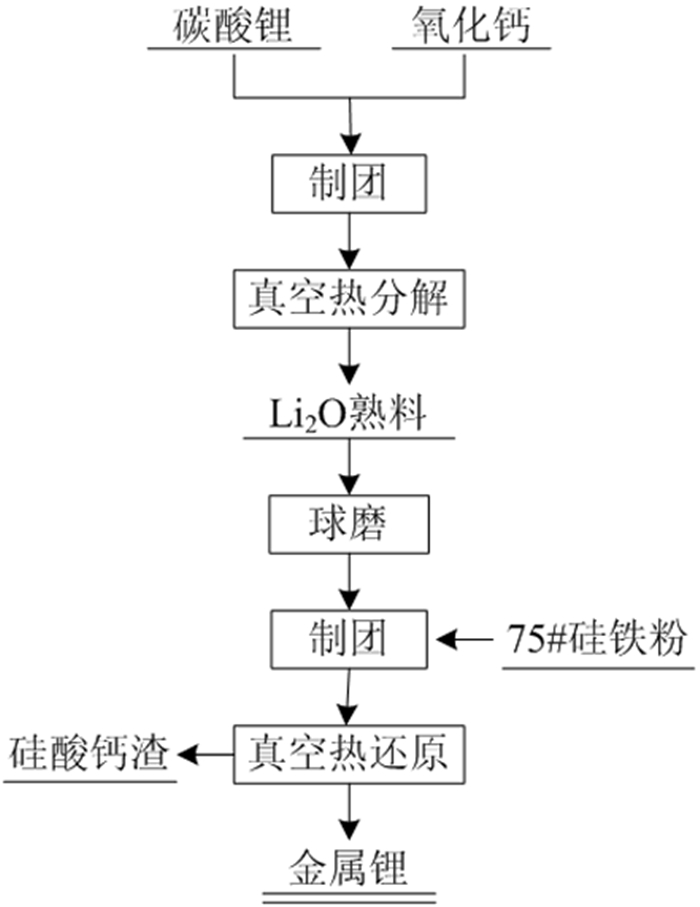 |
| 图 3 真空硅热还原法流程图[13] Fig.3 Flow chart of vacuum silicon thermal reduction method |
| $ {\rm{2L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 2Ca}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + Si}}{\left( {{\rm{Si - Fe}}} \right)_{{\rm{(s)}}}}{\rm{ = C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}}_{{\rm{(s)}}}{\rm{ + 4L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (4) |
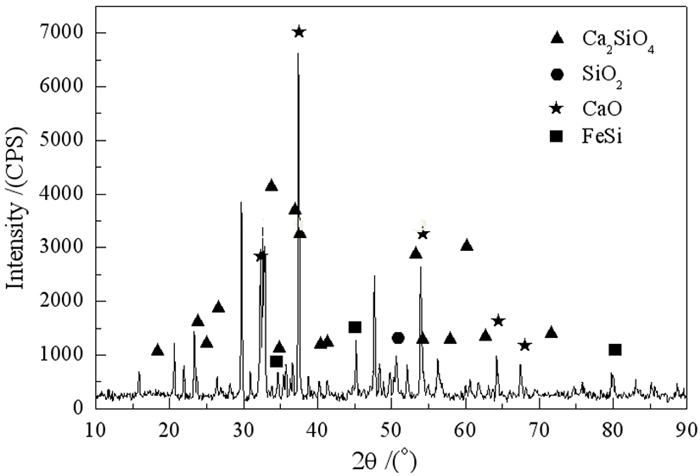 |
| 图 4 硅热还原炼锂所得还原渣XRD图[13] Fig.4 Reduction slag of silicon thermal reduction process |
通过以上研究发现,虽然经过工艺条件优化可以制备出纯度较高的金属锂,且回收率较高。但是还原过程的生产效率较低,具体表现在料锂比非常高,约为13 : 1,同时氧化锂熟料必须通过真空热分解的方式来制备,能耗较高。
狄跃忠[14]等设计并建成7.5 kg/炉的新型内电阻加热真空炼锂中试装置,进行了碳酸锂真空热分解试验和硅热还原制取金属锂的试验。所制备的氧化锂熟料可满足还原过程的需要,但是由于加热系统和结晶器的设计不完善等原因,金属锂的实收率较低,需要进一步优化改进。
3 铝热还原法真空铝热还原法主要是以铝为还原剂,真空条件下还原氧化锂物料,制得金属锂。Kroll[9]在铝粉过量10%、900 ℃、0.1 Pa的条件下,进行铝热还原,金属锂回收率为80%,还原机理如式(5)所示。
| $ {\rm{3L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{({\rm{S}})}}{\rm{ + Ca}}{{\rm{O}}_{({\rm{S}})}}{\rm{ + 2A}}{{\rm{l}}_{({\rm{l}})}}{\rm{ = CaO}} \cdot {\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}_{({\rm{S}})}{\rm{ + 6L}}{{\rm{i}}_{({\rm{g}})}} $ | (5) |
Stauffer[11]进行了铝热还原锂辉石制取金属锂的研究,在m(铝粉) : m(氧化钙) : m(锂辉石)=2 : 15 : 10,反应温度1 050~1 150 ℃下还原2 h,金属锂的回收率为92.2%,纯度85%~90%。林智群[8]研究了以碳酸锂为原料的铝热还原制备金属锂的过程,在加入氧化钙的条件下,通过分段加热实现碳酸锂先分解生成氧化锂,再还原氧化锂制备出金属锂,在该条件下金属锂的还原率可以达到93.37%。
李继东[15]等通过正交试验确定了以氧化锂为原料,真空铝热还原制备金属锂的最佳工艺条件:温度1 170 ℃、还原时间5 h、还原剂粒径100目、铝粉过量15%,在该条件下,金属锂还原率为92.2%。并进行了半工业试验,从配料、成团、分解、还原到最终出炉制得金属锂,工艺实现了连续化,共制得金属锂3.26 kg,回收率为79.8%[16]。但在半工业试验中,出现了金属锂的回收率较低、碳酸锂分解较为困难以及锂蒸气的冷凝回收困难等问题,因此还需要进一步优化改进。
中科院青海盐湖所用真空热还原—蒸馏工艺,以卤水提取的粗制碳酸锂为原料制备了纯度高达99.9%的高纯金属锂[17]。该工艺是以碳酸锂为原料,氧化铝、氧化钙为添加剂,摩尔比为13 : 6 : 8,煅烧得到CaO和LiAlO2的混合物,然后铝热还原得到金属锂,其理论料锂比为11.6 : 1,还原渣直接排放没有进行循环利用。
狄跃忠[14, 18]等以实现还原渣的综合利用为目的,进行了以碳酸锂为原料,常压合成LiAlO2熟料,然后铝热还原制备金属锂。还原过程发生的化学反应有:
| $ {\rm{3LiAl}}{{\rm{O}}_{\rm{2}}}_{({\rm{s}})}{\rm{ + 3Ca}}{{\rm{O}}_{({\rm{s}})}}{\rm{ + A}}{{\rm{l}}_{({\rm{l}})}}{\rm{ = 2}}{[{\rm{CaO}} \cdot {\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}]_{({\rm{s}})}}{\rm{ + 3L}}{{\rm{i}}_{({\rm{g}})}} $ | (6) |
| $ \begin{array}{l} {\rm{21LiAl}}{{\rm{O}}_{\rm{2}}}_{{\rm{(s)}}}{\rm{ + 24Ca}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 7A}}{{\rm{l}}_{{\rm{(l)}}}}{\rm{ = }}\\ {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\rm{2[12CaO\cdot7A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}{{\rm{]}}_{{\rm{(s)}}}}{\rm{ + 21L}}{{\rm{i}}_{{\rm{(g)}}}} \end{array} $ | (7) |
所得还原渣为铝酸钙型,如图 5所示。因此,采用混合碱液溶出—碳酸化分解的方法对还原渣进行了综合利用研究,制备出氢氧化铝。
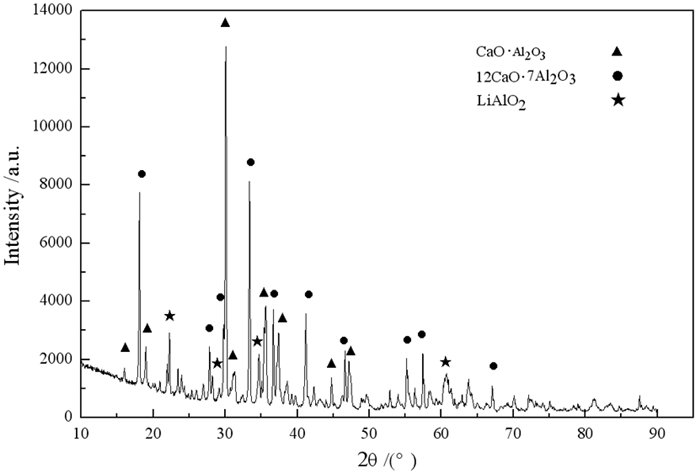 |
| 图 5 铝热还原所得还原渣XRD图[14] Fig.5 Reduction slag of aluminum thermal reduction process |
4 铝硅合金热还原法
由于铝、硅都可以作为还原剂来还原金属锂,因此有学者尝试用铝硅合金作为还原剂来制备金属锂。林智群[8]以铝粉和硅粉混合物为还原剂,按照式(8)的反应,在系统压强为5 Pa、还原温度900~1 100 ℃的条件下,对铝硅合金热还原制备金属锂进行了研究,在该条件下,金属锂的还原率最高可达97.32%,纯度达到99%。
| $ \begin{array}{*{20}{l}} {{\rm{9L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{({\rm{S}})}}{\rm{ + 3Ca}}{{\rm{O}}_{({\rm{S}})}}{\rm{ + 2A}}{{\rm{l}}_{({\rm{l}})}}{\rm{ + 3S}}{{\rm{i}}_{({\rm{s}})}}{\rm{ = }}}\\ {{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\rm{3CaO}} \times {\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}} \times {\rm{3Si}}{{\rm{O}}_{\rm{2}}}_{({\rm{S}})}{\rm{ + 18L}}{{\rm{i}}_{({\rm{g}})}}} \end{array} $ | (8) |
本课题组将摩尔比为1 : 2的碳酸锂与氧化钙混合,经真空热分解得到氧化锂熟料。还原剂采用电热法生产的一次铝硅铁合金,其中含28.83% Al和41.10% Si。将氧化锂熟料与铝硅铁合金粉混合均匀后,在物料粒度小于80 μm、还原剂过量30%、制团压力30 MPa下压团,在真空度为4 Pa、还原温度1 000 ℃下还原180 min,金属锂的还原率可以达到97%以上[14]。对还原渣进行了分析,结果如图 6所示,其主要成分为Ca2SiO4、3CaO·Al2O3、12CaO·7Al2O3。
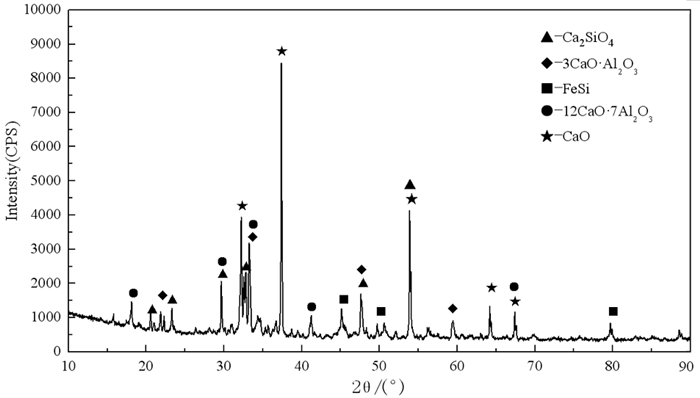 |
| 图 6 铝硅铁合金还原炼锂所得还原渣XRD图[14] Fig.6 Reduction slag of thermal reduction process by aluminum Ferro-silicon alloy |
在一次铝硅铁合金还原氧化锂的过程中,合金中硅是直接与氧化钙、氧化锂反应生成金属锂和硅酸钙,铝是在温度较低时与氧化锂反应生成金属锂和铝酸锂,如式(9)所示:
| $ {\rm{2L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + A}}{{\rm{l}}_{{\rm{(l)}}}}{\rm{ = 2LiAl}}{{\rm{O}}_{\rm{2}}}_{{\rm{(s)}}}{\rm{ + 3L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (9) |
当温度逐步升高时,铝与铝酸锂、氧化锂、氧化钙反应生成金属锂和铝酸钙,其发生的反应如式(10)和式(11)所示:
| $ \begin{array}{l} {\rm{21LiAl}}{{\rm{O}}_{\rm{2}}}_{{\rm{(s)}}}{\rm{ + 24Ca}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 7A}}{{\rm{l}}_{{\rm{(l)}}}}{\rm{ = }}\\ {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\rm{2[12CaO\cdot7A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}{{\rm{]}}_{{\rm{(s)}}}}{\rm{ + 21L}}{{\rm{i}}_{{\rm{(g)}}}} \end{array} $ | (10) |
| $ \begin{array}{*{20}{l}} {{\rm{3LiAl}}{{\rm{O}}_{{\rm{2}}({\rm{s}})}}{\rm{ + 6Ca}}{{\rm{O}}_{({\rm{s}})}}{\rm{ + 7A}}{{\rm{l}}_{({\rm{l}})}}{\rm{ = }}}\\ {{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\rm{2}}{{[{\rm{3CaO}} \cdot {\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}]}_{({\rm{s}})}}{\rm{ + 3L}}{{\rm{i}}_{({\rm{g}})}}} \end{array} $ | (11) |
由于铝硅合金热还原法在还原过程中,生成了更为稳定的固体产物,因此比用纯铝还原氧化锂更有优势[8]。相对而言,铝硅合金热还原法,还原温度较低,金属锂的还原率高,产品纯度高。
5 新型铝热还原法基于前人及本课题组的研究成果,以铝、硅及其合金为还原剂的真空热还原法炼锂工艺具有工业应用前景。但是常规工艺存在两个问题:(1)以碳酸锂制备氧化锂熟料,为实现碳酸锂的彻底分解常需添加大量氧化钙,同时还需进行真空热分解,造成还原过程的料锂比较高,效率较低;(2)常规金属热还原工艺基本未对还原渣的回收处理进行深入研究。因此,针对上述问题开发了新型铝热还原炼锂新工艺:以氢氧化锂为原料常压煅烧合成Li5AlO4型富锂熟料,再与铝粉混合真空热还原富锂熟料(Li5AlO4和CaO混合物)得到金属锂,同时获得理论成分为12CaO·7Al2O3的还原渣,该还原渣可通过碱液溶出、碳酸化分解进行回收利用[19]。其中主要的反应为:
| $ {\rm{10LiO}}{{\rm{H}}_{{\rm{(s)}}}}{\rm{ + A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}_{{\rm{(s)}}}{\rm{ = 2L}}{{\rm{i}}_{\rm{5}}}{\rm{Al}}{{\rm{O}}_{\rm{4}}}_{{\rm{(s)}}}{\rm{ + 5}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{{\rm{(g)}}}} $ | (12) |
| $ {\rm{21L}}{{\rm{i}}_{\rm{5}}}{\rm{Al}}{{\rm{O}}_{{\rm{4(s)}}}}{\rm{ + 48Ca}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 35A}}{{\rm{l}}_{{\rm{(l)}}}}{\rm{ = 5[12CaO\cdot7A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}{{\rm{]}}_{{\rm{(s)}}}}{\rm{ + 105L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (13) |
该还原过程的理论料锂比为8.54 : 1,相比文献报道的传统真空金属热还原炼锂工艺具有显著的优势,有利于提高还原过程的热效率和生产效率,主要的工艺流程如图 7所示。
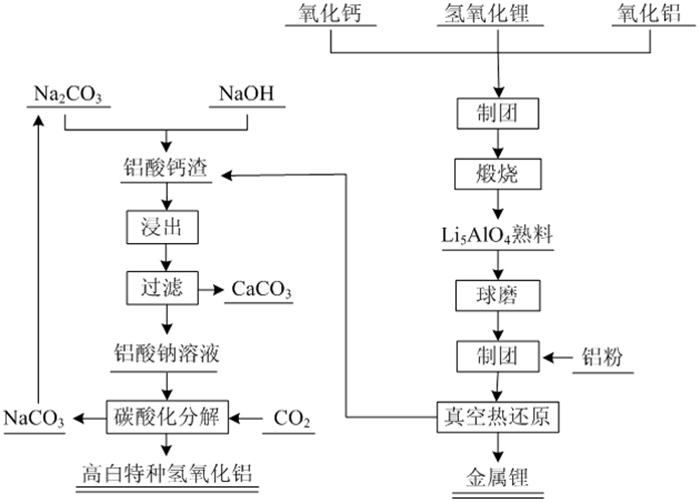 |
| 图 7 新型铝热还原流程[19] Fig.7 Flow chart of a new type of aluminothermic reduction |
唐成伟[20]对Li5AlO4熟料的制备及铝热还原过程进行了研究,以一水氢氧化锂、氧化钙和氧化铝合成Li5AlO4熟料,其物相组成如图 8所示,其主要成分为Li5AlO4和CaO。通过工艺优化金属锂的还原率可以达到96%以上,还原渣物相组成如图 9所示,其主要成分为12CaO·7Al2O3和CaO·Al2O3,为铝酸钙型还原渣。适合用碱液溶出—碳酸化分解制备氢氧化铝的工艺路线进行回收利用。
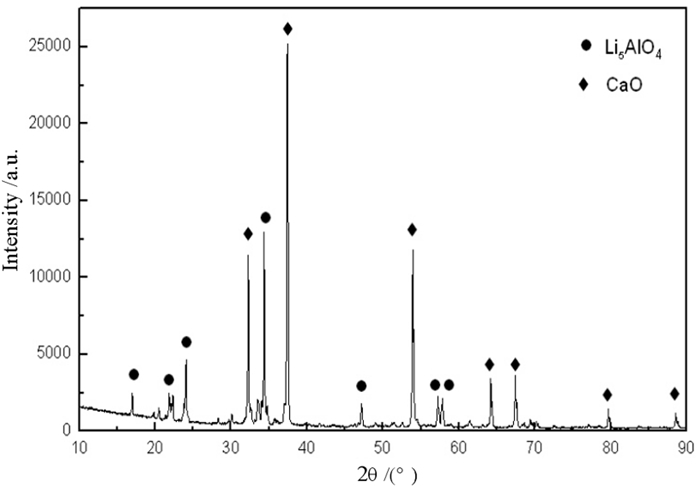 |
| 图 8 富锂熟料的XRD Fig.8 XRD of rich-lithium clinker |
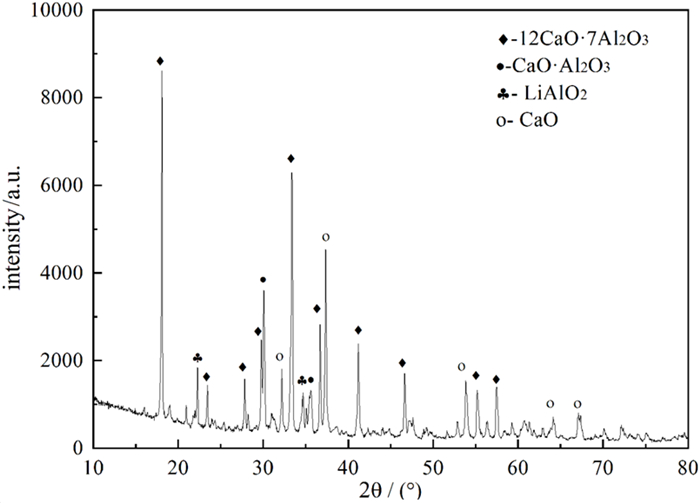 |
| 图 9 铝热还原所得还原渣 Fig.9 Reduction slag of new aluminum thermal reduction process |
通过添加Na2CO3和NaOH进行碱液溶出,可以将其中的大部分氧化铝以及过量铝粉溶出,其溶出的主要反应如下:
| $ {\rm{CaO}} \cdot {\rm{A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{{\rm{3}}({\rm{s}})}}{\rm{ + N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{{\rm{3}}({\rm{l}})}}{\rm{ = CaC}}{{\rm{O}}_{{\rm{3}}({\rm{s}})}}{\rm{ + 2NaAl}}{{\rm{O}}_{{\rm{2}}({\rm{l}})}} $ | (14) |
| $ \begin{array}{l} {\rm{12CaO\cdot7A}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{{\rm{3(s)}}}}{\rm{ + 12N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{{\rm{3(l)}}}}{\rm{ + 5}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{{\rm{(l)}}}}{\rm{ = }}\\ {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} {\rm{12CaC}}{{\rm{O}}_{{\rm{3(s)}}}}{\rm{ + 10NaO}}{{\rm{H}}_{{\rm{(l)}}}}{\rm{ + 14NaAl}}{{\rm{O}}_{{\rm{2(l)}}}} \end{array} $ | (15) |
| $ {\rm{2A}}{{\rm{l}}_{{\rm{(s)}}}}{\rm{ + 2NaO}}{{\rm{H}}_{{\rm{(l)}}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{{\rm{(l)}}}}{\rm{ = 2NaAl}}{{\rm{O}}_{{\rm{2(l)}}}}{\rm{ + 3}}{{\rm{H}}_{{\rm{2(g)}}}} $ | (16) |
前期通过优化条件,还原渣中氧化铝溶出率达到85.24%,再经碳酸化分解可得产品氢氧化铝,如图 10所示。对产品进行XRD分析可知其物相为Al(OH)3,且白度均大于95%,满足高白氢氧化铝国家标准要求。
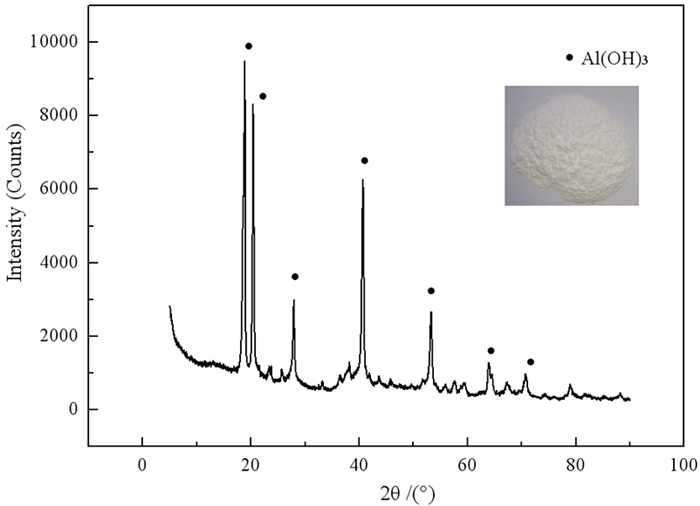 |
| 图 10 氢氧化铝的形貌及XRD Fig.10 XRD and morphology of aluminum hydroxide |
与传统的金属热还原法相比,新型铝热还原采用氢氧化锂为锂源,常压煅烧得到富锂熟料,从而避免了工业上碳酸锂分解困难的问题,Li5AlO4型富锂熟料与铝粉混合制团,真空加热还原过程料锂比得到显著降低,同时还原渣得到资源化利用,该法为真空热还原炼锂提供了一种新思路。
6 氢热还原法1972年,博恩兹(U.Bernds)以氢为还原剂,在1 100 ℃的温度下还原制得了金属锂,并于1973年申请了专利。氢热还原法主要是在高纯氢气流中加热粉状Li2O与惰性金属的混合物,反应过程生成金属间化合物,然后在高真空的条件下将金属化合物中锂蒸馏分离出来,冷凝制得金属锂,同时惰性金属实现循环利用。该方法较为新颖,却由于操作困难等原因并没有进行扩大化的试验,未见有扩大试验的相关报道。
7 铁热还原法昆明理工大学樊粉霞[21]等在热力学研究的基础上,尝试使用金属还原剂铁粉来制备金属锂。工艺流程与碳化钙还原法制备金属锂相近,如图 11所示。主要是通过真空加热使碳酸锂分解,然后以铁粉为还原剂与氧化锂反应,制得金属锂。
 |
| 图 11 真空铁热还原流程[21] Fig.11 Flow chart of vacuum iron thermal reduction process |
试验中金属锂的还原率仅为74.1%,还原过程发生的主要反应如式(17)所示。还原过程同时会生成Li2Fe3O5和Li5FeO4等化合物,相对于其它金属热还原工艺,铁热还原的还原剂比较廉价,而且该工艺将铁粉与碳酸锂直接混合反应,省去了碳酸锂单独分解的过程,节省了降温、升温时间,同时也降低了能耗,但是还原温度过高,而且金属锂的还原率过低,笔者认为基本不具备工业应用的前景。
| $ {\rm{L}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + F}}{{\rm{e}}_{{\rm{(s)}}}}{\rm{ = Fe}}{{\rm{O}}_{{\rm{(s)}}}}{\rm{ + 2L}}{{\rm{i}}_{{\rm{(g)}}}} $ | (17) |
(1) 真空热还原法与熔盐电解法相比,具有原料成本低、无腐蚀性气体产生、产品杂质少等优点。以Al、Si及其合金为还原剂的金属热还原法流程短、消耗少、成本低、环境友好、最具有工业应用价值。
(2) 新型铝热还原法以氢氧化锂替代碳酸锂,常压煅烧制备Li5AlO4型富锂熟料;还原过程理论料锂比为8.5:1,可有效降低真空冶金过程的能耗,提高生产效率;且还原渣可实现增值化利用,制备高白氢氧化铝,是一种高效绿色锂冶金工艺。
(3) 真空热还原法有着良好的应用前景,但走向工业化还需解决的关键问题是:优化还原反应器的冷凝系统以实现锂蒸气的定向收集,促进锂还原率与实收率的同步提升。
| [1] |
张苏江, 张彦文, 张立伟, 等. 中国锂矿资源现状及其可持续发展策略[J]. 无机盐工业, 2020, 52(7): 1-7. |
| [2] |
罗宁川, 莫子璇. 2019年我国锂行业市场情况[J]. 中国金属通报, 2019(11): 1-3. |
| [3] |
周园园. 中国锂资源供需形势及对外依存度分析[J]. 资源与产业, 2019, 21(3): 46-50. |
| [4] |
王秋舒, 元春华. 全球锂矿供应形势及我国资源安全保障建议[J]. 中国矿业, 2019, 28(5): 1-6. |
| [5] |
张明杰, 郭清富. 21世纪的能源金属——锂的冶金现状及发展[J]. 盐湖研究, 2001, 9(3): 52-60. |
| [6] |
陈为亮.真空精炼锂的研究与氧化锂真空碳热还原初探[D].昆明: 昆明理工大学, 2000.
|
| [7] |
林智群, 黄占超, 杨斌, 等. 氧化锂真空碳化钙热还原提取锂的研究[J]. 云南冶金, 2001(6): 31-34, 26. |
| [8] |
林智群.真空热还原提取金属锂的新工艺[D].昆明: 昆明理工大学, 2002.
|
| [9] |
KROLL WJ, SCHLECHTEN AW. Laboratory preparation of lithium metal by vacuum metallurgy[J]. AIME, 1949, 182: 266-274. |
| [10] |
SMEETS AAJ, FRAY DJ. Extraction of lithium by vacuum thermal reduction with aluminum and silicon[J]. Trans. Inst. Min. Metall, 1991, 100: 42-45. |
| [11] |
STAUFFER RA. Vacuum process for preparation of lithium metal from spodumene[J]. AIME, 1949, 182: 275-285. |
| [12] |
小林正夫. 金属锂的真空精炼[J]. 金属, 1958, 28(12): 933-936. |
| [13] |
狄跃忠, 董维维, 彭建平, 等. 以硅铁为还原剂制取金属锂的工艺优化[J]. 过程工程学报, 2009, 9(5): 910-915. |
| [14] |
狄跃忠.真空金属热还原制取金属锂的实验研究[D].沈阳: 东北大学, 2011.
|
| [15] |
李继东, 张保国, 张明杰. 以氧化锂为原料真空铝热还原法制备金属锂的正交实验研究[J]. 真空科学与技术学报, 2014, 34(12): 1366-1369. |
| [16] |
李继东, 张保国, 张明杰. 真空铝热炼锂过程动力学分析与半工业试验[J]. 有色金属工程, 2014, 4(5): 32-34. |
| [17] |
周园, 韩金铎, 贾永忠, 等. 青海盐湖初级碳酸锂产品制备高纯金属锂研究[J]. 稀有金属, 2004, 28(2): 343-345. |
| [18] |
狄跃忠, 彭建平, 王耀武, 等. 真空铝热炼锂还原渣回收氢氧化铝的研究[J]. 东北大学学报(自然科学版), 2019, 40(4): 500-504. |
| [19] |
狄跃忠, 冯乃祥, 彭建平, 等.一种真空铝热还原炼锂的方法:CN102560148A[P].2012-07-11.
|
| [20] |
唐成伟.真空铝热还原炼锂新工艺的研究[D].沈阳: 东北大学, 2013.
|
| [21] |
樊粉霞.真空铁热还原制备金属锂的研究[D].昆明:昆明理工大学,2012.
|
 2020
2020


 ,
,