| 羟基磷灰石去除铅离子过程机理研究 |
2. 武汉科技大学冶金矿产资源高效利用与造块湖北省重点试验室,湖北 武汉 430081
2. Hubei Key Laboratory for Efficient Utilization and Agglomeration of Metallurgic Mineral Resources, Wuhan University of Science and Technology, Wuhan 430081, China
羟基磷灰石[Ca10(PO4)6(OH)2]是人体骨骼和牙齿的主要成分,同时也是天然磷酸盐矿物的重要组成部分。作为一种多功能的矿物材料,羟基磷灰石(HAP)具有十分优异的吸附性能,被广泛应用于环境治理领域。特别是作为重金属离子的吸附剂,HAP一直有着较好的发展前景[1-4]。目前合成HAP的方法主要有化学沉淀法、水热法、溶胶凝胶法和模板法等[5-7],而不同方法制备出的HAP形貌和粒径也各不相同。但值得注意的是,三维多孔结构的HAP具有较好的物理化学性能[8, 9],特别是作为吸附剂而言,Zhu等人利用甘蔗茎顶部的提取物制备出具有分级多孔结构的HAP对Pb2+的吸附能力超过300 mg/g,提升效果显著[10]。近些年对于HAP除铅的研究也开展了不少[11-14],黄远等人采用分子动力学对HAP的溶解过程进行了计算,并结合表面Zeta点位证实了溶解机理的合理性[12],胡田田等通过运用Zeta点位和XRD对HAP吸附铅离子和铜离子的吸附动力学进行了分析,并阐述了化学反应与物理吸附并存的吸附特性[13]。然而对于孔隙丰富的HAP吸附铅的研究少有报道,去除铅离子过程的机理证实不够全面,特别是在低pH值的情况下,多孔HAP吸附铅离子的整个过程不够详细,需要更为直观的证据来补充。
因此,本研究在之前工作的基础上,采用天然磷矿为原料并结合模板法制备出结构可调控的三维多孔HAP[15],并对其进行吸附铅离子的系列试验,对HAP去除铅离子的过程进行探究,通过将XRD、SEM和EDS等检测方法结合,探究了低pH值下HAP去除铅离子的机理,为多孔HAP在处理工业废水的大规模应用提供了理论基础。
1 试验部分 1.1 HAP制备试验采用刘威等人[15]的方法制备出多孔HAP,通过使用天然磷矿为磷源,采用化学沉淀法和模板法相结合,以羧甲基纤维素钠(CMC)为模板剂,通过氨水调节溶液pH值并通过热处理合成出分散性好且具有有序多孔结构的HAP。该HAP具有纯度高、比表面积大、结构均匀的优点,而且整个制备过程简单方便,成本低廉。
1.2 主要仪器原子吸收仪,德国耶拿分析仪器股份公司;PHS-3C型精密pH计,上海日岛科学仪器有限公司;FA1004型电子天平,上海舜宇恒平科学仪器有限公司;SZ-93型自动双重纯水蒸馏器,上海亚荣生化仪器厂;X射线衍射仪(XRD), XD-5A型,日本岛津公司;扫描电镜(SEM), JSM-5510型,日本岛津公司;国华HJ-4多头磁力加热搅拌器,江苏常国华电器有限公司。
1.3 试验方法准确移取一定体积的铅离子溶液于烧杯中,加入适量的HAP,常压下,在适当温度下磁力搅拌一段时间,然后过滤取清液测定其pH值,并将清液稀释一定倍数利用火焰原子吸收法(GB7475-87)测定反应后滤液中铅离子浓度并计算除铅率。
2 结果分析主要研究了不同的反应时间及不同反应溶液的pH值对HAP去除铅离子过程的影响。并通过对反应前后HAP的XRD,SEM,EDS分析和对试验数据的处理分析来阐述反应机理。
2.1 不同反应时间,HAP除铅效果在室温下,取50 mg/L硝酸铅溶液100 mL,调节溶液pH值到4。称取0.05 g HAP加入其中,通过磁力搅拌,在转速相同的情况下,控制反应时间分别为2,5,10,20,30,40 min。将反应后的溶液利用滤膜过滤,测定反应后清液的pH值及此时清液中所含铅离子浓度并计算除铅率。
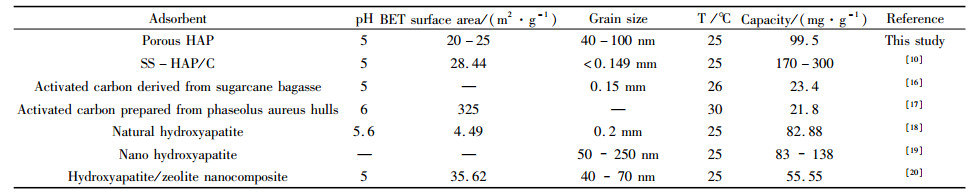
由图 1可知,铅离子去除率随着反应时间增加而增大,最终去除率趋于稳定。在30 min内,溶液中铅离子去除率即达到98%,剩余浓度仅为0.66 mg/L。表 1为近几年关于铅离子吸附材料的性能及特性研究的部分数据对比,可以看出本研究制备的HAP除铅的吸附量约为100 mg/g,要远远大于由植物根茎提取得到的活性炭的21.8 mg/g和23.4 mg/g[16, 17],也明显强于前人制备的HAP及其复合的材料[18-20]。
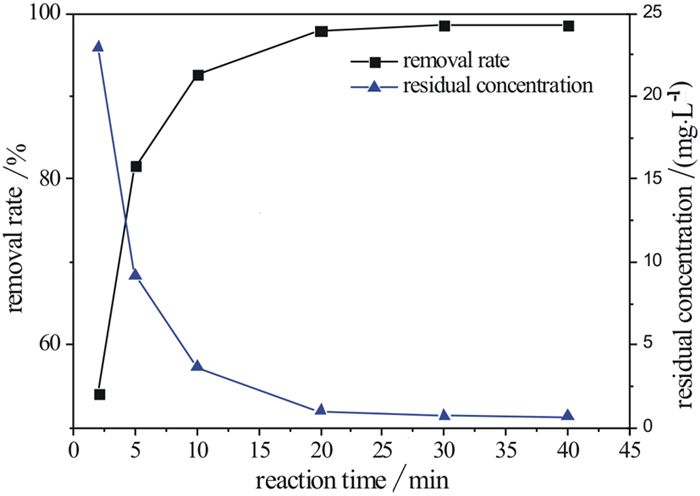 |
| 图 1 不同反应时间的HAP除铅率 Fig.1 Lead removal rate of HAP at different reaction times |
| 表 1 不同研究合成吸附Pb2+材料的性能及特性 Table 1 properties and properties of adsorbed Pb2+ materials in different studies |
|
2.2 不同反应pH值下,HAP除铅效果
同样取50 mg/L的硝酸铅溶液100 mL,HAP用量为0.5 g/L,反应时间10 min,观测pH值分别为2,3,4,5和6时HAP的除铅过程(图 2)。
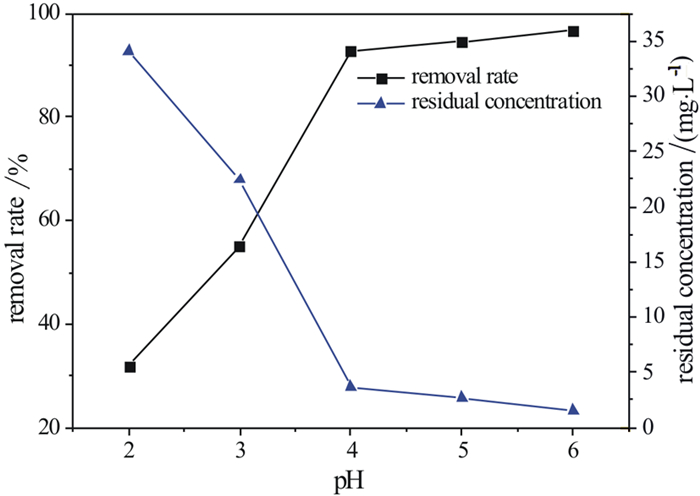 |
| 图 2 不同反应pH值下HAP除铅率 Fig.2 Lead removal rate of HAP under different pH values |
从图 2可以看出,HAP对铅离子的去除率随着pH值的增高而增大,pH值为6时,铅离子去除率达到96.5%, 剩余浓度为1.6 mg/L。当pH值为2~4时,去除率明显增高,当pH值为4~6时,除铅率的增长趋于稳定。这表明溶解—沉淀反应不是反应主要机理。因为溶解—沉淀机理是基于HAP的溶解与铅离子生成沉淀,当pH值越低,HAP溶解的量越大,生成沉淀越多,溶液中铅离子浓度越低,除铅率越高,这显然与试验结果相悖。
2.3 除铅机理由于在不同的反应pH值下,通过离子交换和溶解沉淀反应后的铅离子的存在形式是不同的[21],故而相应的除铅机理也可能有所不同。通过对Pb2+在不同pH值的溶液中络合物的分布系数进行计算,当pH < 4时,溶液中的铅主要以Pb2+形态赋存,当pH>5后,铅的赋存状态不单以Pb2+状态存在,还会生成相应的络合物。因此,对HAP原样、pH=3及pH=5反应后的固体烘干处理后,进行了SEM电镜,EDS与XRD分析,结果如图 3~图 7所示。
 |
| 图 3 不同反应pH值HAP的SEM图:(a) HAP原样;(b) pH=3;(c) pH=5 Fig.3 SEM images of HAP at different pH values:(a) initial HAP; (b) pH=3;(c) pH=5 |
 |
| 图 4 不同pH值HAP表面Ca2+的EDS图:(a) HAP原样;(b) pH=3;(c) pH=5 Fig.4 EDS image of Ca2+ on HAP surface at different pH values:(a) initial HAP; (b) pH=3;(c) pH=5 |
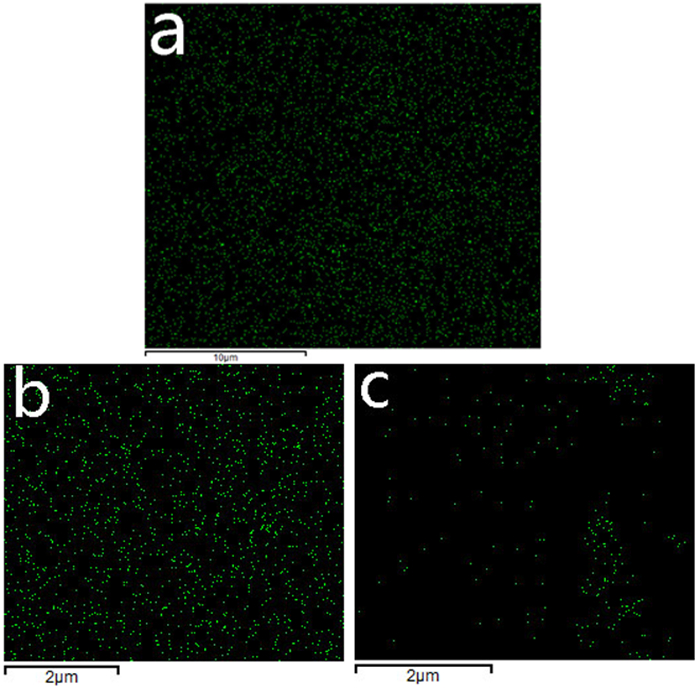 |
| 图 5 不同pH值HAP表面Pb2+的EDS图:(a) HAP原样;(b) pH=3;(c) pH=5 Fig.5 EDS image of Pb2+ on HAP surface at different pH values:(a) initial HAP; (b) pH=3;(c) pH=5 |
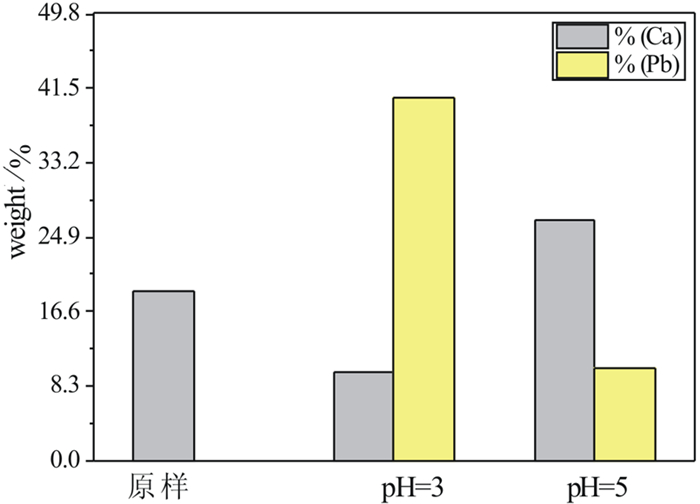 |
| 图 6 不同pH值下HAP表面Ca2+,Pb2+含量变化 Fig.6 Changes of Ca2+ and Pb2+ contents at HAP surface under different pH values |
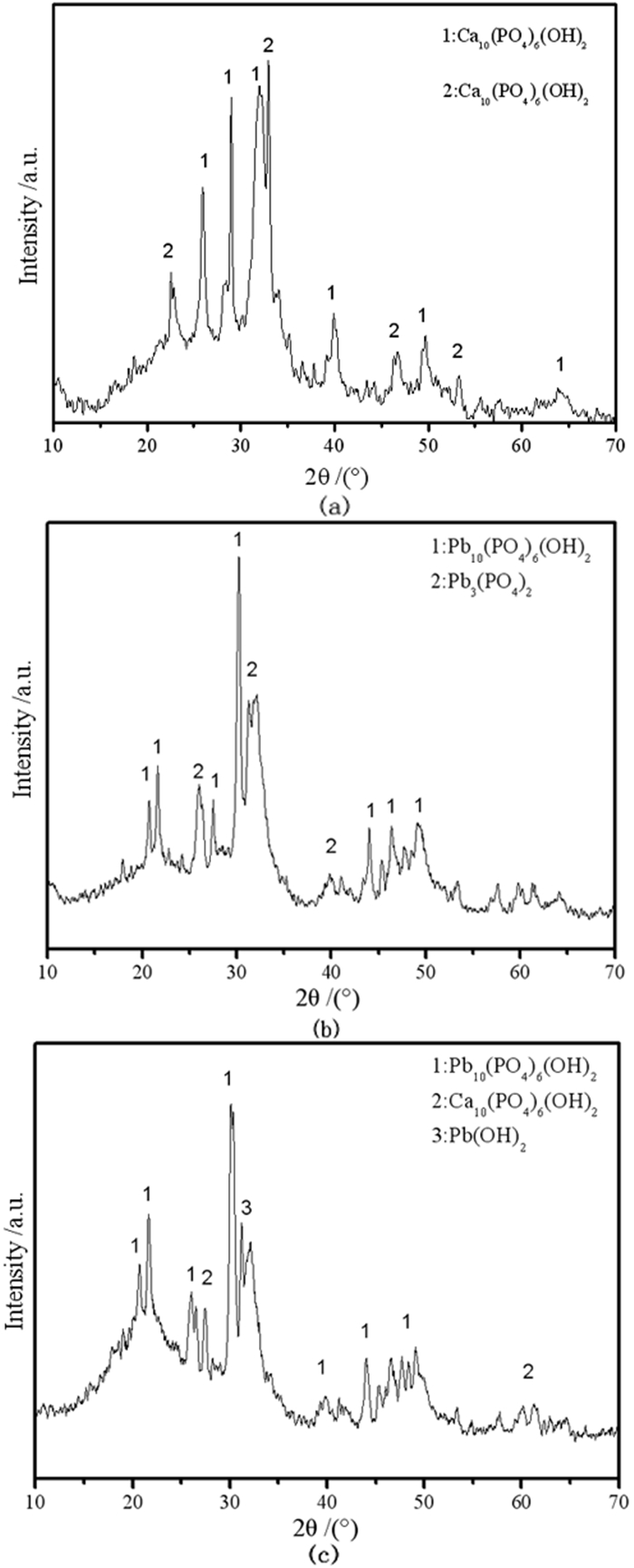 |
| 图 7 不同pH值下主要产物的XRD图:(a) HAP原样;(b) pH=3;(c) pH=5 Fig.7 XRD patterns of the main products at different pH values:(a) initial HAP; (b) pH=3;(c) pH=5 |
由图 3可知,原样HAP表面较为光滑,孔道清晰。当pH=3时,HAP表面变得粗糙,这通常是由HAP在酸性溶液中发生溶解所导致的。
由EDS结果显示(图 6),pH=3时HAP表面的Ca2+含量减少,而Pb2+明显增多(图 5中a,b),而且由图 5b可以看出HAP表面Pb2+的分布是较为均匀的,完全不同于图 5c中呈现局部聚集的现象,这与简单的物理吸附或是局部的沉淀过程所产生的试验现象不相符。而仅当HAP表面均匀分布的Ca2+和溶液中Pb2+通过孔道进行大面积的1:1交换才能确保Ca2+和Pb2+均匀的减少及增多,且符合离子交换过程中不同离子的变化情况[22]。
| $ {{\rm{H}}_3}{{\rm{O}}^ + } + {\rm{C}}{{\rm{a}}^{2 + }}({\rm{HAP}}) \to {\rm{C}}{{\rm{a}}^{2 + }} + {\rm{H}}_{({\rm{HAP}})}^ + + {{\rm{H}}_2}{\rm{O}} $ | (1) |
| $ {\rm{Pb}}_{({\rm{aq}})}^{2 + } + {\rm{Ca}}_{({\rm{HAP}})}^{2 + } \to {\rm{Pb}}_{({\rm{HAP}})}^{2 + } + {\rm{Ca}}_{({\rm{aq}})}^{2 + } $ | (2) |
然后通过XRD结果(图 7中b)分析发现,pH=3时主要产物含少量的Pb3(PO4)2和铅磷灰石,符合溶解沉淀机理反应的结果[23]。
| $ {\rm{C}}{{\rm{a}}_{10}}{\left( {{\rm{P}}{{\rm{O}}_4}} \right)_6}{({\rm{OH}})_2} + 14{{\rm{H}}^ + } \to 10{\rm{C}}{{\rm{a}}^{2 + }} + 6{{\rm{H}}_2}{\rm{PO}}_4^ - + 2{{\rm{H}}_2}{\rm{O}} $ | (3) |
| $ 10{\rm{P}}{{\rm{b}}^{2 + }} + 6{{\rm{H}}_2}{\rm{PO}}_4^ - + 2{{\rm{H}}_2}{\rm{O}} \to 14{{\rm{H}}^ + } + {\rm{P}}{{\rm{b}}_{10}}{\left( {{\rm{P}}{{\rm{O}}_4}} \right)_6}{({\rm{OH}})_2} $ | (4) |
由此可以判断出,当pH值为3时,反应机理主要为离子交换并伴随有少量的溶解沉淀。
由图 3(c)看出HAP表面孔道已被颗粒物堵塞,显然此时有沉淀产生并堆积在HAP表面,由图 5c看到Pb2+主要集中分布在图 3(c)对应的白色颗粒处,表明对应的白色颗粒处具有大量铅离子形成的沉淀,这与pH=3时Pb2+均匀分布差别较大。反应过后溶液pH值升高,通过离子溶度积计算发现此时溶液中满足生成Pb(OH)2的条件。而且,XRD结果显示(图 7 c),pH=5时主要产物为铅磷灰石,HAP和Pb(OH)2,这与计算结果相吻合,证实了水解沉淀机理的存在。而铅离子大量减少(图 6),显然是由于生成铅磷灰石所导致的,因为水解沉淀形成的区域并不大(图 3c,5c),这表明此时反应机理主要为溶解沉淀,而其他区域少量Pb2+的零散分布也表明不存在大范围的离子交换反应发生。由此判断出,当pH值为5时,反应主要为溶解沉淀机理,并且随着反应进行,还包含有水解沉淀发生。
3 结论HAP去除水溶液中铅离子的过程存在复杂的多相反应,其反应机理在pH=3时主要为溶解沉淀和离子交换,在pH=5时,为溶解沉淀和水解沉淀。
多孔HAP对水溶液中铅离子有极好的去除效果,当溶液pH=4时,0.05 g的HAP在40 min内对100 mL,浓度50 mg/L的Pb(NO3)2溶液中的铅离子去除率达到98.6%,剩余铅离子浓度降至0.7 mg/L以下, 达到国家规定排放标准(1 mg/L)。
| [1] |
Bi Y G, Liu D, Liu X M, et al. Preparation and characterization of nano-hydroxyapatite and its adsorption behavior toward copper ions[J]. Nanoscience & Nanotechnology Letters, 2017, 9(5): 810-816. |
| [2] |
Tang S Y, Dong H X, Zhao M L, et al. Effects of hydroxyapatite on absorption and transfer of Pb and Cd in soil-rice system[J]. Journal of Agro-Environment Science, 2016(2): 266-273. |
| [3] |
Yang L, Wei Z, Zhong W, et al. Modifying hydroxyapatite nanoparticles with humic acid for highly efficient removal of Cu2+ from aqueous solution[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2016, 490: 9-21. |
| [4] |
Liu Y, Yan Y, Seshadri B, et al. Immobilization of lead and copper in aqueous solution and soil using hydroxyapatite derived from flue gas desulphurization gypsum[J]. Journal of Geochemical Exploration, 2016, 184: 239-246. |
| [5] |
Liu D M, Troczynski T, Tseng W J. Water-based sol-gel synthesis of hydroxyapatite:process development[J]. Biomaterials, 2001, 22(13): 1721-1730. DOI:10.1016/S0142-9612(00)00332-X |
| [6] |
Mobasherpour I, Heshajin M S, Kazemzadeh A, et al. Synthesis of nanocrystalline hydroxyapatite by using precipitation method[J]. Journal of Alloys & Compounds, 2007, 430(1): 330-333. |
| [7] |
Earl J S, Wood D J, Milne S J. Hydrothermal synthesis of hydroxyapatite[J]. Journal of Physics:Conference Series, 2006, 26: 268-271. DOI:10.1088/1742-6596/26/1/064 |
| [8] |
Makihara T, Sakane M, Noguchi H, et al. Formation of osteon-like structures in unidirectional porous hydroxyapatite substitute[J]. Journal of Biomedical Materials Research Part B:Applied Biomaterials, 2018, 106(7): 2665-2672. DOI:10.1002/jbm.b.34083 |
| [9] |
Sharma R, Singh R, Penna R, et al. Investigations for mechanical properties of Hap, PVC and PP based 3D porous structures obtained through biocompatible FDM filaments[J]. Composites Part B Engineering, 2018, 132: 237-243. DOI:10.1016/j.compositesb.2017.08.021 |
| [10] |
Zhu Y, Jiang Y, Zhu Z, et al. Preparation of a porous hydroxyapatite-carbon composite with the bio-template of sugarcane top stems and its use for the Pb2+ removal[J]. Journal of Cleaner Production, 2018, 187: 650-661. DOI:10.1016/j.jclepro.2018.03.275 |
| [11] |
胥焕岩, 刘羽, 彭明生. 羟基磷灰石的除铅行为及作用机理研究[J]. 矿物岩石地球化学通报, 2007, 26(z1): 128-130. DOI:10.3969/j.issn.1007-2802.2007.z1.074 |
| [12] |
黄远, 李彦秋, 何芳, 等. 羟基磷灰石溶解机理的研究[J]. 临床口腔医学杂志, 2012, 28(6): 328-332. DOI:10.3969/j.issn.1003-1634.2012.06.004 |
| [13] |
胡田田, 仓龙, 王玉军, 等. 铅和铜离子在纳米羟基磷灰石上的竞争吸附动力学研究[J]. 环境科学, 2012, 33(8): 2875-2881. |
| [14] |
Hao L, Lv Y, Song H. The morphological evolution of hydroxyapatite on high-efficiency Pb2+, removal and antibacterial activity[J]. Microchemical Journal, 2017, 135: 16-25. DOI:10.1016/j.microc.2017.07.008 |
| [15] |
刘威, 钱功明, 郑丽, 等. 结构可调控纳米羟基磷灰石的制备研究[J]. 人工晶体学报, 2016, 45(1): 146-150. DOI:10.3969/j.issn.1000-985X.2016.01.025 |
| [16] |
Salihi I U, Kutty S R M, Isa M H. Adsorption of Lead ions onto Activated Carbon derived from Sugarcane bagasse[J]. Materials Science and Engineering, 2017, 201: 11-13. |
| [17] |
Rao M M, Ramana D K, Seshaiah K, et al. Removal of some metal ions by activated carbon prepared from Phaseolus aureus hulls[J]. Journal of Hazardous Materials, 2009, 166(2): 1006-1013. |
| [18] |
Kaludjerovicradoicic T, Raicevic S. Aqueous Pb sorption by synthetic and natural apatite:kinetics, equilibrium and thermodynamic studies[J]. Chemical Engineering Journal, 2010, 160(2): 503-510. |
| [19] |
Fernando M S, Silva R M D, Silva K M N D. Synthesis, characterization, and application of nano hydroxyapatite and nanocomposite of hydroxyapatite with granular activated carbon for the removal of Pb2+ from aqueous solutions[J]. Applied Surface Science, 2015, 351: 95-103. DOI:10.1016/j.apsusc.2015.05.092 |
| [20] |
Zendehdel M, Shoshtari-Yeganeh B, Cruciani G. Removal of heavy metals and bacteria from aqueous solution by novel hydroxyapatite/zeolite nanocomposite, preparation, and characterization[J]. Journal of the Iranian Chemical Society, 2016, 13(10): 1915-1930. DOI:10.1007/s13738-016-0908-9 |
| [21] |
Vila M, Sánchez-Salcedo S, Vallet-Regí M. Hydroxyapatite foams for the immobilization of heavy metals:From waters to the human body[J]. Inorganica Chimica Acta, 2012, 393(12): 24-35. |
| [22] |
T. Suzuki, T. Hatsushika, M. Synthetic hydroxyapatites as inorganic cation-exchangers; exchange characteristics for Pb2+ and Sn2+ ions in acidic solution[J]. Phosphorus Sulfur & Silicon & the Related Elements, 2009, 51(51): 435-435. |
| [23] |
Mavropoulos E, Rossi A M, Costa, Andréa M, et al. Studies on the mechanisms of lead immobilization by hydroxyapatite[J]. Environmental Science & Technology, 2002, 36(7): 1625-1629. |
 2020
2020



