| 锑污染土壤微生物修复机制研究进展 |
2. 湖南省核工业地质局三0六大队,湖南 长沙 410083
2. 306 Bridge of Hunan Nuclear Geology, Changsha 410083, China
锑(Sb)广泛存在于土壤、水体和大气中。Sb在环境中可以以四种价态(-Ⅲ、0、Ⅲ和Ⅴ)存在,其中Sb(Ⅲ)和Sb(Ⅴ)是最普遍的。在好氧环境中,Sb(Ⅴ)为优势种,主要以Sb(OH)6-的形式存在;在缺氧条件下以Sb(Ⅲ)为主,主要以Sb(OH)3的形式存在[1]。此外,Sb也以有机化合物(甲基化物种)形式存在[2]。Sb是生物体内一种非必需的有毒微量类金属元素。长期暴露在高浓度的Sb污染环境中会产生一系列人类健康风险,人体摄入过量Sb可能会导致呕吐、腹泻、皮疹、心脏和呼吸道等疾病[3, 4]。因此,Sb及其化合物已被美国环境保护署(EPA)和欧盟委员会(CEC)列为重点污染物[5]。
环境中的Sb污染是由自然和人为活动造成的。自然来源包括火山活动和含Sb地壳岩石和矿物的风化[6];人为活动来源主要是采矿和冶炼[7]。此外,Sb也被广泛用于制造阻燃剂、轻武器弹药、半导体、二极管、电池、合金、颜料和催化剂等,从而加速了Sb到环境中的释放[3]。全球每年Sb产量超过1.3×106 t,主要生产国为中国、俄罗斯、塔吉克斯坦和玻利维亚等。
图 1显示了近5年来世界各国Sb储量。中国作为全球最大的Sb生产国,拥有世界上最丰富的Sb资源,包括114个Sb矿[8],约占全球Sb总储量的52%。我国Sb资源储量最大的省份是湖南,该省冷水江市锡矿山是全球最大的Sb矿,Sb年产量占全国的三分之一,素有“世界锑都”之称。总体来说,我国Sb污染土壤中主要集中在采矿和冶炼领域。例如,锡矿山已开采多年,大量的废水、矿渣和碱渣被排放到附近环境中,造成了严重的环境污染和生态破坏[8]。因此,开发高效、环保的Sb污染土壤修复技术已成为近年来国内外研究者研究的热点。
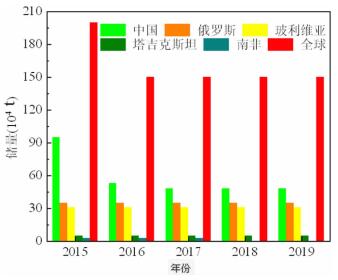 |
| 图 1 世界各国Sb储量(数据来源:美国地质调查局,USGS) Fig.1 Sb reserves of each country in the world |
目前,我国污染土壤修复技术体系主要由物理、化学和生物修复技术组成,主要包括化学法(土壤淋洗、固化/稳定化、氧化/还原、离子拮抗等)[9-12],物理法(电动修复、热处理等)[13, 14]和生物法(植物修复,微生物修复等)[15, 16]。虽然物理化学法具有周期短、操作简单、适应范围广等优势,但也存在成本高、二次污染、对土壤扰动大等不足,故而不能广泛应用。生物技术由于其低成本、可持续、环境友好等特点,在Sb污染土壤修复中的应用越来越受到重视,尤其是微生物介导法[17]。微生物群落是土壤生态系统中最具多样性和优势的生物类群。据报道,微生物的代谢活动负责周期表中大约1/3元素的转化[18]。尽管Sb具有毒性,但许多微生物仍能在Sb污染的环境中生存和繁衍。Luo等[19]利用宏基因组学和PCR技术对As和Sb污染土壤中微生物基因的表达进行了表征。结果发现,与As和Sb循环相关的功能基因(如arsC、arrA、aioA和arsB)的分布、多样性和丰度与As和Sb浓度呈正相关。Majzlan等[20]在富含Sb的尾矿中发现Sphingomonas,Caulobacter,Janthinobacterium,Geobacter,Rhodoferax和Sulfuricurvum等多个菌属具有较高的丰度。此外,有些细菌可以通过微生物氧化还原Sb获得能量并支持其生长[21]。上述结果表明,微生物对Sb具有耐受性,其可能在Sb的生物地球化学循环中起着关键作用。虽然Sb和As在毒理学、物理和化学性质上有一些相似之处,但对Sb生物转化的研究仍然非常有限。另外,目前还不清楚Sb污染环境中地球化学因素对Sb行为的影响。因此,了解土壤理化性质对Sb行为的影响以及微生物与Sb的相互作用机制,对于进一步开发Sb污染土壤的微生物修复策略具有重要意义。
近年来大多数综述文章都集中在环境中Sb的毒理性和生物利用度等方面,关于微生物与Sb相互作用的分子机制的综述较少。本综述的主要内容如下: (1)概述了土壤理化性质对Sb迁移转化行为的影响;(2)介绍了Sb对土壤生物的毒性效应;(3)讨论了微生物对Sb的抗性及解毒机理;(4)分析了Sb污染土壤的微生物修复技术及机理。
1 土壤理化性质对Sb迁移转化行为的影响土壤重金属的行为(迁移、转化、生物利用度和毒性等)与土壤理化性质(如pH、氧化还原电位及其他无机或有机物等)密切相关[22]。因此,了解土壤理化性质如何影响Sb的形态转化、吸附和迁移对于准确评估Sb污染土壤的风险及生物修复Sb污染土壤具有重要指导意义。
在含氧或轻度还原土壤系统中,Sb(Ⅲ)热力学不稳定,Sb主要以Sb(Ⅴ)的形式存在[23]。这主要是由于Sb污染土壤系统中通常存在铁锰(氢)氧化物发生氧化作用或溶解态硫化物缓慢的还原动力学及络合作用[24]。在缺氧土壤系统中,Sb(Ⅲ)占主导地位[25]。此时,微生物逐渐被迫选择能量较低的末端电子受体进行呼吸反应[2]。Mitsunobu等[26]考察了日本某尾矿土壤水中Sb的氧化形态。研究表明,Sb以Sb(Ⅴ)的形式存在,其氧化电位范围分布广泛(Eh = 360 ~ 140 mV, pH 8);Sb与土壤中含Fe物质丰度呈正相关,土壤中Sb的主相为Fe(Ⅲ)氢氧化物。综上,Sb(Ⅲ)更容易在较低的Eh值下被氧化为Sb(Ⅴ),Sb(Ⅴ)在好氧环境中比Sb(Ⅲ)更稳定。Steely等[27]研究了靶场土壤和被砷酸铅农药污染的苹果园土壤中Sb(Ⅲ)和Sb(Ⅴ)与腐殖酸(HA)之间的关系。结果发现,Sb会与HA发生络合作用,HA具有阻止Sb在土壤中迁移的能力,且有利于Sb(Ⅲ)转化为毒性较小的Sb(Ⅴ)。Karimian等[28]指出在有机物质存在的还原条件下,Fe(Ⅱ)的生成可能导致初始亚稳态HA-Sb(Ⅴ)-Fe(Ⅲ)相迅速转变为更稳定的相,从而降低了土壤中Sb的迁移率。此外,在土壤系统中,Sb(Ⅴ)的迁移率在很大程度上受pH的影响[29],即Sb(Ⅴ)的迁移率在较高的pH值下增加。这主要是由于土壤中的Sb(OH)6-阴离子与黏土、铁或铝的含水氧化物和有机质的表面负电荷基团之间存在静电排斥现象。
金属氧化物是土壤中一类重要的矿物,通常具有纳米尺寸,对金属污染物的反应活性较高。针铁矿广泛存在于土壤和沉积物中,其对有毒金属(胶体)在环境的转化和迁移起着重要作用[30]。Fan等[30]考察了溶液pH、针铁矿含量、HA等环境因素对光诱导亚锑酸盐氧化的影响。结果表明,在光照条件下,亚锑酸盐可被针铁矿吸附和氧化,从而降低了环境风险。Tighe和Lockwood[31]报道了在pH值为2.5~7时,95%的Sb (Ⅴ)会被非晶形氢氧化铁吸附,pH值在4左右时达到最大吸附量。同样,赤铁矿的表面结合位点对Sb (Ⅴ)的吸附能力较强,在pH 4时吸附能力最强[32]。此外,有机物可能通过竞争吸附位点、静电作用和形成络合物影响金属的迁移率[33]。据报道,土壤中存在的金属(氢)氧化物对Sb具有很强的吸附能力,且吸附能力强弱依次为MnOOH >Al(OH)3>FeOOH。吸附过程中,pH对Sb吸附程度影响较大,在酸性条件下吸附效果较好。随着pH值增加到6以上,吸附量逐渐减少[2]。当pH值低于6时,超过80%的Sb (Ⅲ)被上述三种物质固定[34]。同时,阳离子和阴离子的存在可以通过影响金属浓度和pH等促进或抑制Sb吸附[35, 36]。利用光谱技术与DFT计算相结合已发现一些吸附体内部复合物的形成,如水合氧化铁对Sb的吸附主要以单齿单核与双齿双核两种构型存在[37, 38];Sb(Ⅴ)主要吸附于水钠锰矿边缘位点,形成单齿单核络合构型[39];铝氢氧化物吸附Sb的构型为双齿双核[40]。这些吸附复合体在环境中非常稳定,很难解吸[41]。此外,缺氧环境下,锰的氧化物可以氧化Sb (Ⅲ),反应过程可以表示为[42]:
| $ \rm Mn{O_2} + Sb{\left( {OH} \right)_3}{\rm{ + }}{H_2}O \to Mn{\left( {OH} \right)_2} + {H_3}Sb{O_4} $ | (1) |
Bagherifam等[43]发现,天然的锰氧化物能够降低农业土壤中Sb的流动性和生物利用度。Xu等[44]发现氧化锰的主要作用是将Sb(Ⅲ)氧化为Sb(Ⅴ),而氧化铁的主要作用是吸附Sb(Ⅴ)。Fu等[45]利用X射线吸收精细结构(XAFS)研究了氧化锰(Ⅳ)在土壤中对Sb(Ⅲ)的氧化作用,发现氧化锰(Ⅳ)在氧化Sb(Ⅲ)过程中起着重要作用。Belzile等[42]发现无论是天然的还是合成的Fe氢氧化物,都可以在短时间内有效地将全部Sb(Ⅲ)转化为Sb(Ⅴ)。然而,在氧化过程中,微生物并没有发挥重要的催化作用,而是在Fe氢氧化物表面进行了电子的非生物转移。总体反应可以表示为:
| $ \rm 2Fe\left( {OH} \right){_3} + Sb{\left( {OH} \right)_3} \to 2Fe\left( {OH} \right){_2} + {H_3}Sb{O_4} + {H_2}O $ | (2) |
如图 2所示, 可能的反应机制可概括为:(1) Fe(Ⅲ)氢氧化物吸附亚锑酸盐并在其表面形成一个复合体(一个Sb(Ⅲ)占据两个Fe(Ⅲ)位点);(2) Sb的两个电子转移到Fe原子上;(3)氧化Sb(Ⅴ)和还原Fe(Ⅱ)的释放。因此,土壤中天然存在的铁锰等(氢)氧化物对Sb的吸附和氧化是一种天然的解毒过程。
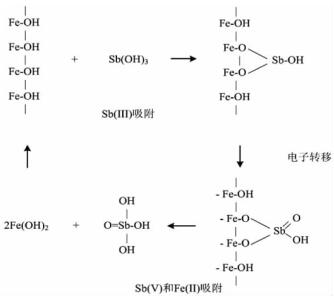 |
| 图 2 Sb(Ⅲ)吸附,电子转移及Sb(Ⅴ)和Fe(Ⅱ)吸附反应示意图[41] Fig.2 Schematic representation of the surface reaction involving adsorption of Sb(Ⅲ), electron transfer and release of Sb(Ⅴ) and Fe(Ⅱ) species [41] |
综上所述,土壤氧化还原电位会影响Sb在土壤中的存在价态,进而影响Sb的毒性和溶解度;土壤有机质(腐殖质)和金属(氢)氧化物可以氧化或固定Sb, 从而在一定程度上降低了Sb的活性和迁移能力;土壤pH值可以促进金属(氢)氧化物对Sb的吸附固定。因此,研究不同地区、不同土壤类型中Sb及其化合物与土壤中矿物和有机物之间的平衡关系以及不同土壤条件(pH、氧化还原电位等)下Sb的迁移转化规律,可以为有效地选择和使用Sb污染土壤修复的方法提供理论依据和技术支持。
2 Sb对土壤微生物的毒性效应Sb进入土壤生态系统后,会通过Sb自身的毒性作用或与土壤多介质组分的交互作用,对土壤生态系统构成污染胁迫。微生物过程在维持土壤功能和健康方面起着关键作用,但微生物过程对环境因子的变化极其敏感[46]。Sb的迁移率和毒性很大程度上取决于其氧化形态[22]。因此,微生物转化Sb可以影响Sb在土壤环境中的毒性;同样,Sb又会对微生物产生生态效应(如生物量、基本呼吸速率、酶活性、群落结构和生化过程等),而负面生态效应会导致土壤微生物多样性失衡,从而影响土壤功能[47, 48]。许多研究已经证明, 土壤酶活性可以作为重金属污染物不利影响的敏感指标[49, 50]。例如,Sb会影响土壤氮循环,主要表现为脲酶和脱氢酶活性的下降[51]。研究表明,Sb(Ⅲ)会影响A. tumefaciens GW4的Ars抗性、Sb(Ⅲ)氧化酶AnoA、磷酸盐代谢、碳水化合物运输和代谢以及脂类、嘌呤和氨基酸的代谢[3]。此外,Sb(Ⅲ)对巯基有很强的亲和力,可以在生物反应中代替磷,说明Sb会抑制DNA复制和微生物代谢过程[52],甚至会导致细菌DNA突变[53]。Sb及其化合物还会破坏细胞内离子平衡,引起细胞缺氧[54]。Obiakor等[55]发现,在短期暴露(2 ~ 6 h)条件下,Sb(Ⅲ)对A. brasilense Sp7的毒性是Sb(Ⅴ)的10倍左右。这可能与两种价态的Sb在细胞中的渗透能力和停留时间有关,Sb(Ⅲ)作为中间价态物质很容易通过自由扩散被水甘油通道转运而渗透细胞膜[56]。尽管目前尚不清楚细胞对Sb(Ⅴ)的转运机制[57],但Sb(Ⅲ)的易渗透性可以解释其比Sb(Ⅴ)毒性相对更高的原因。An和Kim[51]报道了在含Sb(Ⅲ)的肉汤培养基中,Escherichia coli,Bacillus subtilis和Streptococcus aureus的生长活性均受到了抑制。Murata等[58]也证明了在日本茨城县土壤中的Sb(Ⅲ)会降低微生物的存活率。此外,不同价态的Sb对细菌和真菌种群的影响不同,但不论Sb(Ⅲ)和Sb(Ⅴ),其对土壤微生物种群抑制率的大小顺序为:细菌>真菌>放线菌[59]。Diquattro等[60]评估了锑酸盐对不同土壤中微生物群落和土壤生化功能的影响。结果发现,碱性土壤中,Sb(OH)6-在短期内严重抑制了土壤微生物丰度、多样性和功能,最终影响了土壤肥力。当Sb浓度过高时,Sb氧化细菌细胞中H2O2大量积累,H2O2可以通过多不饱和脂肪酸的过氧化作用对细胞膜的脂质层造成氧化损伤,并破坏细菌的代谢功能,从而抑制细菌的生长[61]。
目前,有关Sb不同价态对土壤微生物的生态毒理效应的研究还相对较少。鉴于土壤微生物在维持生态系统整体服务功能方面发挥着重要作用,仍需进一步研究Sb对土壤微生物生长和代谢的毒性机理。
3 微生物对Sb的抗性机制了解微生物对Sb的抗性机制是Sb污染土壤生物修复的关键。微生物会利用不同的途径来避免或减少细胞内Sb的毒性积累,其可以通过改变膜的组成或抑制摄取来增加耐受性。如首先抑制Sb进入细胞,若Sb进入细胞,则促使Sb主动从细胞中挤出,或在细胞内以无毒的形式将其隔离[62]。生物外排是微生物为保护自身免受Sb的毒害而采取的最重要的措施之一。目前还没有发现微生物吸收Sb的专门通道,或许还没有进化出这样的通道,因为Sb不是微生物生长必需的微量元素[63]。基于As和Sb之间相似的化学性质,通常认为它们具有相同的抗性机制。编码As(Ⅲ)/Sb(Ⅲ)泵蛋白的arsB基因(arsRDABC操纵子的成员)已被证明同时具有As(Ⅲ)和Sb(Ⅲ)抗性[64, 65]。arsB编码一个12α螺旋跨膜蛋白,该蛋白常与调节蛋白ArsR、As(Ⅴ)还原酶ArsC、ATP酶ArsA和转录抑制蛋白ArsD结合,将As(Ⅲ)和Sb(Ⅲ)挤出细胞[66, 67]。Butcher等[68]将T. ferrooxidans耐砷基因arsB和arsC克隆到缺失突变体ars的菌株Escherichia coli后,发现其对Sb的抗性增强。尽管ars基因源于专性嗜酸细菌,但其在大肠杆菌中同样具有抗性功能。Li等[66]从Sb矿区中分离除了6株Sb(Ⅲ)氧化菌,包括Acinetobacter sp. JL7, Comamonas sp. JL25, Comamonas sp. JL40, Comamonas sp. S44, Stenotrophomonas sp. JL9和Variovorax sp. JL23。与其他Sb(Ⅲ)氧化菌相比,Comamonas sp. S44对As(Ⅲ)的抗性较高,对Sb(Ⅲ)的抗性较低,分析该菌株的基因组发现了4个编码As(Ⅴ)还原酶蛋白的arsC基因,这可能与高As(Ⅲ)抗性有关。说明Comamonas sp. S44对As和Sb的抗性机制可能存在较大差异。据报道,Acr3p及其同源物YqcL可以替代ArsB作为Sb(Ⅲ)的流出泵,且Acr3p主要存在于Actinobacteria和Alphaproteobacteria中[69],但在古生菌和真核生物中也发现了Acr3p,其中基因簇acr1、acr2和acr3负责Sb(Ⅲ)的抗性[70]。Kang等[71]研究发现,Agrobacterium tumefaciens 5A中acr3的缺失导致了对Sb(Ⅲ)的敏感性增加。Ghosh等[72]发现Sb(Ⅲ)刺激了Saccharomyces cerevisiae中acr3的表达,其基因产物具有Sb(Ⅲ)的耐受性。
此外,Meng等[56]发现As(Ⅲ)和Sb(Ⅲ)可以通过水-甘油的跨膜输送蛋白通道GlpF进入大肠杆菌细胞,并通过ArsB载体蛋白催化Sb(Ⅲ)的外排。另外,在Saccharomyces cerevisiae中,GlpF的同源物Fps1p也介导了Saccharomyces cerevisiae对Sb(Ⅲ)的吸收。fps1的缺失提高了Saccharomyces cerevisiae对Sb(Ⅲ)的耐受性,而该基因的组成性表达导致了超敏反应。当细胞暴露于Sb(Ⅲ)环境时,fps1的表达被抑制,这表明一个协调的基因调控网络可以保护细胞免受Sb(Ⅲ)的毒性影响[62]。ABC超家族转运蛋白Ycf1也可以通过液泡隔离而获得Sb(Ⅲ)耐受性的性能[73]。Kassa等[61]发现高浓度Sb会诱导Serratia marcescens抗氧化生物标志物如脯氨酸(PRO)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)和超氧化物歧化酶(SOD)水平显著升高,使细菌适应环境压力。在Leishmania中,Sb(Ⅲ)主要通过水-甘油通道蛋白AQP1进入细胞[74]。一般来说,AQP1的转录水平与Leishmania细胞中Sb(Ⅲ)的积累和敏感性水平相关[75]。其中,ABC转运蛋白PGPR和ABCI4参与了Sb(Ⅲ)-巯基外排,从而降低了细胞内Sb(Ⅲ)的积累[72]。据报道,Sb(Ⅴ)流入细胞的途径不同于Sb(Ⅲ)[76]。然而,微生物对Sb(Ⅴ)的摄取机制仍不清楚。
4 微生物修复Sb污染土壤近年来,微生物修复Sb污染土壤技术不断发展。整体而言,微生物修复机制与Sb形态、土壤理化性质和微生物种类及特性密切相关。其修复机理主要包括氧化、还原、吸附和甲基化等,各机理往往共同作用、相互影响。因此,对各机理及其相互作用进行定性与定量解析仍然是目前研究的难点和热点。此外,由于微生物修复的复杂性,需要与多学科技术如代谢组学、转录组学、宏基因组学、基因工程等结合使用,以明确其修复机制,进而达到稳定修复效果。
4.1 生物氧化Sb在土壤中主要以Sb(Ⅲ)和Sb(Ⅴ)两种化学形态存在,虽然这两种价态的Sb都是有毒的,但Sb(Ⅲ)化合物的毒性是Sb(Ⅴ)化合物的10倍[77]。因此,将毒性较大的Sb(Ⅲ)氧化为毒性较小的Sb(Ⅴ),对Sb污染土壤修复具有重要意义。除了化学氧化剂(H2O2、碘酸盐、铁锰(氢)氧化物)外,微生物在Sb(Ⅲ)氧化过程中也起着重要作用[3, 78]。
微生物对Sb(Ⅲ)的氧化可以促进Sb污染物的沉淀和原位固定,是一种很有潜力的污染土壤修复方法[77]。到目前为止,对介导Sb(Ⅲ)氧化的细菌种类和分子机制的报道还较少。近年来,已鉴定出60多种好氧Sb(Ⅲ)氧化菌,其中假单胞菌属、单胞菌属、农杆菌属和不动杆菌属占主导地位[3, 79]。Li等[80]发现了一种存在于Sb(Ⅲ)氧化菌Agrobacterium tumefaciens GW4中的氧化还原酶(AnoA)。敲除anoA基因会降低细菌对Sb(Ⅲ)的抗性,使其对Sb(Ⅲ)氧化能力降低约27%,而anoA基因过表达的菌株可使Sb(Ⅲ)氧化能力提高约34%。此外,Li等[81]报道了aioAB是导致细胞周质中Sb(Ⅲ)氧化的原因。若无aioAB,更多的Sb(Ⅲ)进入细胞后,Sb(Ⅲ)氧化酶AnoA和参与细胞氧化应激反应的蛋白显著增加,从而提高了Sb(Ⅲ)的氧化效率。然而,当这两个基因被破坏时,Sb(Ⅲ)氧化过程并没有完全停止,这表明细菌氧化Sb(Ⅲ)还有其他机制的存在[82]。Nguyen等[77]从Sb(Ⅲ)污染土壤中分离出2株Sb(Ⅲ)氧化菌(Shinella sp. NLS1和Ensifer sp. NLS4)。结果发现,两种菌株均能在营养受限的条件下氧化Sb(Ⅲ)。其中,Shinella sp. NLS1具有aioA基因,可以充当亚锑酸盐氧化酶的功能,Ensifer sp. NLS4不具有aioA基因,但其能够在厌氧条件下以硝酸盐为电子受体对Sb(Ⅲ)进行氧化,说明Sb(Ⅲ)生物氧化会通过不同的途径发生。Li等[66]报道了6种Sb(Ⅲ)氧化细菌均未表现出As(Ⅲ)氧化能力,虽然As和Sb具有相似的理化性质。此外,Comamonas sp. S44菌株的全基因组中未发现推测的As(Ⅲ)氧化酶基因aioBA。这与Lehr等[83]报道的A. tumefaciens 5A的情况不同,该菌株同时具有As(Ⅲ)和Sb(Ⅲ)氧化能力。这说明细菌氧化Sb(Ⅲ)和As(Ⅲ)存在不同的基因偶联。此外,Sb(Ⅲ)会诱导细菌的氧化应激反应,会产生大量的H2O2,H2O2可以作为氧化剂将Sb(Ⅲ)氧化为Sb(Ⅴ)[84]。一般来说,生物有氧呼吸不可避免地伴随着活性氧(ROS)的产生。Wang等[82]提出了一种新的非酶介导的氧化机制,即通过破坏Pseudomonas stutzeri TS44的ROS-通路保护,使H2O2积累并促进Sb(Ⅲ)氧化为Sb(Ⅴ)。除过氧化氢酶外,谷胱甘肽(GSH)也被认为是细菌氧化应激反应的重要组成部分[85]。Liu等[85]发现Comamonas testosteroni S44对多种重金属具有抗性,并且能够将有毒的亚锑酸盐(Sb(Ⅲ))氧化成毒性较小的锑酸盐(Sb(Ⅴ))。这可能是Fe-S组装转录因子IscR通过调节IscS介导的半胱氨酸脱硫作用,促进了GSH的形成。另外,Sb(Ⅲ)诱导iscR表达,iscR的缺失降低了细胞GSH含量。这些结果表明氧化细菌Sb(Ⅲ)受到IscR的调控。IscR调控Sb(Ⅲ)氧化的假设模型可概括为:(1) Sb(Ⅲ)可诱导细菌氧化应激反应,产生H2O2;(2)在碱性条件下H2O2将Sb(Ⅲ)氧化为Sb(Ⅴ);(3) IscR参与调控GSH的形成。然后,H2O2被过氧化氢酶KatA和GSH消耗,这也可能影响细菌氧化Sb(Ⅲ) [3]。
然而,对厌氧菌氧化Sb(Ⅲ)的认识还很有限。目前仅分离出几株厌氧或兼性厌氧Sb(Ⅲ)氧化细菌[77, 78, 86],这些菌株利用硝酸盐作为电子受体氧化Sb(Ⅲ),而氧化机制仍不清楚。Li等[78]发现在以硝酸盐为电子受体的缺氧条件下,Sinorhizobium sp. GW3在培养过程中能够同时氧化Fe(Ⅱ)和Sb(Ⅲ);然而,在Fe(Ⅱ)和硝酸盐同时存在的情况下,Sb(Ⅲ)氧化速率明显提高。除Sb(Ⅲ)氧化菌外,其他氧化性微生物也能间接促进Sb(Ⅲ)在自然环境中的氧化。Bai等[87]报道了Mn氧化细菌Pseudomonas sp. QJX-1能够氧化Mn(Ⅱ)形成生物源Mn氧化物(BMO),BMO可以将Sb(Ⅲ)氧化为Sb(Ⅴ),但只有Sb(Ⅲ)氧化生成的Sb(Ⅴ)离子能被进一步吸附到BMO表面。
综上所述,不论在有氧和缺氧环境,Sb(Ⅲ)都可以被土壤中的微生物和铁锰(氢)氧化物等轻易氧化,这也解释了土壤中Sb(Ⅲ)浓度较低的原因。因此,未来对Sb(Ⅲ)生物地球化学氧化的研究可以集中在更为复杂的自然环境中。
4.2 生物还原微生物对Sb(Ⅴ)还原是Sb在生物地球化学循环中不可缺少的过程。这些微生物过程影响了Sb的环境形态和迁移能力。迄今为止,大多数生物修复Sb污染土壤的研究主要集中于Sb(Ⅲ)氧化[25, 66, 88], 对生物还原法修复Sb污染土壤的研究相对较少。根据热力学平衡计算,Sb(Ⅴ)在水溶液中以Sb(OH)6-(锑酸盐)的形式存在,且在含氧土壤系统中相对稳定,而在还原条件下主要以Sb(OH)3(亚锑酸盐)的形式存在[89]。土壤中Sb(Ⅴ)还原为Sb(Ⅲ)的过程已被证明可以与Fe(Ⅱ)的氧化进行非生物耦合[90, 91],但该过程也被证明是由微生物催化进行的[92, 93]。土壤环境中普遍存在Sb氧化还原物被铁锰(氢)氧化物吸附的现象[2, 94],在淹水条件下会通过还原作用溶解释放Sb。在还原条件下,Sb(Ⅴ)会被转化为Sb(Ⅲ),而后者更容易与铁(氢)氧化物结合而被固定[7]。因此,生物还原Sb(Ⅴ)是一种很有前途的生物修复策略。Hockmann等[95]研究表明,在厌氧石灰性土壤中,本地微生物可以迅速将Sb(Ⅴ)还原为Sb(Ⅲ),生成的Sb(Ⅲ)随后与铁(氢)氧化物表面结合,使Sb固定。Lai等[96]证明了Rhizobium可以利用H2作为唯一电子供体将Sb(Ⅴ)还原生成Sb(Ⅲ)沉淀(Sb2O3)。Wang等[97]首次论证了硫酸盐还原菌(SRB)可以将Sb(Ⅴ)还原为Sb(Ⅲ),将硫酸盐离子转化为硫化物并与Sb(Ⅲ)形成络合物作为沉淀的可行性。Kulp等[93]报道了在缺氧沉积物中Sb(Ⅴ)的厌氧细菌还原作用。结果发现利用乙酸或乳酸作为电子供体可以将Sb(Ⅴ)还原成Sb(Ⅲ)并与硫化物络合析出沉淀。Nguyen等[98]从氧化锑生产工厂附近采集的沉积物样本中分离出一株Sb还原细菌JUK-1,其在生长过程中会生成Sb(OH)3的沉淀。Abin和Hollibaugh[99]利用转录组学在Desulfuribacillus stibiiarsenatis MLFW-2T中发现了第一个呼吸型Sb(Ⅴ)还原酶。该酶属于二甲亚砜还原酶(DMSOR)家族,它包含多种能够还原硝酸盐、砷酸盐、硒酸盐、高氯酸盐以及氧化甲酸盐、亚砷酸盐和亚硝酸盐的蛋白[100]。Shi等[101]采用宏基因组学和元转录组学的方法来揭示生物反应器中的DMSOR家族基因是否具有将Sb(Ⅴ)还原的潜力。研究发现,一些DMSOR家族基因(sbrA还原酶基因)高度转录,含有sbrA的假定操纵子包括编码c型细胞色素的基因、响应调节因子和铁氧化还原蛋白,它们共同实现Sb(Ⅴ)还原。然而,目前关于细菌还原Sb(Ⅴ)的分子机制尚不清楚,参与这一反应的酶也尚未确定。
此外,土壤环境中Sb的迁移率通常会受到与铁矿物吸附或共沉淀作用的影响[1, 102, 103]。铁氧化物的形成和矿物相转化对Sb的迁移性起着重要作用[104, 105]。研究表明,除Sb(Ⅴ)还原菌外,微生物对Fe(Ⅲ)的还原也会对Sb的迁移率产生很大的影响[7, 106]。Li等[78]证实了由微生物(Sinorhizobium sp. GW3)介导产生的含Fe(Ⅲ)的沉淀物可以有效地氧化和固定Sb(Ⅲ)。Burton等[107]发现异化的Fe(Ⅲ)还原菌Shewanella putrefaciens (CN-32)介导的Fe(Ⅲ)还原有助于在还原环境中固定Sb(Ⅴ)。Arsic等[25]也发现了微生物介导的Fe(Ⅲ)还原似乎与污染沉积物中Sb流动性的降低有关。
在之前的研究中,微生物Fe(Ⅲ)还原对Sb迁移率的影响很少被单独考虑(即在微生物还原的Fe(Ⅲ)是唯一终端电子的条件下)。这些影响主要是从微生物介导的复杂环境中(例如在天然土壤和沉积物中)的研究中推断出来的。在自然环境中,微生物对Fe(Ⅲ)、Mn(Ⅳ)和Sb(Ⅴ)还原通常同时发生,这可能会使得Sb与铁矿物组合发生变化,从而导致Sb的滞留[107]。因此,研究Fe(Ⅲ)、Mn(Ⅳ)微生物还原与Sb(Ⅲ)的反应过程,并进一步研究其在特定条件下(好氧、缺氧、其他还原性金属离子存在)的反应机理,有助于阐明Sb在土壤环境中的行为。这也可能是一种修复土壤中Sb污染的有效方法。
4.3 生物吸附在微生物与Sb的相互作用过程中,生物吸附是第一步[108]。研究表明,环境微生物(如细菌、真菌、藻类)可以吸附和固定多种重金属[109, 110]。Sb的生物吸附机制主要是由于细胞壁上存在的羧基、羟基和氨基官能团通过静电吸引、离子交换和络合等方式吸附和固定Sb[17, 111]。Gu等[112]从尾矿中分离到一种新型细菌(Acinetobacter sp. JH7),发现Acinetobacter sp. JH7可以吸附Sb(Ⅲ)。红外光谱分析表明,-OH, C-N和C-O等官能团可能参与了Sb(Ⅲ)的生物吸附。Zhang等[113]发现Synechocystis sp.可以通过细胞壁上的蛋白质和多糖吸附Sb(Ⅲ),吸附量可达4.68 mg·g-1(干重)。Zhang等[114]使用激发-发射矩阵(EEM)荧光光谱法研究了Synechocystis sp.胞外聚合物物质(EPS)与Sb(Ⅲ)的络合。结果发现,EPS与Sb(Ⅲ)之间的相互作用是自发的、吸热的。Sb(Ⅲ)与EPS的结合主要受氢键和范德华力的影响。红外光谱分析表明,EPS中的多糖参与了Sb(Ⅲ)与EPS的络合。Cai等[115]研究了Bacillus subtilis对Sb(Ⅲ)的吸附特性。结果表明,Bacillus subtilis在水溶液中对Sb(Ⅲ)离子的生物吸附是可行的、吸热的、自发的,其可作为一种廉价的原生细菌材料,在低温条件下协助植物吸收弱酸性或中性pH污染土壤中的Sb。Sun[111]和Wu等[116]研究了cyanobacteria Microcystis对Sb(Ⅲ)和Sb(Ⅴ)的生物吸附过程。结果表明,cyanobacteria Microcystis对Sb(Ⅲ)和Sb(Ⅴ)有较大的吸附潜力。其中,当pH为4时,cyanobacteria Microcystis对Sb(Ⅲ)的最大生物吸附量为4.88 mg·g-1(干重);当pH为2.8时,cyanobacteria Microcystis对Sb(Ⅴ)的最大生物吸附量为7 340.2 mg·kg-1(干重)。Sb(Ⅲ)的生物吸附符合Freundlich和Langmuir等温线模型,Sb(Ⅴ)的生物吸附符合Freundlich等温线模型。此外,绿色海藻(Cladophora sericea和Ulva rigida)和棕色海藻(Sargassum muticum和Ascophyllum nodosum)对Sb(Ⅲ)和Sb(Ⅴ)也有生物吸附能力[117, 118]。
目前,虽然做了大量工作来探索微生物对Sb的吸附行为,但针对土壤细菌的研究相对较少。事实上,大多数微生物会附着在土壤细粒矿物上,从而形成微生物-矿物复合材料[119],其是土壤重金属的重要吸附剂[120],并表现出不同于纯矿物或微生物对金属离子的吸附特性[121, 122]。Lei等[108]研究了厌氧条件下耐锑土壤细菌Bacillus cereus和针铁矿组成二元复合材料对Sb(Ⅲ)的吸附行为。结果表明,针铁矿、Bacillus cereus和细菌-针铁矿复合材料对Sb(Ⅲ)的吸附与pH无关。通过XPS光谱分析发现,该吸附行为主要与针铁矿的铁羟基官能团和细菌的羧基和氨基/酰胺基团有关。
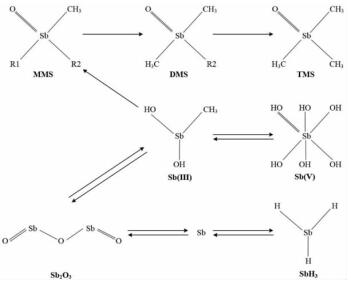
4.4 生物甲基化已有大量文献证实了金属有机化合物对生态系统和人类健康产生不利影响的可能性[123]。然而,目前关于Sb甲基化化合物的生态毒理学研究还很少,但现有的文献均表明甲基化Sb化合物的毒性很低[124]。Burrell等[125]测定了二苯基-、三苯基-、三甲基锑化合物的真菌毒性,发现只有二苯基锑化合物的EC50值低于30 mg·L-1。另外,锑化氢和三甲基锑((CH3)3Sb)被认为具有基因毒性[126]。然而,引起DNA损伤所需的最低溶液浓度为200 μmol·L-1。但该浓度比在发酵气体中发现的典型痕量三甲基锑浓度要高出许多数量级[124]。此外,三甲基二氯化锑((CH3)3SbCl2)细胞膜通透性较差,在正常暴露条件下不会引起细胞和基因毒性效应[127]。综上,Sb生物甲基化可以将Sb(Ⅲ)转化为毒性较小的物质[一甲基锑(MMS)、二甲基锑(DMS)和三甲基锑(TMS)][128]。然而,一些研究者认为Sb的生物甲基化是一个偶然的过程[129],而不是一种解毒机制。
目前,多种微生物已被证明具有锑甲基化的能力[130, 131],主要包括:好氧丝状真菌(Scopulariopsis brevicaulis、Phaeolus schweinitzii),严格厌氧原核生物(厌氧细菌:Clostridium collagenovorans、Desulfovibrio vulgaris;产甲烷古菌:Methanobacterium formicicum、Methanobacterium thermoautrophicum、Methanosar-cina barkeri)以及严格好氧细菌(Flavobacterium sp.)和好氧酵母菌(Cryptococcus humicolus),厌氧条件下生长的混合培养菌也显示出了Sb甲基化活性。因此,好氧和厌氧微生物似乎都能使Sb甲基化。最初的研究主要集中在Scopulariopsis brevicaulis上,结果发现只形成了一种挥发性物质,即(CH3)3Sb。其中,s-腺苷蛋氨酸的前体甲硫氨酸被认为是Scopulariopsis brevicaulis甲基化的甲基供体[132]。在厌氧条件下生长的混合培养菌和好氧菌Pseudomonas fluorescens对(CH3)3SbBr2的转化产物中也发现了(CH3)3Sb[131]。此外,好氧真菌Scopulariopsis brevicaulis和Phaeolus schweinitzii在生长过程中可以将无机Sb生物甲基化形成SbH3、(CH3)2SbH、(CH3)3Sb和一些非挥发性甲基锑[133-135],且甲基化的过程是从MMS到DMS,再到TMS[136],此反应过程如图 3所示。在缺氧条件下,Cryptococcus humicolus也可以与无机Sb生物甲基化形成SbH3、(CH3)2SbH、(CH3)3Sb,且Sb甲基化程度与Sb的初始底物浓度呈正相关[137]。据报道,Sb(Ⅲ)比Sb(Ⅴ)更易于生物甲基化。研究发现,Scopulariopsis brevicaulis不能使Sb(Ⅴ)甲基化[138],或者Sb(Ⅴ)甲基化效率低于Sb(Ⅲ)[134]。Andrewes等[133]也发现了Phaeolus schweintzii对Sb(Ⅴ)生物甲基化效率较低的现象。也有研究表明Sb(Ⅴ)可以被Cryptococcus humicolus[139]和土壤及污泥细菌[131, 136]生物甲基化。Duester等[140]发现土壤中甲基化锑的比例高于As,这与其他关于微生物培养过程中Sb与As生物甲基化的研究情况相反。鉴于Sb甲基化化合物在Sb的生物地球化学循环中的重要性,未来仍需要从不同的生态系统中进行研究以更好地理解Sb生物甲基化对Sb污染环境修复的意义。
5 展望
土壤Sb污染是一个全球性问题。微生物修复是目前最具发展和应用前景的技术,但其规模化应用性研究相对较少。这主要是由于微生物修复Sb污染土壤的反应过程和机理并未完全明确,以及对应的技术需求与管理支撑尚缺乏针对性研究。此外,由于土壤环境条件的复杂性,微生物修复Sb污染土壤需要综合考虑Sb的生物地球化学循环、迁移率、生物利用度,以及生物修复后的相关风险等因素。由于Sb与As具有相似的化学特性,土壤Sb污染修复可以借鉴As修复的生化途径。然而,Sb的生物修复也会通过一些独特的生化机制进行。为了加速Sb污染土壤的生物修复进程,在今后的研究中,应进一步考虑以下几个方面:
(1) 有必要探索更多的具有较高Sb(Ⅲ)氧化能力的Sb抗性菌株。另外,除了生物驱动的Sb(Ⅲ)氧化外,一些非生物因素如土壤环境中的有机物、铁锰矿物、过氧化氢和碘酸盐等也已被证实可将Sb(Ⅲ)氧化为Sb(Ⅴ)。在实际环境条件下,Sb(Ⅲ)氧化反应可能是由化学和微生物协同作用引起的。因此,应综合考虑这两个因素的影响。
(2) 土壤环境中Sb氧化还原物可以被铁锰(氢)氧化物吸附,且Sb(Ⅴ)被还原为Sb(Ⅲ)时更容易与铁锰(氢)氧化物结合而被固定。然而,微生物介导的Sb和铁锰矿物的转化对Sb迁移率的影响关注较少。这是理解Sb生物地球化学和Fe循环之间相互作用方面的一个关键缺口。这也可能是一种修复Sb污染土壤的有效方法。
(3) 目前,虽然对Sb(Ⅲ)生物甲基化已进行了研究,但Sb(Ⅲ)甲基化的机制尚不清楚。此外,Sb(Ⅲ)生物甲基化所产生的挥发性甲基和氢化物衍生物可能对环境造成危害。因此,关于Sb(Ⅲ)甲基化的机制和甲基化Sb与天然胶态配体(如天然有机质、黏土、铁锰(氢)氧化物等)的结合仍需进一步进行研究。
(4) 考虑到Sb污染环境条件的极端复杂性,有必要对Sb污染土壤生物修复后的可持续性进行研究。因此,可以利用其他学科发展技术和微生物法联合修复技术将Sb从土壤中提取出来,可减少生态系统和人类健康风险。
| [1] |
FILELLA M, BELZILE N, CHEN Y W. Antimony in the environment:A review focused on natural waters:I. Occurrence[J]. Earth-Science Reviews, 2002, 57(1-2): 125-176. DOI:10.1016/S0012-8252(01)00070-8 |
| [2] |
WILSON S C, LOCKWOOD P V, ASHLEY P M, et al. The chemistry and behaviour of antimony in the soil environment with comparisons to arsenic:A critical review[J]. Environmental Pollution, 2010, 158(5): 1169-1181. DOI:10.1016/j.envpol.2009.10.045 |
| [3] |
LI J X, WANG Q, OREMLAND R S, et al. Microbial antimony biogeochemistry:Enzymes, regulation, and related metabolic pathways[J]. Applied and Environmental Microbiology, 2016, 82(18): 5482-5495. DOI:10.1128/AEM.01375-16 |
| [4] |
MURCIEGO A M, SANCHEZ A G, GONZALEZ M A R, et al. Antimony distribution and mobility in topsoils and plants (cytisus striatus, cistus ladanifer and dittrichia viscosa) from polluted sb-mining areas in extremadura (spain)[J]. Environmental Pollution, 2007, 145(1): 15-21. |
| [5] |
J, WANG X, GUO X J, et al. A review of removal technology for antimony in aqueous solution[J]. Journal of Environmental Sciences, 2020, 90: 189-204. DOI:10.1016/j.jes.2019.12.008 |
| [6] |
SMICHOWSKI P. Antimony in the environment as a global pollutant:A review on analytical methodologies for its determination in atmospheric aerosols[J]. Talanta, 2008, 75(1): 2-14. DOI:10.1016/j.talanta.2007.11.005 |
| [7] |
HOCKMANN K, LENZ M, TANDY, et al. Release of antimony from contaminated soil induced by redox changes[J]. Journal of Hazardous Materials, 2014, 275: 215-221. DOI:10.1016/j.jhazmat.2014.04.065 |
| [8] |
HE M C, WANG X Q, WU F C, et al. Antimony pollution in china[J]. Science of the Total Environment, 2012, 421: 41-50. |
| [9] |
GUEMIZA K, MERCIER G, BLAIS J F. Pilot-scale decontamination of small-arms shooting range soil polluted with copper, lead, antimony, and zinc by acid and saline leaching[J]. Journal of Environmental Engineering, 2015, 141(1): 1-10. |
| [10] |
TSITONAKI A, PETRI B, CRIMI M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate:A review[J]. Critical Reviews in Environmental Science and Technology, 2010, 40(1): 55-91. DOI:10.1080/10643380802039303 |
| [11] |
BARKER A J, DOUGLAS T A, ILGEN A G, et al. Lead and antimony from bullet weathering in newly constructed target berms:Chemical speciation, mobilization, and remediation strategies[J]. Science of the Total Environment, 2019, 658: 558-569. DOI:10.1016/j.scitotenv.2018.12.188 |
| [12] |
HUANG Y Z, ZHANG W Q, ZHAO L J. Silicon enhances resistance to antimony toxicity in the low-silica rice mutant, lsi1[J]. Chemistry & Ecology, 2012, 28(4): 341-354. |
| [13] |
PEDERSEN K B, JENSEN P E, OTTOSEN L M, et al. The relative influence of electrokinetic remediation design on the removal of As, Cu, Pb and Sb from shooting range soils[J]. Engineering Geology, 2018, 238: 52-61. DOI:10.1016/j.enggeo.2018.03.005 |
| [14] |
WANG X L, WANG M H, QUAN S X, et al. Influence of thermal treatment on fixation rate and leaching behavior of heavy metals in soils from a typical e-waste processing site[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 82-88. |
| [15] |
FENG R, WEI C, TU S, et al. The uptake and detoxification of antimony by plants:A review[J]. Environmental & Experimental Botany, 2013, 96: 28-34. |
| [16] |
NGUYEN V K, PARK Y, LEE T. Microbial antimonate reduction with a solid-state electrode as the sole electron donor:A novel approach for antimony bioremediation[J]. Journal of Hazardous Materials, 2019, 377: 179-185. DOI:10.1016/j.jhazmat.2019.05.069 |
| [17] |
UNGUREANU G, SANTOS S, BOAVENTURA R, et al. Arsenic and antimony in water and wastewater:Overview of removal techniques with special reference to latest advances in adsorption[J]. Journal of Environmental Management, 2015, 151: 326-342. |
| [18] |
WANG N N, ZHANG S H, HE M C. Bacterial community profile of contaminated soils in a typical antimony mining site[J]. Environmental Science and Pollution Research, 2018, 25(1): 141-152. DOI:10.1007/s11356-016-8159-y |
| [19] |
LUO J M, BAI Y H, LIANG J S, et al. Metagenomic approach reveals variation of microbes with arsenic and antimony metabolism genes from highly contaminated soil[J]. Plos One, 2014, 9(10): 1-9. |
| [20] |
MAJZLAN J, LALINSKA B, CHOVAN M, et al. A mineralogical, geochemical, and microbiogical assessment of the antimony- and arsenic-rich neutral mine drainage tailings near pezinok, slovakia[J]. American Mineralogist, 2011, 96(1): 1-13. |
| [21] |
XI J H, HE M C, LIN C Y. Adsorption of antimony(Ⅲ) and antimony(Ⅴ) on bentonite:Kinetics, thermodynamics and anion competition[J]. Microchemical Journal, 2011, 97(1): 85-91. DOI:10.1016/j.microc.2010.05.017 |
| [22] |
KONG L H, HU X Y, HE M C. Mechanisms of Sb(Ⅲ) oxidation by pyrite-induced hydroxyl radicals and hydrogen peroxide[J]. Environmental Science & Technology, 2015, 49(6): 3499-3505. |
| [23] |
HERATH I, VITHANAGE M, BUNDSCHUH J. Antimony as a global dilemma:Geochemistry, mobility, fate and transport[J]. Environmental Pollution, 2017, 223: 545-559. DOI:10.1016/j.envpol.2017.01.057 |
| [24] |
CHEN Y W, DENG T L, FILELLA M, et al. Distribution and early diagenesis of antimony species in sediments and porewaters of freshwater lakes[J]. Environmental Science & Technology, 2003, 37(6): 1163-1168. |
| [25] |
ARSIC M, TEASDALE P R, WELSH D T, et al. Diffusive gradients in thin films reveals differences in antimony and arsenic mobility in a contaminated wetland sediment during an oxic-anoxic transition[J]. Environmental Science & Technology, 2018, 52(3): 1118-1127. |
| [26] |
MITSUNOBU S, HARADA T, TAKAHASHI Y. Comparison of antimony behavior with that of arsenic under various soil redox conditions[J]. Environmental Science & Technology, 2006, 40(23): 7270-7276. |
| [27] |
STEELY S, AMARASIRIWARDENA D, XING B S. An investigation of inorganic antimony species and antimony associated with soil humic acid molar mass fractions in contaminated soils[J]. Environmental Pollution, 2007, 148(2): 590-598. DOI:10.1016/j.envpol.2006.11.031 |
| [28] |
KARIMIAN N, BURTON E D, JOHNSTON S G. Antimony speciation and mobility during Fe(Ⅱ)-induced transformation of humic acid-antimony(Ⅴ)-iron(Ⅲ) coprecipitates[J]. Environmental Pollution, 2019, 254: 1-10. |
| [29] |
NAKAMARU Y, TAGAMI K, UCHIDA S. Antimony mobility in japanese agricultural soils and the factors affecting antimony sorption behavior[J]. Environmental Pollution, 2006, 141(2): 321-326. DOI:10.1016/j.envpol.2005.08.040 |
| [30] |
FAN J X, WANG Y J, FAN T T, et al. Photo-induced oxidation of Sb(Ⅲ) on goethite[J]. Chemosphere, 2014, 95: 295-300. DOI:10.1016/j.chemosphere.2013.08.094 |
| [31] |
TIGHE M, LOCKWOOD P. Importance of noncrystalline hydroxide phases in sequential extractions to fractionate antimony in acid soils[J]. Communications in Soil Science & Plant Analysis, 2007, 38(11-12): 1487-1501. |
| [32] |
AMBE S. Adsorption-kinetics of antimony(Ⅴ) ions onto alpha-Fe2O3 surfaces from an aqueous-solution[J]. Langmuir, 1987, 3(4): 489-493. DOI:10.1021/la00076a009 |
| [33] |
WANG S L, MULLIGAN C N. Effect of natural organic matter on arsenic mobilization from mine tailings[J]. Journal of Hazardous Materials, 2009, 168(2-3): 721-726. DOI:10.1016/j.jhazmat.2009.02.088 |
| [34] |
THANABALASINGAM P, PICKERING W F. Specific sorption of antimony(Ⅲ) by the hydrous oxides of Mn, Fe, and Al[J]. Water Air and Soil Pollution, 1990, 49(1-2): 175-185. DOI:10.1007/BF00279519 |
| [35] |
ZHOU S, SATO T, OTAKE T. Dissolved silica effects on adsorption and co-precipitation of Sb(Ⅲ) and Sb(Ⅴ) with ferrihydrite[J]. Minerals, 2018, 8(3): 1-12. |
| [36] |
QI P F, PICHLER T. Competitive adsorption of As(Ⅲ), As(Ⅴ), Sb(Ⅲ) and Sb(Ⅴ) onto ferrihydrite in multi-component systems:Implications for mobility and distribution[J]. Journal of Hazardous Materials, 2017, 330: 142-148. DOI:10.1016/j.jhazmat.2017.02.016 |
| [37] |
GUO X J, WU Z J, HE M C, et al. Adsorption of antimony onto iron oxyhydroxides:Adsorption behavior and surface structure[J]. Journal of Hazardous Materials, 2014, 276: 339-345. DOI:10.1016/j.jhazmat.2014.05.025 |
| [38] |
MITSUNOBU S, TAKAHASHI Y, TERADA Y, et al. Antimony(Ⅴ) incorporation into synthetic ferrihydrite, goethite, and natural iron oxyhydroxides[J]. Environmental Science & Technology, 2010, 44(10): 3712-3718. |
| [39] |
SUN Q, LIU C, ALVES M E, et al. The oxidation and sorption mechanism of Sb on delta-MnO2[J]. Chemical Engineering Journal, 2018, 342: 429-437. DOI:10.1016/j.cej.2018.02.091 |
| [40] |
ILGEN A G, TRAINOR T P. Sb(Ⅲ) and Sb(Ⅴ) sorption onto Al-rich phases:Hydrous Al oxide and the clay minerals kaolinite KGa-1b and oxidized and reduced nontronite NAu-1[J]. Environmental Science & Technology, 2012, 46(2): 843-851. |
| [41] |
DU H H, TAO J, YANG R J, et al. Bacteria affect Sb(Ⅲ, Ⅴ) adsorption and oxidation on birnessite[J]. Journal of Soils and Sediments, 2020, 20: 2418-2425. DOI:10.1007/s11368-020-02607-1 |
| [42] |
BELZILE N, CHEN Y W, WANG Z J. Oxidation of antimony (Ⅲ) by amorphous iron and manganese oxyhydroxides[J]. Chemical Geology, 2001, 174(4): 379-387. DOI:10.1016/S0009-2541(00)00287-4 |
| [43] |
BAGHERIFAM S, LAKZIAN A, FOTOVAT A, et al. In situ stabilization of as and sb with naturally occurring Mn, Al and Fe oxides in a calcareous soil:Bioaccessibility, bioavailability and speciation studies[J]. Journal of Hazardous Materials, 2014, 273: 247-252. DOI:10.1016/j.jhazmat.2014.03.054 |
| [44] |
XU W, WANG H, LIU R, et al. The mechanism of antimony(Ⅲ) removal and its reactions on the surfaces of Fe-Mn binary oxide[J]. Journal of Colloid & Interface Science, 2011, 363(1): 320-326. |
| [45] |
FU L, SHOZUGAWA K, MATSUO M. Oxidation of antimony (Ⅲ) in soil by manganese (Ⅳ) oxide using x-ray absorption fine structure[J]. Journal of Environmental Sciences, 2018, 73: 31-37. DOI:10.1016/j.jes.2018.01.003 |
| [46] |
RABBI S M F, DANIEL H, LOCKWOOD P V, et al. Physical soil architectural traits are functionally linked to carbon decomposition and bacterial diversity[J]. Scientific Reports, 2016, 6: 1-9. DOI:10.1038/s41598-016-0001-8 |
| [47] |
XU Y L, SESHADRI B, BOLAN N, et al. Microbial functional diversity and carbon use feedback in soils as affected by heavy metals[J]. Environment International, 2019, 125: 478-488. DOI:10.1016/j.envint.2019.01.071 |
| [48] |
HE M C, WANG N N, LONG X J, et al. Antimony speciation in the environment:Recent advances in understanding the biogeochemical processes and ecological effects[J]. Journal of Environmental Sciences, 2019, 75: 14-39. DOI:10.1016/j.jes.2018.05.023 |
| [49] |
BROHON B, DELOLME C, GOURDON R. Complementarity of bioassays and microbial activity measurements for the evaluation of hydrocarbon-contaminated soils quality[J]. Soil Biology & Biochemistry, 2001, 33(7-8): 883-891. |
| [50] |
KARACA A, NASEBY D C, LYNCH J M. Effect of cadmium contamination with sewage sludge and phosphate fertiliser amendments on soil enzyme activities, microbial structure and available cadmium[J]. Biology and Fertility of Soils, 2002, 35(6): 428-434. DOI:10.1007/s00374-002-0490-4 |
| [51] |
AN Y J, KIM M. Effect of antimony on the microbial growth and the activities of soil enzymes[J]. Chemosphere, 2009, 74(5): 654-659. DOI:10.1016/j.chemosphere.2008.10.023 |
| [52] |
SHOTYK W, KRACHLER M, CHEN B. Anthropogenic impacts on the biogeochemistry and cycling of antimony[M]. Sigel A, Sigel H, Sigel RKO (eds). Metal ions in biological systems, vol 44:Biogeochemistry, availability, and transport of metals in the environment.. London:Taylor & Francis Ltd, 2005: 171-203.
|
| [53] |
ASAKURA K, SATOH H, CHIBA M, et al. Genotoxicity studies of heavy metals:Lead, bismuth, indium, silver and antimony[J]. Journal of Occupational Health, 2009, 51(6): 498-512. DOI:10.1539/joh.L9080 |
| [54] |
YANG X Z, SHI Z, YUAN M Y, et al. Adsorption of trivalent antimony from aqueous solution using graphene oxide:Kinetic and thermodynamic studies[J]. Journal of Chemical and Engineering Data, 2015, 60(3): 806-813. |
| [55] |
OBIAKOR M O, WILSON S C, TIGHE M, et al. Antimony causes mortality and induces mutagenesis in the soil functional bacterium Azospirillum brasilense sp7[J]. Water Air and Soil Pollution, 2019, 230(8): 1-14. |
| [56] |
MENG Y L, LIU Z J, ROSEN B P. As(Ⅲ) and Sb(Ⅲ) uptake by GIpf and efflux by ArsB in escherichia coli[J]. Journal of Biological Chemistry, 2004, 279(18): 18334-18341. DOI:10.1074/jbc.M400037200 |
| [57] |
FILELLA M, BELZILE N, LETT M C. Antimony in the environment:A review focused on natural waters. Ⅲ. Microbiota relevant interactions[J]. Earth-Science Reviews, 2007, 80(3-4): 195-217. DOI:10.1016/j.earscirev.2006.09.003 |
| [58] |
MURATA T, KANAO-KOSHIKAWA M, TAKAMATSU T. Effects of Pb, Cu, Sb, in and ag contamination on the proliferation of soil bacterial colonies, soil dehydrogenase activity, and phospholipid fatty acid profiles of soil microbial communities[J]. Water Air and Soil Pollution, 2005, 164(1-4): 103-118. DOI:10.1007/s11270-005-2254-x |
| [59] |
WANG Q S, HE M C, WANG Y. Influence of combined pollution of antimony and arsenic on culturable soil microbial populations and enzyme activities[J]. Ecotoxicology, 2011, 20(1): 9-19. |
| [60] |
DIQUATTRO S, GARAU G, MANGIA N P, et al. Mobility and potential bioavailability of antimony in contaminated soils:Short-term impact on microbial community and soil biochemical functioning[J]. Ecotoxicology and Environmental Safety, 2020, 196: 1-10. |
| [61] |
KASSA-LAOUAR M, MECHAKRA A, RODRIGUE A, et al. Antioxidative enzyme responses to antimony stress of serratia marcescens - an endophytic bacteria of Hedysarum pallidum roots[J]. Polish Journal of Environmental Studies, 2020, 29(1): 141-152. |
| [62] |
WYSOCKI R, CHERY C C, WAWRZYCKA D, et al. The glycerol channel fps1p mediates the uptake of arsenite and antimonite in saccharomyces cerevisiae[J]. Molecular Microbiology, 2001, 40(6): 1391-1401. DOI:10.1046/j.1365-2958.2001.02485.x |
| [63] |
TOWNSHEND A. Metals and their compounds in the environment. Occurrence, analysis and biological relevance[J]. Analytica Chimica Acta, 1993, 271(2): 331-332. |
| [64] |
WANG G J, KENNEDY S P, FASILUDEEN S, et al. Arsenic resistance in halobacterium sp strain nrc-1 examined by using an improved gene knockout system[J]. Journal of Bacteriology, 2004, 186(10): 3187-3194. DOI:10.1128/JB.186.10.3187-3194.2004 |
| [65] |
BRANCO R, CHUNG A P, MORAIS P V. Sequencing and expression of two arsenic resistance operons with different functions in the highly arsenic-resistant strain Ochrobactrum tritici SCⅡ24T[J]. Bmc Microbiology, 2008, 8: 1-12. DOI:10.1186/1471-2180-8-1 |
| [66] |
LI J, WANG Q, ZHANG S Z, et al. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. International Biodeterioration & Biodegradation, 2013, 76: 76-80. |
| [67] |
ROSEN B R, LIU Z J. Transport pathways for arsenic and selenium:A mini review[J]. Environment International, 2009, 35(3): 512-515. DOI:10.1016/j.envint.2008.07.023 |
| [68] |
BUTCHER B G, DEANE S M, RAWLINGS D E. The chromosomal arsenic resistance genes of thiobacillus ferrooxidans have an unusual arrangement and confer increased arsenic and antimony resistance to escherichia coli[J]. Applied and Environmental Microbiology, 2000, 66(5): 1826-1833. DOI:10.1128/AEM.66.5.1826-1833.2000 |
| [69] |
ACHOUR A R, BAUDA P, BILLARD P. Diversity of arsenite transporter genes from arsenic-resistant soil bacteria[J]. Research in Microbiology, 2007, 158(2): 128-137. DOI:10.1016/j.resmic.2006.11.006 |
| [70] |
ROSEN B P. Families of arsenic transporters[J]. Trends in Microbiology, 1999, 7(5): 207-212. DOI:10.1016/S0966-842X(99)01494-8 |
| [71] |
KANG Y S, SHI Z J, BOTHNER B, et al. Involvement of the acr3 and dcta anti-porters in arsenite oxidation in Agrobacterium Tumefaciens 5A[J]. Environmental Microbiology, 2015, 17(6): 1950-1962. DOI:10.1111/1462-2920.12468 |
| [72] |
MANZANO J I, GARCIA-HERNANDEZ R, CASTANYS S, et al. A new abc half-transporter in leishmania major is involved in resistance to antimony[J]. Antimicrobial Agents and Chemotherapy, 2013, 57(8): 3719-3730. DOI:10.1128/AAC.00211-13 |
| [73] |
GHOSH M, SHEN J, ROSEN B P. Pathways of As(Ⅲ) detoxification in Saccharomyces cerevisiae[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(9): 5001-5006. DOI:10.1073/pnas.96.9.5001 |
| [74] |
GOURBAL B, SONUC N, BHATTACHARJEE H, et al. Drug uptake and modulation of drug resistance in Leishmania by an aquaglyceroporin[J]. Journal of Biological Chemistry, 2004, 279(30): 31010-31017. DOI:10.1074/jbc.M403959200 |
| [75] |
MARQUIS N, GOURBAL B, ROSEN B P, et al. Modulation in aquaglyceroporin AQP1 gene transcript levels in drug-resistant Leishmania[J]. Molecular Microbiology, 2005, 57(6): 1690-1699. DOI:10.1111/j.1365-2958.2005.04782.x |
| [76] |
BROCHU C, WANG J Y, ROY G, et al. Antimony uptake systems in the protozoan parasite Leishmania and accumulation differences in antimony-resistant parasites[J]. Antimicrobial Agents and Chemotherapy, 2003, 47(10): 3073-3079. DOI:10.1128/AAC.47.10.3073-3079.2003 |
| [77] |
NGUYEN V K, CHOI W, YU J, et al. Microbial oxidation of antimonite and arsenite by bacteria isolated from antimony-contaminated soils[J]. International Journal of Hydrogen Energy, 2017, 42(45): 27832-27842. DOI:10.1016/j.ijhydene.2017.08.056 |
| [78] |
LI J X, ZHANG Y X, ZHENG S L, et al. Anaerobic bacterial immobilization and removal of toxic Sb(Ⅲ) coupled with Fe(Ⅱ)/Sb(Ⅲ) oxidation and denitrification[J]. Frontiers in Microbiology, 2019, 10: 1-11. DOI:10.3389/fmicb.2019.00001 |
| [79] |
SHI Z J, CAO Z, QIN D, et al. Correlation models between environmental factors and bacterial resistance to antimony and copper[J]. Plos One, 2013, 8(10): 1-11. |
| [80] |
LI P Z, LIN C Y, CHENG H G, et al. Contamination and health risks of soil heavy metals around a lead/zinc smelter in southwestern china[J]. Ecotoxicology and Environmental Safety, 2015, 113: 391-399. DOI:10.1016/j.ecoenv.2014.12.025 |
| [81] |
LI J X, YANG B R, SHI M M, et al. Effects upon metabolic pathways and energy production by Sb(Ⅲ) and As(Ⅲ)/Sb(Ⅲ)-oxidase gene aioa in Agrobacterium tumefaciens GW4[J]. Plos One, 2017, 12(2): 1-19. |
| [82] |
WANG D, ZHU F Q, WANG Q, et al. Disrupting ROS-protection mechanism allows hydrogen peroxide to accumulate and oxidize Sb(Ⅲ) to Sb(Ⅴ) in Pseudomonas stutzeri TS44[J]. Bmc Microbiology, 2016, 16: 1-11. DOI:10.1186/s12866-015-0617-z |
| [83] |
LEHR C R, KASHYAP D R, MCDERMOTT T R. New insights into microbial oxidation of antimony and arsenic[J]. Applied and Environmental Microbiology, 2007, 73(7): 2386-2389. DOI:10.1128/AEM.02789-06 |
| [84] |
LI J X, YANG B R, SHI M M, et al. Abiotic and biotic factors responsible for antimonite oxidation in Agrobacterium tumefaciens GW4[J]. Scientific Reports, 2017, 7: 1-11. DOI:10.1038/s41598-016-0028-x |
| [85] |
LIU H, ZHUANG W, ZHANG S, et al. Global regulator iscr positively contributes to antimonite resistance and oxidation in Comamonas testosteroni S44[J]. Frontiers in molecular biosciences, 2015, 2(70): 1-12. |
| [86] |
TERRY L R, KULP T R, WIATROWSKI H, et al. Microbiological oxidation of antimony(Ⅲ) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J]. Applied and Environmental Microbiology, 2015, 81(24): 8478-8488. DOI:10.1128/AEM.01970-15 |
| [87] |
BAI Y H, JEFFERSON W A, LIANG J S, et al. Antimony oxidation and adsorption by in-situ formed biogenic Mn oxide and Fe-Mn oxides[J]. Journal of Environmental Sciences, 2017, 54: 126-134. DOI:10.1016/j.jes.2016.05.026 |
| [88] |
LI J X, WANG Q, LI M S, et al. Proteomics and genetics for identification of a bacterial antimonite oxidase in Agrobacterium tumefaciens[J]. Environmental Science & Technology, 2015, 49(10): 5980-5989. |
| [89] |
FILELLA M, BELZILE N, CHEN Y W. Antimony in the environment:A review focused on natural waters Ⅱ. Relevant solution chemistry[J]. Earth-Science Reviews, 2002, 59(1-4): 265-285. DOI:10.1016/S0012-8252(02)00089-2 |
| [90] |
KIRSCH R, SCHEINOST A C, ROSSBERG A, et al. Reduction of antimony by nano-particulate magnetite and mackinawite[J]. Mineralogical Magazine, 2008, 72(1): 185-189. DOI:10.1180/minmag.2008.072.1.185 |
| [91] |
MITSUNOBU S, TAKAHASHI Y, SAKAI Y. Abiotic reduction of antimony(Ⅴ) by green rust (Fe4(Ⅱ)Fe2(Ⅲ)(OH)12SO4·3H2O)[J]. Chemosphere, 2008, 70(5): 942-947. DOI:10.1016/j.chemosphere.2007.07.021 |
| [92] |
ABIN C A, HOLLIBAUGH J T. Dissimilatory antimonate reduction and production of antimony trioxide microcrystals by a novel microorganism[J]. Environmental Science & Technology, 2014, 48(1): 681-688. |
| [93] |
KULP T R, MILLER L G, BRAIOTTA F, et al. Microbiological reduction of Sb(Ⅴ) in anoxic freshwater sediments[J]. Environmental Science & Technology, 2014, 48(1): 218-226. |
| [94] |
LEUZ A K, MONCH H, JOHNSON C A. Sorption of Sb(Ⅲ) and Sb(Ⅴ) to goethite:Influence on Sb(Ⅲ) oxidation and mobilization[J]. Environmental Science & Technology, 2006, 40(23): 7277-7282. |
| [95] |
HOCKMANN K, LENZ M, TANDY S, et al. Release of antimony from contaminated soil induced by redox changes[J]. Journal of Hazardous Materials, 2014, 275(30): 215-221. |
| [96] |
LAI C Y, WEN L L, ZHANG Y, et al. Autotrophic antimonate bio-reduction using hydrogen as the electron donor[J]. Water Research, 2016, 88: 467-474. DOI:10.1016/j.watres.2015.10.042 |
| [97] |
WANG H W, CHEN F L, MU S Y, et al. Removal of antimony (Sb(Ⅴ)) from sb mine drainage:Biological sulfate reduction and sulfide oxidation-precipitation[J]. Bioresource Technology, 2013, 146: 799-802. DOI:10.1016/j.biortech.2013.08.002 |
| [98] |
NGUYEN V K, LEE J U. Isolation and characterization of antimony-reducing bacteria from sediments collected in the vicinity of an antimony factory[J]. Geomicrobiology Journal, 2014, 31(10): 855-861. DOI:10.1080/01490451.2014.901440 |
| [99] |
ABIN C A, HOLLIBAUGH J T. Transcriptional response of the obligate anaerobe Desulfuribacillus stibiiarsenatis MLFW-2T to growth on antimonate and other terminal electron acceptors[J]. Environmental Microbiology, 2019, 21(2): 618-630. |
| [100] |
Lv LV P L, SHI L D, WANG Z, et al. Methane oxidation coupled to perchlorate reduction in a membrane biofilm batch reactor[J]. Science of the Total Environment, 2019, 667: 9-15. DOI:10.1016/j.scitotenv.2019.02.330 |
| [101] |
SHI L D, WANG M, HAN Y L, et al. Multi-omics reveal various potential antimonate reductases from phylogenetically diverse microorganisms[J]. Applied Microbiology and Biotechnology, 2019, 103(21-22): 9119-9129. DOI:10.1007/s00253-019-10111-x |
| [102] |
SCHEINOST A C, ROSSBERG A, VANTELON D, et al. Quantitative antimony speciation in shooting-range soils by exafs spectroscopy[J]. Geochimica Et Cosmochimica Acta, 2006, 70(13): 3299-3312. DOI:10.1016/j.gca.2006.03.020 |
| [103] |
CUI X D, WANG Y J, HOCKRNANN K, et al. Effect of iron plaque on antimony uptake by rice (oryza sativa l.)[J]. Environmental Pollution, 2015, 204-133-140. |
| [104] |
KARIMIAN N, JOHNSTON S G, BURTON E D. Antimony and arsenic behavior during Fe(Ⅱ)-induced transformation of jarosite[J]. Environmental Science & Technology, 2017, 51(8): 4259-4268. |
| [105] |
KARIMIAN N, JOHNSTON S G, BURTON E D. Antimony and arsenic partitioning during Fe2+-induced transformation of jarosite under acidic conditions[J]. Chemosphere, 2018, 195: 515-523. DOI:10.1016/j.chemosphere.2017.12.106 |
| [106] |
HOCKMANN K, TANDY S, LENZ M, ET AL, et al. Antimony leaching from contaminated soil under manganese- and iron-reducing conditions:Column experiments[J]. Environmental Chemistry, 2014, 11(6): 624-631. DOI:10.1071/EN14123 |
| [107] |
BURTON E D, HOCKMANN K, KARIMIAN N, et al. Antimony mobility in reducing environments:The effect of microbial iron(Ⅲ)-reduction and associated secondary mineralization[J]. Geochimica Et Cosmochimica Acta, 2019, 245: 278-289. DOI:10.1016/j.gca.2018.11.005 |
| [108] |
LEI M, TAO J, YANG R J, et al. Binding of Sb(Ⅲ) by Sb-tolerant Bacillus cereus cell and cell-goethite composite:Implications for sb mobility and fate in soils and sediments[J]. Journal of Soils and Sediments, 2019, 19(6): 2850-2858. DOI:10.1007/s11368-019-02272-z |
| [109] |
ANAYURT R A, SARI A, TUZEN M. Equilibrium, thermodynamic and kinetic studies on biosorption of Pb(Ⅱ) and Vd(Ⅱ) from aqueous solution by macrofungus (lactarius scrobiculatus) biomass[J]. Chemical Engineering Journal, 2009, 151(1-3): 255-261. DOI:10.1016/j.cej.2009.03.002 |
| [110] |
DAS S K, DAS A R, GUHA A K. A study on the adsorption mechanism of mercury on aspergillus versicolor biomass[J]. Environmental Science & Technology, 2007, 41(24): 8281-8287. |
| [111] |
SUN F H, WU F C, LIAO H Q, et al. Biosorption of antimony(Ⅴ) by freshwater cyanobacteria microcystis biomass:Chemical modification and biosorption mechanisms[J]. Chemical Engineering Journal, 2011, 171(3): 1082-1090. |
| [112] |
GU J H, SUNAHARA G, DURAN R, et al. Sb(Ⅲ)-resistance mechanisms of a novel bacterium from non-ferrous metal tailings[J]. Ecotoxicology and Environmental Safety, 2019, 186: 1-9. |
| [113] |
ZHANG D Y, PAN X L, ZHAO L, et al. Biosorption of antimony (Sb) by the Cyanobacterium synechocystis sp[J]. Polish Journal of Environmental Studies, 2011, 20(5): 1353-1358. |
| [114] |
ZHANG D Y, PAN X L, MU G J. Biosorption of Sb(Ⅲ) to exopolymers from Cyanobacterium synechocystis sp.:A fluorescence and ftir study[J]. Polish Journal of Environmental Studies, 2012, 21(5): 1497-1503. |
| [115] |
CAI Y, LI X P, LIU D Y, et al. A novel Pb-resistant bacillus subtilis bacterium isolate for co-biosorption of hazardous Sb(Ⅲ) and Pb(Ⅱ):Thermodynamics and application strategy[J]. International Journal of Environmental Research and Public Health, 2018, 15(4): 1-18. |
| [116] |
WU F C, SUN F H, WU S, et al. Removal of antimony(Ⅲ) from aqueous solution by freshwater cyanobacteria Microcystis biomass[J]. Chemical Engineering Journal, 2012, 183: 172-179. DOI:10.1016/j.cej.2011.12.050 |
| [117] |
UNGUREANU G, FILOTE C, SANTOS S C R, et al. Antimony oxyanions uptake by green marine macroalgae[J]. Journal of Environmental Chemical Engineering, 2016, 4(3): 3441-3450. |
| [118] |
UNGUREANU G, SANTOS S C R, VOLF I, et al. Biosorption of antimony oxyanions by brown seaweeds:Batch and column studies[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3463-3471. |
| [119] |
WU H Y, CHEN W L, RONG X M, et al. Adhesion of Pseudomonas putida onto kaolinite at different growth phases[J]. Chemical Geology, 2014, 390: 1-8. DOI:10.1016/j.chemgeo.2014.10.008 |
| [120] |
MOON E M, PEACOCK C L. Adsorption of Cu(Ⅱ) to ferrihydrite and ferrihydrite-bacteria composites:Importance of the carboxyl group for Cu mobility in natural environments[J]. Geochimica Et Cosmochimica Acta, 2012, 92: 203-219. DOI:10.1016/j.gca.2012.06.012 |
| [121] |
DU H H, LIN Y P, CHEN W L, et al. Copper adsorption on composites of goethite, cells of Pseudomonas putida and humic acid[J]. European Journal of Soil Science, 2017, 68(4): 514-523. |
| [122] |
FRANZBLAU R E, DAUGHNEY C J, SWEDLUND P J, et al. Cu(Ⅱ) removal by anoxybacillus flavithermus-iron oxide composites during the addition of Fe(Ⅱ)(aq)[J]. Geochimica Et Cosmochimica Acta, 2016, 172: 139-158. DOI:10.1016/j.gca.2015.09.031 |
| [123] |
DOPP E, HARTMANN L M, FLOREA A M, et al. Environmental distribution, analysis, and toxicity of organometal(loid) compounds[J]. Critical Reviews in Toxicology, 2004, 34(3): 301-333. DOI:10.1080/10408440490270160 |
| [124] |
FILELLA M. Alkyl derivatives of antimony in the environment[J]. Metal ions in life sciences, 2010, 7: 267-301. |
| [125] |
BURRELL R E, CORKE C T, GOEL R G. Fungitoxicity of organoantimony and organobismuth compounds[J]. Journal of Agricultural and Food Chemistry, 1983, 31(1): 85-88. DOI:10.1021/jf00115a023 |
| [126] |
ANDREWES P, KITCHIN K T, WALLACE K. Dimethylarsine and trimethylarsine are potent genotoxins in vitro[J]. Chemical Research in Toxicology, 2003, 16(8): 994-1003. DOI:10.1021/tx034063h |
| [127] |
DOPP E, HARTMANN L M, FLOREA A M, et al. Trimethylantimony dichloride causes genotoxic effects in chinese hamster ovary cells after forced uptake[J]. Toxicology in Vitro, 2006, 20(6): 1060-1065. DOI:10.1016/j.tiv.2006.01.018 |
| [128] |
GEBEL T. Arsenic and antimony:Comparative approach on mechanistic toxicology[J]. Chemico-Biological Interactions, 1997, 107(3): 131-144. DOI:10.1016/S0009-2797(97)00087-2 |
| [129] |
JENKINS R O, FORSTER S N, CRAIG P J. Formation of methylantimony species by an aerobic prokaryote:Flavobacterium sp[J]. Archives of Microbiology, 2002, 178(4): 274-278. DOI:10.1007/s00203-002-0456-9 |
| [130] |
MICHALKE K, SCHMIDT A, HUBER B, et al. Role of intestinal microbiota in transformation of bismuth and other metals and metalloids into volatile methyl and hydride derivatives in humans and mice[J]. Applied and Environmental Microbiology, 2008, 74(10): 3069-3075. DOI:10.1128/AEM.02933-07 |
| [131] |
GURLEYUK H, VANFLEETSTALDER V, CHASTEEN T G. Confirmation of the biomethylation of antimony compounds[J]. Applied Organometallic Chemistry, 1997, 11(6): 471-483. DOI:10.1002/(SICI)1099-0739(199706)11:6<471::AID-AOC590>3.0.CO;2-H |
| [132] |
ANDREWES P, CULLEN W R, POLISHCHUK E. Antimony biomethylation by Scopulariopsis brevicaulis:Characterization of intermediates and the methyl donor[J]. Chemosphere, 2000, 41(11): 1717-1725. DOI:10.1016/S0045-6535(00)00063-1 |
| [133] |
ANDREWES P, CULLEN W R, POLISHCHUK E, et al. Antimony biomethylation by the wood rotting fungus Phaeolus schweinitzii[J]. Applied Organometallic Chemistry, 2001, 15(6): 473-480. DOI:10.1002/aoc.131 |
| [134] |
JENKINS R O, CRAIG P J, GOESSLER W, et al. Biomethylation of inorganic antimony compounds by an aerobic fungus:Scopulariopsis brevicaulis[J]. Environmental Science & Technology, 1998, 32(7): 882-885. |
| [135] |
CRAIG P J, JENKINS R O, DEWICK R, et al. Trimethylantimony generation by Scopulariopsis brevicaulis during aerobic growth[J]. Science of the Total Environment, 1999, 229(1-2): 83-88. DOI:10.1016/S0048-9697(99)00063-7 |
| [136] |
WEHMEIER S, FELDMANN J. Investigation into antimony mobility in sewage sludge fermentation[J]. Journal of Environmental Monitoring, 2005, 7(12): 1194-1199. DOI:10.1039/b509538g |
| [137] |
HARTMANN L M, CRAIG P J, JENKINS R O. Influence of arsenic on antimony methylation by the aerobic yeast Cryptococcus humicolus[J]. Archives of Microbiology, 2003, 180(5): 347-352. DOI:10.1007/s00203-003-0600-1 |
| [138] |
ANDREWES P, CULLEN W R, FELDMANN J, et al. The production of methylated organoantimony compounds by Scopulariopsis brevicaulis[J]. Applied Organometallic Chemistry, 1998, 12(12): 827-842. DOI:10.1002/(SICI)1099-0739(199812)12:12<827::AID-AOC797>3.0.CO;2-O |
| [139] |
SMITH L M, MAHER W A, CRAIG P J, et al. Speciation of volatile antimony compounds in culture headspace gases of Cryptococcus humicolus using solid phase microextraction and gas chromatography-mass spectrometry[J]. Applied Organometallic Chemistry, 2002, 16(6): 287-293. DOI:10.1002/aoc.303 |
| [140] |
DUESTER L, DIAZ-BONE R A, KOSTERS J, et al. Methylated arsenic, antimony and tin species in soils[J]. Journal of Environmental Monitoring, 2005, 7(12): 1186-1193. DOI:10.1039/b508206d |
 2020
2020