| 天然铝硅酸盐矿物对氟离子的吸附性能研究 |
氟是一种积累毒物,含氟污染物主要来源于氟矿物的开采、玻璃刻蚀加工、金属的电解或电镀、磷肥生产、钢铁冶炼和煤炭燃烧等工业所产生的排放物[1-3]。环境中过量氟化物对人类健康构成严重威胁,体内摄入过量的氟会干扰多种酶的活性,破坏钙、磷的代谢平衡,出现不同程度的氟骨病[4]。因此,含氟污水的净化是当今各行业面临的紧迫任务。从工业废水和饮用水中去除氟化物的有效技术主要涉及化学沉淀[5]、反渗透[6]、吸附[7]、混凝沉降法[8]、离子交换法树脂法[9]等。吸附是一种有效的离子交换或表面化学反应过程,然而复杂的吸附材料制备过程以及原料的高成本限制了吸附剂的实际应用。另一方面,铝土矿、石膏、活性氧化铝、活性炭等材料[10-12]被用作吸附剂从溶液中去除氟离子取得了良好的研究进展。因此,进一步探索天然低成本的氟离子吸附剂,实现高效率和低成本的氟化物去除是非常有意义的。
铝硅酸盐是硅酸盐中SiO4四面体的一部分被AlO4四面体取代组成,常见矿物例如一水铝石、高岭土,沸石等[13, 14]。该类矿物广泛用于去除水溶液中的Pb2+、Cr3+、Cu2+、Cd2+等重金属污染物[15, 16]。其对金属离子的吸附机理为矿物内部分Si-O四面体中的Si4+与Fe3+,或Al-O八面体内的Al3+与Mg2+、Ca2+等低价离子发生置换,使得其层间荷负电,因此表面对阳离子具有较强的吸附能力[17]。同时,铝硅酸盐类矿物具有很空旷的硅氧骨架,在结构中有许多交叉的孔道以及较大内表面积的孔洞,是从水溶液中吸附氟离子的潜在天然材料。鉴于此,本文主要考察了天然铝硅酸盐矿物通过吸附法来处理高浓度含氟废水的应用情况,并通过溶液化学分析、X射线衍射(XRD)、扫描电子显微镜(SEM)、傅里叶变换红外光谱(FTIR)、X射线光电子能谱(XPS)等检测对氟离子的吸附机理进行研究。
1 试验材料及试验方法 1.1 试验材料试验使用的含氟模拟废水为氟化钠(60 ℃的恒温干燥箱中干燥4 h,取出冷却到室温)与适量去离子水配制的氟离子质量浓度为150 mg/L的NaF溶液。
一水硬铝石(Al2O3·H2O)和三水铝石(Al2O3·3H2O)来源于河北某铝土矿,纯度按氧化铝计分别为81.23%、61.69%。高岭石(Al4[Si4O10](OH)8)来源于江西某高岭土矿,纯度为81.45%。使用前,均采用小型破碎机(Grinder,Type JC6)对矿物进行破碎,混合均匀后用振动磨(ZHM-1A)磨细,分别用0.074、0.037、0.023、0.018 mm筛子进行湿筛,得到的不同粒级天然铝硅酸盐矿物在40 ℃恒温箱中烘干,装袋备用。
试验所用试剂为:氟化钠、溴甲酚绿、柠檬酸、柠檬酸三钠、乙醇、氟化钙,硝酸、硫酸、氢氧化钠作为pH值调整剂,所用试剂均为分析纯。
1.2 氟离子吸附单因素试验首先将50 mL模拟废液置于锥形瓶中并调至所需pH值,然后加入一定量的天然铝硅酸盐矿物,将保鲜膜封口后的锥形瓶置于转速200 r/min、温度25 ℃的恒温振荡器中震荡一定时间。反应结束后将废液离心后用针孔过滤器(0.45 μm)取上清液进行氟离子浓度的测定。滤渣洗涤、烘干后进行FTIR、XPS分析。试验中,系统探究溶液pH值、高岭石用量、反应时间等因素对氟离子去除结果的影响。
试验中,氟离子的吸附去除率计算如下:
| $ {R_e} = \frac{{{C_0} - {C_t}}}{{{C_0}}} \times 100\% $ | (1) |
Re——吸附去除率,%;
C0——溶液中起始氟离子浓度,mg/L;
Ct——反应后溶液中氟离子浓度,mg/L。
1.3 吸附动力学试验方法在一系列锥形瓶中加入50 mL的含氟模拟废液再加入高岭石,用量为10 g/L,溶液pH值为1.5。控制反应时间分别为0、1、2、3、4、5、10、30、60、120 min。将反应后的浊液经0.45 μm滤膜过滤后得到澄清液,再通过饱和甘汞电极法测定溶液中氟离子浓度。
1.4 吸附等温线试验方法配制质量浓度分别为30、50、60、80、100 mg/L的模拟液,取50 mL模拟液于锥形瓶中再加入10g/L的高岭石,反应10 min后浊液经过0.45 μm滤膜过滤后得到澄清液,并测定氟离子浓度。
1.5 分析及检测方法采用饱和甘汞电极法进行氟离子浓度的检测[18]。采用XRD(D8 Advance,Germany)、FTIR(Nicolet IS 50,America)、XPS(ESCALAB250Xi,America)、SEM(JEOLJSM-7500F,Japan)分析天然高岭石与反应产物的组分、形貌特征。
2 试验结果与讨论 2.1 天然铝硅酸盐矿物去除含氟废水中氟离子的对比试验选用一水硬铝石(Al2O3·H2O)、三水铝石(Al2O3·3H2O)、高岭石(Al4[Si4O10](OH)8)作为氟离子的吸附剂,比较三种除氟剂在不同pH值条件下的除氟效果。取初始氟离子浓度为150 mg/L的模拟溶液50 mL于锥形瓶中,天然铝硅酸盐纯矿物的用量为15 g/L、粒度为-18 μm,在转速200 r/min、温度25 ℃的恒温振荡器中振荡60 min。探索在不同的溶液初始pH值(1.5、3、5、7、9、10、11)下天然铝硅酸盐矿物对氟离子的吸附能力。
试验结果如图 1所示,高岭石的除氟率在不同pH值下明显高于另外两种铝土矿,其除氟率与pH值关系呈U字形,最佳除氟率为80.11%。两种铝土矿的除氟率均较低,三水软铝石、一水硬铝石的最高除氟率分别为41.74%、25.77%,随pH值增大除氟率减小且pH>5时除氟率几乎为零。这是因为在碱性条件下,铝土矿表面荷负电与F-产生静电排斥[19]所致。同时,OH-对活化点的竞争吸附作用使铝土矿的Al-O八面体链状结构更加紧密,F-离子难以在其结构内部发生扩散[20]。
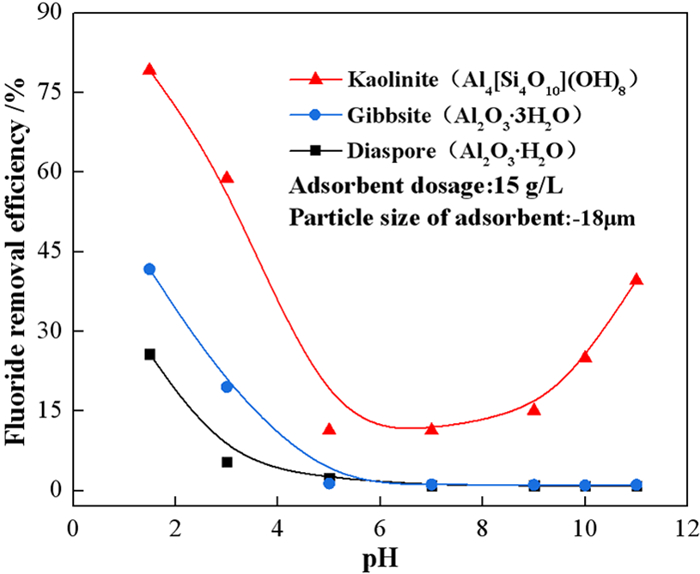 |
| 图 1 pH值对三种铝硅酸盐矿物除氟的影响 Fig.1 Effect of pH on defluorination of three aluminosilicate minerals |
2.2 高岭石表征
高岭石的除氟率在不同pH值条件下均高于铝土矿,因此在后续研究中针对高岭石的除氟过程进行了深入分析。高岭石属于1:1型层状硅酸盐矿物,由于具有特殊的层状结构而呈现出较大的比表面积[21]。通过粒度与比表面积检测得到高岭石的表面积平均粒度为2.181 μm,体积平均粒度为6.66 μm,比表面积为18.61 m2/g。同时,对高岭石进行SEM、XRD检测分析结果见图 2所示。
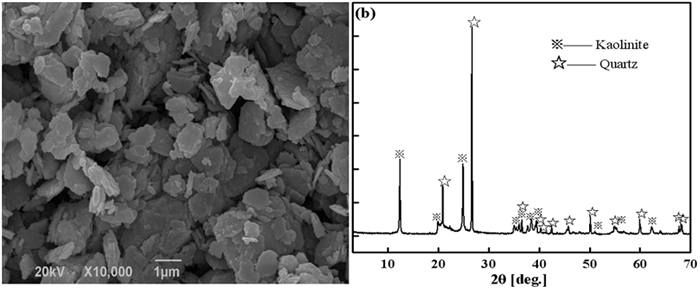 |
| 图 2 天然高岭石的(a)SEM图,(b)XRD图 Fig.2 (a) SEM and (b) XRD of natural kaolinite |
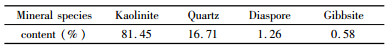
如图 2(a)所示,天然高岭石为假六方片状,其结构单元是由硅氧四面体和铝氧八面体组成,疏松的结构有利于高岭石对氟离子的吸附。图 2(b)显示高岭石的XRD特征衍射峰尖锐,说明此次试验所用天然高岭石结晶良好。高岭石的XRD半定量分析结果见表 1所示。由表中结果可知,天然高岭石矿物中主要含高岭石与石英,含少量的一水硬铝石与三水铝石。
| 表 1 天然高岭石的矿物含量 Table 1 Mineral contents of natural kaolinite |
|
2.3 高岭石去除氟离子的单因素条件试验 2.3.1 pH值对除氟效果的影响
高岭石的结构式为Al2[Si2O5](OH)4,其单元层的内表面羟基具有两性性质,当环境pH值低于高岭石零电荷点(PZC)时可得质子成为带正电荷表面,当环境pH值高于PZC时又可失质子成为带负电荷表面,使得高岭石表面活性增加。因此探索了体系pH值分别为1.5、2、3、5、7、9、11、12、13时,高岭石对氟离子的去除率,试验中其他试验条件保持不变。
模拟废水中,F元素以F-、HF两种形式存在,根据公式(2)和(3),可计算出常温下模拟废水中F的两种形式浓度随pH值的变化,结果如图 3(b)所示。
| $ {{{\rm{F}}^ - } + {{\rm{H}}^ + } = {\rm{HF}}\quad {{\rm{ \mathsf{ β} }}_1} = {{10}^{ - 3.45}}} $ | (2) |
| $ {{\alpha _{\rm{F}}} = 1 + {{\rm{ \mathsf{ β} }}_1}\left[ {{{\rm{H}}^ + }} \right]} $ | (3) |
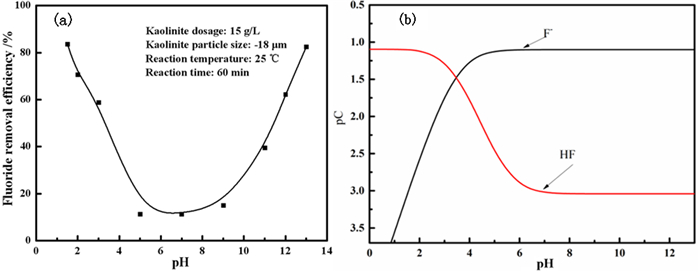 |
| 图 3 (a) 溶液pH值对氟离子去除率的影响;(b)模拟含氟废液的pC-pH图 Fig.3 (a) Effect of solution pH on removal efficiency of fluoride ions; (b) Simulated pC-pH diagram of fluoride-containing wastewater |
如图 3(a)所示,在酸性条件下(pH < 5),高岭石对氟离子的去除率随着pH值的增加而降低,在pH=1.5时氟离子的去除率最高,达到83.69%。由图 3(b)可知,此时溶液中HF分子为氟离子的主要存在形式。高岭石是层状晶体结构的硅酸盐矿物,氟化物对高岭石有一定的插层作用,并对层间羟基进行取代[22]。在低pH值条件下,高岭石外表面和边缘的羟基可以接受溶液中的质子,使其表面带正电荷使F离子作为反离子被吸附,方程如下[23]:
| $ {\rm{M}} - {\rm{OH}} + {{\rm{H}}^ + } = {\rm{M}} - {\rm{OH}}_2^ + $ | (4) |
| $ {\rm{M}} - {\rm{OH}} + {\rm{O}}{{\rm{H}}^ - } = {\rm{M}}{{\rm{O}}^ - } + {{\rm{H}}_2}{\rm{O}} $ | (5) |
在pH值为5~9的条件下,高岭石的铝氧面在溶液pH值大于PZC(零电点,约为3.5~4.6[24])时脱质子而带负电荷,而此时含氟废液中氟化物主要以F-形式存在,因静电斥力的存在导致高岭石对氟离子的去除率较低。在体系pH>9的碱性条件下,天然高岭石与强碱作用后, 促使Si4+、Al3+溶出,导致其内部层间距增大, 促进氟离子在其层间的吸附[25]。同时,Al3+在碱性条件下的絮凝作用有利于氟离子的进一步去除[26]。因此氟离子的去除率随着pH值的增加而提升。当pH=13时氟离子去除率达82.44%。在实际的生产中大部分需求是在酸性体系下实现对氟离子的去除,如硫酸锌浸出液在电解炼锌前的除氟,玻璃刻蚀酸液、贵金属溶蚀加工废液,电镀酸洗废液等。因此酸性条件下氟离子的去除更具有实际意义,选定高岭石对氟离子的最佳去除pH值为1.5。
2.3.2 高岭石用量对除氟效果的影响调节含氟废液的pH=1.5,在高岭石加入量分别为:1 g/L、5 g/L、10 g/L、15 g/L、20 g/L、25 g/L时,考察了高岭石用量对试验结果的影响,试验结果如图 4所示。结果表明,氟离子的去除率先随高岭石用量的增加而迅速增加,随后在用量为10 g/L时达到平衡,此时氟离子的去除率为80.77%。高岭石对氟离子的吸附容量随着用量的增加逐渐下降。在高岭石用量为1 g/L时,达最大吸附容量,为22.71 mg/g。
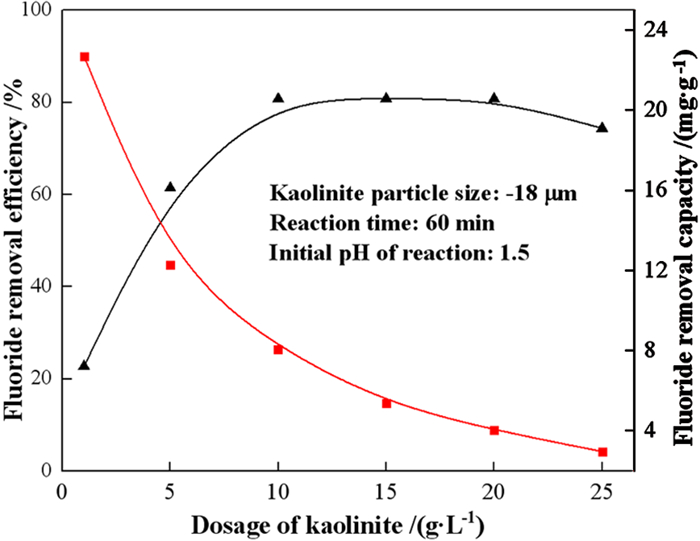 |
| 图 4 高岭石用量对氟离子去除率的影响 Fig.4 Effect of kaolinite dosage on fluoride removal efficiency |
2.3.3 粒度对除氟效率的影响
用-100+200目、-200+400目、-400+600目、-600+800目、-800目的高岭石分别对含氟溶液进行吸附试验,考察高岭土粒度对其除氟率的影响。研究中,其他试验条件为:高岭石用量10 g/L、pH=1.5、T=25 ℃、反应时间为60 min,试验结果如图 5所示。结果表明,氟离子去除率随着高岭石的粒度的减小而增大。高岭石粒度越小其比表面积越大,吸附氟离子的能力越强。
 |
| 图 5 高岭石粒度对氟离子去除率的影响 Fig.5 Effect of Kaolinite Particle Size on Fluoride Removal Efficiency |
2.3.4 吸附时间对除氟效率的影响
其他试验条件保持不变,控制吸附时间分别为1、2、3、4、5、10、15、30、60、120 min时,考察了不同时间高岭石对氟离子去除率的影响,试验结果如图 6所示。结果表明,高岭石对氟离子的吸附率随时间呈线性增长,在10 min后达到吸附平衡,氟离子去除率达到80.23%,高岭土对氟离子的饱和吸附容量为8.08 mg/g。
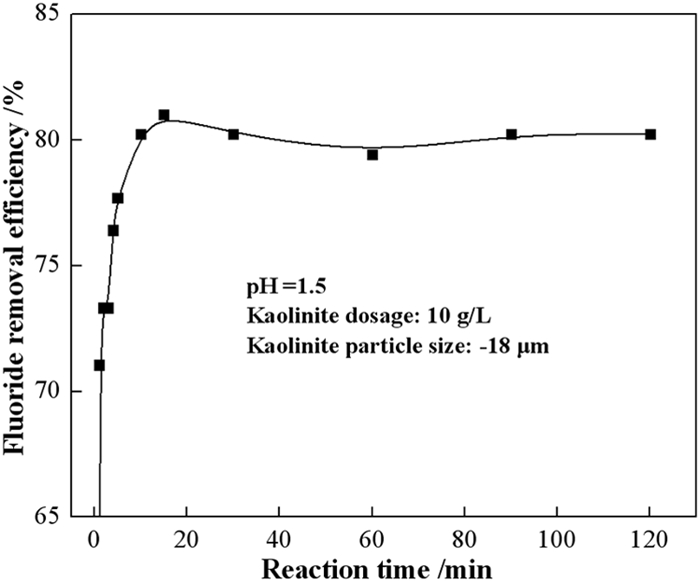 |
| 图 6 吸附时间对氟离子去除率的影响 Fig.6 Effect of adsorption time on fluoride removal efficiency |
通过单因素条件试验可得出,高岭石吸附氟离子的最佳试验条件为:pH=1.5、反应时间10 min、粒度为-18 μm、用量为10 g/L。在该条件下,高岭石对溶液中原始浓度为150 mg/L氟离子的平均去除率为80.13%。
2.4 高岭石除氟的机理研究 2.4.1 吸附动力学研究高岭石对氟离子的去除是通过表面对氟离子的吸附,为更好地研究其吸附机理并为其除氟提供依据,进行了相关动力学研究。动力学准一级、准二级以及吸附容量的计算方程如下:
吸附容量的计算方程式为:
| $ Q = \frac{{V\left( {{C_0} - {C_t}} \right)}}{m} $ | (6) |
准一级方程表示为:
| $ lg\left( {{Q_e} - {Q_t}} \right) = tg\left( {{Q_e}} \right) - {k_1}t $ | (7) |
准二级方程为:
| $ \frac{t}{{{Q_t}}} = \frac{1}{{{Q_e}}}t + \frac{1}{{{k_2}O_e^2}} $ | (8) |
C0—溶液中氟离子的初始质量浓度,mg/L;
Ct—t时溶液中氟离子的质量浓度,mg/L;
m—高岭石的质量,g;
Qe—平衡时的氟离子的吸附容量,mg/g;
Qt—t时氟离子的吸附容量,mg/g;
k—准一级反应速率常数,min-1;
t—除氟剂与模拟溶液的反应时间,min;
K2—准二级反应速率常数。
以log(Qe-Qt)为纵坐标,t为横坐标绘制准一级的线性拟合图 7(a),以t/Qt为纵坐标,时间t为准横坐标进行线性拟合后得图 7(b),相关参数如表 2。
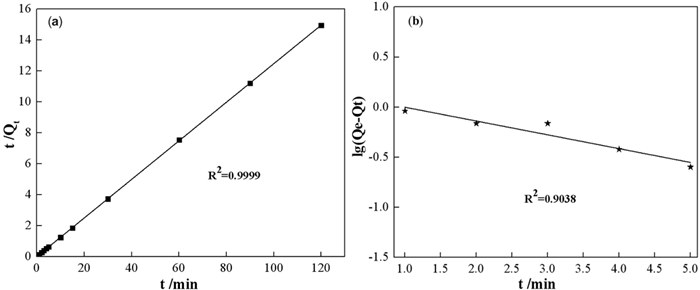 |
| 图 7 高岭石准一级(a)准二级吸附动力学拟合(b) Fig.7 (a) Kinetic fitting of quasi-first-order; (b) Quasi-second-order adsorption of kaolinite |
| 表 2 吸附动力学模型相关参数 Table 2 Relevant parameters of adsorption kinetic model |
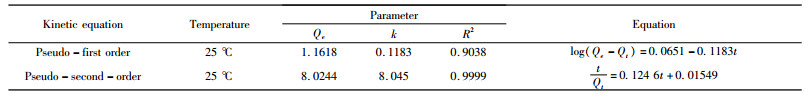
|
随着吸附反应的进行,Qe在前5 min显著增加,随后增长相对缓慢,并在10 min后到达平衡。如图 7所示,准一级动力学拟合与试验数据的一致性较差,拟合优度R2=0.9038,在平衡时高岭土对氟离子的理论吸附容量(Qe=1.1618 mg/L)偏离试验结果(Q=8.08 mg/L)。准二级拟合与试验数据具有较好的一致性,R2=0.9999,k2=8.045 min-1,理论吸附容量(Qe=8.0244 mg/g)几乎等于试验结果。这些结果表明,高岭石对溶液中氟离子的吸附过程发生了离子交换,涉及电子共享或得失[27]。高岭石对氟离子的吸附容量要优于常见的天然吸附材料[28](见表 3)。
| 表 3 天然吸附材料对氟离子的吸附容量比较/(mg·g-1) Table 3 Comparison of adsorption capacity of natural adsorption materials for fluorine ions |

|
2.4.2 吸附等温线
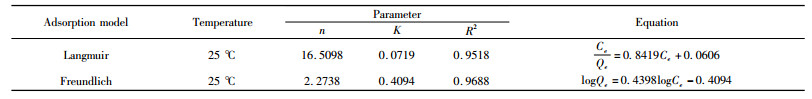
为进一步探究高岭石对溶液中氟离子的吸附方式,采用Langmuir方程和Freundlich方程对高岭石的吸附等温线进行拟合分析。通过Origin对数据进行拟合后得图 8,相关数据见表 3。
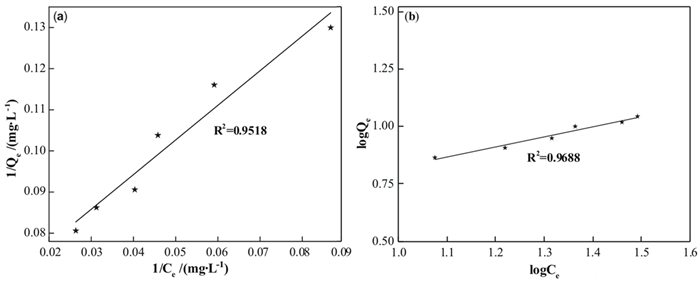 |
| 图 8 高岭石吸附氟离子的(a) Langmuir、(b) Freundlich吸附等温线 Fig.8 (a) Langmuir and (b) Freundlich adsorption isotherms of fluoride ions on kaolinite |
Langmuir方程为:
| $ \frac{1}{{{Q_e}}} = \frac{1}{{n{K_1}{C_e}}} + \frac{1}{n} $ | (9) |
Freundlich方程为:
| $ log {Q_e} = \frac{1}{m}log {C_e} + {K_2} $ | (10) |
K1—Langmuir平衡常数,L/g;
n—常数,mg/g;
Ce—反应后溶液中氟离子的浓度,mg/L;
K2—Freundlich常数。
由表 4可知,Freundlich模型R2=0.9688优于Langmuir模型R2=0.9518,Freundlich模型较符合高岭石吸附氟的规律特性。该结果说明高岭石对模拟废液中氟离子的吸附过程属于单层吸附[29]。计算得1/n值较小且0.1 < 1/n < 0.5,表示该吸附过程容易进行,且为间歇性吸附。
| 表 4 Langmuir、Freundlich吸附等温线拟合吸附过程的回归参数 Table 4 Langmuir and Freundlich adsorption isotherms fitting regression parameters of adsorption |
|
2.4.3 傅里叶红外分析
在最佳试验条件下将天然高岭石与含氟溶液反应后的固体渣进行傅里叶红外分析,其试验结果如图 9。
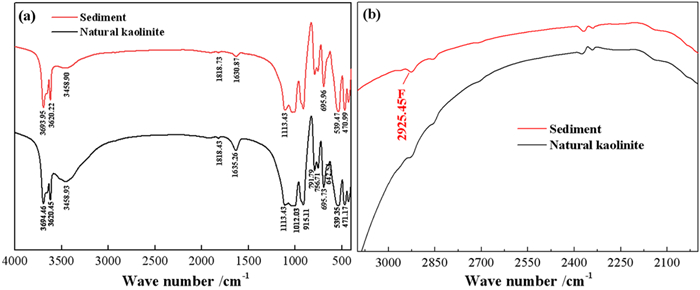 |
| 图 9 天然高岭石及除氟渣的FTIR全谱(a),FTIR局部窄谱(b) Fig.9 (a) FTIR full spectrum and (b) FTIR local narrow spectrum of natural kaolinite and defluorinated residue |
由图 9 (a)可知,天然高岭石的四个羟基吸收峰分别是3 696 cm-1、3 653 cm-1、3 669 cm-1、3 620 cm-1,但样品中只出现了两种羟基的振动吸收峰,这是由于高岭石在研磨的过程中羟基峰发生了合并[30, 31]。除氟后,表面羟基振动吸收峰(3 694.46 cm-1)、内羟基振动吸收峰(3 620.45 cm-1)均变得尖锐,说明高岭石在强酸体系除氟过程中发生了一定的脱羟基作用,有利于羟基与氟离子的离子交换[32]。图 9 (b)分别为天然高岭石除氟前、后的红外光谱局部窄谱图(3 100 cm-1~2 000 cm-1),高岭石在吸附氟离子后出现了F的振动峰,说明氟离子吸附后高岭石的表面有氟化物附着。
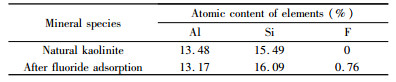
2.4.4 XPS分析XPS结果如图 10所示,高岭石吸附氟离子后在能带为685.66 eV处出现F元素的特征峰,说明高岭石在发生吸附反应后表面有氟化物的附着。高岭石除氟前、后表面元素的原子含量如表 5所示。除氟后高岭石表面的铝原子含量减少,氟原子含量增加,说明在酸性体系下高岭石表面存在Al3+溶出,这与文献报道一致[23],氟原子含量增加说明氟离子在高岭石表面发生有效附着。
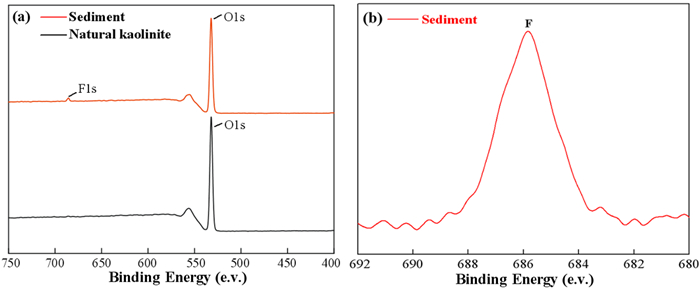 |
| 图 10 天然高岭石及除氟渣的XPS全谱(a),F1s的XPS窄谱(b) Fig.10 (a) XPS full spectrum of natural kaolinite and defluorinated residue, (b) XPS narrow spectrum of F1s |
| 表 5 天然高岭石及除氟后表面原子含量 Table 5 Atomic content on the surface of natural kaolinite and defluorinated residue |
|
图 11(a)对天然高岭石的Al2p轨道进行分峰可知,图谱中能带为74.69 eV、75.15 eV分别对应Al-OH键的2p3/2以及2p1/2轨道[33]。图 11(b)显示氟离子吸附后,高岭石表面在75.36 eV处出现新的特征峰,根据文献知这是Al-F键[34]。这说明氟离子与高岭石中的羟基发生离子交换,且在高岭石表面生成Al-F键。
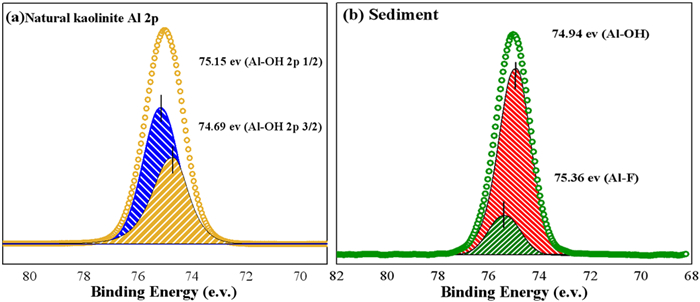 |
| 图 11 Al 2p XPS图谱:(a)天然高岭石Al 2p3/2, Al 2p1/2;(b)氟离子吸附后高岭石的Al 2p Fig.11 XPS Atlas of Al 2p: (a) Al 2p 3/2 of natural kaolinite and Al 2p 1/2; (b) Al 2p of kaolinite adsorbed by fluoride ions |
3 结论
(1) 高岭石由于具有特殊的层状结构而呈现出较大的比表面积,其对氟离子的去除率明显高于一水硬铝石、三水铝石,三种铝硅酸盐矿物对氟离子的最佳去除率分别为83.69%、25.77%、41.74%。
(2) 高岭石单元层的内表面羟基具有两性性质,因此在强酸、强碱环境下对氟离子的去除率较大。高岭石的质子化、脱羟基作用以及Si4+、Al3+溶出造成的硅铝酸盐层间间隙增大是氟离子被吸附去除的主要原因。在温度25 ℃、高岭石用量10 g/L、粒度-18 μm、pH=13的条件下反应10 min,氟离子去除率可达82.44%。
(3) 吸附动力学研究表明高岭石对氟离子的吸附符合准二级吸附模型,其理论吸附容量Qe=8.0244 mg/g,吸附等温线符合Freundlich吸附模型属于单层吸附。高岭石在吸附过程中发生了脱羟基作用,氟离子与高岭石中的羟基发生离子交换,且在高岭石表面生成Al-F键。
| [1] |
张强国, 谢果. 氟危害及重庆氟污染的对策[J]. 重庆科技学院学报, 2005(4): 17-19. |
| [2] |
雷绍民, 郭振华. 氟污染的危害及含氟废水处理技术研究进展[J]. 金属矿山, 2012, 41(4): 152-155. DOI:10.3969/j.issn.1001-1250.2012.04.039 |
| [3] |
戴东情, 张秀, 李海敏. 湿法炼锌中氟氯来源及控制研究[J]. 江苏科技信息, 2018, 35(2): 39-41. DOI:10.3969/j.issn.1004-7530.2018.02.013 |
| [4] |
Zuo H, Chen L, Kong M, et al. Toxic effects of fluoride on organisms[J]. Life Sciences, 2018, 198: 18-24. DOI:10.1016/j.lfs.2018.02.001 |
| [5] |
Gogoi S, Nath S K, Bordoloi S, et al. Fluoride removal from groundwater by limestone treatment in presence of phosphoric acid[J]. Journal of Environmental Management, 2015, 152: 132-139. |
| [6] |
反渗透除氟预处理技术的试验研究[D].泰安: 山东农业大学, 2012.
|
| [7] |
D Alessandro W, Bellomo S, Parello F. Fluorine adsorption by volcanic soils at Mt. Etna, Italy[J]. Applied Geochemistry, 2012, 27(6): 1179-1188. |
| [8] |
姜英杰.混凝沉淀法除氟技术的新进展[C].北京: 中国土木工程学会水工业分会给水深度处理研究会年会, 2012.
|
| [9] |
李华, 孔令东. 改性阳离子交换树脂的制备及其除氟性能研究[J]. 中北大学学报(自然科学版), 2008, 29(4): 352-355. DOI:10.3969/j.issn.1673-3193.2008.04.013 |
| [10] |
E á, Giménez A, Ballesteros J C. Fluoride accumulation by plants grown in acid soils amended with flue gas desulphurisation gypsum[J]. Journal of Hazardous Materials, 2011, 192(3): 1659-1666. DOI:10.1016/j.jhazmat.2011.06.084 |
| [11] |
Tian D, Wang L, Ding R. The study on fluorine removal of drinking water by modified activated carbon[J]. Petrochemical Industry Application, 2011. |
| [12] |
苏馈足, 徐得潜, 唐德江, 等. 天然铝土矿物除氟剂吸附性能研究[J]. 合肥工业大学学报(自然科学版), 2009, 32(7): 1042-1045. DOI:10.3969/j.issn.1003-5060.2009.07.023 |
| [13] |
陆薇宇, 罗海燕, 许霞. 广西百色铝土矿工艺矿物学研究[J]. 矿产综合利用, 2014(2): 57-61. |
| [14] |
易龙生, 黎七荣, 齐莉娜, 等. 宁乡某高岭土的工艺矿物学研究[J]. 矿产综合利用, 2016(2): 78-80. DOI:10.3969/j.issn.1000-6532.2016.02.018 |
| [15] |
蒋明琴, 金晓英, 王清萍, 等. 天然高岭土对Pb~(2+), Cd~(2+), Ni~(2+), Cu~(2+)的吸附及解吸性能研究[J]. 福建师范大学学报(自然科学版), 2009, 25(2): 55-59. |
| [16] |
徐玉芬. 黏土矿物对废水中Cu~(2+)、Cd~(2+)、Cr~(3+)的吸附试验研究[J]. 矿产综合利用, 2008(3): 28-31. DOI:10.3969/j.issn.1000-6532.2008.03.008 |
| [17] |
程运, 王昕晔, 吕文婷, 等. 高岭土高温吸附重金属和碱金属的研究进展[J]. 化工进展, 2019, 38(8): 3852-3865. |
| [18] |
董菊芬, 董丙坤. 生活饮用水中氟离子含量测定[J]. 河北化工, 2010, 33(3): 60-61. DOI:10.3969/j.issn.1003-5059.2010.03.026 |
| [19] |
苏馈足, 徐得潜, 唐德江, 等. 天然铝土矿物除氟剂吸附性能研究[J]. 合肥工业大学学报(自然科学版), 2009, 32(7): 1042-1045. DOI:10.3969/j.issn.1003-5060.2009.07.023 |
| [20] |
印万忠, 韩跃新, 魏新超, 等. 一水硬铝石和高岭石可浮性的晶体化学分析[J]. 金属矿山, 2001(6): 29-33. |
| [21] |
Srivastava P, Singh B, Angove M. Competitive adsorption behavior of heavy metals on kaolinite[J]. Journal of Colloid & Interface Science, 2015, 290(1): 28-38. |
| [22] |
陈湘清, 胡岳华, 王毓华. 氟化钠在铝硅酸盐矿物浮选中的作用机理研究[J]. 金属矿山, 2004(10): 32-35. DOI:10.3321/j.issn:1001-1250.2004.10.010 |
| [23] |
王洪涛. 高岭石胶体的降氟作用机理[J]. 南京大学学报(自然科学), 2002, 38(6): 855-859. |
| [24] |
赵杏媛, 张有瑜. 黏土矿物与黏土矿物分析[M]. 北京: 海洋出版社, 1990: 109-115.
|
| [25] |
于涛, 郭风林. 三元复合驱结垢机理研究——NaOH对高岭石和蒙脱石的作用[J]. 东北石油大学学报, 2001, 25(2): 28-30. DOI:10.3969/j.issn.2095-4107.2001.02.009 |
| [26] |
狄平宽, 单忠健. Ca~(2+)、Al~(3+)对聚丙烯酰胺在高岭土絮凝过程中作用的影响[J]. 环境科学, 1991(6): 20-448. |
| [27] |
朱迟.藻类生物絮凝剂和饮用水除氟生物吸附剂的研究[D].武汉: 华中师范大学, 2007. http://d.wanfangdata.com.cn/Thesis_Y1809703.aspx
|
| [28] |
苏馈足, 徐得潜, 李洋, 等. 铝土矿除氟吸附剂制备及其性能研究[J]. 工业用水与废水, 2008, 39(6): 78-81. DOI:10.3969/j.issn.1009-2455.2008.06.021 |
| [29] |
Ghorai S, Pant K K. Equilibrium, kinetics and breakthrough studies for adsorption of fluoride on activated alumina[J]. Separation & Purification Technology, 2005, 42(3): 265-271. |
| [30] |
孙伟, 刘文莉, 胡岳华.聚丙烯酰胺与高岭石相互作用的FTIR研究[C].长沙: 全国选矿专业学术年会, 2006.
|
| [31] |
方燕.研磨及酸化高岭石的晶体结构及其对Cu~(2+)的表界面作用[D].广州: 中国科学院广州地球化学研究所, 2017. http://cdmd.cnki.com.cn/Article/CDMD-80165-1017074626.htm
|
| [32] |
牛继南, 强颖怀, 王志辉. 氟置换高岭石层间羟基的能量最小化模拟[J]. 物理化学学报, 2010, 26(6): 1541-1551. DOI:10.3866/PKU.WHXB20100515 |
| [33] |
Zhang N, Ejtemaei M, Nguyen A V, et al. XPS analysis of the surface chemistry of sulfuric acid-treated kaolinite and diaspore minerals with flotation reagents[J]. Minerals Engineering, 2019, 136. |
| [34] |
Coulombe M, Lebeuf M, Fairley N, et al. Cryolitic vein XPS imaging from an industrial grade carbon[J]. Journal of Electron Spectroscopy & Related Phenomena, 2012, 185(12): 588-597. |
 2020
2020


