| 氨基功能化硅胶的制备及其对镧离子的吸附行为研究 |
中国南方拥有大量的离子吸附型稀土矿, 是我国特有且具有极高利用价值的新型稀土矿。目前采用被认为最为环保的就地渗滤浸出技术, 可以实现从千分之几乃至万分之几的离子吸附型稀土原矿中提取得到稀土品位在92%以上的稀土氧化物精矿或碳酸盐。但是提取过程中仍然存在浸矿后期低浓度浸出液和淋滤水中低浓度稀土难以回收的问题。针对低浓度稀土浸出液体系, 液固吸附[1]由于耗能低、操作简单、效率高、环境污染小, 同时又可以选择性地富集某些金属一直以来受到广泛重视。目前各种有机、无机吸附剂已经被广泛用于稀溶液中稀土离子的吸附回收研究[2-8]。
液固吸附技术的关键是要制备出吸附容量大、分离效率高、成本低廉、可再生且环境相容性好的固体吸附剂。硅胶(SiO2)是一种具有很高活性、无毒、无味、无污染的无机多孔材料, 拥有较高的比表面积, 对有机溶剂、高酸和高温有较好的耐受力, 并且具有良好的物理和机械性能。更重要的是, 表面含有大量的Si-OH, 可以通过酯化、醚化及氨基化等途径固定其他配体, 是一种优良的吸附剂载体。硅胶已有工业生产和应用, 但对金属离子的吸附容量有限, 一般需要经过物理或化学处理来增加金属离子的负载量[9-15]。
本研究采用甲苯为溶剂, 一步合成了γ-氨丙基三乙氧基硅烷修饰的氨基功能化硅胶(SiO2-NH2)多孔吸附剂, 并用于模拟浸出液中三价稀土镧离子(La(Ⅲ))吸附回收性能的研究。
1 试验部分 1.1 主要试剂和仪器碳酸镧[La2(CO3)3]·8H2O(纯度>99.5%), 由包头稀土矿有限公司提供, La(Ⅲ)离子母液由碳酸镧经稀硝酸溶解, 加热挥发除去多余的硝酸, 去离子水定容配制成浓度为0.01 mol/L的储备液备用。硅胶(200~300目), 青岛海洋化工有限公司。γ-氨丙基三乙氧基硅烷(≡Si-CH2CH2CH2NH2)(纯度>98%), 湖北荆州精细化工有限公司。试验用水为去离子水, 氨水(25%~28%, 优级纯), 其他试剂均为市售分析纯。
主要分析测试仪器:扫描电镜(S-4800), DSC/TG热分析仪(NE-TZSCH STA 449 C), pH 211数字pH计(HANNA, 意大利), OPTIMA 7000DV电感耦合等离子体原子发射光谱仪(ICP-OES, PekinElmer, 美国), 傅里叶变换红外光谱仪(Bruker Tensor 27, 德国), Avanti J-E离心机(Beckman coulter, 美国), THZ-C恒温振荡器。CHN元素分析采用FlashEAI112元素分析仪(美国TermoEleetron公司), N2吸附/解吸表征采用ASAP2020自动微孔/化学吸附分析仪(美国MicromeriticS公司)。
1.2 试验方法 1.2.1 吸附剂合成活化硅胶:取硅胶(200~300目) 1 kg, 加入3 L 6 mol/L的HCl, 浸泡24 h, 过滤, 用去离子水洗涤至中性, 150 ℃干燥6 h, 得到活化硅胶备用, 产物记为SiO2。
胺基修饰硅胶:在1 L烧瓶中依次加入50 g硅胶、250 mL无水甲苯和50 mL γ-胺丙基三乙氧基硅烷。搅拌回流反应12 h, 过滤, 依次用甲苯、乙醇洗涤除去未键合的硅烷化试剂, 100 ℃真空干燥12 h, 得到产物57 g备用, 产物记为SiO2-NH2。
1.2.2 吸附剂的表征pH-电导率滴定可以表征键合硅胶表面-NH2含量。称量0.1 g键合硅胶, 加入适量去离子水, 用0.1 mol/L的HCl溶液调节溶液pH为2左右, 逐次加入0.149 3 mol/L的NaOH标准溶液100 μL, 用pH计和电导率仪记录每次的平衡pH和电导率值直至溶液pH超过11, 整个滴定过程, 体系均置于25 ℃恒温水浴中。根据滴定曲线, 利用二阶微商法, 确定拐点处的pH值[16]。
1.2.3 吸附试验液固吸附:准确称取一定质量的吸附剂于具塞三角瓶中, 加入一定体积金属离子储备液, 用氨水和盐酸调节溶液pH值, 并加水至溶液总体积为25 mL。将此具塞三角瓶置于水浴摇床中恒温反应一定时间, 转速200 r/min, 定时取样。吸附平衡后, 样品溶液经0.22 μm水系滤膜过滤后, 用ICP-OES测溶液中金属离子的浓度。平衡吸附率E(%)和吸附量q(mg/g)和按照公式(1)和(2)计算[17]:
| $ E\left( \% \right) = \frac{{{C_i}-{C_e}}}{{{C_i}}} \times 100\% $ | (1) |
| $ q\left( {{\rm{mg}}/{\rm{g}}} \right) = \frac{{({C_{\rm{i}}}-{C_{\rm{e}}}) \times V \times {{10}^{-3}}}}{W} $ | (2) |
其中:Ci、Ce分别为溶液中金属离子的起始浓度、吸附平衡后的浓度, mg/L; V为吸附溶液的体积, mL; W为吸附剂的质量, g。
2 结果与分析 2.1 表征SiO2和SiO2-NH2的热重与差式扫描量热(TG/DSC)表征的结果如图 1所示。在TG谱图中, SiO2和SiO2-NH2两个样品都有两个失重峰。第一个失重峰发生在473 K, 与此同时, DSC谱图上也出现了相应的放热峰, 这可能是由于吸附剂表面物理吸附水和溶剂的脱附造成的。第二个失重峰在SiO2的TG/DSC谱图上只出现了一个很小的失重峰和放热峰(图 1 A), 可能来自SiO2表面化学键合态的水的脱附以及表面Si-OH的脱水缩合。SiO2-NH2在温度为473~1 073 K之间出现了一个明显的失重峰和放热峰(图 1 B), 主要归因于负载的γ-胺丙基三乙氧基硅烷的分解。因此, 可以进一步说明γ-胺丙基三乙氧基硅烷已经负载到SiO2上。
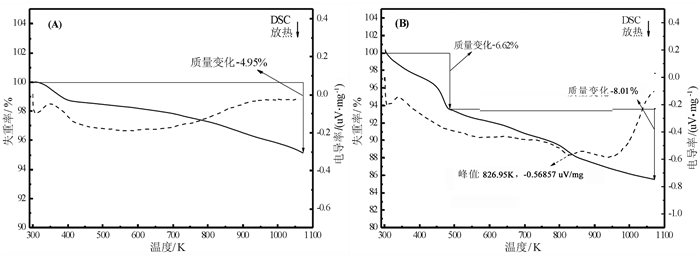 |
| 图 1 TG/DSC曲线:(A)活化SiO2; (B)SiO2-NH2 Fig.1 TG/DSC curves:(A) activated SiO2; (B) SiO2-NH2 |
N2吸附—解吸测定前, 样品经373 K脱气8 h处理, 并分别采用Brunauer-Emmett-Teller(BET)和Barrett-Joyner-Halenda(BJH)法计算样品的比表面积(SBET)、孔容积(VP)和孔半径(RP), 计算结果列入表 1中。从表中可以看出, SiO2和SiO2-NH2的比表面积相差不大(差别小于1%), 孔容和孔半径微弱下降, 分别降低了0.052 cm3/g和0.828 nm, 证明γ-胺丙基三乙氧基硅烷是以单分子层形式修饰至SiO2表面。
| 表 1 活化SiO2和SiO2-NH2的结构表征参数 Table 1 Structure characterization parameters of activated SiO2 and SiO2-NH2 |
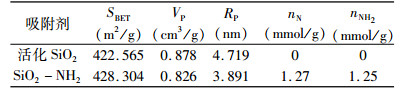 |
分别采用CHN元素分析法和pH-电位滴定法测定了键合官能团-NH2在SiO2表面的键合量。CHN元素分析结果计算得出N原子的含量nN为1.27 mmol/g。图 2显示了SiO2-NH2的pH-电导率滴定曲线。
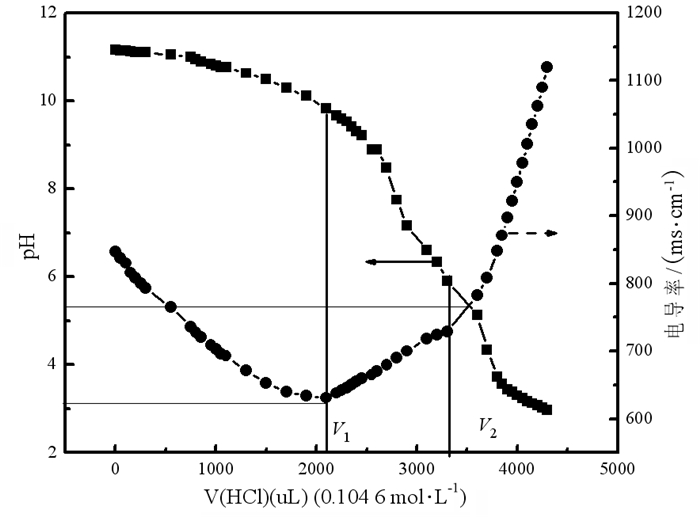 |
| 图 2 SiO2-NH2的pH-电导率滴定曲线 Fig.2 The pH and electric conductivity titration curve of SiO2-NH2 |
图中的V1、V2分别为剩余NaOH和自由-NH2的滴定终点。根据pH滴定曲线的结果(图 2), SiO2-NH2表面-NH2官能团的负载量nNH2(mmol/g)可由式(3)计算得出[16]:
| $ {n_{{\rm{N}}{{\rm{H}}_{\rm{2}}}}} = ({V_2}-{V_1}) \times {C_{{\rm{HC1}}}}/{m_{{\rm{Si}}{{\rm{O}}_2}-{\rm{N}}{{\rm{H}}_2}}} $ | (3) |
其中, (V2-V1)为自由-NH2转变为质子化-NH3+所消耗的HCl溶液的体积(1.195 mL), CHCl为滴定用标准HCl溶液的浓度(0.104 6 mol/L), WSiO2-NH2为加入SiO2-NH2的质量(0.1 g)。由上式计算得出-NH2官能团含量nNH2为1.25 mmol/g, 与元素分析1.27 mmol/g结果相一致, 证明这两种分析方法可靠。
根据pH滴定试验的结果推断出溶液中-NH2官能团的存在状态与溶液pH的关系, 如图 2所示。经历了两个变化阶段, 当溶液pH≥6时, 氨基以自由-NH2存在; pH在3到6之间时, 随着HCl的加入, 溶液H+浓度增加, 自由-NH2开始逐渐被质子化, 转变为质子化的-NH3+, 质子化-NH3+的含量随着溶液H+浓度增加而增加, 直至pH达到3, 氨基全部转变为质子化-NH3+状态; 再继续增加溶液H+浓度, 氨基基团的状态将不再改变。
2.2 pH影响对不同pH值下La(Ⅲ)在吸附剂SiO2-NH2上的吸附率进行了测量, 其结果如图 3所示。
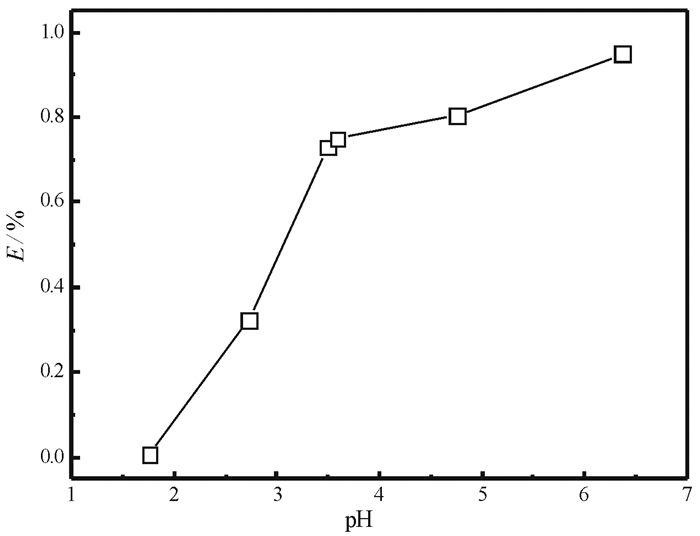 |
| 图 3 溶液pH对SiO2-NH2吸附La(Ⅲ)的影响 Fig.3 Effect of pH on the adsorption of La(Ⅲ) on SiO2-NH2 (吸附条件:t=12 h; W=0.1 g; Ci=250 mg/L; V=25 mL; T=298.15 K) |
从图中可以看出, La(Ⅲ)在SiO2-NH2上的吸附量随着pH的增加而增加, 大致可以分为2个阶段。第一个阶段, 当pH在1.76到3.59范围内的时候, La(Ⅲ)在SiO2-NH2上的吸附量随pH的增加而快速增加。尤其在pH为1.76时, La(Ⅲ)在SiO2-NH2上的吸附量几乎可以忽略不计, 说明高酸度有利于La(Ⅲ)的解吸。第二个阶段, 当pH在3.59到6.37范围内的时候, La(Ⅲ)在SiO2-NH2上的吸附量随pH的增加而缓慢增加。所以, 后续试验pH将选择在6.4左右进行。因为在较高pH的水溶液中稀土离子容易水解而沉淀, 所以没有进一步增加试验pH值。
2.3 吸附热力学图 4描述了SiO2-NH2对溶液中La(Ⅲ)的吸附量随溶液中La(Ⅲ)平衡浓度的变化曲线。La(Ⅲ)的吸附量随着溶液中La(Ⅲ)的加入量的增加而逐渐增加, 并逐渐趋于平衡。
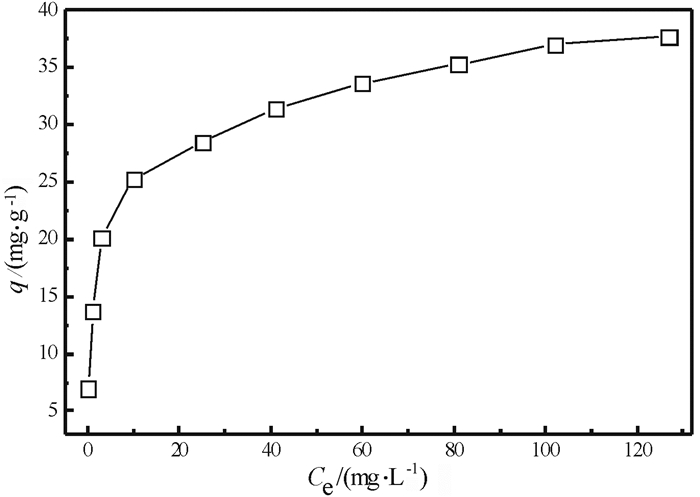 |
| 图 4 SiO2-NH2吸附La(Ⅲ)的热力学等温线 Fig.4 Langmuir isothermal adsorption curve for La(Ⅲ) on SiO2-NH2 (吸附条件:t=12 h; W=0.1 g; pH=6.4±0.1;V=25 mL; T=298.15 K) |
从图中可以看出La(Ⅲ)最大饱和吸附容量为37.7 mg/g。在热力学吸附平衡研究中, 描述吸附等温线最常用的表达式是Langmuir方程。
Langmuir方程的线性化形式为:
| $ {C_{\rm{e}}}/{q_{\rm{e}}} = {C_{\rm{e}}}/{q_{\rm{m}}} + 1/(b \times {q_{\rm{m}}}) $ | (4) |
式中, b、qm均为常数, 其中qm为吸附剂对La(Ⅲ)单层最大吸附量。用Langmuir方程对吸附等温线进行拟合, 拟合参数见表 2。
| 表 2 Langmuir方程拟合参数 Table 2 Fitting parameters of Langmuir equation |
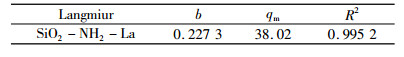 |
拟合所得的相关系数(R2)为0.995 2, 且由Langmuir拟合方程计算出的La(Ⅲ)最大饱和吸附量分别为38.02 mg/g, 与实际试验结果37.7 mg/g相符, 表明由Langmuir等温吸附方程描述La(Ⅲ)的吸附等温线较为确切, 根据Langmuir等温吸附方程的假设条件, 可以推测SiO2-NH2对溶液中La(Ⅲ)的吸附属于单分子层的化学吸附。
2.4 吸附动力学图 5为吸附剂SiO2-NH2对La(Ⅲ)的吸附量随时间变化的曲线。由动力学曲线可知, 开始阶段, SiO2-NH2对La(Ⅲ)吸附迅速, 在2 h内即可吸附平衡吸附量的90%以上。此后吸附量随时间的增加而缓慢增加, 6 h内达到完全平衡, 平衡吸附量为36.6 mg/g。在吸附动力学研究中, 准二级反应速率方程对吸附速率进行处理最为常见, 其表达式为:
| $ t/q = 1/({k_2} \times {q_{\rm{e}}}^2) + t/{q_{\rm{e}}} $ | (5) |
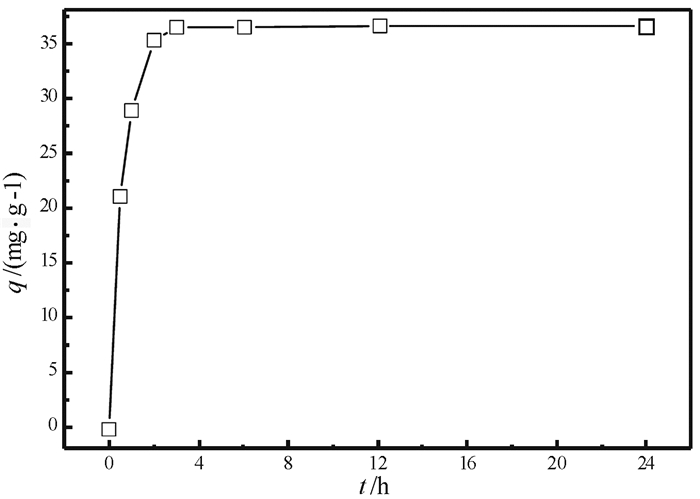 |
| 图 5 SiO2-NH2吸附La(Ⅲ)的动力学曲线 Fig.5 Kinetics adsorption curve forLa(Ⅲ) on SiO2-NH2 (吸附条件:Ci=250 mg/L; W=0.1 g; pH=6.4±0.1; V=25 mL; T=298.15 K) |
式中:t为吸附时间(h); q和qe分别为吸附时间t和吸附平衡时的吸附量, mg/g; k2为二级反应速率常数, g/(mg·h)。
表 3给出了SiO2-NH2的二级反应动力学模型参数, 准二级动力学模型拟合的相关系数为0.999 8, 计算的平衡吸附量为37.03 mg/g, 与真实试验数据36.6 mg/g相符, 这表明准二级吸附机制起主要作用。根据准二级吸附动力学模型的假设, 该吸附过程的速率控制步骤为化学吸附环节。
| 表 3 SiO2-NH2对La(Ⅲ)吸附的二级反应动力学模型参数 Table 3 Second order kinetics parameters of La(Ⅲ)adsorption |
 |
2.5 解吸与再生
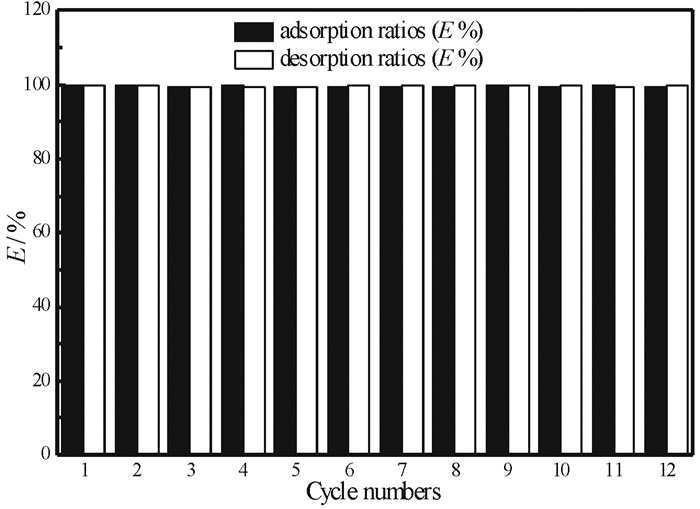
将负载了La(Ⅲ)的吸附剂(SiO2-NH2-La)用盐酸(HCl浓度0.2 mol/L)进行解吸, 计算得到的解吸率99.9%。说明0.2 mol/L HCl溶液可以实现吸附剂中La(Ⅲ)的高效回收。吸附剂用氨水活化, 然后用去离子水水洗至中性再生, 用于下一轮的循环吸附。吸附剂经过12次吸附—解吸—活化再生循环试验后的吸附量变化如图 6所示, 经过12次循环后, SiO2-NH2对La(Ⅲ)的吸附量几乎没有变化, 证明吸附剂具有优良的循环使用性能。
 |
|
图 6 吸附剂吸附-解吸循环试验 Fig.6 Adsorption-desorption cycle tests of adsorbents (吸附条件:t=2 h; Ci=200 mg/L; W=0.1 g; pH=6.4±0.1;V=25 mL; T=298.15 K; 解吸条件:V= 25 mL; T=298.13 K; t=1 h; CHCl=0.2 mol/L) |
3 结论
本文以无水甲苯为反应介质, 以γ-胺丙基三乙氧基硅烷为功能配体, 合成了氨基修饰的硅胶吸附剂(SiO2-NH2), 并详细研究了SiO2-NH2对水溶液中La(Ⅲ)的静态吸附性能。主要结论如下:
(1) pH对稀土La(Ⅲ)离子的吸附性能有显著影响, 随着pH增加, La(Ⅲ)的吸附量先快速增加后缓慢增加, 在pH为6.4左右达到最大值。
(2) 热力学等温吸附表明, 随着溶液中La(Ⅲ)浓度的增加, La(Ⅲ)在SiO2-NH2上的吸附量逐渐增加, 298 K下的最大饱和吸附量为37.7 mg/g, 等温吸附符合Langmiur吸附模型, 证明La(Ⅲ)在吸附剂表明属于单分子的化学吸附, Langmiur方程计算La(Ⅲ)的饱和吸附容量为38.02 mg/g。
(3) 动力学研究表明, 随着吸附时间的增加, SiO2-NH2对La(Ⅲ)的吸附量先迅速增加后缓慢增加, 2 h内可达到平衡吸附量的90%以上, 完全平衡时间为6 h, 吸附符合准二级动力学吸附模型, 证明化学吸附为该过程的速率控制步骤。
(4) 盐酸浓度为0.2 mol/L时, 可以实现La(Ⅲ)在吸附剂上几乎完全解吸。经过12次的吸附—解吸循环试验以后, SiO2-NH2对La(Ⅲ)的吸附性能没有明显变化, 吸附剂循环使用性能优良。
以上结论证明:利用SiO2-NH2多孔吸附剂从离子吸附型稀土矿低浓度浸出液和淋滤水中回收稀土离子是可行的。
| [1] |
Turker. A.R.. New sorbents for solid-phase extraction for metal enrichment[J]. Clean-Soil Air Water, 2007, 35(6): 548-557. DOI:10.1002/(ISSN)1863-0650 |
| [2] |
Rahman M.L., Biswas T.K., Sarkar S.M., et al. Adsorption of rare earth metals from water using a kenaf cellulose-based poly(hydroxamic acid) ligand[J]. Journal of Molecular Liquids, 2017, 243: 616-623. DOI:10.1016/j.molliq.2017.08.096 |
| [3] |
Ogata T., Narita H., Tanaka M.. Adsorption mechanism of rare earth elements by adsorbents with diglycolamic acid ligands[J]. Hydrometallurgy, 2016, 163: 156-160. DOI:10.1016/j.hydromet.2016.04.002 |
| [4] |
Zhao F., Repo E., Meng Y., et al. An EDTA-β-cyclodextrin material for the adsorption of rare earth elements and its application in preconcentration of rare earth elements in seawater[J]. Journal of Colloid and Interface Science, 2016, 465: 215-224. DOI:10.1016/j.jcis.2015.11.069 |
| [5] |
Ogata T., Narita H., Tanaka M.. Adsorption behavior of rare earth elements on silica gel modified with diglycol amic acid[J]. Hydrometallurgy, 2015, 152: 178-182. DOI:10.1016/j.hydromet.2015.01.005 |
| [6] |
Page M.J., Soldenhoff K., Ogden M.D.. Comparative study of the application of chelating resins for rare earth recovery[J]. Hydrometallurgy, 2017, 169: 275-281. DOI:10.1016/j.hydromet.2017.02.006 |
| [7] |
Anastopoulos I., Bhatnagar A., Lima. E.C.. Adsorption of rare earth metals:A review of recent literature[J]. Journal of Molecular Liquids, 2016, 221: 954-962. DOI:10.1016/j.molliq.2016.06.076 |
| [8] |
Sun X., Luo H., Mahurin S.M., et al. Adsorption of rare earth ions using carbonized polydopamine nano carbon shells[J]. Journal of Rare Earths, 2016, 34(1): 77-82. DOI:10.1016/S1002-0721(14)60582-2 |
| [9] |
Wang M., Qu R., Sun C., et al. Dynamic adsorption behavior and mechanism of transition metal ions on silica gels functionalized with hydroxyl-or amino-terminated polyamines[J]. Chemical Engineering Journal, 2013, 221: 264-274. DOI:10.1016/j.cej.2013.02.036 |
| [10] |
Qin W., Xu S., Xu G., et al. Preparation of silica gel bound crown ether and its extraction performance towards zirconium and hafnium[J]. Chemical Engineering Journal, 2013, 225: 528-534. DOI:10.1016/j.cej.2013.03.127 |
| [11] |
Yantasee W., Fryxell G.E., Lin Y., et al. Hydroxypyridinone functionalized self-assembled monolayers on nanoporous silica for sequestering lanthanide cations[J]. Journal of Nanoscience and Nanotechnology, 2005, 5(4): 527-529. DOI:10.1166/jnn.2005.096 |
| [12] |
Jal P.K., Patel S., K B.. Mishra.Chemical modification of silica surface by immobilization of functional groups for extractive concentration of metal ions[J]. Talanta, 2004, 62(5): 1005-1028. DOI:10.1016/j.talanta.2003.10.028 |
| [13] |
Park H.J., Tavlarides L.L.. Adsorption of neodymium(Ⅲ) from aqueous solutions using a phosphorus functionalized adsorbent[J]. Industrial & Engineering Chemistry Research, 2010, 49(24): 12567-12575. |
| [14] |
Dai S., Burleigh M.C., Ju Y.H., et al. Hierarchically imprinted sorbents for the separation of metal ions[J]. Journal of the American Chemical Society, 2000, 122(5): 992-993. DOI:10.1021/ja993168x |
| [15] |
王福春, 王万坤, 刘伟, 等. 二氧化硅微球包埋羧甲基壳聚糖回收稀土镧离子[J]. 矿产保护与利用, 2017(3): 68-74. |
| [16] |
Muzzarelli R.A.A., Tanfani F., Emanuelli M., et al. N-(carboxymethylidene) chitosans and N-(carboxymethyl) chitosans:novel chelating polyampholytes obtained from chitosan glyoxylate[J]. Carbohydrate Research, 1982, 107(2): 199-214. DOI:10.1016/S0008-6215(00)80539-X |
| [17] |
Dai S., Burleigh M.C., Shin Y., et al. Imprint coating:a novel synthesis of selective functionalized ordered mesoporous sorbents[J]. Angewandte Chemie International Edition, 1999, 38(9): 1235-1239. DOI:10.1002/(SICI)1521-3773(19990503)38:9<1235::AID-ANIE1235>3.0.CO;2-X |
 2018
2018 


