| 氧化亚铁硫杆菌在金属硫化矿浸出中的作用机理及应用 |
2. 贵州喀斯特环境生态系统教育部野外科学观测研究站,贵州 贵阳 550025;
3. 贵州贵达元亨环保科技有限公司,贵州 贵阳 550025
2. The Science Park Development Co., Ltd., of Guizhou University, Guiyang 550025, China;
3. Guida Yuanheng Environmental Protection Technology Co., Ltd., Guiyang 550025, China
矿产资源是我国经济建设的重要基础,从矿产资源中提炼的贵重金属被应用于通信、化工、能源、电力和日常生活中。因此其提炼技术成为绿色经济发展的关键。传统的冶金技术按其特点不同可以分为火法冶金和湿法冶金。火法冶金由于要维持高温所需热源,需要燃烧碳质燃料供热,同时生产过程中会产生大量废气如含氟和沥青烟气等,对环境造成污染。而湿法冶金工艺中会使用大量化学药剂浸出萃取重金属,但多数药剂的使用安全还不尽人意,还有研究表明湿法冶金工艺中使用的化学溶剂含有内分泌干扰物[1]。而生物浸矿技术具有规模可控性、操作简单、流程较少、经济环保等优势,受到人们广泛关注。根据资料显示,生物浸矿技术炼铜的能耗、温室气体排放、硫排放和产生的有毒副产品仅相当于火法炼铜的43.2%、45.2%、5.1%和5.0%[2]。生物浸出技术不仅应用于高品位矿石浸出,同时也在尾矿浸出中起着重要作用。尾矿是选矿后的废弃物,属于低品位矿石,目前对于尾矿的处理大多是堆存。而堆存会大量占用土地,且随着雨水冲刷,一方面其中的有害重金属离子会污染周边土壤和地下水;另一方面尾矿中的钼、镍、铜等有价值的金属资源也会浪费。因此,利用生物浸出技术浸出低品位尾矿有利于矿产资源的高效利用。
氧化亚铁硫杆菌(Thiobacillus ferrooxidans, T.f菌)属于化能自养型革兰氏阴性菌,好氧嗜酸,能够将O2作为电子受体,通过将Fe2+氧化生成Fe3+或将单质硫、还原性无机硫化合物氧化为硫酸盐而获得生长所需的能量,广泛存在于酸性矿山水及含铁或硫的酸性环境中。这种特殊的代谢方式使其成为金属硫化矿生物浸出过程中的关键生物之一,并且被作为生物冶金模式细菌[3]。
T.f菌浸出机理复杂多样,其中双氧化系统(铁氧化系统、硫氧化系统)在浸矿过程中起着重要重要。且影响T.f菌的浸矿效率的因素有很多,包括pH、温度、接种量、矿石粒度、矿浆浓度、溶解氧等。并且随着研究的深入,研究者[4]发现在细菌浸矿过程中,在细菌产生的胞外聚合物(Extracellular Polymeric Substances, EPS)作为反应介质的试验中,其生物氧化反应速率最快。因此,本文梳理了近年来T.f菌浸矿的作用机理,并对EPS在浸矿过程中的作用和研究进行总结,以期能为今后T.f菌在生物浸矿方面的机理完善提供理论基础。
2 氧化亚铁硫杆菌的生理学特征 2.1 形态特征氧化亚铁硫杆菌(Thiobacillus ferrooxidans),是短杆菌,能运动,革兰氏阴性,具有圆钝的末端,单生或对生,成短链者少[5],在不同的营养条件下具有不同的形态特征,即其细胞形状及菌落颜色、大小与营养条件有关。常用的9K培养基组分(g/L): FeSO4·7H2O(44.2),(NH4)2SO4 (3.0),KCl (0.1),K2HPO4(0.50),MgSO4·7H2O (0.50),Ca(NO3)2 (0.01),用质量比1:1的H2SO4调节pH为2.0。在9K固体培养基上培养,该菌会长出圆形凸起状的黄褐色的圆形小菌落[6]。将该菌放在9K液体培养基里培养,培养基中Fe2+氧化生成Fe3+,菌液由浅绿色变为红棕色[7],同时培养基中Fe3+会发生水解,生成黄钾铁矾类沉淀[8],其反应方程式为:
| $ \begin{array}{l} 3{\rm{F}}{{\rm{e}}^{3 + }} + {{\rm{M}}^ + } + 2{\rm{HSO}}_4^ - + 6{{\rm{H}}_2}{\rm{O}} \to \\ {\rm{MF}}{{\rm{e}}_3}{\left( {{\rm{S}}{{\rm{O}}_4}} \right)_2}{({\rm{OH}})_6} \downarrow + 8{{\rm{H}}^ + } \end{array} $ | (1) |
式中M+可能是K+、Na+、NH4+和H3O+[9]。该沉淀主要有黄钾铁矾、黄铵铁钒和黄钠铁矾[10-11],影响其生成的关键因素是溶液的pH和Fe3+的浓度[12]。在浸出过程中,黄钾铁矾类沉淀覆盖在矿物上,会影响重金属的浸出。因此如何控制浸出过程中沉淀的生成是提高细菌浸出效率的关键因素之一。
2.2 生长条件T.f菌是自养型微生物,通过固定大气中的CO2或是利用较低浓度的甲酸盐来获得碳源[13]。试验证明该菌每氧化1 mol的Fe2+便固定10.4 mol的CO2[14]。其最适生长条件为:pH=2, 温度为30 ℃[15-16]。此外在培养过程中,Fe2+浓度、培养基营养物质的不同对该菌的生长过程具有很大的影响。
LIU等[14]研究了Fe2+、溶解氧以及悬浮固体物质的浓度对T.f菌生长的影响。研究表明,该菌的最大比生长速率为0.1 h-1;当溶解氧浓度低于0.20 mg/L时,T.f菌无法生长。当摇瓶中的固体悬浮物浓度达到0.5%以上时,氧气浓度会显著下降,而当瓶中的固体悬浮物质量浓度升到15%时,对氧化速率的影响很小。同时试验结果显示,随着Fe2+浓度的增加,T.f菌的生长速率也增加,但是Fe3+会抑制T.f菌的生长。
TUOVIXEN等[17]研究了无机物对T.f菌的生长情况的影响,试验结果表明硝酸盐、氯化物、钾和钙的缺失对T.f菌的生长没有明显影响,相反高浓度的硝酸盐和氯化物存在时,细菌的生长会受到抑制;同时铵盐、硫酸盐、磷和镁是T.f菌生长的必须物质,这与刘欣伟等人[18]的研究结果吻合,即在一定Mg2+浓度下,氧化亚铁硫杆菌才能正常生长。
2.3 生长动力学研究为了探究T.f菌的生长过程,不少学者研究了该菌的生长动力学模型。对于T.f菌的生长动力学模型的研究大多是基于非竞争性抑制的Monod方程建立的,在此基础上考虑Fe2+、Fe3+或其他离子对T.f菌生长的抑制作用建立起各种模型。Gomez J M等[19]在Monod方程基础上增加Fe2+和Fe3+浓度影响,得到竞争性抑制生长模型:
在考虑Fe3+影响的Monod方程基础上,Boon MD等人[20]结合Pirt方程考虑细菌消耗O2的速率得到以下细菌生长动力学模型:
| $ \begin{array}{*{20}{c}} {\mu = \frac{{{\mu _{\max }} + {m_{\rm{o}}} \cdot Y_{0{\rm{x}}}^{\max }}}{{1 + \frac{{{K_{\rm{s}}}}}{{\left[ {{\rm{F}}{{\rm{e}}^{2 + }}} \right] - {{\left[ {{\rm{F}}{{\rm{e}}^{2 + }}} \right]}_t}}} + \frac{{{K_s}}}{{{K_i}}} \cdot \frac{{\left[ {{\rm{F}}{{\rm{e}}^{3 + }}} \right]}}{{\left[ {{\rm{F}}{{\rm{e}}^{2 + }}} \right] - {{\left[ {{\rm{F}}{{\rm{e}}^{2 + }}} \right]}_t}}}}} - }\\ {{m_{\rm{o}}} \cdot Y_{0{\rm{x}}}^{\max }} \end{array} $ |
式中YOXmax是最大产率系数(细菌对氧),mo是O2的维持系数。该模型建立比生长速率和O2比消耗速率的方程,利用拟合所得各动力学常数来模拟计算值,结果表明与试验值吻合较好。
虽然不同学者研究生长动力学得到的模型不尽相同,但多以Monod为基础建立。浸出过程中,T.f菌一方面会利用Fe2+、S或Fe2S, 另一方面也会受到浸出溶液中重金属的胁迫[21]。在研究浸出不同矿物时,应考虑目标重金属对生长动力学模型的贡献。
3 氧化亚铁硫杆菌的浸出机理氧化亚铁硫杆菌(Thiobacillus ferrooxidans)浸出重金属的机制一般分为“直接-接触”和“间接-非接触”原理,其中细菌的铁氧化系统和硫氧化系统(双氧化系统)在浸矿过程中起着非常重要的作用。同时,通过深入研究浸出机理,不少研究者将研究热点聚焦于细菌分泌的胞外聚合物。
3.1 直接作用T.f菌浸矿的直接作用是指在浸矿过程中,细菌通过酶促作用吸附在矿物质表面,溶解矿物中部分重金属(如图 1a所示)。在细菌附着矿物的过程中,会产生胞外聚合物(Extracellular Polymeric Substances, EPS),为细菌浸矿提供反应场所。
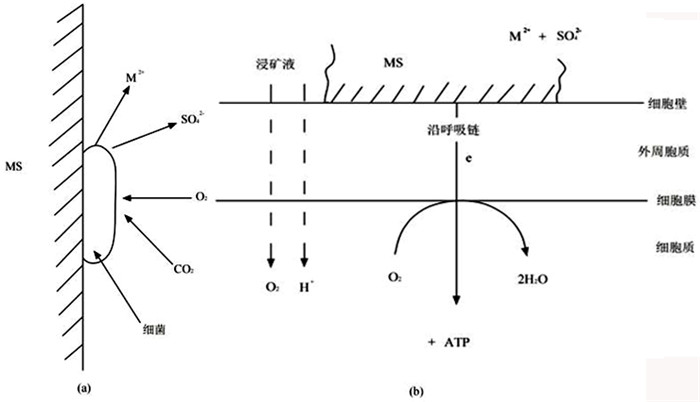 |
| 图 1 T.f菌浸出硫化矿的直接作用示意图(a)和电子传递示意图(b)[22] Fig.1 Schematic diagram of the direct action of Thiobacillus ferrooxidans leaching |
细菌直接作用于硫化矿物时,一方面吸附在矿物表面的细菌接收来自矿物表面的电子,进行呼吸作用,另一方面矿物失去电子而被氧化(如图 1b所示)。细菌浸出黄铁矿的直接作用反应如下[23]:
| $ 2 \mathrm{FeS}_{2}+7 \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O} \stackrel{\text { T.f } f \text { 菌 }}{\longrightarrow} 2 \mathrm{FeSO}_{4}+2 \mathrm{H}_{2} \mathrm{SO}_{4} $ | (2) |
相对于直接作用,间接作用是指在浸矿过程中,细菌和矿物并没有直接接触,而是作为“催化剂”维持反应体系中的酸性环境和氧化剂Fe3+浓度。伍赠玲[24]通过添加黄铁矿测定硫砷铜矿的化学浸出,证明无菌条件下Fe3+可以促进硫砷铜矿的溶解。间接作用机理中,细菌将Fe2+氧化成Fe3+,Fe3+与黄铁矿作用生成Fe2+和S,随后S被T.f菌氧化成硫酸盐,其反应过程如下:
| $ 2 \mathrm{Fe}^{2+}+2 \mathrm{H}+0.5 \mathrm{O}_{2} \stackrel{\text { I.f 囷 }}{\longrightarrow} 2 \mathrm{Fe}^{3+}+\mathrm{H}_{2} \mathrm{O} $ | (3) |
| $ 2 \mathrm{Fe}^{3+}+\mathrm{FeS}_{2} \stackrel{T . f \text { 菌 }}{\longrightarrow} 3 \mathrm{Fe}^{2+}+2 \mathrm{~S} $ | (4) |
| $ 2 \mathrm{~S}+3 \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O} \stackrel{\text { T.f } \text { 菌 }}{\longrightarrow} 2 \mathrm{H}_{2} \mathrm{SO}_{4} $ | (5) |
T.A. FOWLER等[25]认为,在浸矿过程中由于溶液中的Fe2+/Fe3+浓度是变化的,无法在不同条件下判断细菌浸出和化学浸出的差异性。因此,他们通过控制反应溶液的氧化还原电位来使溶液中的Fe2+/Fe3+浓度维持在初始浓度,通过添加T.f菌和无菌试验对闪锌矿的浸出情况进行对比,阐明了该浸出过程细菌浸矿以间接作用为主导,且无直接证据表明细菌浸出的直接作用。
因此T.f菌在生物浸矿过程中是以直接作用为主导还是以间接作用为主导是存在争议的,需要更多试验手段去佐证。并且这种浸出机理的分类不是很确切,没有明确的分割界限,还需要从浸出过程中双氧化系统(铁氧化系统和硫氧化系统)和胞外聚合物的角度去分析浸出机理。
3.3 铁氧化系统该菌在生长过程中通过氧化Fe2+或还原态的硫,从而获得能量来维持其新陈代谢。研究认为,氧化亚铁硫杆菌具有胞外电子传递的能力[26],而其氧化Fe2+的电子传递过程是极其复杂的,目前已经发现了多种参与铁氧化呼吸链过程的功能成分,也有不少学者提出了多种电子传递链假设。如图 2所示,一般认为,电子从Fe2+传递到O2的过程主要包括:Fe2+—亚铁氧化还原酶—铁系兰素—细胞色素C—a1型细胞色素氧化酶—O2;主要包括两个过程:(1)强酸环境下,胞外Fe2+被氧化成Fe3+;(2)胞内的电子传递过程激发二磷酸腺苷(adenosine diphosphate, ADP)转化成腺嘌呤核苷三磷酸(adenosine triphosphate, ATP),细菌获取能量维持代谢,而O2作为最终的电子受体。
其中,周质空间内的亚铁氧化酶和铁系兰素是铁氧化系统中的重要成分。
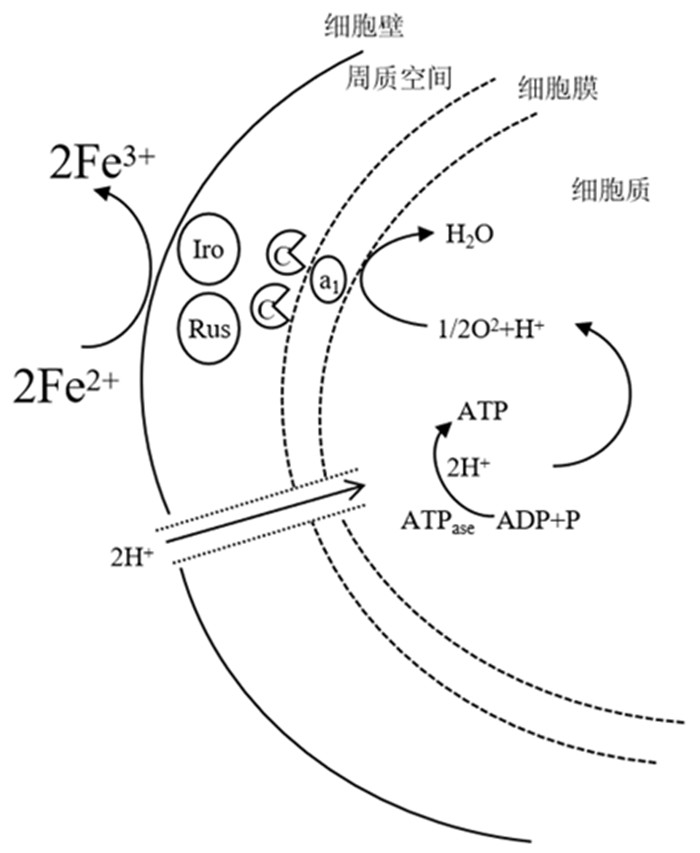 |
| 1—Iro:亚铁氧化酶;2—Rus:铁系兰素;3—C:细胞色素C;4—a1:a1型细胞色素氧化酶 图 2 T.f菌氧化Fe(II)的机理模型图[27-30] Fig.2 Model diagram of Fe(II) oxidation by Thiobacillus ferrooxidans |
3.4 硫氧化系统
氧化亚铁硫杆菌的浸矿过程中,硫代硫酸盐途径和多聚硫酸盐途径是主要的硫氧化过程,存在硫原子被转化成多聚硫S8或者硫代硫酸盐的过程。硫代硫酸盐溶解途径是指细菌浸矿时产生的Fe3+作为初始氧化剂攻击酸不溶性金属硫化物,在此过程中产生的硫代硫酸盐起主要媒介作用,最后通过化学或生物反应生成硫酸盐产物,从而使金属溶解出来[31]。多聚硫化氢溶解途径是指在低pH条件下,酸溶性金属硫化物中的部分硫主要被氧化为元素硫[32],而其中硫代谢过程是通过位于不同细胞区室中的不同硫氧化酶来实现的,包括细胞外膜区域中细胞外元素硫的活化和氧化,硫氧化系统核心的硫代硫酸代谢酶途径以及细胞周质中的硫代谢蛋白[33-34]。
如图 3所示,微生物的硫代硫酸盐途径和多聚硫酸盐途径的初步反应差异是硫代硫酸盐途径生成了硫代硫酸盐,而多聚硫酸盐途径生成了H2Sn+。
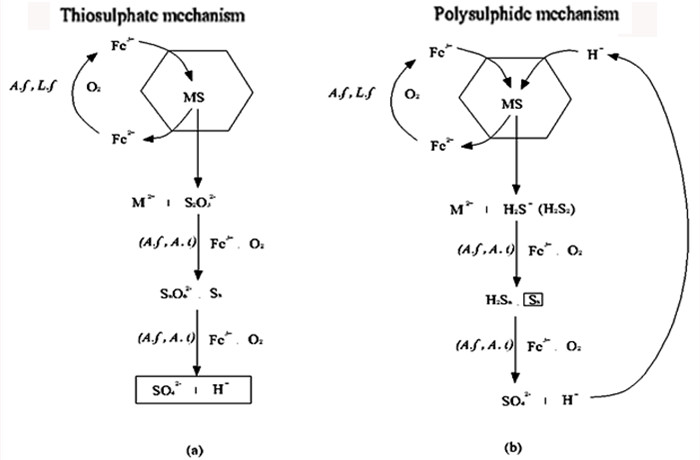 |
| 图 3 基于硫化矿性质的硫代硫酸盐溶解和多聚硫化氢溶解途径示意图[35] Fig.3 Scheme of the two metal sulfide oxidation pathways (mechanisms) via thiosulfate or polysulfides and sulfur based on the properties of metal sulfides (MS) |
此后,基因组学明确了硫氧化系统的过程中起关键作用的酶。例如,类异二硫还原酶(the heterodisulfifide reductase,Hdr)的功能是将二硫化物中间体氧化为亚硫酸盐并在细胞质中产生电子[36];DsrE3A和TusA蛋白是胞质硫转运的核心成分,能与S4O62-反应,将硫化物转运至Hdr硫氧化系统[37];而doxDA基因簇参与硫代硫酸盐氧化途径[34]。
目前关于双氧化系统的研究多专注于一个氧化系统去解释浸出机理,但是双氧化系统之间应该存在一定的联系,需要有更多学者将两者联系起来研究,从而更加全面地了解浸出机理。
3.5 胞外聚合物直接作用机理中,细菌产生的EPS一方面使细菌吸附在矿物上,另一方面为溶解矿物提供反应场所,因此EPS是浸出机理中值得深入研究的领域。EPS是微生物在生长过程中产生的代谢产物,化学成分主要包括蛋白质、糖类和脂类等,其中蛋白质和多糖占EPS的30%~50%[38-39];其相对分子量分布范围为1×104~3×104[40]。细菌细胞在表面逐渐累积EPS,形成胞外聚合物层,通过黏着性的糖类成分在细菌表面附着并增厚,同时使细菌黏附于矿石表面[41]。而EPS空间结构一般分为固着性EPS和溶解性EPS[42]。
EPS的化学成分随其底物而异,并且附着也随底物而异。Ramírez等人[43]利用氧化亚铁硫杆菌分别以金属硫化物、硫代硫酸盐、元素硫或亚铁离子为能源物质,发现细菌总蛋白表达会出现差异。另外,Arevik Vardanyan等人[44]分别以可溶态的亚铁离子和黄铁矿颗粒为底物培养筛选出的嗜酸菌,研究结果显示,在亚铁培养基里培养的氧化亚铁硫杆菌产生的溶解性EPS量大于固着性EPS量,反之,以黄铁矿颗粒为底物的细菌产生的固着性EPS较多,且在含Fe2+中培养的氧化亚铁硫杆菌会产生糖醛酸。此外,能源物质的含量也会影响氧化亚铁硫杆菌产生的EPS含量,Albert Saavedra等人[45]通过共聚焦激光扫描显微镜(CLSM)来对高浓度培养的AT.f菌产生的EPS进行可视化和定量分析,试验结果显示,适应较高总铁浓度的细胞在其表面上显示出最大量的EPS积累。
EPS在浸矿过程中起着重要作用。有研究表明[46],EPS的增加可以提高菌株的生物侵蚀能力,并提高生物浸出效率。同时,直接作用理论认为,硫矿物浸出的过程中主要是细菌介导Fe3+的还原,从而氧化硫化物矿物:
| $ \mathrm{MS}+2 \mathrm{Fe}^{3+} \rightarrow \mathrm{M}^{2+}+\mathrm{S}^{0}+2 \mathrm{Fe}^{2+} $ | (6) |
综上所述,胞外聚合物的作用一般是:(1)络合Fe3+、氧化矿物[45]和重金属[47]。K Harneit等人[48]的研究表明,在含有Fe2+和黄铁矿的基质中生长的细菌产生的EPS中可以检测到Fe3+,而在含硫磺的基质中生长的体系中检测不到络合Fe3+的EPS。(2)介导细胞与矿物质的附着。EPS的主要成分大多是具有多种极性和非极性的官能团和表面积较大的大分子物质,如羧基、羟基等活性基团,而多糖类物质对EPS的吸附作用贡献较大[49],最初的吸附作用发生在矿物表面凹陷处[50]。(3)改变矿物表面的亲疏水性,一定程度上可以加快矿物在水溶液中的溶解[51]。EPS中亲水性基团和疏水性基团的存在使其具有两性特征,其主要成分多糖类如甘露糖、鼠李糖、糖醛酸等物质主要带有羟基、羧基和醛基等亲水性基团[52],而蛋白质由于含有半胱氨酸、异亮氨酸、丙氨酸、色氨酸等氨基酸呈现疏水性强的特点[53],试验表明[54],活性污泥EPS的亲水组分含量大于疏水性组分的含量。(4)介导生物浸出过程中矿物质表面发生的电化学反应。由于EPS的组成结构总体呈电负性[55],因此细胞表面呈电负性的EPS会降低其表面电荷密度,从而增加表面电势,较高氧化还原电位有利于矿物的生物浸出[56]。
以上可以看出,EPS在浸出过程是起重要且积极作用的。那么如何诱导细菌产生更多EPS从而促进浸出,这有待研究者深入研究。
4 影响T.f菌浸矿的因素及其在不同矿产中的应用 4.1 影响T.f菌浸矿的因素生物浸出技术在矿产资源利用中应用的受限因素较多。D.W等人[57]研究结果显示,在不添加表面活性剂的试验中,33 d内摇瓶试验铜的浸出率比固定瓶试验高35%;而添加了表面活性剂Tween 20的摇瓶试验中,铜的浸出量是对照组的三倍。表明表面活性剂可以增加细菌与矿物表面的接触,而振荡则是为反应提供了必要的O2。Fe2+浓度也是浸矿过程的重要因素。传统的9K培养基中Fe2+质量浓度为44.2 g/L,而不同学者研究的铁离子浓度不尽相同,从9 g/L到60 g/L不等[58-61]。因此有必要对生物浸出过程中的影响因素归纳总结,从而减少生物浸出的时间和经济成本。影响氧化亚铁硫杆菌浸出过程的因素主要有温度、pH、矿物粒度和晶体结构等。
4.1.1 温度温度影响微生物生长和代谢活动,是微生物浸矿过程中的重要影响因素。邓蓉等人[62]设计的温度梯度试验结果表明,当试验温度在25~30 ℃,氧化亚铁硫杆菌的ATP酶活性与温度呈正相关;当温度高于30 ℃,细菌体内的蛋白质活性会降低,阻止体ATP酶的基因表达,从而降低ATP酶的活力,抑制微生物的生长与代谢。但是在实际生产过程中,浸出环节的温度高达40~50 ℃,因此高温细菌的筛选和培育应成为研究重点。
4.1.2 pHpH在浸矿体系中影响细菌生成及矿物表面细菌胞外分泌物的吸附,对细菌浸矿的影响较大。金吉梅[63]利用氧化亚铁硫杆菌浸出氧化铜矿,发现pH=1、2、3时铜浸出率分别为40%、55%和60%,即pH=3时铜浸出效果最好。
4.1.3 矿物粒度矿物粒度也是影响细菌浸矿过程的因素之一。李靓洁等人[64]在研究氧化亚铁硫杆菌浸出黄铜矿的影响因素时发现,矿物粒度对细菌浸出重金属的浸出率影响较小,因为在为期144 d的浸出试验中,添加104 μm的矿石和添加74 μm的矿石的浸出率相差较小。因此在考虑工艺成本的前提下,并不是矿物粒度越小越好。
4.1.4 晶体结构晶体结构是决定不同矿物细菌浸出效率差异的关键因素。Pécou E[65]认为,影响浸矿速率的决定因素是矿物本身的性质。诸多研究表明,黄铜矿的晶型、晶格结构和晶格能等晶体性质是影响其细菌浸出的因素[66-67]。
4.2 T.f菌在不同矿产中的应用氧化亚铁硫杆菌作为一种微生物浸矿的模式细菌,被运用于不同种类矿物的浸出中,如铜矿、金矿等(见表 1)。
| 表 1 T.f菌在各类金属硫化矿浸出中的应用进展 Table 1 Research progress on Thiobacillus ferrooxidans of leaching of metal sulfide ores |

|
关于T.f菌浸出矿的研究内容包含:(1)浸出工艺参数的调整。如pH、温度、矿浆浓度等,以获得最佳浸出效率。(2)浸出机理的研究。通过化学浸出与生物浸出的对比,验证直接/间接作用;或是通过不同方法提取EPS并检测其性质,通过表征手段佐证EPS在浸矿过程中的作用;随着科学手段的不断更新,研究者也致力于在分子层面上为研究T.f菌浸出机理提供一定的理论依据,如通过检测相关基因的表达量变化。但是在此过程中仍存在一些待解决的科学问题:实际工业生产中浸出温度高达40~50 ℃,而试验研究的T.f菌适应温度最佳在30 ℃,因此耐高温和高毒性因子适应的T.f菌培育应成为未来研究的主要方向。此外,EPS在T.f菌浸出过程中的作用和影响应进一步明确。最后,目前关于T.f菌浸出的研究多集中于金矿、铜矿,少数关注其他矿如钼镍矿、铀矿和铊矿等,但中国是世界上锑矿资源最丰富的国家,矿山开采和金属冶炼是我国锑资源的重要来源,利用微生物浸出技术解决锑矿尾矿资源化问题也是今后应该关注的。
5 结语(1) 大量的研究工作中,由于在溶液中很难保持相同的浸出条件,故在比较有菌和无菌浸出硫化矿过程中的速率影响时很难得到满意结果。因此尽管关于T.f菌浸出硫化矿有大量的研究与讨论,但对于细菌浸出过程是通过直接作用还是通过间接作用尚无定论。
(2) 目前关于微生物浸矿的研究并不单一聚焦于“直接作用”或是“间接作用”,而关于双氧化系统中的铁氧化系统的研究较为系统、完整,但是硫氧化系统由于其复杂性和检测手段的局限性,这方面的研究还有待深入。
(3) EPS在浸提过程中起着重要且积极作用。那么如何诱导细菌产生更多EPS从而促进浸出将会是未来的研究热点。同时,T.f菌不同时期浸出不同硫化矿产生的EPS可能有所不同,这方面的研究有待补充,从而使浸出机理的研究更加完善。
(4) T.f菌浸出不同金属硫化矿的机理和生长动力学模型不尽相同,未来可以在已有研究基础上,对细菌浸出铊矿、锑矿等进行深一步研究。
| [1] |
栾和林, 姚文, 吴萌. 湿法冶金中的一些污染新问题的探讨[J]. 矿冶, 2002, 11(z1): 281-282. DOI:10.3969/j.issn.1005-7854.2002.z1.075 |
| [2] |
姜金龙, 戴剑峰, 冯旺军, 等. 火法和湿法生产电解铜过程的生命周期评价研究[J]. 兰州理工大学学报, 2006(1): 19-21. DOI:10.3969/j.issn.1673-5196.2006.01.005 |
| [3] |
周姗, 栗树珍, 钟慧, 等. 冶金模式微生物Acidithiobacillus ferrooxidans表面质子吸附特性的研究[J]. 矿产保护与利用, 2020, 40(4): 1-8. |
| [4] |
SAND W, GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(1): 49-56. DOI:10.1016/j.resmic.2005.07.012 |
| [5] |
R.E. 布坎南, N.E. 吉本斯. 伯杰细菌鉴定手册(中文第八版)[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组. 北京: 科学出版社, 1984.
|
| [6] |
庄贺, 沈俊剑, 黎俊, 等. 氧化亚铁硫杆菌的分离鉴定及培养条件优化[J]. 微生物学通报, 2013, 40(7): 1131-1137. |
| [7] |
高健, 彭宏, 李邦梅, 等. 两株不同铁氧化细菌合成的沉淀差异性分析[J]. 中国有色金属学报, 2007(3): 453-458. DOI:10.3321/j.issn:1004-0609.2007.03.018 |
| [8] |
王艳锦, 郑正, 周培国, 等. 不同培养基中氧化亚铁硫杆菌生长及沉淀研究[J]. 生物技术, 2006, 16(4): 70-73. DOI:10.3969/j.issn.1004-311X.2006.04.028 |
| [9] |
JENSEN A B, WEBB C. Ferrous sulphate oxidation using thiobacillus ferrooxidans: a review[J]. Process Biochemistry, 1995, 30(3): 225-236. DOI:10.1016/0032-9592(95)85003-1 |
| [10] |
宋永伟, 王蕊, 杨琳琳, 等. 三种次生矿物固定A.ferrooxidans的Fe2+氧化及成矿性能比较[J]. 中国环境科学, 2020, 40(5): 2073-2080. DOI:10.3969/j.issn.1000-6923.2020.05.025 |
| [11] |
田祖源, 李浩东, 魏茜, 等. Cu2+、Fe2+和Fe3+对中等嗜热混合菌浸出黄铜矿的影响[J]. 中国有色金属学报, 2021, 31(1): 171-180. |
| [12] |
邓明强, 白静, 白建峰, 等. 影响嗜酸氧化亚铁硫杆菌生长及生物浸出效率的研究进展[J]. 湿法冶金, 2016, 35(3): 171-175. |
| [13] |
RAWLINGS D E, KUSANO T. Molecular genetics of Thiobacillus ferrooxidans[J]. Microbiological Reviews, 1994, 58(1): 39-55. DOI:10.1128/mr.58.1.39-55.1994 |
| [14] |
LIU M, BRANION R, DUNCAN D W. The effects of ferrous iron, dissolved oxygen, and inert solids concentrations on the growth of thiobacillus ferrooxidans[J]. The Canadian Journal of Chemical Engineering, 1988, 66(3): 445-451. DOI:10.1002/cjce.5450660315 |
| [15] |
李先艳. 高性能氧化亚铁硫杆菌菌株的诱变与培育[D]. 西安: 西安工程大学, 2019.
|
| [16] |
陶语若. 抑制氧化亚铁硫杆菌作用下沉淀生成的研究[J]. 广州化工, 2012, 40(9): 111-113. DOI:10.3969/j.issn.1001-9677.2012.09.039 |
| [17] |
TUOVINEN O H, NIEMELA S I, GYLLENBERG H G. Effect of mineral nutrients and organic substances on the development of Thiobacillus ferrooxidans[J]. Biotechnology and Bioengineering, 2010, 13(4): 517-527. |
| [18] |
刘欣伟, 冯雅丽, 李浩然, 等. 镁离子浓度对氧化亚铁硫杆菌生长动力学的影响[J]. 中国有色金属学报, 2012, 22(8): 2353-2359. |
| [19] |
GOMEZ J M, GARO I. Kinetic equation for growth of Thiobacillus ferrooxidans in submerged culture over aqueous ferrous sulphate solutions[J]. Journal of Biotechnology, 1996, 48(1-2): 147-152. DOI:10.1016/0168-1656(96)01504-0 |
| [20] |
BOON M, RAS C, HEIJNEN J J. The ferrous iron oxidation kinetics of Thiobacillus ferrooxidans in batch cultures[J]. Applied Microbiology and Biotechnology, 1999, 51(6): 813-819. DOI:10.1007/s002530051467 |
| [21] |
SHI J, WANG D S, ZOU K Y. Domestication and Kinetics Parameters of Thiobacillus Ferrooxidans in High Concentration of Uranium[J]. Journal of Nantong University(Natural Science Edition), 2014, 13(3): 24-27. |
| [22] |
HUANG T, LI D W. Presentation on mechanisms and applications of chalcopyrite and pyrite bioleaching in biohydrometallurgy-a presentation[J]. Biotechnology Reports, 2014, 4(1): 107-119. |
| [23] |
NT A, RSS B, CDH A. Microbial removal of sulphur from petroleum coke (petcoke)[J]. Fuel, 2019, 235: 1501-1505. DOI:10.1016/j.fuel.2018.08.072 |
| [24] |
伍赠玲. 黄铁矿对硫砷铜矿化学浸出的促进作用[J]. 中国有色金属学报, 2018, 28(11): 2376-2382. |
| [25] |
FOWLER T A, CRUNDWELL F K. Leaching of zinc sulfide by Thiobacillus ferrooxidans: experiments with a controlled redox potential indicate no direct bacterial mechanism[J]. Applied and Environmental Microbiology, 1998, 64(10): 3570-3575. DOI:10.1128/AEM.64.10.3570-3575.1998 |
| [26] |
梁方圆, 吴冉冉, 曹昌丽, 等. 氧化亚铁硫杆菌的胞外电子传递研究[J]. 高等学校化学学报, 2014, 35(2): 372-376. |
| [27] |
何正国, 李雅芹, 周培瑾. 氧化亚铁硫杆菌的铁和硫氧化系统及其分子遗传学[J]. 微生物学报, 2000(5): 563-566. DOI:10.3321/j.issn:0001-6209.2000.05.021 |
| [28] |
田克立, 林建群, 张长铠, 等. 氧化亚铁硫杆菌铁氧化系统分子生物学研究进展[J]. 微生物学通报, 2002, 29(1): 85-88. DOI:10.3969/j.issn.0253-2654.2002.01.021 |
| [29] |
武华平. 氧化亚铁硫杆菌及其在环境工程中的应用[J]. 广东工业大学学报, 2005, 22(4): 18-21. DOI:10.3969/j.issn.1007-7162.2005.04.005 |
| [30] |
VERA M, SCHIPPERS A, SAND W. Progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation—part A[J]. Applied microbiology and biotechnology, 2013, 97(17): 7529-7541. DOI:10.1007/s00253-013-4954-2 |
| [31] |
LI Y, KAWASHIMA N, LI J, et al. A review of the structure, and fundamental mechanisms and kinetics of the leaching of chalcopyrite[J]. Adv Colloid Interface, 2013, 197/198: 1-32. |
| [32] |
NARULA N, REINICKE M, HAFERBURG G, et al. Plant-microbe interaction in heavy-metal-contaminated soils[C] // Kothe E, Varma A. Bio-geo interactions in heavy metal-contaminated soils. Springer, Heidelberg, 2012: 143-162.
|
| [33] |
QUATRINI R, APPIA-AYME C, DENIS Y, et al. Insights into the iron and sulfur energetic metabolism of Acidithiobacillus ferrooxidans by microarray transcriptome profiling[J]. Hydrometallurgy, 2006, 83(1/2/3/4): 263-272. |
| [34] |
WANG R, LIN J, LIU X, et al. Sulfur oxidation in the acidophilic autotrophic acidithiobacillus spp[J]. Frontiers in Microbiology, 2019(9): 3290. |
| [35] |
TAO H, LI D. Presentation on mechanisms and applications of chalcopyrite and pyrite bioleaching in biohydrometallurgy a presentation[J]. Biotechnology Reports, 2014, 4(1): 107-119. |
| [36] |
WAGNER T, KOCH J, ERMLER U, et al. Methanogenic heterodisulfide reductase (HdrABC-MvhAGD) uses two noncubane[4Fe-4S] clusters for reduction[J]. Science, 2017, 357(6352): 699-703. DOI:10.1126/science.aan0425 |
| [37] |
LIU L, STOCKDREHER Y, KOCH T, et al. Thiosulfate transfer mediated by DsrE/TusA homologs from acidothermophilic sulfur-oxidizing archaeon metallosphaera cuprina[J]. Journal of Biological Chemistry, 2014, 289(39): 26949-26959. DOI:10.1074/jbc.M114.591669 |
| [38] |
HOUGHTON J I, STEPHENSON T. Effect of influent organic content on digested sludge extracellular polymer content and dewaterability[J]. Water Research, 2002, 36(14): 3620-3628. DOI:10.1016/S0043-1354(02)00055-6 |
| [39] |
HC A, JIA W B, BT A, et al. Generation behavior of extracellular polymeric substances and its correlation with extraction efficiency of valuable metals and change of process parameters during bioleaching of spent petroleum catalyst[J]. Chemosphere, 2021, 275: 130006. DOI:10.1016/j.chemosphere.2021.130006 |
| [40] |
皋德祥, 邓欢欢, 张明华, 等. 微生物胞外聚合物的研究进展[J]. 温州医学院学报, 2012, 42(3): 297-301. DOI:10.3969/j.issn.1000-2138.2012.03.030 |
| [41] |
YI Q, WU S, SOUTHAM G, et al. Acidophilic iron- and sulfur-oxidizing bacteria, acidithiobacillus ferrooxidans, drives alkaline pH neutralization and mineral weathering in Fe ore Tailings[J]. Environmental science & technology, 2021, 55: 8020-8034. |
| [42] |
余志波, 刘亚洁, 吴静琳, 等. 生物浸矿过程中细菌胞外聚合物的作用研究进展[J]. 有色金属(冶炼部分), 2016(2): 1-6. DOI:10.3969/j.issn.1007-7545.2016.02.001 |
| [43] |
RAMÍREZ P, GUILIANI N, VALENZUELA L, et al. Differential protein expression during growth of acidithiobacillus ferrooxidans on ferrous iron, sulfur compounds, or metal sulfides[J]. Applied & Environmental Microbiology, 2004, 70(8): 4491-4498. |
| [44] |
VARDANYAN A, VARDANYAN N, KHACHATRYAN A, et al. Adhesion to mineral surfaces by cells of leptospirillum, acidithiobacillus and sulfobacillus from armenian sulfide ores[J]. Minerals, 2019, 9(2): 69. DOI:10.3390/min9020069 |
| [45] |
SAAVEDRA A, AGUIRRE P, GENTINA J C. Climbing the hill: The implications of a two-step adaptation on biooxidation of ferrous ion at high total iron concentrations by At. ferrooxidans[J]. Hydrometallurgy, 2020, 197: 105486. DOI:10.1016/j.hydromet.2020.105486 |
| [46] |
GAO X, LIU X, FU C, et al. Novel Strategy for Improvement of the Bioleaching Efficiency of Acidithiobacillus ferrooxidans Based on the AfeI/R Quorum Sensing System[J]. Minerals, 2020, 10(3): 222. DOI:10.3390/min10030222 |
| [47] |
ZENG W, LI F, WU C, et al. Role of extracellular polymeric substance (EPS) in toxicity response of soil bacteria Bacillus sp. S3 to multiple heavy metals[J]. Bioprocess and Biosystems Engineering, 2020, 43(1): 153-167. DOI:10.1007/s00449-019-02213-7 |
| [48] |
HARNEIT K, GÖKSEL A, KOCK D, et al. Adhesion to metal sulfide surfaces by cells of Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans and Leptospirillum ferrooxidans[J]. Hydrometallurgy, 2006, 83(1/2/3/4): 245-254. |
| [49] |
郑蕾, 丁爱中, 王金生, 等. 不同组成活性污泥胞外聚合物吸附Cd2+, Zn2+特征[J]. 环境科学, 2008, 29(10): 2850-2855. DOI:10.3321/j.issn:0250-3301.2008.10.029 |
| [50] |
杨洪英, 王胜利, 佟琳琳, 等. 微生物胞外聚合物在浸矿过程中作用的研究进展[J]. 有色金属, 2010, 62(3): 103-105. DOI:10.3969/j.issn.2095-1744.2010.03.024 |
| [51] |
YUAN X, YUAN C, GONG W, et al. The depression of pyrite flotation by thibacillus ferrooxidans[J]. Journal of Wuhan University of Technology(Materials ence Edition), 2000, 15(1): 60-65. |
| [52] |
PIROG T P, KORZHB Y V, SHEVCHUKB T A. The effect of cultivation conditions on the physicochemical properties of the exopolysaccharide ethapolan[J], 2009, 45(1): 50-55.
|
| [53] |
DIGNAC M F, URBAIN V, RYBACKI D, et al. Chemical description of extracellular polymers: implication on activated sludge floc structure[J]. Water Science and Technology, 1998, 38(8/9): 45-53. |
| [54] |
袁冬琴, 王毅力. 活性污泥胞外聚合物(EPS)的分层组分及其理化性质的变化特征研究[J]. 环境科学, 2012, 33(10): 3522-3528. |
| [55] |
王利, 温建康. 嗜酸氧化亚铁硫杆菌胞外聚合物浸矿作用研究[J]. 金属矿山, 2011, 40(7): 86-89. |
| [56] |
虞艳云. 胞外聚合物在含铁矿物同微生物界面过程中的作用研究[D]. 合肥: 合肥工业大学, 2014.
|
| [57] |
DUNCAN D W, TRUSSELL P C, WALDEN C C. Leaching of Chalcopyrite with Thiobacillus ferrooxidans: Effect of Surfactants and Shaking[J]. Applied Microbiology, 1964, 12(2): 122-126. DOI:10.1128/am.12.2.122-126.1964 |
| [58] |
王超远. 氧化亚铁硫杆菌浸出硫化铜矿试验研究[D]包头: 内蒙古科技大学, 2020.
|
| [59] |
GUO Y, HUANG P, ZHANG W, et al. Leaching of heavy metals from Dexing copper mine tailings pond[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(10): 3068-3075. DOI:10.1016/S1003-6326(13)62835-6 |
| [60] |
LIZAMA H M, SUZUKI I. Rate equations and kinetic parameters of the reactions involved in pyrite oxidation by thiobacillus ferrooxidans[J]. Applied & Environmental Microbiology, 1989, 55(11): 2918-2923. |
| [61] |
LIZAMA H M, SUZUKI I. Bacterial leaching of a sulfide ore by Thiobacillus ferrooxidans and Thiobacillus thiooxidans part Ⅱ: Column leaching studies[J]. Hydrometallurgy, 1989, 33(3): 301-310. |
| [62] |
邓蓉, 张小云, 张梦雪, 等. 嗜酸氧化亚铁硫杆菌培养及其影响因素[J]. 湘潭大学自然科学学报, 2014(4): 67-71. DOI:10.3969/j.issn.1000-5900.2014.04.013 |
| [63] |
金吉梅. 微生物强化浸出氧化铜矿的试验研究[D]. 赣州: 江西理工大学, 2010.
|
| [64] |
李靓洁, 董发勤, 谌书, 等. 氧化亚铁硫杆菌浸取黄铜矿石影响因素的试验研究[J]. 矿物学报, 2012, 32(3): 449-454. |
| [65] |
PÉCOU E, MAASS A, REMENIK D, et al. A mathematical model for copper homeostasis in Enterococcus hirae[J]. Mathematical Biosciences, 2006, 203(2): 222-239. DOI:10.1016/j.mbs.2006.04.009 |
| [66] |
马骏, 汪菊香, 武彪, 等. 晶体结构对黄铜矿、黄铁矿生物浸出差异性影响[J]. 中国有色金属学报, 2015, 25(10): 2898-2904. |
| [67] |
NIE Z, ZHANG W, LIU H, et al. Bioleaching of chalcopyrite with different crystal phases by Acidianus manzaensis[J]. Transactions of Nonferrous Metals Society of China, 2019, 29(3): 617-624. DOI:10.1016/S1003-6326(19)64971-X |
| [68] |
刘新艳, 刘丹丹, 张鸣昕. 提高金矿生物氧化细菌耐温性能试验研究[J]. 有色金属(选矿部分), 2015(5): 48-51. DOI:10.3969/j.issn.1671-9492.2015.05.011 |
| [69] |
董颖博, 林海, 陆琳斐, 等. 浮选药剂对嗜酸氧化亚铁硫杆菌活性的影响[J]. 化工学报, 2011(6): 1662-1668. DOI:10.3969/j.issn.0438-1157.2011.06.028 |
| [70] |
D·内斯托, 向平, 肖力子. 用氧化亚铁硫杆菌生物浸出难处理金矿物的机理[J]. 国外金属矿选矿, 2001, 38(11): 11-14+10. |
| [71] |
剡倩, 张苗苗, 郭晓鹏, 等. X射线诱变选育嗜酸氧化亚铁硫杆菌及其对难处理金矿浸出的研究[J]. 辐射研究与辐射工艺学报, 2016, 34(5): 40-46. |
| [72] |
苏贵珍, 陆建军, 陆现彩, 等. 微生物-矿物接触作用对金属硫化物溶解的影响—氧化亚铁硫杆菌参与黄铜矿溶解的初步研究[J]. 地学前缘, 2008, 15(6): 100-106. DOI:10.3321/j.issn:1005-2321.2008.06.013 |
| [73] |
项拥军. 氧化亚铁硫杆菌对黄铜矿的氧化作用[J]. 金属矿山, 2000, 10(10): 24-24. DOI:10.3321/j.issn:1001-1250.2000.10.010 |
| [74] |
余润兰, 刘晶, 陈安, 等. 嗜酸氧化亚铁硫杆菌(ATCC 23270)浸出黄铜矿过程中的EPS、Cu2+和Fe3+的相互作用机制(英文)[J]. 中国有色金属学报: 英文版, 2013(1): 231-236. |
| [75] |
薛洪其. 氧化亚铁硫杆菌对钼镍尾矿金属的浸出作用及其机理探讨[D]. 贵州: 贵州大学, 2017.
|
| [76] |
黎丹丹. 氧化亚铁硫杆菌和氧化硫硫杆菌联合浸出铊矿尾矿及浸出液毒性评价[D]. 贵州: 贵州大学.
|
| [77] |
张青青, 杨爱江, 姚维, 等. 硫氧化细菌对锑矿尾矿重金属浸出研究[J]. 环境科学与技术, 2014(5): 26-30. |
| [78] |
张旭, 冯雅丽, 张小伟. 黄铁矿-微生物体系还原浸出低品位氧化锰矿工艺过程研究[J]. 矿冶工程, 2018, 38(5): 106-108+112. |
| [79] |
刘晓燕. 用于软锰矿脱硫的铁、锰氧化细菌的诱变育种及其对Fe、Mn的氧化动力学研究[D]. 成都: 四川大学, 2005.
|
| [80] |
李志章, 徐晓军. 氧化亚铁硫杆菌对低品位锰矿浸出的试验研究[J]. 金属矿山, 2006(11): 50-53. DOI:10.3321/j.issn:1001-1250.2006.11.014 |
 2021
2021



