| 硅藻蛋白石基先进材料的构建和应用研究进展 |
2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
硅藻(Diatom)是一类在各种水体中广泛分布的硅质微生物,其单体尺寸较小,一般只有十几到几十微米[1]。目前,已鉴定出超过10万种硅藻,每种硅藻都有独特的三维壳体形状(如圆盘状、筒状和羽纹状等,见图 1),根据硅藻壳体形状可将其分为中心硅藻纲和羽纹硅藻纲[2]。硅藻细胞的形态虽然千差万别,但具有共性特征。就其自身而言,细胞主体结构都是由上、下两个半壳套合而成(套在外部的称为上壳,内部的称为下壳),形成类培养皿结构[3]。硅藻通过简单的自组装过程生成复杂的三维多孔硅藻壳(硅藻细胞壁),且受遗传基因的控制,硅藻壳体具有很高的可重复性和数十纳米的精度[4]。因此,硅藻被称为“纳米工厂”。作为地球上最“成功”的光合微生物,硅藻通过光合作用吸收二氧化碳的量约占地球生态系统的五分之一,因此,硅藻生物硅的归趋对于理解全球硅、碳等元素循环具有极为重要的意义[5]。
 |
| 图 1 硅藻壳体多样化的形貌(标尺10 μm)[6] Fig.1 Various shapes and 3D structures of diatoms (scale bar 10 μm) |
硅藻壳体的主要成分是硅藻蛋白石,其由含水的无定形二氧化硅小球以最紧密形式堆积形成,在矿物学上属于A型蛋白石(Opal-A)[2, 7]。以硅藻蛋白石为主要成分的非金属矿在工业上被称为硅藻土(diatomite),其是由远古时期硅藻生物的遗骸(硅藻壳体)沉积形成的生物沉积岩[7]。硅藻蛋白石具有独特的多级孔结构,因而具有质轻、比表面积大、孔隙率高、吸附能力强、隔音和隔热效果好等特点,其作为助滤剂、吸附剂和载体等广泛应用于化工、石油、建材等工业领域[8]。此外,硅藻蛋白石还具有独特的力学、光学、光激发性能和好的生物相容性。本研究组的最新研究表明[7],硅藻土矿中的硅藻蛋白石其表面还往往具有富铝铁质的薄膜,赋予了其多样的表面性质(图 2)。基于此,硅藻蛋白石在多种高性能材料开发领域具有广阔的前景。例如,Losic[9]曾提出“硅藻纳米技术(Diatom nanotechnology)”这一术语,用于描述与基于硅藻蛋白石先进材料的开发和应用研究相关的学科领域,其涵盖了分子生物学、材料学、生物技术、纳米技术以及光电学等多种潜在领域。
 |
| 图 2 硅藻蛋白石表面的富铝铁质薄膜[7] Fig.2 Morphology and elemental distribution of diatomaceous opal |
近二十年来,人们在硅藻蛋白石基先进材料领域陆续取得了一些重要的研究进展。本文着重介绍了硅藻蛋白石基先进材料在环境污染治理、纳米能源(锂离子电池、超级电容器、太阳能电池、储氢和储热材料等)和生物医药(药物传输和缓释、生物组织工程、凝血剂和生物传感)等相关领域中的新进展,特别是对各类先进材料的应用机理和局限性进行了总结和讨论。我国是硅藻土资源大国,因此,尽管上述某些领域仍处于发展阶段、有些应用甚至尚处于起步期,但相关探索是将我国硅藻土资源优势转化为技术优势进而取得高附加值的基础。我们期望,通过硅藻土-硅藻纳米技术以及硅藻蛋白石先进材料研究的快速发展,我国在硅藻土和硅藻蛋白石资源利用领域能够早日在国际上取得领先优势。
1 环境功能材料目前,环境污染已成为可持续发展和生态文明建设面临的重要难题。其中,水体重金属离子污染尤为突出[10]。大多数重金属离子具有毒性和致癌风险,且难以降解,对生态环境和人类健康造成严重威胁[11, 12]。硅藻蛋白石由于其三维多孔结构、高渗透性、低密度、高比表面积和大量的活性硅醇基团(Si—OH),在环境修复应用中被认为是良好的生态环境功能材料。
通常,硅藻蛋白石与重金属离子之间的相互作用发生在硅藻蛋白石-水界面上。硅藻蛋白石的吸附能力与其羟基产生的净负电荷密切相关。硅藻蛋白石的表面和孔隙中含有大量的羟基(如孤立羟基、氢键缔合羟基)和吸附水。Si—OH在水溶液中会发生离子化,根据pH值的变化而捕获或失去H+[10]。当pH值低于零电荷点(pH=2.0~3.0)时,由于-OH获得质子(式1),硅藻蛋白石带正电。反之,硅藻蛋白石表面失去质子而带负电(式2)。因此,在低pH值条件下,金属阳离子与H+在硅藻蛋白石表面的竞争吸附占主导作用,其主要机理是重金属阳离子在硅藻蛋白石表面的静电吸附及其与H+的交换作用。在高pH条件下,水解和沉淀作用主导着重金属离子的去除。然而,天然硅藻蛋白石表面羟基的负电荷有限,对重金属离子的吸附效率并不高。为了克服这一问题,有必要对其进行表面改性以从水中去除多样化的重金属离子。硅藻蛋白石常见的改性方法有酸热活化、无机和有机功能化。
| $ {\rm ≡Si-OH+H^+→≡Si-OH^+_2} $ | (1) |
| $ {\rm ≡Si-OH+H^-→≡Si-OH^-+H_2O} $ | (2) |
天然硅藻蛋白石的吸附活性位点来源于其表面羟基,包括孤立羟基、氢键缔合羟基以及吸附水(自由吸附水和氢键键合水)。然而,这些羟基的暴露程度受吸附水的制约。Yuan等[13]发现热处理有助于提高硅藻蛋白石表面羟基的反应活性。只有在水基本脱附后孤立羟基和氢键缔合羟基暴露量达到最高,相应的热处理温度高达约1 000 ℃左右,此时硅藻蛋白石表面才达到比较充分的活化,有利于基于羟基的界面作用的发生。此外,酸活化也能够有效提高硅藻蛋白石的吸附能力[14, 15]。酸活化后,硅藻蛋白石的形貌不变,但微孔数量和比表面积都会增加。酸热活化可通过除去吸附的水分子和碳酸盐杂质来增加硅藻蛋白石的微孔数量、比表面积和表面羟基,进而提高硅藻蛋白石对阳离子的吸附能力。然而,目前对于硅藻蛋白石的羟基数量、比表面积和孔分布对其重金属离子吸附性能的影响机制仍然缺乏研究。
1.2 无机功能化为了增加硅藻蛋白石的吸附活性位点,一些研究人员在硅藻蛋白石表面负载纳米金属氧化物,如锰氧化物[16-19]。Al-Degs等[16, 20]采用沉淀氧化法将锰氧化物负载到硅藻蛋白石的表面上,改性后硅藻蛋白石的比表面积增加了2.4倍,对Pb2+、Cu2+、Cd2+的吸附容量分别达到了99、51、26 mg/g(未改性硅藻蛋白石的吸附容量分别为24、21、16 mg/g)。Caliskan等[17]采用相同方法改性硅藻蛋白石以去除水中Zn2+,也获得了相似的发现。锰氧化物改性提高了硅藻蛋白石对重金属离子的吸附能力,其主要原因是:(1)改性硅藻蛋白石比表面积的增加;(2)改性硅藻蛋白石的负电荷比天然硅藻蛋白石高。Li等[19]认为Pb2+还可以与硅藻蛋白石表面的羟基发生H+交换而被吸附(式3和4)。
| $ {\rm -Mn-OH+Pb^{2+}→-Mn-O-Pb+H^{+}} $ | (3) |
| $ {\rm -Mn-OH+Pb^{2+}→(-Mn-O)_{2}-Pb+2H^{+}} $ | (4) |
锰氧化物改性不仅可以提高硅藻蛋白石对重金属阳离子的吸附能力,还能提升对重金属阴离子团的去除效果。此外,还可以通过调控锰氧化物的形貌进一步提高改性硅藻蛋白石的吸附效果,如花形、线形和片状等[21, 22]。锰氧化物的比表面积、羟基数量与改性硅藻蛋白石对重金属阴离子团的吸附能力呈正相关。其机理为Cr(Ⅵ)、As(Ⅴ)与锰氧化物的表面羟基作用形成Cr-O-Mn和As-O-Mn键而被吸附。
此外,铁氧化物改性对硅藻蛋白石的重金属离子吸附能力也具有显著的提升作用[23-26]。Knoerret al.[24]在碱性条件下以FeSO4改性硅藻蛋白石,在其表面负载了纤铁矿(α-FeOOH)和针铁矿(γ-FeOOH))的混合物,并用于去除水中的As。Fe2+在碱性条件下形成Fe(OH)2,然后在硅藻蛋白石表面逐步氧化形成铁氧化物(式5)。水中的砷主要以H3AsO3(pH=7.5~8.0)和H2AsO3-(pH=8.0~10.0)的形式存在,其吸附机理如式6和7所示。Du等[23]研究了α-Fe2O3/硅藻蛋白石对As(Ⅲ)和As(Ⅴ)的吸附机理,他们认为α-Fe2O3/硅藻蛋白石在初期主要通过静电作用吸附As(Ⅲ)和As(Ⅴ),而在后期主要通过共价键进行化学吸附。由于铁氧化物和锰氧化物对重金属离子具有吸附活性,因此,还可将Fe-Mn二元氧化物负载到硅藻蛋白石表面以提高吸附效率[27]。
| $ {\rm 4Fe^{2+}+5OH^{-}O_{2}→3Fe^{III}OOH+Fe^{3+}+H_{2}O} $ | (5) |
| $ {\rm ≡FeOH+H_{3}AsO_{3}→≡FeH_{2}AsO_{3}+H_{2}O} $ | (6) |
| $ {\rm ≡FeOH+H_{2}AsO^{-}_{3}→≡FeHAsO^{-}_{3}+H_{2}O} $ | (7) |
为了进一步提高吸附能力,还可采用有机物对硅藻蛋白石进行功能化改性,以增加吸附重金属的活性位点的数量。Caner等[28]研究发现壳聚糖包覆的硅藻蛋白石比表面积和孔体积均增加,壳聚糖/硅藻蛋白石对Hg2+吸附量比天然硅藻蛋白石高70%,且具有良好的重复利用率。Yu等[29]也对硅藻蛋白石进行了类似的功能化改性,改性硅藻蛋白石在初始阶段就对Cd2+具有较高的吸附率,最大单分子层吸附率为102.9 mg/g。Abu-Zurayk等[30]发现,十六烷基三甲基溴化铵改性后的硅藻蛋白石比表面积减小,但对Pb(Ⅱ),Cr(Ⅲ)和Cr(Ⅵ)的吸附容量增加,但并未对其吸附机理进行讨论。此外,有机硅氧烷改性硅藻蛋白石也可提升其吸附能力。Yang等[31]研究了3-巯基丙基三甲氧基硅烷(MPTMS)、3-氨基丙基三甲氧基硅烷(APTES)和n-(2-氨基乙基)-3-氨基丙基三甲氧基硅烷(AEAPTMS)改性硅藻蛋白石对Hg2+吸附行为。研究发现,MPTMS,APTES和AEAPTMS改性的硅藻蛋白石在平衡状态下对Hg2+的吸附能力显着增强,分别达到185.2、131.7和169.5 mg/g,这是由于硅藻蛋白石表面的巯基、氨基和乙二氨基与溶液中的Hg2+之间的亲和力更强(图 3)。
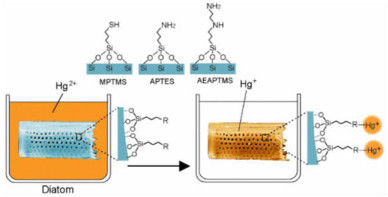 |
| 图 3 有机硅烷化改性硅藻蛋白石吸附Hg+示意图[31] Fig.3 Schematic presentation for the related mechanisms of modified diatomite for removal of Hg+[31] |
如上所述,有机功能化改性主要是通过负载或者嫁接活性官能团(如-SH、-NH2或-NH-NH2),来增强硅藻蛋白石的负电荷。但是,不同活性官能团对特定重金属离子的吸附性能和机制有待开展更为全面的研究。此外,阳离子表面活性剂改性硅藻蛋白石提高其吸附性能的机制也有待进一步探索。
2 纳米能源材料 2.1 锂离子电池理想的锂离子电池(Lithium ion battery, LIB)需具备低成本、高能量密度和持久耐用等特点,其性能在很大程度上取决于锂存储材料。硅具有高达4 200 mAh·g-1的理论容量,是锂离子电池最具吸引力的负极材料之一[32-35]。其中,具有独特的分级结构和高比表面积的多孔硅可以促进锂离子的快速运输,从而在充放电循环过程中提供优异的倍率性能并保持良好的电导率。然而,这些硅基负极材料的最大局限就是高成本以及化学刻蚀带来的健康风险和环境污染问题,这些缺点严重制约了多孔硅材料的工业应用。
由于硅藻蛋白石的主要化学成分是SiO2,且具有多孔结构,可为纳米级的多孔硅提供理想的模板和硅源,是制造多孔硅负极的最具潜力的原材料之一。Bao et al. [36]开发了一种将硅藻蛋白石还原为多孔硅材料的镁热还原法,该方法相比于碳热还原法具有更低的反应温度(650 ℃),且能够保留硅藻蛋白石的多级孔结构。其原理是气态Mg还原SiO2并生成MgO/Si复合物。由于反应温度低,且生成的MgO包裹在Si的表面,产物中Si并不会熔结或晶粒变粗。经过HCl去除MgO后可得到Si,并保留了硅藻蛋白石的多级孔结构。虽然采用镁热还原法也可以将石英SiO2还原为Si,但其不具备硅藻蛋白石制备的Si材料的多级孔结构[37]。Campbell等[38]采用镁热还原法将硅藻蛋白石还原为多孔硅,然后用聚丙烯酸(PAA)作为原料包覆形成碳膜(图 4)。该方法制备的多孔硅的比表面积远大于原始硅藻蛋白石,作为负极材料时具有良好的循环稳定性和优异的倍率性能(图 5),比容量约为石墨理论值的2倍。Wang等[39]发现,使用硅藻蛋白石制备的多孔Si/C复合材料用于锂离子电池负极时,其充放电比容量高达1 700 mAh·g-1。这些实例表明,将硅藻蛋白石转化为多孔硅是具有应用潜力的锂离子电池负极材料,其结构和性能的调控有待进一步研究。
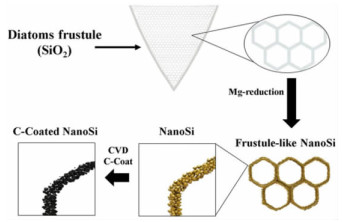 |
| 图 4 基于硅藻蛋白石的多孔硅电极材料[38] Fig.4 Schematic illustration of the process of obtaining C-coated, DE-derived, porous Si structures for use as Li-ion anode active material |
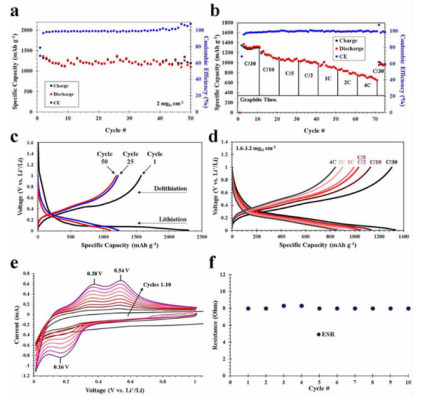 |
| 图 5 包覆碳膜的多孔硅电极的电化学性能[38] Fig.5 Electrochemical properties of diatom-derived nano Si-based electrodes |
2.2 超级电容器
超级电容器是通过电极与电解质之间形成的界面双层来存储能量的新型元器件,具有高功率密度、高充放电速率、长循环寿命(数百万个循环)和突出的循环稳定性。硅藻蛋白石独特的三维多孔结构,为多孔电化学活性材料合成提供了理想的模板。硅藻蛋白石合成电化学活性材料的思路有三种:一是将电化学活性材料负载到硅藻蛋白石上;二是以硅藻蛋白石为模板,合成电化学活性材料;三是将硅藻蛋白石还原为多孔硅,再进一步负载电化学活性材料。
Zhang等将锰和镍的氧化物负载到硅藻蛋白石的三维结构上,制备用于超级电容器的多孔复合电极。由于硅藻蛋白石表面的独特结构,MnO2纳米片在硅藻蛋白石表面垂直生长,从而增加了电极的比表面积并形成分级结构[40]。因此,MnO2/硅藻蛋白石电极的容量达到了202.6 F·g-1。相似地,负载NiO的硅藻蛋白石的比容量也高达218.7 F·g-1,经1 000次循环后其容量保持率为90.61%[41]。此外,可将不同的氧化物与硅藻蛋白石结合起来提高超级电容器的性能。例如,在硅藻蛋白石表面连续负载一层TiO2纳米球和一层MnO2纳米片,TiO2纳米球和硅藻蛋白石提供丰富的界面和开孔通道,显著提升了MnO2纳米片的电子传输效率,从而改善其比容量和循环稳定性[42]。还可以将硅藻蛋白石、MnO2和氧化石墨烯(GO)组成复合电极材料,由于具有良好的导电率和大比表面积,其比容量达到了152.5 F·g-1,经2 000次循环后容量保持率为83.3%(电流密度为2 A·g-1)[43]。
Zhang等[40]发现以硅藻蛋白石为模板合成的多孔MnO2纳米材料具有更优的容量和循环稳定性。随后,Li等[44]以三种不同结构的硅藻蛋白石为模板合成不同形状的MnO2电化学活性材料(图 6)。其中,以直链型硅藻蛋白石合成的MnO2在电流密度为0.5 A·g-1时比容量达到了371.2 F·g-1,且具有良好的循环稳定性(电流密度为5 A·g-1时经过2 000次循环后,容量保持率为93.1%)。这一发现表明,可以硅藻蛋白石为模板,合成多孔纳米氧化物活性材料,从而提高超级电容器的性能。
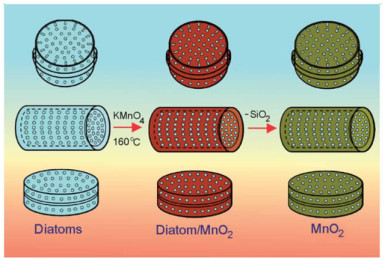 |
| 图 6 以硅藻蛋白石为模板合成多孔MnO2电化学活性材料的示意图[44] Fig.6 Schematic diagram showing the process of synthesis of diatom/MnO2 and 3-D MnO2 structures with replicated diatom's morphology |
Zhang等[45]采用镁热还原法将硅藻蛋白石还原为多孔硅,并进一步通过水热工艺在其表面生长MnO2纳米片,该电极材料的电化学性能显著提升,在0.5 A·g-1的电流密度下的容量高达341.5 F·g-1,还具有良好的倍率性(电流增加20倍时保持率为47.7%)和循环稳定性(循环2 000次后保持率为84.8%)。基于硅藻蛋白石合成的多孔Si@MnO2纳米片(正极)和活性氧化石墨烯物(负极)组成的不对称超级电容器的最大功率密度达到了2.22 kW·kg-1,能量密度为23.2 Wh·kg-1。硅藻蛋白石制备的多孔硅具有良好的电导率和独特的纳米结构,增加了电极的比表面积和在电解质中暴露的活性位点数量,从而提升了该复合电极的电化学性能。
以上研究表明,在硅藻蛋白石表面上精确控制金属氧化物或氢氧化物的形态和成分,或者以硅藻蛋白石作为模板和硅源合成纳米多孔硅,都可以有效提高超级电容器的功率密度、充放电速率、循环寿命和循环稳定性。硅藻蛋白石复合电极材料独特的多孔纳米结构可以解决电极材料在长期循环中的聚集和体积膨胀问题。
2.3 太阳能电池太阳能电池分为硅太阳能电池、纳米晶体太阳能电池、塑料太阳能电池、有机太阳能电池等[46-50]。其中,以具有可调节光电特性的硅太阳能电池为主流。
然而,生产光伏材料涉及复杂且昂贵的沉积系统和有毒化学品的使用,对人体健康和环境具有严重的负面影响。生物成因的硅藻蛋白石,不仅环境友好、成本低廉,还具有多级孔结构,是太阳能电池硅材料潜在原料。Chandrasekaran等[51]以硅藻蛋白石为原料制备了具有三维多孔结构和高比表面积的硅半导体材料,实现了太阳能的转换和持续的光电流(图 7),并用于水解过程。此外,还可以进一步在多孔硅表面沉积光催化活性物质CdS将光电流密度提高到14 μA·cm-2。
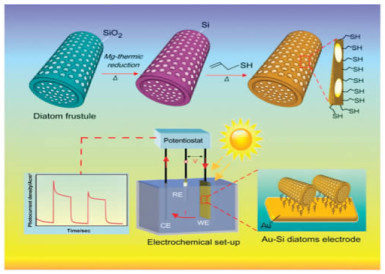 |
| 图 7 镁热还原法制备的基于硅藻蛋白石的纳米多孔硅在光电转换中的应用[51] Fig.7 Schematic representation of magnesiothermic conversion ofdiatom frustules to nanostructured silicon and their application for photoelectrochemical energy conversion |
1991年,O'regan和Grätzel提出了一种新型的太阳能电池,即染料敏化太阳能电池(DSSC)[52]。这种太阳能电池材料是基于TiO2纳米晶体,其转化效率为7%,但随后又将转化效率提高到了10%[53]。由于同时具备高转换效率和低成本的优势,DSSC引起了研究人员极大的兴趣。此后,诸如TiO2[47],ZnO[54],SnO2[55]和Nb2O5[56]之类的金属氧化物逐步被应用于DSSC研究中。其中,TiO2因其独特的光电特性(可被紫外光激发)而最具吸引力。然而,TiO2薄膜最大的局限性在于它缺乏足够高的比表面积[57]。硅藻蛋白石具有大比表面积,可将大量染料分子吸附在其表面来提高太阳能电池的转化效率[58, 59],这一特点使其在染料敏化电池领域具有重要的应用价值。硅藻蛋白石的折射率为1.43[60],而多孔TiO2薄膜的折射率为1.7~2.5[61],这将导致TiO2-硅藻蛋白石层具有较高的介电差异以及光在孔阵列中的散射。因此,TiO2与硅藻蛋白石组成的复合材料提高了染料敏化电池的转化率[62]。硅藻蛋白石与TiO2的混合可以增强光阱效应和光学散射特性,并增加工作电极的染料负载量和比表面积。Huang等[62]利用旋涂和高温烧结技术制备了一种新型TiO2/硅藻蛋白石电极用于染料敏化电池。当电极材料分别连续涂覆一层硅藻蛋白石和两层TiO2时,其转换率为最优。
可见,硅藻蛋白石对提升太阳能电池中的性能具有十分重要的积极作用。由于其储量丰富,低成本和环境友好,硅藻蛋白石在太阳能电池中的应用是一个有前途的方向。但是,硅藻蛋白石太阳能电池的转换效率仍然需要继续提高,以满足实际应用的需求。
2.4 储氢材料氢气是一种清洁和高效的能源,是有望(部分)替代化石燃料的能源之一。然而,在室温和大气压下建立一个安全且有效的储氢系统非常困难。高孔隙率、大表面积、小尺寸、强吸附性和突出的热稳定性使硅藻蛋白石成为储氢的理想材料。硅藻蛋白石的氢吸附能力在很大程度上取决于其孔隙特征。Jin等[63]研究发现,酸热活化可以改善硅藻蛋白石的孔结构和性质,并将硅藻蛋白石的氢吸附能力从0.463%提高至0.833%(质量分数,2.63 MPa和298 K时)。此外,他们还发现贵金属纳米颗粒(Pd和Pt)在硅藻蛋白石结构上的分散也能够显著提高其氢吸附能力。Milovanovic′等[64]发现硅藻蛋白石和MgH2的混合有助于提升其氢吸附能力,这种复合材料的多孔结构对氢气的吸脱附具有至关重要的作用。尽管硅藻蛋白石在储氢领域的潜力巨大,然而,目前相关研究还较少。要进一步推动硅藻蛋白石的储氢应用,还需要进一步深入研究硅藻蛋白石结构对氢气吸脱附性能的影响,以及进一步提高其吸附量的方法。
2.5 热能存储材料热能存储(Thermal energy storage,TES)是一种清洁和有效利用能源的方案,在节能减排领域越来越受重视[65-68]。热能存储方法有三种类型:显热存储、潜热存储和热化学能存储[69, 70]。由于在热能存储和释放过程中具有储能密度高和温度变化小的优点[71],使用相变材料(Phase change materials, PCM)来实现储能的潜热存储是最有效的技术。相比于有机相变材料,无机相变材料具有更高的能量存储密度和导热性[72]。然而,这类材料在固-液转变过程中的高泄漏风险制约了其商业应用[72, 73]。为了克服这个问题,需要引入支撑骨架来构建形态稳定的相变复合材料。这类支撑材料主要是微囊容器和聚合物微囊壳,如脂肪酸酯[74]、膨胀石墨[73, 75]、有机膨润土[76]、膨胀珍珠岩[77]、石膏[78]、硅藻蛋白石[79, 80]、蛭石[81, 82]、坡缕石[83]等。值得一提的是,当生活环境中的相对湿度发生变化时,多孔材料可以吸收或释放水蒸气,调节室内环境的相对湿度,从而使人感到舒适并减少能耗。因此,多孔的硅藻蛋白石在潜热存储相变材料中的应用具有功能上的优势。
Xu等[84]制备了具有高延展性和储热能力的石蜡/硅藻蛋白石复合相变材料和石蜡/硅藻蛋白石/多壁碳纳米管复合相变材料。这两种复合相变材料具有良好的化学相容性和热稳定性[85, 86]。Karaman等[80]制备了一种聚乙二醇(PEG)/硅藻蛋白石复合相变材料,其熔融温度和潜热能分别为27.70 ℃和87.09 J/g。Li等[87]用熔融吸附法制备了几种形状稳定的二元脂肪酸/硅藻蛋白石复合相变材料。其中,癸酸-月桂酸/硅藻蛋白石复合相变材料的潜热能为66.81 J/g,相变温度为16.74 ℃。总之,基于硅藻蛋白石的复合相变材料具有相变温度区域内表观比热大、导热系数合适、在相变过程中形状稳定的优点。
3 生物医药材料 3.1 药物传输和缓释载体医药领域的一个重要挑战就是如何将有效浓度的治疗药物输送到人体的特定区域(即患病组织),且对健康组织的副作用最小[88, 89]。合成多孔SiO2具有独特的理化特性,作为药物载体已得到广泛研究[90]。然而,合成多孔SiO2成本高昂且合成过程比较费时[91]。硅藻蛋白石不仅具备合成多孔SiO2的特点,而且成本低廉,是潜在的先进药物载体[92]。
2004年,Rosi等利用硅藻蛋白石制备了定向传输系统,成功地调控了金纳米颗粒在DNA功能化硅藻蛋白石表面的负载和释放[93]。Aw等[94, 95]首次探索了硅藻蛋白石微胶囊用于封装口服的治疗药物,证实了硅藻蛋白石对吲哚美辛的释药效果,其载药量约为22%,且在14d内持续释放。Zhang等[96]评估了硅藻蛋白石负载泼尼松和美沙拉嗪口服给药的释放效果,结果表明两种药物都具有持续释放的特点。同时,体外毒性评估显示,在Caco-2/HT-29共培养的单层膜上,即使硅藻蛋白石在高达1 000 μg·mL-1的浓度下其毒性也可以忽略不计,且两种药物的渗透性均得到提升。
为更好地控制硅藻蛋白石对药物的负载和释放,可对硅藻蛋白石进行表面改性和功能化。Aw等[97]分别采用有机硅烷(三氨基丙基乙氧基硅烷(APTES)和N-(2-氨乙基)-3-氨丙基三甲氧基硅烷(AEAPTMS))和膦酸(2-羧乙基磷酸和16-膦酰基十六烷酸)对硅藻蛋白石进行表面改性,分别赋予硅藻蛋白石微胶囊疏水性和亲水性。亲水性改性增加了药物负载量并延长了药物释放时间,而疏水改性则相反。Bariana等[98]通过有机硅烷和有机磷酸改性硅藻蛋白石来调控不溶性药物(吲哚美辛)和水溶性药物(庆大霉素)的载药量和释放特性,也得出相似的结论。因此,可以通过表面性质的调控来调节载药量和缓释时间。
此外,还可以利用其它生物或合成材料对硅藻蛋白石进行表面功能化改性,以赋予其诸如磁驱动、触发式药物释放等特性。Losic等[99]利用多巴胺修饰的氧化铁纳米粒子对硅藻蛋白石表面进行功能化改性,制备了磁性药物载体。这种磁化的硅藻蛋白石药物缓释系统可实现难溶性药物吲哚美辛长达两周的持续释放。Todd等[100]研究负载了氧化铁纳米粒子的硅藻蛋白石作为磁性传递载体的活体试验结果表明,与对照组相比,当施加磁场时,在肿瘤部位观察到明显的颗粒堆积(6.4倍)。这一思路可以被用作癌症药物的磁引导靶向药物递送,与传统的药物传输系统相比具有明显优势。
Kumeria等[101]探索了硅藻蛋白石作为药物载体的另一种改性方法,他们首次制备了一种复合硅藻蛋白石微胶囊,其表面负载了二维氧化石墨烯(GO)纳米片,从而赋予该系统基于pH条件的触发释放能力(图 8)。他们使用APTES对硅藻蛋白石的表面进行硅烷化处理,在表面上获得带正电荷的胺基官能团,从而将氧化石墨烯纳米片通过静电吸引或共价键负载到硅藻蛋白石表面。这种方法可以显著改变非类固醇抗炎药在不同pH条件下的缓释特性。除药物和载体之间的化学作用外,物理作用也可用于调控药物的缓释特性。Vasani等采用表面引发原子转移自由基聚合(ATRP)的方法将温敏性共聚物低聚乙二醇甲基丙烯酸酯嫁接到硅藻蛋白石微囊的表面。改性后微胶囊对抗菌药物左氧氟沙星的释放具有很强的温度依赖性。
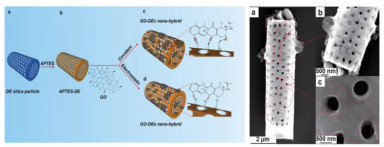 |
| 图 8 (a) 氧化石墨烯改性硅藻蛋白石的示意图;(b)的硅藻蛋白石的SEM图[101] Fig.8 (a) Schematic representation of covalent functionalization of diatoms frustule surface. (b) SEM images of the graphene oxide diatom nanohybrid prepared through electrostatic attachment. |
硅藻蛋白石的表面功能化改性除了提高其载药量外,还可以通过负载聚合物和多肽(或蛋白质)以增强其生物相容性、减少聚集、增强细胞同化和溶液稳定性[102]。Terracciano等[102]采用聚乙二醇(PEG)和细胞穿膜肽(CPP)包覆的硅藻蛋白石碎片纳米颗粒传输抗癌药物索拉非尼。经红细胞(RBC)和乳腺癌细胞(MCF-7和MDAMB-231)测试证实,该纳米颗粒在水溶液中稳定且具有生物相容性。此外,CPP的存在显著改善了细胞对药物的摄取量,而PEG的包覆使抗癌药物的负载量提高了两倍。
最近,有学者对硅藻蛋白石在基因治疗中的应用进行了研究。Rea等[103]将聚D-精氨酸肽和小干扰RNA(siRNA)的复合物嫁接到APTES改性的硅藻蛋白石表面上,使siRNA在到达其作用位点——细胞质之前不被核酸酶降解。
大量研究表明硅藻蛋白石具有持续和可控释放多种药物的能力,且具有临床应用的潜力。但是,硅藻蛋白石的化学成分是SiO2,在生物流体中的生物降解性很差[104-106]。这会导致SiO2颗粒的聚积,尤其是在器官中重复给药的情况下。此外,全身性靶向药物传输系统在到达目标前就被吞噬系统大量清除,从而增加了急性或慢性毒性的风险[107]。Borak等[108]在老鼠活体试验中就发现,SiO2颗粒在肺气囊和肾小球内部滞留。
合成多孔硅可以克服硅藻蛋白石材料作为药物载体的局限性[109]。然而,多孔硅的合成非常耗时,且步骤繁多、成本高昂以及使用高毒化学品(如氢氟酸)[109]。此外,氢氟酸的使用可能最终导致多孔硅的毒性残留,从而限制了该系统在实际生物医学中的应用。硅藻蛋白石是一种低成本和低毒性的硅源,将其转化为可生物降解的多孔硅是一种可行的方案。
Maher等[110, 111]利用硅藻蛋白石开发了一种新型的多孔硅药物载体,首次发现了这种多孔硅的光致发光特性,并利用生理环境下硅的生物可降解性开发了自我报告系统(药物载体本身报告了某个时间点剩余或释放的药物量)(图 9)。在生理条件下(37 ℃和pH=7.4)进行测试时,多孔硅具有较高的结晶度和高的体外降解速率。载有道诺霉素(DNR)的硅藻多孔硅用于预防增生性玻璃体视网膜病变(PVR)的体外释放研究表明,药物可持续释放长达30 d。该载体具有自我报告能力,通过基于光致发光的简单分析来监测发光和不发光药物的释放[110](图 9b)。基于硅藻蛋白石的多孔硅作为药物传输和缓释载体的释放机理主要包括两个方面:一是药物分子通过孔道扩散;而是药物分子随多孔硅的扩散而扩散。此外,多孔硅的降解在负载药物的释放中起关键作用。
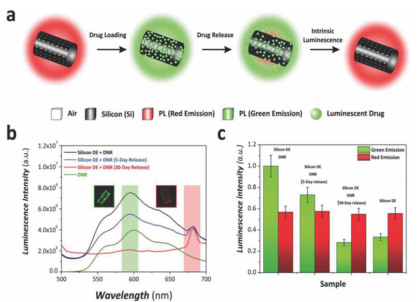 |
| 图 9 (a) 多孔硅载体的载药与释放以及自我报告示意图;(b)DNR释放5 d和30 d后多孔硅载体的光致发光光谱图;(c)DNR释放过程中不同阶段的共聚焦显微镜图像发光强度图[110] Fig.9 (a) Schematic illustration showing DNR loading onto diatom silicon replicas and the change in luminescence properties at the different stages of the release process. (b) Photoluminescence spectra of silicon DE replicas after DNR loading, after 5 and 30 days of release regions. (c) Bar chart showing the intensity of luminescence measured from confocal microscope images after the different stages of the process |
3.2 生物组织工程
硅在骨骼形成和维持、改善成骨细胞功能和诱导矿化中起重要作用。骨变形和骨畸形通常与硅元素的缺乏症有关[112]。硅藻蛋白石是廉价而丰富的生物SiO2的来源,可用于再生医学。Cicco等[113]将威氏海链藻(Thalassiosiraweissflogii)的SiO2外壳用于增强L细胞和骨肉瘤细胞MG63的黏附和增殖。结果表明,添加硅藻蛋白石和功能化硅藻蛋白石的细胞培养48 h和7 d后,两种细胞的细胞活力均显著提高。需要注意的是,硅藻蛋白石在组织工程中的应用研究还处于起步阶段,其临床应用还需要更为广泛且细致的探索。
3.3 凝血剂目前,常见的止血剂包括沸石和壳聚糖绷带,但这些止血剂的应用均受到各种限制。例如,沸石可能会因产生大量热而导致组织灼伤(温度可达95 ℃)。硅藻蛋白石作为一种无细胞毒性、无免疫原性和廉价的止血剂,能够克服常规止血剂的缺点[114]。硅藻蛋白石可提供高效的血浆吸收率,且不会产生任何热量(与沸石相反)。Chao等[114]用不同浓度(0.5%、1%、3%和5%)的壳聚糖包覆两种硅藻蛋白石(市售硅藻土和实验室培养硅藻壳)作为凝血剂,体外溶血和体内凝血测的试结果表明,与未涂覆的硅藻蛋白石相比,包覆壳聚糖引起的溶血活性差异可忽略不计。通过对比不同凝血剂对大鼠尾巴凝血时间发现,与纱布(510.26±63.22 s)和市售QuikClot沸石(133.66±21.84 s)相比,壳聚糖包覆的硅藻蛋白石凝血时间最短(98.34±26.54 s)。此外,由于硅藻蛋白石的快速且强大的流体吸附特性,包覆壳聚糖的硅藻蛋白石也不会导致大凝块。
3.4 生物传感硅藻蛋白石的光学和光子特性可在生物传感领域加以应用。Fuhrmann等[115]发现硅藻蛋白石的三维纳米结构会与光产生强烈的相互作用,使通过的光发生强烈的散射,表现出离散的光子特征。研究人员发现,硅藻蛋白石的光子特性(导光、透射和衍射等)高度依赖于硅藻物种[116],数值模拟证明这种效应与波长有关,并且不会在紫外光谱范围内发生。Noyes等[117]首次报道了光与圆筛藻壳的超微结构相互作用,光透过壳面并与壳面相互作用,形成了六重对称的衍射。Di Caprio等[118]使用数字全息术研究了硅藻壳及其光子性质在圆筛藻中帮助叶绿体迁移的作用。结果表明,硅藻壳的光子特性能够通过硅藻中叶绿体的迁移使光的收集最大化。
这些独特的光学特性不仅可以帮助硅藻生长,而且还可以用于实际应用中,例如用于生物传感[119]。许多研究[120-122]表明硅藻蛋白石可以通过改变光致发光性能而对NO2的出现具有指示作用。通常,NO2在硅藻蛋白石上的吸附会导致表面氧缺陷的静态荧光淬灭,从而导致发光。Lettieri等[123]研究了温度和NO2浓度对硅藻蛋白石光致发光强度的影响,发现NO2检测限在50 ppb以上。硅藻蛋白石的三维结构还可以组装等离子激元金属纳米颗粒,用于表面增强拉曼光谱(SERS)的传感应用[124-126]。Kong等[127]在硅藻蛋白石上原位生长等离子的银纳米粒子,该粒子具有SERS活性,可用于基于SERS的空气、水和土壤污染物检测。Lin等[128]构建了一种可以检测心脏生物标记物的系统,该系统可检测范围为1 pg·mL-1~1 μg·mL-1。此外,硅藻蛋白石还可以用于电化学传感器,其主要作用是从样品中过滤分离目标物。Kabiri等[129]将硅藻蛋白石颗粒填充到微流体通道中,用于分离食用染料,并通过光学探针进行检测。硅藻蛋白石的三维多孔结构还是合成具有复杂结构的功能性微结构器件的重要模板。Losic等[130]以海链藻硅藻蛋白石为模板,通过阴模和阳模合成了金属和聚合物结构器件,并证明了其独特的光学性质和可用于生物传感应用的能力,将来有望在生物传感器领域进行更多的探索。
4 结论和展望硅藻蛋白石是一种重要的非金属矿物资源。由于具有多级孔结构、遗传基因控制的纳米精度和良好的生物相容性,已应用于重金属吸附、锂离子电池、超级电容器、太阳能电池、储氢、储热、药物传输与缓释、组织工程、凝血剂和生物传感等,在环境治理、纳米能源和生物医药等领域具有重要的应用潜力,是未来高性能材料开发的重要战略支撑点。加之我国硅藻土资源丰富,储量居世界第二位[131]。因此,从某种意义上来说,硅藻土具有成为我国战略性非金属矿产资源的潜力。
硅藻通过数百万年的进化,从而通过基因控制合成了三维多孔的硅藻蛋白石,这是人类目前通过化工和材料技术尚难以企及的。但是,我们可以利用硅藻蛋白石的特殊结构和性质,或者利用硅藻生物可控地生产低成本、高精度的硅藻蛋白石材料。硅藻物种数以万计,但目前人们仅仅探索了其中很小一部分硅藻蛋白石的结构和新材料应用。此外,关于硅藻蛋白石先进材料的应用性能和作用机制的探索,尚处于起步阶段。未来若在该领域的开展更多的科学研究和工程探索,有望解决这类材料的应用局限性,从而推动我国在环境治理、新能源和生物医药等民生科技领域取得优势。
| [1] |
袁巍巍.硅藻土基多孔矿物复合材料制备及其对有机污染物的吸附/催化性研究[D].广州: 中国科学院研究生院(广州地球化学研究所), 2016. http://cdmd.cnki.com.cn/Article/CDMD-80165-1016188320.htm
|
| [2] |
袁鹏.硅藻土的提纯及其表面羟基、酸位研究[D].广州: 中国科学院广州地球化学研究所, 2001. http://cdmd.cnki.com.cn/Article/CDMD-80165-2002080818.htm
|
| [3] |
史家远, 姚奇志, 周根陶. 硅藻细胞壁硅化过程中有机质-矿物的相互作用[J]. 高校地质学报, 2011, 17(1): 76-85. DOI:10.3969/j.issn.1006-7493.2011.01.010 |
| [4] |
Maher S, Kumeria T, Aw M S, et al. Diatom silica for biomedical applications:Recent progress and advances[J]. Advanced Healthcare Materials, 2018, 7(19): 1800552. DOI:10.1002/adhm.201800552 |
| [5] |
Liu D, Yuan P, Tian Q, et al. Lake sedimentary biogenic silica from diatoms constitutes a significant global sink for aluminium[J]. Nature Communications, 2019, 10(1): 1-7. DOI:10.1038/s41467-018-07882-8 |
| [6] |
Losic D, Mitchell J G, Voelcker N H. Diatomaceous lessons in nanotechnology and advanced materials[J]. Advanced Materials, 2009, 21(29): 2947-2958. DOI:10.1002/adma.200803778 |
| [7] |
Yuan P, Liu D, Zhou J, et al. Identification of the occurrence of minor elements in the structure of diatomaceous opal using FIB and TEM-EDS[J]. American Mineralogist, 2019, 104(9): 1323-1335. DOI:10.2138/am-2019-6917 |
| [8] |
袁鹏, 吴大清. 硅藻土在一些高附加值产品中的应用及其基础研究[J]. 矿物岩石, 2000, 20(1): 101-104. |
| [9] |
Losic D. Diatom nanotechnology[M]. Cambridge: Royal Society of Chemistry, 2017.
|
| [10] |
Zhao Y, Tian G, Duan X, et al. Environmental applications of diatomite minerals in removing heavy metals from water[J]. Industrial & Engineering Chemistry Research, 2019, 58(27): 11638-11652. |
| [11] |
Bera A, Trivedi J S, Kumar S B, et al. Anti-organic fouling and anti-biofouling poly (Piperazineamide) thin film nanocomposite membranes for low pressure removal of heavy metal ions[J]. Journal of Hazardous Materials, 2018, 343: 86-97. DOI:10.1016/j.jhazmat.2017.09.016 |
| [12] |
Lin Q, Liu E, Zhang E, et al. Reconstruction of atmospheric trace metals pollution in southwest China using sediments from a large and deep alpine lake:Historical trends, sources and sediment focusing[J]. Science of the total environment, 2018, 613: 331-341. |
| [13] |
Yuan P, Liu D, Tan D-Y, et al. Surface silylation of mesoporous/macroporous diatomite (Diatomaceous earth) and its function in Cu (Ⅱ) adsorption:the effects of heating pretreatment[J]. Microporous and mesoporous materials, 2013, 170: 9-19. DOI:10.1016/j.micromeso.2012.11.030 |
| [14] |
Alyosef H A, Ibrahim S, Welscher J, et al. Effect of acid treatment on the chemical composition and the structure of egyptian diatomite[J]. International Journal of Mineral Processing, 2014, 132: 17-25. DOI:10.1016/j.minpro.2014.09.001 |
| [15] |
Mohamed E A, Selim A Q, Zayed A M, et al. Enhancing adsorption capacity of egyptian diatomaceous earth by thermo-chemical purification:methylene blue uptake[J]. Journal of Colloid and Interface Science, 2019, 534: 408-419. DOI:10.1016/j.jcis.2018.09.024 |
| [16] |
Al-Degs Y, Khraisheh M, Tutunji M. Sorption of lead Ions on diatomite and manganese oxides modified diatomite[J]. Water Research, 2001, 35(15): 3724-3728. DOI:10.1016/S0043-1354(01)00071-9 |
| [17] |
Caliskan N, Kul A R, Alkan S, et al. Adsorption of zinc (Ⅱ) on diatomite and manganese-oxide-modified diatomite:a kinetic and equilibrium study[J]. Journal of Hazardous Materials, 2011, 193: 27-36. DOI:10.1016/j.jhazmat.2011.06.058 |
| [18] |
Li E, Zeng X. Sorption of Cr (Ⅲ) Ion from aqueous solution by two kinds of modified diatomite[J]. Water Science and Technology, 2012, 66(6): 1340-1347. DOI:10.2166/wst.2012.327 |
| [19] |
Li S, Li D, Su F, et al. Uniform surface modification of diatomaceous earth with amorphous manganese oxide and its adsorption characteristics for lead ions[J]. Applied Surface Science, 2014, 317: 724-729. DOI:10.1016/j.apsusc.2014.08.184 |
| [20] |
Al-Degs Y S, Tutunju M F, Shawabkeh R A. The feasibility of using diatomite and Mn-diatomite for remediation of Pb2+, Cu2+, and Cd2+from water[J]. Separation Science and Technology, 2000, 35(14): 2299-2310. DOI:10.1081/SS-100102103 |
| [21] |
Du Y, Wang L, Wang J, et al. Flower-, Wire-, and Sheet-Like MnO2-Deposited Diatomites:Highly efficient absorbents for the removal of Cr (Ⅵ)[J]. Journal of Environmental Sciences, 2015, 29: 71-81. DOI:10.1016/j.jes.2014.06.047 |
| [22] |
Du Y, Zheng G, Wang J, et al. MnO2 nanowires in situ grown on diatomite:highly efficient absorbents for the removal of Cr (Ⅵ) and As (Ⅴ)[J]. Microporous and Mesoporous Materials, 2014, 200: 27-34. DOI:10.1016/j.micromeso.2014.07.043 |
| [23] |
Du Y, Fan H, Wang L, et al. α-Fe2O3 nanowires deposited diatomite:highly efficient absorbents for the removal of arsenic[J]. Journal of Materials Chemistry A, 2013, 1(26): 7729-7737. DOI:10.1039/c3ta11124e |
| [24] |
Knoerr R, Brendlé J, Lebeau B, et al. Preparation of ferric oxide modified diatomite and its application in the remediation of As (Ⅲ) species from solution[J]. Microporous and Mesoporous Materials, 2013, 169: 185-191. DOI:10.1016/j.micromeso.2012.09.036 |
| [25] |
Puente-Urbina A, Montero-Campos V. Porous materials modified with Fe3O4 nanoparticles for arsenic removal in drinking water[J]. Water, Air, & Soil Pollution, 2017, 228(9): 374. |
| [26] |
Wu C-C, Wang Y-C, Lin T-F, et al. Removal of arsenic from waste water using surface modified diatomite[J]. Journal of the Chinese Institute of Environmental Engineering, 2005, 15(4): 255-261. |
| [27] |
Chang F, Qu J, Liu H, et al. Fe-Mn binary oxide incorporated into diatomite as an adsorbent for arsenite removal:preparation and evaluation[J]. Journal of Colloid and Interface Science, 2009, 338(2): 353-358. DOI:10.1016/j.jcis.2009.06.049 |
| [28] |
Caner N, Sarı A, TüZen M. Adsorption characteristics of mercury (Ⅱ) ions from aqueous solution onto chitosan-coated diatomite[J]. Industrial & Engineering Chemistry Research, 2015, 54(30): 7524-7533. |
| [29] |
Yu Z-H, Zhang Y-F, Zhai S-R, et al. Amino-modified mesoporous sorbents for efficient Cd (Ⅱ) adsorption prepared using non-chemical diatomite as precursor[J]. Journal of Sol-Gel Science and Technology, 2016, 78(1): 110-119. DOI:10.1007/s10971-015-3933-8 |
| [30] |
Abu-Zurayk R A, Al Bakain R Z, Hamadneh I, et al. Adsorption of Pb (Ⅱ), Cr (Ⅲ) and Cr (Ⅵ) from aqueous solution by surfactant-modified diatomaceous earth:Equilibrium, kinetic and thermodynamic modeling studies[J]. International Journal of Mineral Processing, 2015, 140: 79-87. DOI:10.1016/j.minpro.2015.05.004 |
| [31] |
Yu Y, Addai-Mensah J, Losic D. Functionalized diatom silica microparticles for removal of mercury ions[J]. Science and Technology of Advanced Materials, 2012, 13(1): 015008. DOI:10.1088/1468-6996/13/1/015008 |
| [32] |
Dahn J R, Zheng T, Liu Y, et al. Mechanisms for lithium insertion in carbonaceous materials[J]. Science, 1995, 270(5236): 590-593. DOI:10.1126/science.270.5236.590 |
| [33] |
Etacheri V, Marom R, Elazari R, et al. Challenges in the development of advanced Li-ion batteries:a review[J]. Energy & Environmental Science, 2011, 4(9): 3243-3262. |
| [34] |
Poizot P, Laruelle S, Grugeon S, et al. Searching for new anode materials for the Li-ion technology:time to deviate from the usual path[J]. Journal of Power Sources, 2001, 97: 235-239. |
| [35] |
Wen C J, Huggins R A. Thermodynamic study of the lithium-tin system[J]. Journal of the Electrochemical Society, 1981, 128(6): 1181-1187. DOI:10.1149/1.2127590 |
| [36] |
Bao Z, Weatherspoon M R, Shian S, et al. Chemical reduction of three-dimensional silica micro-assemblies into microporous silicon replicas[J]. Nature, 2007, 446(7132): 172-175. DOI:10.1038/nature05570 |
| [37] |
Arunmetha S, Vinoth M, Srither S R, et al. Study on production of silicon nanoparticles from quartz sand for hybrid solar cell applications[J]. Journal of Electronic Materials, 2017, 47(1): 493-502. |
| [38] |
Campbell B, Ionescu R, Tolchin M, et al. Carbon-coated, diatomite-derived nanosilicon as a high rate capable Li-ion battery anode[J]. Scitific Reports, 2016, 6: 33050. DOI:10.1038/srep33050 |
| [39] |
Wang M-S, Fan L-Z, Huang M, et al. Conversion of diatomite to porous Si/C composites as promising anode materials for lithium-ion batteries[J]. Journal of Power Sources, 2012, 219: 29-35. DOI:10.1016/j.jpowsour.2012.06.102 |
| [40] |
Zhang Y X, Huang M, Li F, et al. One-pot synthesis of hierarchical MnO2-modified diatomites for electrochemical capacitor electrodes[J]. Journal of Power Sources, 2014, 246: 449-456. DOI:10.1016/j.jpowsour.2013.07.115 |
| [41] |
Zhang Y X, Li F, Huang M, et al. Hierarchical NiO moss decorated diatomites via facile and templated method for high performance supercapacitors[J]. Materials Letters, 2014, 120: 263-266. DOI:10.1016/j.matlet.2014.01.091 |
| [42] |
Guo X L, Kuang M, Li F, et al. Engineering of three dimensional (3-D) diatom@TiO2@MnO2 composites with enhanced supercapacitor performance[J]. Electrochimica Acta, 2016, 190: 159-167. DOI:10.1016/j.electacta.2015.12.178 |
| [43] |
Wen Z Q, Li M, Li F, et al. Morphology-controlled MnO2-graphene oxide-diatomaceous earth 3-dimensional (3D) composites for high-performance supercapacitors[J]. Dalton Transactions, 2016, 45(3): 936-942. DOI:10.1039/C5DT04082E |
| [44] |
Li F, Xing Y, Huang M, et al. MnO2 nanostructures with three-dimensional (3D) morphology replicated from diatoms for high-performance supercapacitors[J]. Journal of Materials Chemistry A, 2015, 3(15): 7855-7861. DOI:10.1039/C5TA00634A |
| [45] |
Sun X W, Zhang Y X, Losic D. Diatom silica, an emerging biomaterial for energy conversion and storage[J]. Journal of Materials Chemistry A, 2017, 5(19): 8847-59. DOI:10.1039/C7TA02045G |
| [46] |
Baxter J, Bian Z, Gang C, et al. Nanoscale design to enable the revolution in renewable energy[J]. Energy & Environmental Science, 2009, 2(6): 559-588. |
| [47] |
Chen X, Mao S S. Titanium Dioxide Nanomaterials:Synthesis, Properties, Modifications, and Applications[J]. Chemical Reviews, 2017, 107(7): 2891-2959. |
| [48] |
Gonalves L M, De Zea Bermudez V, Ribeiro H A, et al. Dye-sensitized solar cells:A safe bet for the future[J]. Energy & Environmental Science, 2008, 1(6): 655-667. |
| [49] |
Hernández-Alonso M D, Fresno F, Suárez S, et al. Development of alternative photocatalysts to TiO2:challenges and opportunities[J]. Energy & Environmental Science, 2009, 2(12): 1231-1257. |
| [50] |
Inoue Y. Photocatalytic water splitting by RuO2 -loaded metal oxides and nitrides with d 0-and d 10-related electronic configurations[J]. Energy & Environmental Science, 2009, 2(4): 364. |
| [51] |
Chandrasekaran S, Sweetman M J, Kant K, et al. Silicon diatom frustules as nanostructured photoelectrodes[J]. Chemical Communications, 2014, 50(72): 10441-10444. DOI:10.1039/C4CC04470C |
| [52] |
O'regan B, Grätzel M. Low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films[J]. Nature, 1991, 353(6346): 737-740. DOI:10.1038/353737a0 |
| [53] |
Nazeeruddin M K, Kay A, Rodicio I, et al. Conversion of light to electricity by cis-X2bis (2, 2'-bipyridyl-4, 4'-dicarboxylate) ruthenium (Ⅱ) charge-transfer sensitizers (X=Cl-, Br-, I-, CN-, and SCN-) on nanocrystalline titanium dioxide electrodes[J]. Journal of the American Chemical Society, 1993, 115(14): 6382-6390. DOI:10.1021/ja00067a063 |
| [54] |
Zhang Q, Dandeneau C S, Zhou X, et al. ZnO nanostructures for dye-sensitized solar cells[J]. Advanced Materials, 2009, 21(41): 4087-4108. DOI:10.1002/adma.200803827 |
| [55] |
Duong T-T, Choi H-J, He Q-J, et al. Enhancing the efficiency of dye sensitized solar cells with an SnO2 blocking layer grown by nanocluster deposition[J]. Journal of Alloys and Compounds, 2013, 561: 206-210. DOI:10.1016/j.jallcom.2013.01.188 |
| [56] |
Barea E, Xu X, Gonzálezpedro V, et al. Origin of efficiency enhancement in Nb2O5 coated titanium dioxide nanorod based dye sensitized solar cells[J]. Energy & Environmental Science, 2011, 4(9): 3414-3419. |
| [57] |
Losic D, Triani G, Evans P J, et al. Controlled pore structure modification of diatoms by atomic layer deposition of TiO2[J]. Journal of Materials Chemistry, 2006, 16(41): 4029-4034. DOI:10.1039/b610188g |
| [58] |
Hoshikawa T, Ikebe T, Yamada M, et al. Preparation of silica-modified TiO2 and application to dye-sensitized solar cells[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2006, 184(1-2): 78-85. DOI:10.1016/j.jphotochem.2006.04.001 |
| [59] |
Park K H, Li H, Dhayal M, et al. Performance improvement of dye-sensitized glass powder added TiO2 solar cells[J]. Journal of Nanoscience and Nanotechnology, 2008, 8(10): 5252-5256. DOI:10.1166/jnn.2008.1024 |
| [60] |
Fuhrmann T, Landwehr S, El Rharbi-Kucki M, et al. Diatoms as living photonic crystals[J]. Applied Physics B, 2004, 78(3-4): 257-260. DOI:10.1007/s00340-004-1419-4 |
| [61] |
Tachibana Y, Akiyama H Y, Kuwabata S. Optical simulation of transmittance into a nanocrystalline anatase TiO2 film for solar cell applications[J]. Solar Energy Materials and Solar Cells, 2007, 91(2-3): 201-206. DOI:10.1016/j.solmat.2006.09.001 |
| [62] |
Huang D-R, Jiang Y-J, Liou R-L, et al. Enhancing the efficiency of dye-sensitized solar cells by adding diatom frustules into TiO2 working electrodes[J]. Applied Surface Science, 2015, 347: 64-72. DOI:10.1016/j.apsusc.2015.04.064 |
| [63] |
Jin J, Zheng C, Yang H. Natural diatomite modified as novel hydrogen storage material[J]. Functional Materials Letters, 2014, 7(3): 1450027. DOI:10.1142/S1793604714500271 |
| [64] |
Milovanović S, Matović L, Drvendžija M, et al. Hydrogen storage properties of MgH2- diatomite composites obtained by high-energy ball milling[J]. Journal of Microscopy, 2008, 232(3): 522-525. DOI:10.1111/j.1365-2818.2008.02113.x |
| [65] |
Dincer I. On thermal energy storage systems and applications in buildings[J]. Energy and Buildings, 2002, 34(4): 377-388. DOI:10.1016/S0378-7788(01)00126-8 |
| [66] |
Khudhair A M, Farid M M. A review on energy conservation in building applications with thermal storage by latent heat using phase change materials[J]. Energy conversion and management, 2004, 45(2): 263-275. DOI:10.1016/S0196-8904(03)00131-6 |
| [67] |
Liu C-P, Seeds A. Wireless-over-fiber technology-bringing the wireless world indoors[J]. Optics and Photonics News, 2010, 21(11): 28-33. DOI:10.1364/OPN.21.11.000028 |
| [68] |
Tyagi V, Kaushik S, Tyagi S, et al. Development of phase change materials based microencapsulated technology for buildings:a review[J]. Renewable and Sustainable Energy Reviews, 2011, 15(2): 1373-1391. DOI:10.1016/j.rser.2010.10.006 |
| [69] |
Regin A F, Solanki S, Saini J. Heat transfer characteristics of thermal energy storage system using PCM capsules:a review[J]. Renewable and Sustainable Energy Reviews, 2008, 12(9): 2438-2458. DOI:10.1016/j.rser.2007.06.009 |
| [70] |
Zhou D, Zhao C-Y, Tian Y. Review on thermal energy storage with phase change materials (PCMs) in building applications[J]. Applied Energy, 2012, 92: 593-605. DOI:10.1016/j.apenergy.2011.08.025 |
| [71] |
Memon S A. Phase change materials integrated in building walls:A state of the art review[J]. Renewable and Sustainable Energy Reviews, 2014, 31: 870-906. DOI:10.1016/j.rser.2013.12.042 |
| [72] |
Sarier N, Onder E. Organic phase change materials and their textile applications:an overview[J]. Thermochimica Acta, 2012, 540: 7-60. DOI:10.1016/j.tca.2012.04.013 |
| [73] |
Zhang Z, Shi G, Wang S, et al. Thermal energy storage cement mortar containing n-octadecane/expanded graphite composite phase change material[J]. Renewable Energy, 2013, 50: 670-675. DOI:10.1016/j.renene.2012.08.024 |
| [74] |
Sarı A, Biçer A. Thermal energy storage properties and thermal reliability of some fatty acid esters/building material composites as novel form-stable PCMs[J]. Solar Energy Materials and Solar Cells, 2012, 101: 114-122. DOI:10.1016/j.solmat.2012.02.026 |
| [75] |
Lafdi K, Mesalhy O, Elgafy A. Graphite foams infiltrated with phase change materials as alternative materials for space and terrestrial thermal energy storage applications[J]. Carbon, 2008, 46(1): 159-168. DOI:10.1016/j.carbon.2007.11.003 |
| [76] |
Li M, Wu Z, Kao H, et al. Experimental investigation of preparation and thermal performances of paraffin/bentonite composite phase change material[J]. Energy Conversion and Management, 2011, 52(11): 3275-3281. DOI:10.1016/j.enconman.2011.05.015 |
| [77] |
Jiao C, Ji B, Fang D. Preparation and properties of lauric acid-stearic acid/expanded perlite composite as phase change materials for thermal energy storage[J]. Materials Letters, 2012, 67(1): 352-354. DOI:10.1016/j.matlet.2011.09.099 |
| [78] |
Li M, Wu Z, Chen M. Preparation and properties of gypsum-based heat storage and preservation material[J]. Energy and Buildings, 2011, 43(9): 2314-2319. DOI:10.1016/j.enbuild.2011.05.016 |
| [79] |
Li M, Kao H, Wu Z, et al. Study on preparation and thermal property of binary fatty acid and the binary fatty acids/diatomite composite phase change materials[J]. Applied Energy, 2011, 88(5): 1606-1612. DOI:10.1016/j.apenergy.2010.11.001 |
| [80] |
Karaman S, Karaipekli A, Sarı A, et al. Polyethylene glycol (PEG)/diatomite composite as a novel form-stable phase change material for thermal energy storage[J]. Solar Energy Materials and Solar Cells, 2011, 95(7): 1647-1653. DOI:10.1016/j.solmat.2011.01.022 |
| [81] |
Karaipekli A, Sarı A. Capric-myristic acid/vermiculite composite as form-stable phase change material for thermal energy storage[J]. Solar Energy, 2009, 83(3): 323-332. DOI:10.1016/j.solener.2008.08.012 |
| [82] |
Karaipekli A, Sarı A. Preparation, thermal properties and thermal reliability of eutectic mixtures of fatty acids/expanded vermiculite as novel form-stable composites for energy storage[J]. Journal of Industrial and Engineering Chemistry, 2010, 16(5): 767-773. DOI:10.1016/j.jiec.2010.07.003 |
| [83] |
Li M, Wu Z, Kao H. Study on preparation, structure and thermal energy storage property of capric-palmitic acid/attapulgite composite phase change materials[J]. Applied Energy, 2011, 88(9): 3125-3132. DOI:10.1016/j.apenergy.2011.02.030 |
| [84] |
Xu B, Li Z. Performance of novel thermal energy storage engineered cementitious composites incorporating a paraffin/diatomite composite phase change material[J]. Applied Energy, 2014, 121: 114-122. DOI:10.1016/j.apenergy.2014.02.007 |
| [85] |
Xu B, Li Z. Paraffin/diatomite/multi-wall carbon nanotubes composite phase change material tailor-made for thermal energy storage cement-based composites[J]. Energy, 2014, 72: 371-380. DOI:10.1016/j.energy.2014.05.049 |
| [86] |
Li X, Sanjayan J G, Wilson J L. Fabrication and stability of form-stable diatomite/paraffin phase change material composites[J]. Energy and Buildings, 2014, 76: 284-394. DOI:10.1016/j.enbuild.2014.02.082 |
| [87] |
Li M, Wu Z, Kao H. Study on preparation and thermal properties of binary fatty acid/diatomite shape-stabilized phase change materials[J]. Solar Energy Materials and Solar Cells, 2011, 95(8): 2412-2416. DOI:10.1016/j.solmat.2011.04.017 |
| [88] |
Ferrari M. Cancer nanotechnology:opportunities and challenges[J]. Nature Reviews Cancer, 2005, 5(3): 161-171. DOI:10.1038/nrc1566 |
| [89] |
Wagner V, Dullaart A, Bock A-K, et al. The emerging nanomedicine landscape[J]. Nature Biotechnology, 2006, 24(10): 1211. DOI:10.1038/nbt1006-1211 |
| [90] |
Shahbazi M A, Herranz B, Santos H A. Nanostructured porous Si-based nanoparticles for targeted drug delivery[J]. Biomatter, 2012, 2(4): 296-312. DOI:10.4161/biom.22347 |
| [91] |
Delalat B, Sheppard V C, Rasi G S, et al. Targeted drug delivery using genetically engineered diatom biosilica[J]. Nature Communications, 2015, 6: 8791. DOI:10.1038/ncomms9791 |
| [92] |
Anderson M W, Holmes S M, Hanif N, et al. Hierarchical pore structures through diatom zeolitization[J]. Angewandte Chemie International Edition, 2000, 39(15): 2707-2710. DOI:10.1002/1521-3773(20000804)39:15<2707::AID-ANIE2707>3.0.CO;2-M |
| [93] |
Rosi N L, Thaxton C S, Mirkin C A. Control of nanoparticle assembly by using DNA-modified diatom templates[J]. Angewandte Chemie International Edition, 2004, 43(41): 5500-5503. DOI:10.1002/anie.200460905 |
| [94] |
Aw M S, Simovic S, Addai-Mensah J, et al. Silica microcapsules from diatoms as new carrier for delivery of therapeutics[J]. Nanomedicine, 2011, 6(7): 1159-1173. DOI:10.2217/nnm.11.29 |
| [95] |
Aw M S, Simovic S, Yu Y, et al. Porous silica microshells from diatoms as biocarrier for drug delivery applications[J]. Powder technology, 2012, 223: 52-58. DOI:10.1016/j.powtec.2011.04.023 |
| [96] |
Zhang H, Shahbazi M-A, Mäkilä E M, et al. Diatom silica microparticles for sustained release and permeation enhancement following oral delivery of prednisone and mesalamine[J]. Biomaterials, 2013, 34(36): 9210-9219. DOI:10.1016/j.biomaterials.2013.08.035 |
| [97] |
Aw M S, Bariana M, Yu Y, et al. Surface-functionalized diatom microcapsules for drug delivery of water-insoluble drugs[J]. Journal of biomaterials applications, 2013, 28(2): 163-174. |
| [98] |
Bariana M, Aw M S, Losic D. Tailoring morphological and interfacial properties of diatom silica microparticles for drug delivery applications[J]. Advanced Powder Technology, 2013, 24(4): 757-763. DOI:10.1016/j.apt.2013.03.015 |
| [99] |
Losic D, Yu Y, Aw M S, et al. Surface functionalisation of diatoms with dopamine modified iron-oxide nanoparticles:toward magnetically guided drug microcarriers with biologically derived morphologies[J]. Chemical Communications, 2010, 46(34): 6323-6325. DOI:10.1039/c0cc01305f |
| [100] |
Todd T, Zhen Z, Tang W, et al. Iron oxide nanoparticle encapsulated diatoms for magnetic delivery of small molecules to tumors[J]. Nanoscale, 2014, 6(4): 2073-2076. DOI:10.1039/c3nr05623f |
| [101] |
Kumeria T, Bariana M, Altalhi T, et al. Graphene oxide decorated diatom silica particles as new nano-hybrids:towards smart natural drug microcarriers[J]. Journal of Materials Chemistry B, 2013, 1(45): 6302-6311. DOI:10.1039/c3tb21051k |
| [102] |
Terracciano M, Shahbazi M A, Correia A, et al. Surface bioengineering of diatomite based nanovectors for efficient intracellular uptake and drug delivery[J]. Nanoscale, 2015, 7(47): 20063-20074. DOI:10.1039/C5NR05173H |
| [103] |
Rea I, Martucci N M, De S L, et al. Diatomite biosilica nanocarriers for siRNA transport inside cancer cells[J]. BBA-General Subjects, 2014, 1840(12): 3393-3403. DOI:10.1016/j.bbagen.2014.09.009 |
| [104] |
Cauda V, Schlossbauer A, Bein T. Bio-degradation study of colloidal mesoporous silica nanoparticles:Effect of surface functionalization with organo-silanes and poly(ethylene glycol)[J]. Microporous & Mesoporous Materials, 2010, 132(1): 60-71. |
| [105] |
Hao N, Liu H, Li L, et al. In vitro degradation behavior of silica nanoparticles under physiological conditions[J]. Journal of Nanoscience & Nanotechnology, 2012, 12(8): 6346. |
| [106] |
Martinez J O, Chiappini C, Ziemys A, et al. Engineering multi-stage nanovectors for controlled degradation andtunable release kinetics[J]. Biomaterials, 2013, 34(33): 8469-8477. DOI:10.1016/j.biomaterials.2013.07.049 |
| [107] |
Park J H, Gu L, Von M G, et al. Biodegradable luminescent porous silicon nanoparticles for in vivo applications[J]. Nature Materials, 2009, 8(4): 331-336. |
| [108] |
Borak B, Biernat P, Prescha A, et al. In vivo study on the biodistribution of silica particles in the bodies of rats[J]. Advances in Clinical and Experimental Medicine, 2012, 21(1): 13-18. |
| [109] |
Guo M, Zou X, Hao R, et al. Fabrication of high surface area mesoporous silicon via magnesiothermic reduction for drug delivery[J]. Microporous & Mesoporous Materials, 2011, 142(1): 194-201. |
| [110] |
Maher S, Alsawat M, Kumeria T, et al. Microcarriers:luminescent silicon diatom replicas:self-reporting and degradable drug carriers with biologically derived shape for sustained delivery of therapeutics[J]. Advanced Functional Materials, 2015, 25(32): 5240. DOI:10.1002/adfm.201570218 |
| [111] |
Maher S, Kumeria T, Wang Y, et al. From the mine to cancer therapy:natural and biodegradable theranostic silicon nanocarriers from diatoms for sustained delivery of chemotherapeutics[J]. Advanced Healthcare Materials, 2016, 5(20): 2667-2678. DOI:10.1002/adhm.201600688 |
| [112] |
Le T D, Bonani W, Speranza G, et al. Processing and characterization of diatom nanoparticles and microparticles as potential source of silicon for bone tissue engineering[J]. Materials Science & Engineering C Materials for Biological Applications, 2016, 59: 471-479. |
| [113] |
Cicco S R, Vona D, De Giglio E, et al. Chemically modified diatoms biosilica for bone cell growth with combined drug-delivery and antioxidant properties[J]. Chempluschem, 2015, 80(7): 1104-1112. DOI:10.1002/cplu.201402398 |
| [114] |
Chao F, Jing L, Wu G S, et al. Chitosan coated diatom silica as hemostatic agent for haemorrhage control[J]. Acs Applied Materials & Interfaces, 2016, 8(50): 34234-34243. |
| [115] |
Fuhrmann T, Landwehr S, Rharbikucki M E, et al. Diatoms as living photonic crystals[J]. Applied Physics B, 2004, 78(3-4): 257-260. DOI:10.1007/s00340-004-1419-4 |
| [116] |
Yamanaka S, Yano R, Usami H, et al. Optical properties of diatom silica frustule with special reference to blue light[J]. Journal of Applied Physics, 2008, 103(7): 074701. DOI:10.1063/1.2903342 |
| [117] |
Noyes, Joseph, Sumper, et al. Light manipulation in a marine diatom[J]. Journal of Materials Research, 2008, 23(12): 3229-3235. DOI:10.1557/JMR.2008.0381 |
| [118] |
Di Caprio G, Coppola G, De S L, et al. Shedding light on diatom photonics by means of digital holography[J]. Journal of Biophotonics, 2014, 7(5): 341-350. DOI:10.1002/jbio.201200198 |
| [119] |
Butcher K S A, Ferris J M, Phillips M R, et al. A luminescence study of porous diatoms[J]. Materials Science & Engineering C Biomimetic & Supramolecular Systems, 2005, 25(5): 658-663. |
| [120] |
Bismuto A, Setaro A, Maddalena P, et al. Marine diatoms as optical chemical sensors:A time-resolved study[J]. Sensors & Actuators B Chemical, 2008, 130(1): 396-399. |
| [121] |
De Stefano L, Maddalena P, Moretti L, et al. Nano-biosilica from marine diatoms:A brand new material for photonic applications[J]. Superlattices & Microstructures, 2009, 46(1): 84-89. |
| [122] |
Setaro A, Lettieri S, Maddalena P, et al. Highly sensitive optochemical gas detection by luminescent marine diatoms[J]. Applied Physics Letters, 2007, 91(5): 051921. DOI:10.1063/1.2768027 |
| [123] |
Lettieri S, Setaro A, Stefano L D, et al. The gas-detection properties of light-emitting diatoms[J]. Advanced Functional Materials, 2008, 18(8): 1257-1264. DOI:10.1002/adfm.200701124 |
| [124] |
Kong X, Xi Y, Le Duff P, et al. Detecting explosive molecules from nanoliter solution:A new paradigm of SERS sensing on hydrophilic photonic crystal biosilica[J]. Biosensors and Bioelectronics, 2017, 88: 63-70. DOI:10.1016/j.bios.2016.07.062 |
| [125] |
Ren F, Campbell J, Rorrer G L, et al. Surface-enhanced Raman spectroscopy sensors from nanobiosilica with self-assembled plasmonic nanoparticles[J]. IEEE Journal of Selected Topics in Quantum Electronics, 2014, 20(3): 127-132. DOI:10.1109/JSTQE.2014.2301016 |
| [126] |
Ren F, Campbell J, Wang X, et al. Enhancing surface plasmon resonances of metallic nanoparticles by diatom biosilica[J]. Optics Express, 2013, 21(13): 15308-15313. DOI:10.1364/OE.21.015308 |
| [127] |
Kong X, Squire K, Li E, et al. Chemical and biological sensing using diatom photonic crystal biosilica with in-situ growth plasmonic nanoparticles[J]. IEEE Transactions on Nanobioscience, 2016, 15(8): 828-834. DOI:10.1109/TNB.2016.2636869 |
| [128] |
Lin K-C, Kunduru V, Bothara M, et al. Biogenic nanoporous silica-based sensor for enhanced electrochemical detection of cardiovascular biomarkers proteins[J]. Biosensors and Bioelectronics, 2010, 25(10): 2336-2342. DOI:10.1016/j.bios.2010.03.032 |
| [129] |
Kabiri S, Kurkuri M D, Kumeria T, et al. Frit-free PDMS microfluidic device for chromatographic separation and on-chip detection[J]. RSC Advances, 2014, 4(29): 15276-15280. DOI:10.1039/C4RA01393J |
| [130] |
Losic D, Mitchell J G, Lal R, et al. Rapid fabrication of micro-and nanoscale patterns by replica molding from diatom biosilica[J]. Advanced Functional Materials, 2007, 17(14): 2439-2446. DOI:10.1002/adfm.200600872 |
| [131] |
郑水林, 孙志明, 胡志波, 等. 中国硅藻土资源及加工利用现状与发展趋势[J]. 地学前缘, 2014, 21(5): 274-280. |
 2019
2019



