| 赤泥的弱酸浸出脱碱及综合利用研究 |
赤泥是铝土矿生产氧化铝过程中产生的一种碱性固体废弃物[1-3]。通过不同的生产工艺,每吨氧化铝可以产生1~2 t赤泥[4]。随着近年来全球氧化铝工业的快速发展,氧化铝生产的赤泥产量也大量增加[5]。目前,全球赤泥存储量估计超过34亿t,年增长率约1.2亿t[6]。遗憾的是,全球赤泥平均利用率仅为15%,中国赤泥平均利用率仅为4%[7]。因此,必须采取有效的技术手段来处理固体废物。根据目前的研究现状,赤泥可以应用于有价金属回收、土壤材料、填料和建筑材料[8-10]。然而,赤泥的强碱性限制了其应用,因此需要对赤泥进行脱碱处理,以便进行下一步的综合利用。
赤泥的脱碱方法主要有水浸法、钙离子置换法、湿法碳化法和强酸浸法[11-13]。水浸法可以去除赤泥中的游离碱,不消耗药剂,但需多次脱碱和长期浸出,延长了操作时间,影响了赤泥的后续综合利用[14]。钙离子置换法能显著去除赤泥中的游离碱和结构碱,但药剂用量较大,脱碱率一般在80%以下[15-16]。当使用湿法碳化处理赤泥时,钠的浸出率一般小于85%。该方法在不消耗化学药剂的情况下,有效地浸出赤泥中的游离碱和结构碱。但湿法碳化法要求在高压条件下浸出,对浸出设备要求严格,要求条件难以控制,操作繁琐[17-18]。
酸浸是一种有效的脱碱方法,一般认为,酸浓度越高,脱碱率越高。Hong等[20]研究表明,硫酸的浓度越高,钠的浸出率越高,在硫酸浓度为1.8 mol/L、温度20 ℃下反应30 min,钠的浸出率达到99.99%。Huang等[21]研究了利用柠檬酸从赤泥中选择性脱除钠,在柠檬酸用量15%、液固体比7 mg/g、浸出温度100 ℃、搅拌速度300 r/min、浸出时间为120 min条件下,钠的浸出率大于95%。Alharthi[22]等采用中性赤泥吸收CO2,在液固比为5 mL/g、浸出温度为25 ℃、搅拌速度为300 r/min条件下,碳化后赤泥中钠的含量降低到85%。同时酸浓度越高,金属回收率越高。在105 ℃条件下,Uzun和Gulfen[23]采用6 mol/L硫酸浸出赤泥,铁的浸出率可达97.46%。Tuncuk等[24]研究使用4 mol/L硫酸、固液比为0.04 g/L在90 ℃温度的条件下浸出4 h,铝的回收率高达96.82%。到目前为止,许多研究通过强酸浸出赤泥提高脱碱率和金属回收率[n(H2SO4)>6 mol/L],而对低浓度的酸浸关注较少。强酸浸出可获得较高的脱碱率,但选择性较低。钪、钇、铼、钛、钙和铝在酸浸液中溶解,导致滤液组成复杂,并产生污染的渗滤液。其强酸性使浸出渣[25]制备吸附剂、填料和建筑材料复杂化。此外,强酸浸出通常需要高温和高压,这增加了生产成本。本文创新性采用低浓度的硫酸浸出赤泥[(n(H2SO4) < 1 mol/L],根据赤泥应用于不同的领域时,对钠浸出率的要求有所不同的,选择不同程度的处理工艺,大大降低了生产成本,同时浸出液和浸出渣成分相对简单。例如,用于土壤团聚体的赤泥的处理过程相对简单,简单地将赤泥中的游离碱溶解,处理后赤泥的pH值约为8.5左右,为中性或弱碱性。以往的强酸浸出赤泥酸性过强,需要二次中和后应用于土壤,本阶段研究不需要二次中和。但是赤泥要用作建筑材料,必须将赤泥中结构碱去除,处理后赤泥中钠的含量约为0.6%,低于1%,满足建材要求。因此,理论上,赤泥样品经酸浸脱碱程度不同,可以广泛用于不同的领域[25]。
为了获得高效的脱碱率和降低生产成本,本文研究了较低浓度的硫酸浸出赤泥实现赤泥的脱碱,分析了赤泥酸浸过程中的主要影响因素、脱碱化机理和浸出动力学。该研究为赤泥的多级脱碱工艺提供了依据。
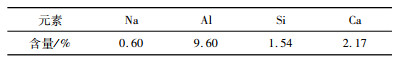
2 试验 2.1 试验原料与试剂试验用赤泥样品来源于山东省拜耳法氧化铝厂。表 1显示了赤泥的主要化学组成。由表可见,该赤泥中碱的主要成分为氧化钠,其含量高达9.14%。若不进行处理,会造成严重的环境污染,并且不能直接作为二次资源使用,同时氧化铝、氧化钙、氧化铁、氧化钛和氧化硅也出现在赤泥中。
| 表 1 赤泥的主要化学组成 Table 1 Main chemical compositions of red mud |
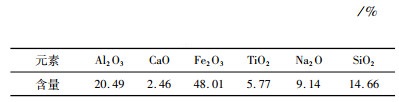
|
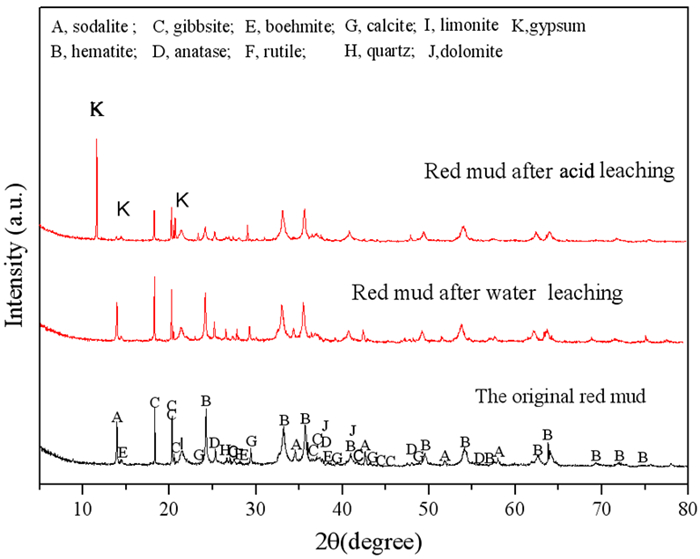
图 1显示了赤泥的XRD分析图谱。从图中可以看出该赤泥的主要的物相组成为方钠石、赤铁矿、长石、锐钛矿、薄水铝石、金红石、方解石、石英、褐铁矿、白云石。其中钠主要赋存于方钠石中,仅仅通过水浸过程难以去除。
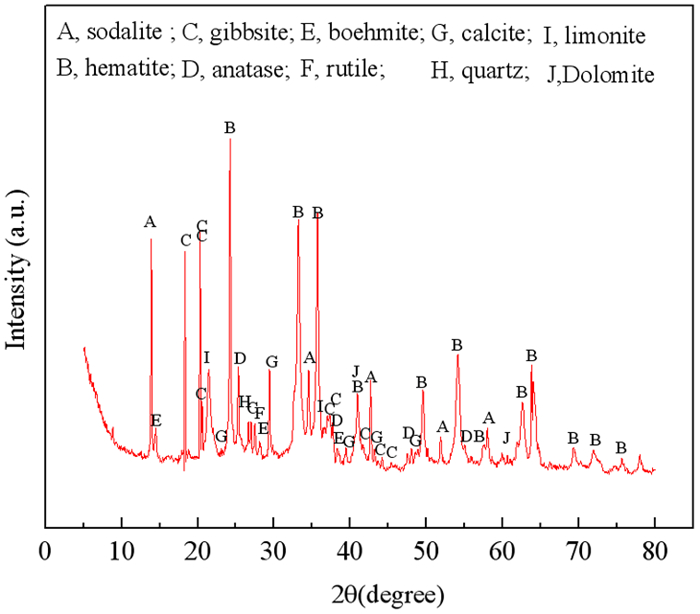 |
| 图 1 赤泥样品的XRD图谱 Fig.1 XRD patterns of red mud |
试验过程中所用试剂均为AR/GR级。硫酸(H2SO4,95%~98%)和Na标准溶液(1 000 mg/mL)为天津登科化学试剂技术有限公司。试验用水为去离子水。
2.2 试验设置与步骤首先,将赤泥样品(100 g)按质量/体积(g/L)的比例加入到一定浓度的硫酸溶液中。然后,在不同浸出温度和浸出时间下,使用KX79-1型磁加热搅拌机,以300 r/min的转速(搅拌速度实验除外)和1/4 g/mL的固液比(S/L)搅拌赤泥浆料。用国产SHB-IIIA真空吸滤机过滤得到酸浸液和浸出渣。浸出渣在80 ℃烘干16 h (TE-DO130)。
2.3 分析方法采用电感耦合等离子体发射光谱法(ICP-OES、SPECTRO BLUE SOP、SPECTRO)测定浸出液中钠等元素的含量。利用式(1)[26]计算离子的浸出率(X):
| $ X=\left(M_{1} \times V_{1}\right) /\left(M_{2} \times m\right) \times 100 \% $ | (1) |
X为M离子的浸出率, M2为M元素在赤泥中的含量(g/mL), m是赤泥的质量g,M1为滤液中M离子的含量(g/mL), V1为滤液的体积(mL)。
采用能量衍射谱(SEM-EDS, Nova400 NanoSEM, le350PentaFET X-3)扫描电子显微镜和X射线衍射(XRD, D8 Advance, BRUKER)对酸浸前后样品进行表征。
根据未反应收缩核模型理论,赤泥酸浸脱碱动力学可以通过式(2)描述:
| $\begin{array}{c} t=\left[1-2 x_{i} / 3-\left(1-x_{i}\right)^{\frac{2}{3}}\right] / k_{a}+ \\ {\left[1-\left(1-\left(1-x_{i}\right)^{\frac{1}{3}}\right] / k_{b}\right.} \end{array} $ | (2) |
若浸出过程受产物层扩散控制,则浸出动力学可由式(3)表示:
| $k_{a} t=\left[1-2 x_{i} / 3-\left(1-x_{i}\right)^{\frac{2}{3}}\right] $ | (3) |
此过程中1-2xi/3-(1-xi)
若浸出过程受化学反应控制,浸出动力学可由式(4)表示:
| $k_{b} t=\left[1-\left(1-\left(1-x_{i}\right)^{\frac{1}{3}}\right]\right. $ | (4) |
此过程中1-(1-(1-xi)
温度对浸出速率的影响主要表现在速率常数,可用Arrhenius公式表示两者之间的关系:
| $K=\ln k_{0} e^{\frac{-E_{0}}{R T}} $ | (5) |
两边取对数得到:
| $\ln k=\ln k_{0}-\frac{E_{0}}{R} \cdot \frac{1}{T} $ | (6) |
式中:t为反应时间(min),xi为金属离子的浸出率,ka为内扩散速率常数(min-1),kb为化学反应速率常数(min-1),T为开氏温度(K),E0为表观活化能(KJ/mol),R为8.314 J·mol-1·K-1,K0为频率因子。
对lnk对1/T作图,然后求直线的斜率,就可以计算出赤泥反应的表观活化能。
3 结果和讨论 3.1 赤泥的浸出行为 3.1.1 硫酸浓度的影响在固液比(S/L)为1/4 g/mL,搅拌速度为300 r/min,298 K温度条件下浸出10 min。研究了不同酸浓度对赤泥脱碱的影响,结果如图 2所示。
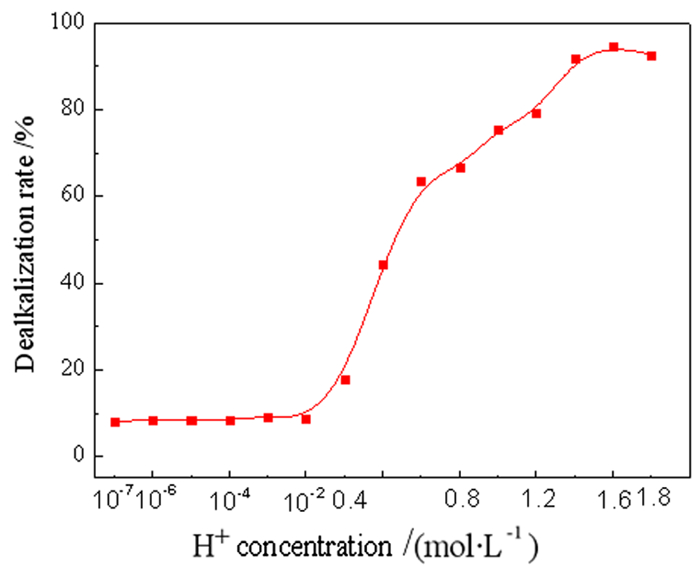 |
| 图 2 H+浓度对赤泥脱碱的影响 Fig.2 Effect of H+ concentration on the dissolution efficiency of Na from red mud |
从图 2可以看出,不添加H2SO4时,赤泥的脱碱率仅为8.02%。当酸度小于0.05 mol/L时,脱碱率基本不变,当酸度大于0.05 mol/L时,脱碱率明显增加。在0.8 mol/L H2SO4的作用下,赤泥脱碱率可达94.70%。当H2SO4浓度大于0.8 mol/L时,脱碱率略有降低。因此,选择硫酸的最佳酸浓度为0.8 mol/L。
3.1.2 固液比的影响在硫酸浓度为0.8 mol/L、搅拌速度为300 r/min、搅拌温度为298 K、浸出时间为10 min的条件下进行酸浸实验,研究不同S/L比对赤泥脱碱的影响。结果如图 3所示。
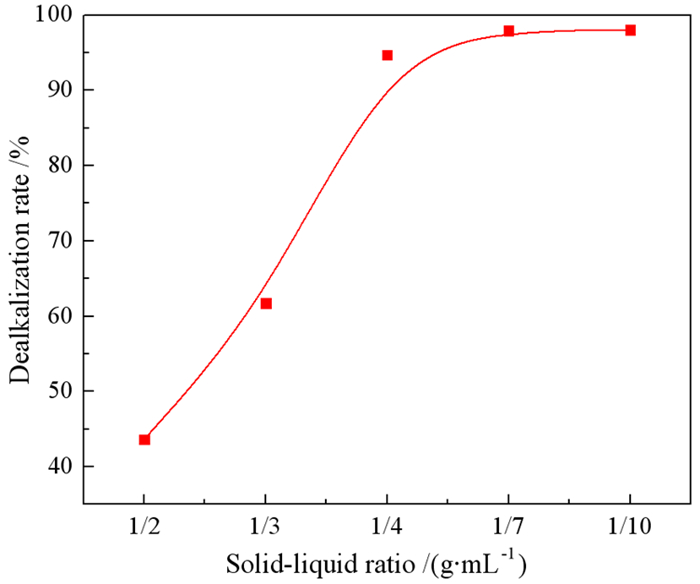 |
| 图 3 固液比对赤泥脱碱的影响 Fig.3 Effect of S/L ratio on the dissolution efficiency of Na in red mud |
从图 3可以看出,脱碱率随S/L比的减小而增大。当S/L比由1/2 g/mL降至1/4 g/mL时,脱碱率迅速提高,由43.66%提高到94.70%。当S/L比降至1/10 g/mL时,脱碱率变化不大,由94.90%升至98.03%。随着S/L比的降低,虽然减少赤泥的用量可以获得较高的脱碱率,但H2SO4与赤泥没有反应完全。因此,本实验选择1/4 g/mL作为最佳的S/L比。
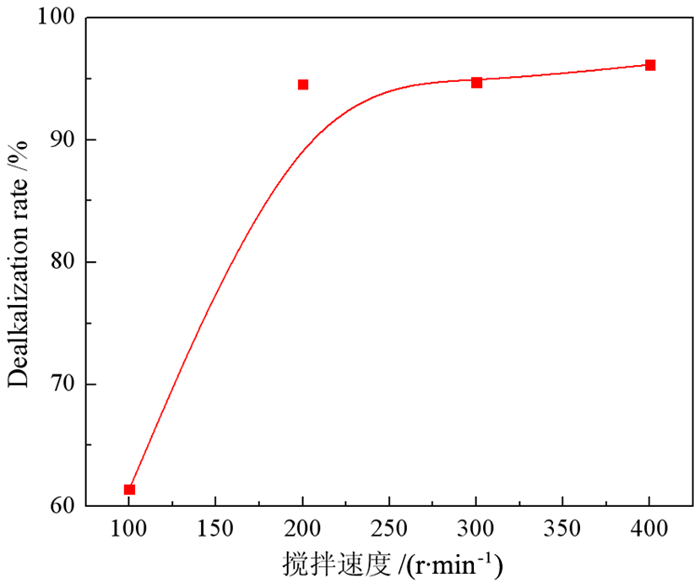
3.1.3 搅拌速度的影响在0.8 mol/L H2SO4、S/L比为1/4 g/mL、298 K温度下反应10 min,研究搅拌速度对赤泥脱碱的影响,结果如图 4所示。
 |
| 图 4 搅拌速度对赤泥脱碱的影响 Fig.4 Effect of stirring speed on the dissolution efficiency of Na from red mud |
从图 4可以看出,随着搅拌速度从100 r/min增加到300 r/min,脱碱率迅速增加,从61.43%增加到94.70%。因为搅拌过程加速了酸浸过程中反应物的传质和扩散,从而促进了脱碱反应的进行[27]。当搅拌速度增加到400 r/min时,脱碱率只有少量增加,由94.70%增加到96.13%。由于搅拌速度过快,离心力增大,离子接触时间缩短,反应不完全,容易导致溶液乳化,阻碍H2SO4与赤泥的相分离[28]。搅拌速度过快,能耗高[29]。因此,本实验的最佳搅拌速度为300 r/min。
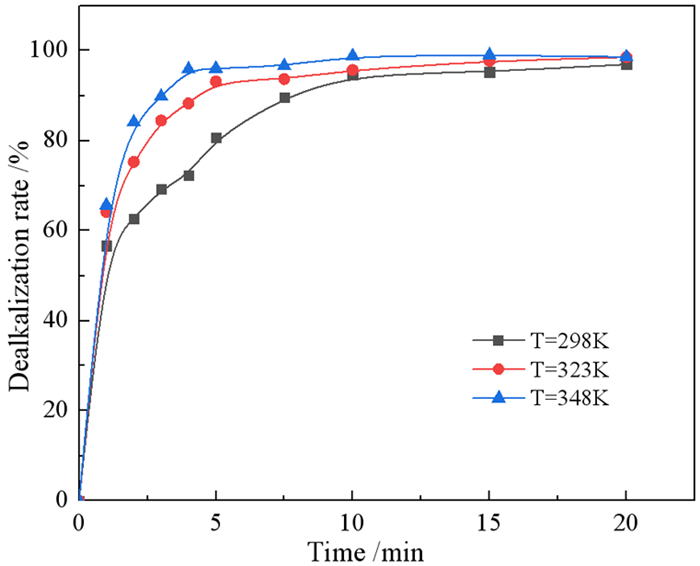
3.1.4 浸出温度和反应时间的影响考察反应温度和反应时间对浸出效果的影响可以估计反应的表观活化能,从而判断反应动力学模型及反应过程的限制环节。在浸出优化条件为H2SO4浓度为0.8 mol/L、固液比为1/4 g/mL、搅拌速度为300 r/min时,考察不同温度(298 K、323 K、348 K)下浸出时间对钠浸出率的影响,如图 5所示。
 |
| 图 5 浸出温度和反应时间对赤泥脱碱的影响 Fig.5 Effect of temperature on the leaching of Na |
在不同温度下,钠的浸出率随反应时间的变化如图 5所示,在323 K和348 K温度下,前5 min内浸出率迅速增加到较高值,随着时间的延长,钠的浸出率几乎不变。在298 K浸出温度条件下,钠的浸出率在10 min时迅速增加达到较高值,随着时间继续增加,钠的浸出率变化不大。在浸出时间为10 min时,浸出温度为298 K、323 K、348 K条件下,钠的浸出率分别为94.70%、95.71%、97.63%。当浸出温度在20 min时,在相同的浸出温度条件下,钠的浸出率分别为96.96%、98.54%、98.61%。因此在323 K和348 K温度下浸出5 min或者在298 K温度下浸出10 min,硫酸与赤泥中大部分含钠的化合物基本反应完全,大部分的钠被浸出,尽管升高温度和延长浸出时间可以进一步提高钠的浸出率,但是赤泥中剩余钠的含量低,浸出率变化不大,考虑到消耗大量能量,成本较高,为了获得高效的脱碱化和较低的成本,选择浸出温度为298 K下浸出10 min为合适的浸出条件。
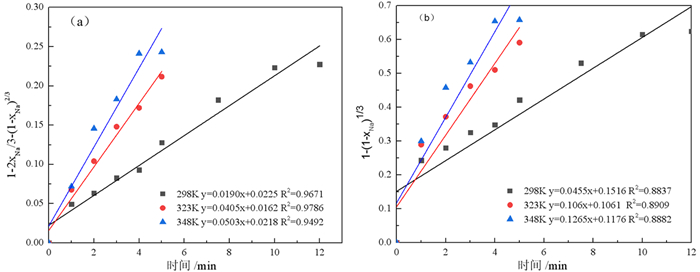
3.2 动力学分析为了确定酸浸脱碱主要过程的动力学特征,将323 K和348 K温度下前5 min的数据和298 K前10 min的数据代入式(3)和式(4)进行线性拟合,结果如图 6所示。通过比较可知,赤泥中钠离子的浸出与化学反应控制偏差较大,而与产物层扩散控制模拟公式的拟合效果比较好,这一点从相关系数R2可以看出,产物层扩散与反应时间关系的相关系数均明显大于化学反应与反应时间关系的相关系数,由此可以推断钠的浸出过程主要受产物层扩散模型控制。同时,随着温度的提高,产物层扩散速率常数增长明显,可从298 K时的0.019 0 min-1增长到323 K时的0.040 5 min-1,而348 K时的产物层扩散速率常数为0.050 3 min-1。
 |
| 图 6 赤泥酸浸过程产物层扩散控制(a)和化学反应控制(b)动力学拟合曲线 Fig.6 Acid leaching product layer diffusion control (a) and chemical reaction control (b) dynamics fitting curves |
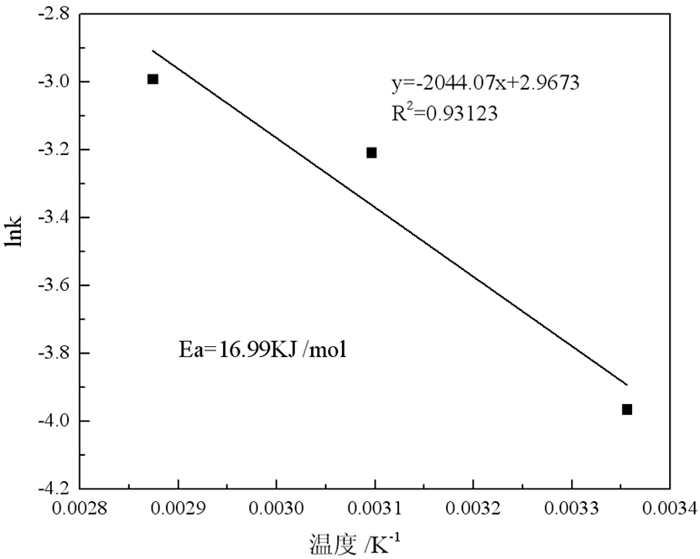
将图 6所求的速率常数k代入式(6),以lnk对1/T作图,得到图 7中的关系曲线,根据图 7斜率求出反应活化能E0。由图 7所得的相关系数0.931 2,直线斜率为-2 044.07,求出钠浸出过程的表观活化能为16.99 KJ/mol,根据浸出动力学理论,当表观活化能大于41.8 kJ/mol时,浸出过程受化学反应控制;当表观活化能小于11.2 kJ/mol时受产物层扩散控制;当表观活化能介于两者之间时,浸出过程受化学反应和产物层扩散联合控制,该赤泥酸浸过程表观活化能更接近于11.2 kJ/mol,故受产物层扩散步骤控制,表观活化能越低,说明反应速率越快,反应过程越容易进行,因此较低浓度的硫酸更容易与赤泥中的含钠化合物发生反应,达到脱碱的效果[30]。
 |
| 图 7 酸浸脱碱过程的表观活化能曲线 Fig.7 The curve of apparent activation energy on recovery of Na with sulfuric acid leaching |
3.3 XRD分析结果
硫酸浸出前后赤泥物相分析结果如图 8所示,主要物相有方钠石[(Na6Al6Si6O24)·(2NaX or Na2X)]、赤铁矿(Fe2O3)、三水铝石[Al (OH)3]、锐钛矿(TiO2)、勃姆石[γ-AlO(OH)]、金红石(TiO2)、石英(SiO2)、方解石(CaCO3)、褐铁矿[FeO(OH)·nH2O]、白云石[CaMg(CO3)]和石膏(CaSO4)。
 |
| 图 8 硫酸浸出前后浸出渣的XRD图谱 Fig.8 XRD patterns of the leaching residue before and after sulfuric acid leaching |
从图 8中XRD分析可知,在不使用H2SO4的浸出过程中,赤泥的矿物组成没有变化,即水浸出过程。如上所述,赤泥中的钠离子主要存在于方钠石中,且难以去除。因此,在无硫酸浸出时,由于赤泥中游离钠NaOH、Na2CO3、Na2SO4的溶解,赤泥的脱碱率仅为17.84%。0.8 mol/L H2SO4使酸浸渣中方钠石和方解石的衍射峰降低,赤泥脱碱率达到94.70%,部分赤铁矿和三水铝石溶解在酸浸液中。在酸浸渣中出现了石膏的衍射峰,表明可能有部分方解石与硫酸反应中形成石膏。结合动力学分析, 赤泥中的方解石与硫酸反应生成硫酸钙微溶物质,一部分溶解在溶液中,另一部分附着在赤泥颗粒表面,抑制了赤泥和硫酸的进一步反应, 降低钠离子浸出反应的活化能。而酸浸渣中褐铁矿、辉石、锐钛矿、金红石和石英的矿物组成基本不变。结果表明,采用硫酸浸出工艺可以达到理想的脱碱效果。
由表 2可知,浸出渣中钠含量仅为0.6%,说明H2SO4浸出对赤泥脱碱有较高的效果。因此,脱碱后的浸出渣可安全用于筑坝或作为建筑材料和吸附材料的原料。该工艺实现了赤泥脱碱,既安全又环保。
| 表 2 浸出渣的主要化学成分 Table 2 The main chemical composition of the leached residue |
|
3.4 SEM分析结果
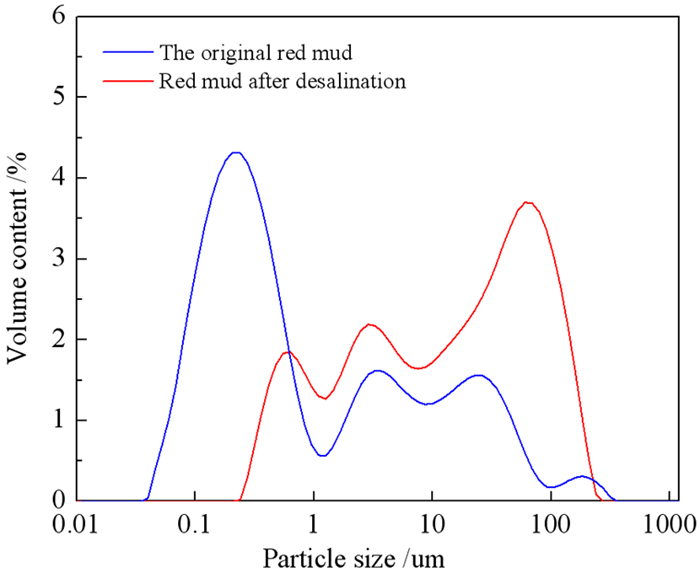
分别测定了原赤泥、硫酸脱碱后赤泥的粒度分布。结果如图 9所示。可以看出,脱碱前后赤泥的粒级发生了很大的变化。原始赤泥粒径主要集中在0.1~ 10 μm, 0.01~0.1 μm最大,占49.53%。脱碱赤泥粒径主要集中在10~1 000 μm,其中10~100 μm最大,占35.18%。硫酸脱碱后赤泥粒径比原始赤泥粒径粗,说明硫酸脱碱能促进赤泥颗粒间的团聚。
 |
| 图 9 原赤泥与硫酸脱碱后赤泥粒度分布 Fig.9 Particle size distribution of red mud and the residue after dealkalization |
用扫描电镜分析了浸出前后赤泥的微观结构。图 10 (A)和(B)对应于脱碱前后赤泥的SEM图像(S/L比值1/4 g/mL, 搅拌速度300 r/min和硫酸浓度为0.8 mol/L 10 min在298 K), 赤泥的粒径显著增加, 增加了从几微米到几十微米。结果表明,硫酸能促进赤泥颗粒的团聚,且两者具有协同作用,有利于后续在工业生产中应用[31]。结果表明,酸浸是一种较好的脱碱方案。
 |
| 图 10 (A) 原始赤泥和(B)硫酸脱碱后浸出渣的SEM图像 Fig.10 SEM images of (A) the original red mud and (B) the residue after dealkalization |
4 赤泥的综合利用
基于上述理论分析,酸的用量对赤泥脱碱行为有显著影响。根据赤泥的用途不同,对赤泥采用不同的处理工艺,使赤泥得到高效的回收利用。
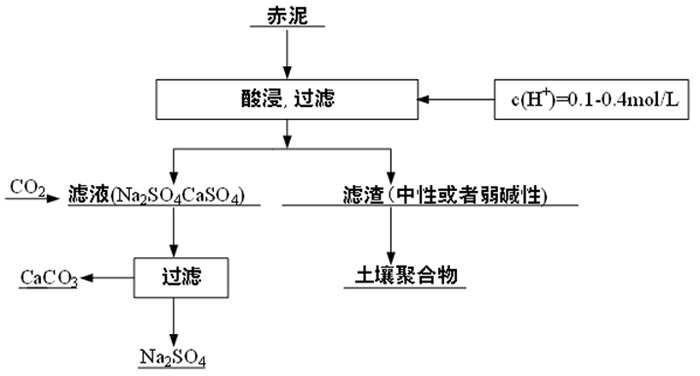
例如,如果赤泥用于土壤,只需要将赤泥的pH值降为中性或微碱性。在这种情况下, 它不需要钠的浸出率很高、赤泥脱碱所需要的酸用量非常小, 因此设计一个相对简单的处理工艺, 如图 11所示。图 12显示了赤泥滤渣作为土壤种植的月季花,此时的土壤是用H2SO4浓度为0.2 mol/L的酸溶液处理后呈微碱性的赤泥滤渣。图 12(a)、12(b)分别为在赤泥滤渣中种植了5天和15天的月季。图 12(c)是图 12 (b)的部分放大图。从图 12 (c)中可以清楚地看到月季能够开花并长出新芽,说明此时的赤泥滤渣可以作为土壤。
 |
| 图 11 赤泥脱碱后滤渣作为土壤团聚体的工艺流程图 Fig.11 Flow chart of red mud dealkalization leaching process and filter residue used as soil aggregates |
 |
| 图 12 赤泥脱碱后代替土壤直接种植月季生长图(a)种植5 d;(b)种植15 d;(c)种植15 d局部放大图 Fig.12 The Rosa Chinensis planted for (a) 5 days, (b) 15 days, and (c) 15 days with the enlarged image |
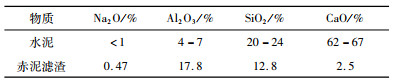
如果赤泥用作建筑材料,钠的含量必须降低到1%以下[32]。此时需要较大的酸剂量,浸出液中也含有大量的钙,根据动力学的结果,可以考虑优先通入二氧化碳除掉钙离子,如图 13所示。水泥和赤泥滤渣的成分对比见表 3。结果表明,当H2SO4浓度为1.6 mol/L时,钠含量为0.47%。此时的赤泥滤渣可以代替水泥用于建筑材料[33]。
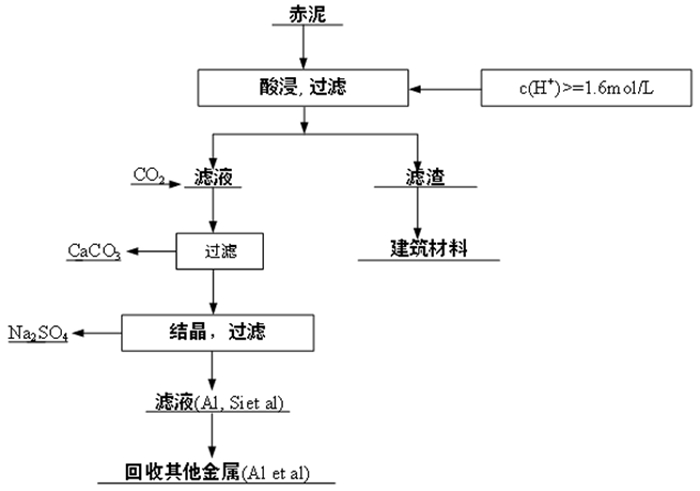 |
| 图 13 赤泥脱碱后滤渣作为建筑材料的工艺流程图 Fig.13 Flow chart of red mud dealkalization leaching process and filter residue used as building materials |
| 表 3 水泥和赤泥滤渣成分对比 Table 3 The composition of cement and red mud residual |
|
5 结论
(1) 最佳酸浸脱碱条件为:0.8 mol/L硫酸,反应温度298 K,反应时间10 min, S/L比1/4 g/mL,搅拌速度300 r/min,脱碱率可达90%以上。该处理工艺不仅取得了有效的脱碱效果,而且试验中使用的低浓度硫酸可以用工业废酸代替,为工业废酸的充分利用提供了可能。
(2) 动力学分析表明,在较低浓度硫酸浸出过程中,赤泥脱碱的主要过程受产物层扩散控制,钠浸出过程的表观活化能为16.99 kJ/mol。XRD分析结果证实,产物层形成的主要原因是赤泥中的方解石与硫酸反应生成硫酸钙微溶物质,一部分溶解在溶液中,另一部分附着在赤泥颗粒表面,抑制了赤泥和硫酸的进一步反应,要想提高浸出率优先考虑除钙,然后再进行下一步的酸浸反应,这样不仅可以节约酸,还能降低钠离子浸出反应的活化能。
(3) 基于以上的理论研究,提出一种多级酸浸脱碱工艺:(1)当H+浓度从0.1 mol/L增加到0.4 mol/L时,得到的滤渣为弱碱性可以直接应用于土壤; (2)当H+浓度达到1.6 mol/L时,剩余的滤渣中钠含量为0.6%,可用于建筑材料,实现赤泥的回收利用。
| [1] |
ZHANG Y, SHI Q, LUO M, et al. Improved bauxite residue dealkalization by combination of aerated washing and electrodialysis[J]. Journal of Hazardous Materials, 2019, 364: 682-690. DOI:10.1016/j.jhazmat.2018.10.023 |
| [2] |
LU F, XIAO T, LIN J, et al. Recovery of gallium from Bayer red mud through acidic-leaching-ion-exchange process under normal atmospheric pressure[J]. Hydrometallurgy, 2018, 175: 124-132. DOI:10.1016/j.hydromet.2017.10.032 |
| [3] |
CHUN T, ZHU D, PAN J, et al. Recovery of Alumina from Magnetic Separation Tailings of Red Mud by Na2CO3 Solution Leaching[J]. Metallurgical & Materials Transactions B, 2014, 45(3): 827-832. DOI:10.1007/s11663-014-0023-1 |
| [4] |
WANG Q, YU H, BEN T, et al. Preparation of lightweight high-strength thermal insulation and decoration integration porous ceramics using red mud[J]. Journal of the Australian Ceramic Society, 2019, 91-98. DOI:10.1007/s41779-019-00374-y |
| [5] |
CHUN S, RAI H, NISHIYAMA M, et al. Using Organic Matter with Chemical Amendments to Improve Calcareous Sodic Soil[J]. Communications in Soil Science & Plant Analysis, 2007, 38(1): 205-216. |
| [6] |
YI R R, CAO W. Current Situation and Prospect of Comprehensive Utilization of Red Mud[J]. Applied Mechanics & Materials, 2014, 522/523/524: 811-816. |
| [7] |
DAVRIS P, BALOMENOS E, PANIAS D, et al. Selective leaching of rare earth elements from bauxite residue (red mud), using a functionalized hydrophobic ionic liquid[J]. Hydrometallurgy, 2016, 164: 125-135. DOI:10.1016/j.hydromet.2016.06.012 |
| [8] |
HE H, YUE Q, QI Y, et al. The effect of incorporation of red mud on the properties of clay ceramic bodies[J]. Applied Clay Science, 2012, 70(DEC.): 67-73. |
| [9] |
KANG S P, KWON S J. Effects of red mud and Alkali-Activated Slag Cement on efflorescence in cement mortar[J]. Construction & Building Materials, 2017, 133: 459-467. |
| [10] |
KANFMAN, E N., LITTLE M H., SELVARAJ PT. Recycling of FGD gypsum to calcium carbonate and elemental sulfur using mixed sulfate-reducing bacteria with sewage digest as a carbon source[J]. Journal of Chemical Technology & Biotechnology, 2010, 66(4): 365-374. |
| [11] |
ZHU X, LI W, GUAN X. An active dealkalization of red mud with roasting and water leaching[J]. Journal of Hazardous Materials, 2015, 286: 85-91. DOI:10.1016/j.jhazmat.2014.12.048 |
| [12] |
CHEN L B, ZHANG Y F, ZHANG Y. Dealkalization of red mud generated in alumina production by sub-molten salt process under atmospheric pressure[J]. Chinese journal of process engineering, 2010, 10(3): 470-475. |
| [13] |
ZHAO B L, HONG X L, MENG M L. Effects of cooling method on removal of sodium from active roasting red mud based on water leaching[J]. Hydrometallurgy, 2017, 167: 92-100. DOI:10.1016/j.hydromet.2016.10.021 |
| [14] |
LUO M, QI X, ZHANG Y, et al. Study on dealkalization and settling performance of red mud[J]. Environmental ence and Pollution Research, 2016, 24(2): 1-9. |
| [15] |
U ROHDE, F RUTHE, PG JONES, et al. Formation and Structure of the First 7-Aza-1-phosphanorbornadiene Complex[J]. Angewandte Chemie International Edition, 2010, 38(1/2): 215-217. |
| [16] |
LUO M, Y REN, J TONG, et al. Study on dealkalization and settling performance of red mud[J]. Environmental Science & Pollution Research International, 24(2): 1794-1802. |
| [17] |
WANG Y, ZHANG T A, LYU G, et al. Recovery of alkali and alumina from bauxite residue (red mud) and complete reuse of the treated residue[J]. Journal of Cleaner Production, 2018, 188(1): 456-465. |
| [18] |
JIAO J, LANG L, RUOHUA L, et al. Preparation and thermal performance of binary fatty acid with diatomite as form-stable composite phase change material for cooling asphalt pavements[J]. Construction and Building Materials, 2019, 226(30): 616-642. |
| [20] |
HONG L C, TING W, YANG K, et al. Technology conditions and mechanism discussion of sodium and iron extraction from red mud by acid[J]. inorganic chemicals industry, 2016, 1: 44-48. |
| [21] |
HUANG K, LI Y F, JIAO S Q, et al. Adsorptive removal of methylene blue dye wastewater from aqueous solution using citric acid activated red mud[J]. Zhongguo Youse Jinshu Xuebao/Chinese Journal of Nonferrous Metals, 2011, 21(12): 3182-3188. |
| [22] |
ALHARTHI A I, HARGREAVES J S J, PULFORD I D, et al. Hydrocarbon cracking over red mud and modified red mud samples[J]. Sustain. Metall, 2016, 2: 387-393. DOI:10.1007/s40831-016-0082-4 |
| [23] |
UZUN D, MUSTAFA G. Dissolution kinetics of iron and aluminium from red mud in sulphuric acid solution[J]. Indian Journal of Chemical Technology, 2007, 14(3): 263-268. |
| [24] |
TUNCUK A, CIFTLIK S, AKCIL A. Factorial experiments for iron removal from kaolin by using single and two-step leaching with sulfuric acid[J]. Hydrometallurgy, 2013, 134/135: 80-86. DOI:10.1016/j.hydromet.2013.02.006 |
| [25] |
BORRA C R, BLANPAIN B, PONTIKES Y, et al. Recovery of Rare Earths and Major Metals from Bauxite Residue (Red Mud) by Alkali Roasting, Smelting, and Leaching[J]. Journal of Sustainable Metallurgy, 2017, 3(2): 393-404. DOI:10.1007/s40831-016-0103-3 |
| [26] |
JIAO J, YaANQING T, RUO H L, et al. Synergy Effect of Attapulgite, Rubber, and Diatomite on Organic Montmorillonite Modified Asphalt[J]. Journal of Materials in Civil Engineering, 2019, 31(2): 04018388. DOI:10.1061/(ASCE)MT.1943-5533.0002601 |
| [27] |
ZHANG Y, HU Y, SUN N, et al. A novel precipitant for separating lithium from magnesium in high Mg/Li ratio brine[J]. Hydrometallurgy, 2019, 187: 125-133. DOI:10.1016/j.hydromet.2019.05.019 |
| [28] |
EDWIN C. Microscopical and elemental FESEM and Phenom ProX-SEM-EDS analysis of osteocyte- and blood vessel-like microstructures obtained from fossil vertebrates of the Eocene Messel Pit, Germany[J]. Peerj, 2016, 4(5). |
| [29] |
KONG X, LI M, LI X, et al. Acid transformation of bauxite residue: conversion of its alkaline characteristics[J]. Journal of Hazardous Material, 2017, 324: 382-390. DOI:10.1016/j.jhazmat.2016.10.073 |
| [30] |
SAHU M.K, PATEL R K J R A. Removal of safranin-O dye from aqueous solution using modified red mud[J]. Kinetics and equilibrium studies, 2015, 5(96): 78491-78501. DOI:10.1016/j.jhazmat.2016.10.073 |
| [31] |
LI X F, YE Y Z, XUE S G, et al. Leaching optimization and dissolution behavior of alkaline anions in bauxite residue[J]. Transactions of Nonferrous Metals Society of China, 2017, 28(6). |
| [32] |
XUE S G, WU Y J, LI Y W, et al. Application of industrial waste to alkaline regulation of red mud[J]. Journal of central south university, 2019, 26(2): 268-288. DOI:10.1007/s11771-019-4000-3 |
| [33] |
LANCIA A, MUSMARRA D, PEPE F, et al. Characteristic times for limestone particle dissolution in the production of gypsum from the wet flue gas desulfurization process[J]. Environmental Science & Technology, 1994, 28(6): 1031-1036. |
 2021
2021


