| 湿法炼锌渣柠檬酸浸出回收钴、锌和镍 |
2. 上海大学 省部共建高品质特殊钢冶金与制备国家重点实验室, 上海 200444
2. State Key Laboratory of Advanced Special Steel, Shanghai University, Shanghai 200444, China
近年来,中国锌冶炼行业快速发展,锌产量已连续多年位居世界第一[1-2]。锌的冶炼分火法和湿法两类,但现在世界上85%以上的锌都由湿法工艺生产,其主要生产工序包括焙烧、浸出、净化和电积[3-5]。由于湿法炼锌在净化阶段产出的渣中含有相当数量的钴、镍、铜、锌、铅、镉等有价金属,若弃之不用,不仅造成环境污染,也是有价金属资源的浪费,因此有必要加以综合回收利用[6-8]。
目前,从湿法炼锌净化渣中回收有价金属的主要方法有氧化沉淀法、选择性浸出法、溶剂萃取法等[9-11]。无论采用何种方法,浸出都是最重要的环节,其主要目的是将净化渣中的目标金属通过化学反应转移到浸出液中,以便于进一步从中分离和提取有价金属元素,并制成相应产品[12-13]。目前主要采用传统无机酸(如H2SO4[14]、HCl[15]、HNO3[16])浸出净化渣中的有价金属,并配合溶剂萃取或选择性沉淀等进行分离回收。然而,采用无机酸处理净化渣不仅在浸出和金属提取过程中会污染环境,增大环保压力,而且对设备造成腐蚀,增加成本[17]。使用有机酸作为浸出剂较无机酸对环境更友好,朱显峰等[18]采用苹果酸作为浸出剂,对废旧锂离子电池三元正极材料的酸浸过程进行了研究,在优化条件下,Co和Ni的浸出率均达到95%以上。Li等人[19]将柠檬酸用于废旧锂离子电池中有价金属的浸出回收,在最佳条件下超过90%的钴被浸出。尽管有机酸浸出废旧电池中的有价金属有相关研究,但采用有机酸浸出湿法炼锌净化渣未见文献报道,因此本文提出了采用有机酸浸出湿法炼锌净化渣中有价金属的方法。
本研究以云南某锌冶炼厂产生的净化渣为研究对象,采用有机酸作为浸出剂。根据金属离子与有机酸的络合原理[20],研究了有机酸种类、浸出剂浓度、浸出温度、液固比、浸出时间、搅拌速度和pH值对有价金属浸出率的影响。以期为湿法炼锌净化渣中有价金属回收利用提供一种经济环保的方法,从而达到锌矿资源综合利用的目的。
1 试验部分 1.1 试验原料试验所用湿法炼锌净化渣来自云南某企业,外观为浅绿色。将该净化渣研磨过0.180 mm分样筛,然后在105 ℃下烘干至恒重,测得含水率为20.46%,去除水分的净化渣置于干燥器中保存备用。该净化渣的化学成分如表 1所示,物相分析结果(XRD)如图 1所示。
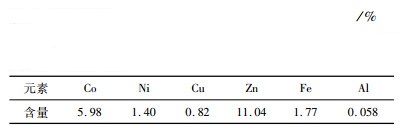
| 表 1 湿法炼锌净化渣主要化学成分 Table 1 Main chemical components of purification residue from zinc hydrometallurgy |
|
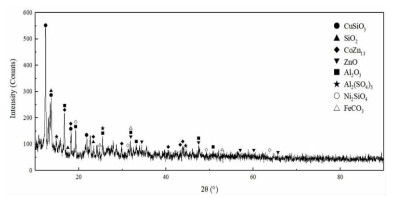 |
| 图 1 湿法炼锌净化渣XRD图谱 Fig.1 XRD pattern of purification residue from zinc hydrometallurgy |
从表 1可以看出,该湿法炼锌净化渣Co、Ni、Fe、Zn的含量均超过1%,其中Co的含量高达5.98%,极具回收价值。图 1表明,湿法炼锌净化渣成分比较复杂,主要成分有钴锌合金、硅酸镍、硅酸铜、氧化锌、硫酸铝、脉石等。
1.2 试验仪器与试剂(1) 试验主要仪器:电热恒温鼓风干燥箱、数显恒温双孔水浴锅、雷磁pHS-3C型pH计、循环水式多用真空泵SHB-IIIA。
分析仪器为X射线衍射仪(D8 ADVANCE)和电感耦合等离子体发射光谱仪(Thermo Scientific iCAP 6000)。
(2) 试验试剂:柠檬酸、苹果酸、H2SO4、NaOH等,均为分析纯,购自国药集团化学试剂有限公司。
1.3 试验方法(1) 原料预处理:因湿法炼锌净化渣直接用有机酸浸出,有价金属的浸出率很低,故浸出前将渣在600 ℃下焙烧4 h进行预处理。处理后物相分析结果(XRD)如图 2所示。
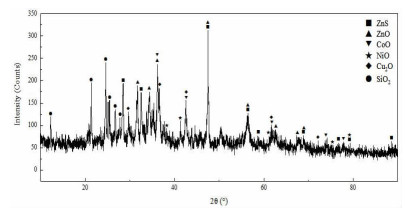 |
| 图 2 预处理后湿法炼锌净化渣XRD图谱 Fig.2 XRD pattern of purification residue from zinc hydrometallurgy after pretreatment |
从图 2可以看出,预处理后湿法炼锌净化渣中有价金属存在形态发生了改变,主要以氧化亚钴、氧化镍和氧化锌等形式存在。
(2) 浸出试验:准确称取10.00 g预处理后的湿法炼锌净化渣,加入于250 mL三口烧瓶中, 添加适量的浸出剂,置于水浴锅中搅拌反应一定时间后,用循环水式多用真空泵进行液固分离,得到滤液后测定终点pH值,浸出渣用去离子水洗涤过滤3遍以上,浸出液及洗涤液均加入500 mL容量瓶中并定容。取5 mL定容液稀释20倍后,用ICP-OES测定其中的金属含量。金属浸出率X(%)计算公式如下所示:
| $ X = \frac{{CV \times 20}}{{MW \times {{10}^{ - 6}}}} \times 100\% $ | (1) |
式中:
X为金属的浸出率,%;
C为浸出液中金属离子的浓度,μg/L;
V为浸出液定容体积,mL;
M为净化渣的试样质量,g;
W为净化渣中相应金属的含量,%。
1.4 试验原理柠檬酸(CA),又名枸橼酸,分子式为C6H8O7,是一种三羧酸类化合物,为无色晶体,无臭,易溶于水,柠檬酸有三个H+可以电离,其电离方程式如下[17, 21]:
| $ {{\rm{H}}_{\rm{3}}}{\rm{Cit = }}{{\rm{H}}_{\rm{2}}}{\rm{Ci}}{{\rm{t}}^ - }{\rm{ + }}{{\rm{H}}^{\rm{ + }}}pK{a_{\rm{1}}} = 3.13 $ | (2) |
| $ {{\rm{H}}_{\rm{2}}}{\rm{Ci}}{{\rm{t}}^ - }{\rm{ = HCi}}{{\rm{t}}^{{\rm{2}} - }}{\rm{ + }}{{\rm{H}}^{\rm{ + }}}pK{a_2} = 4.76 $ | (3) |
| $ {\rm{HCi}}{{\rm{t}}^{{\rm{2}} - }}{\rm{ = Ci}}{{\rm{t}}^{{\rm{3}} - }}{\rm{ + }}{{\rm{H}}^{\rm{ + }}}pK{a_{\rm{3}}}{\rm{ = 6}}{\rm{.40}} $ | (4) |
由此可知,柠檬酸是一种中等强度的酸。作为酸它可与金属氧化物发生复分解反应,以二价金属氧化物为例,反应通式为:
| $ {\text{MO + 2}}{{\text{H}}_{\text{3}}}{\text{Cit}} \rightleftharpoons {\text{2}}{{\text{H}}_{\text{2}}}{\text{Ci}}{{\text{t}}^ - }{\text{ + }}{{\text{M}}^{{\text{2 + }}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} $ | (5) |
| $ {\text{MO + 2}}{{\text{H}}_{\text{2}}}{\text{Ci}}{{\text{t}}^ - } \rightleftharpoons {\text{2HCi}}{{\text{t}}^{{\text{2}} - }}{\text{ + }}{{\text{M}}^{{\text{2 + }}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} $ | (6) |
| $ {\text{MO + 2HCi}}{{\text{t}}^{{\text{2}} - }} \rightleftharpoons {\text{2Ci}}{{\text{t}}^{{\text{3}} - }}{\text{ + }}{{\text{M}}^{{\text{2 + }}}}{\text{ + }}{{\text{H}}_{\text{2}}}{\text{O}} $ | (7) |
但柠檬酸的各级电离常数较小,故(5)~(7)的反应程度较低,即仅靠柠檬酸的酸性很难将渣中的金属以离子形态浸入溶液中。
然而,柠檬酸又是小分子有机酸中络合能力最强的酸,它可与金属阳离子络合形成易溶于水、且稳定常数较大的柠檬酸-金属络合物,其生成反应如下[20]:
| $ {\rm{2[}}{{\rm{H}}_{\rm{2}}}{\rm{Ci}}{{\rm{t}}^ - }{\rm{] + }}{{\rm{M}}^{{\rm{2 + }}}} \to {\rm{M[}}{{\rm{H}}_{\rm{2}}}{\rm{Ci}}{{\rm{t}}^ - }{{\rm{]}}_{\rm{2}}} $ | (8) |
| $ {\rm{2[HCi}}{{\rm{t}}^{{\rm{2}} - }}{\rm{] + 2}}{{\rm{M}}^{{\rm{2 + }}}} \to {{\rm{M}}_{\rm{2}}}{{\rm{[HCi}}{{\rm{t}}^{{\rm{2}} - }}{\rm{]}}_{\rm{2}}} $ | (9) |
| $ {\rm{2[Ci}}{{\rm{t}}^{{\rm{3}} - }}{\rm{] + 3}}{{\rm{M}}^{{\rm{2 + }}}} \to {{\rm{M}}_{\rm{3}}}{{\rm{[Ci}}{{\rm{t}}^{{\rm{3}} - }}{\rm{]}}_{\rm{2}}} $ | (10) |
式(8)~(10)的反应较完全,促使式(5)~(7)的反应向右进行,亦即浸出反应能够持续进行并实现渣中金属的浸出。
2 试验结果和讨论湿法炼锌净化渣中有价金属Co的含量较高,如何高效且环保浸出Co是本试验的研究重点。因此,本试验以Co的浸出率作为判断浸出效果的指标。
2.1 湿法炼锌净化渣有价金属的浸出 2.1.1 有机酸种类对浸出率的影响取预处理后的湿法炼锌净化渣10.00 g,在温度60 ℃、液固比10:1、搅拌速度200 r/min、pH 1.0条件下,考察浓度分别为1 mol/L的苹果酸和柠檬酸溶液,对金属浸出率的影响,结果如图 3和图 4所示。
 |
| 图 3 苹果酸对金属浸出率的影响 Fig.3 Effects of malic acid on the leaching rate of metals |
 |
| 图 4 柠檬酸对金属浸出率的影响 Fig.4 Effects of citric acid on the leaching rate of metals |
对比图 3和图 4可以看出, 两种浸出剂均能浸出净化渣中包括Co在内的金属,其中金属浸出能力大小为Co>Zn>Ni>Cu。浸出50 min时,用柠檬酸浸出,Co的浸出率达到97.99%,而苹果酸只有82.78%。同时柠檬酸浸出在50 min时Co的浸出已达到平衡,但苹果酸浸出此时Co的浸出率仍随时间的增加而增大。图中还可看出,试验时间范围内柠檬酸浸Co的最大浸出率大于苹果酸浸出。另外,柠檬酸的市场价格低于苹果酸,更具有应用价值。因此后续试验采用柠檬酸作为净化渣的浸出剂。
2.1.2 柠檬酸浓度对浸出率的影响在温度60 ℃、液固比10:1、搅拌速度200 r/min、pH1.0、浸出时间90 min条件下,考察了柠檬酸浓度对金属浸出率的影响,结果见图 5。
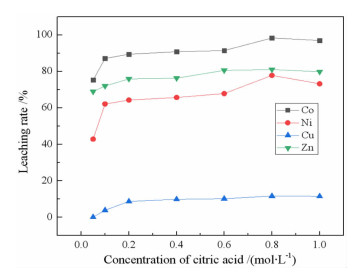 |
| 图 5 柠檬酸浓度对金属浸出率的影响 Fig.5 Effects of concentration of citric acid on the leaching rate of metals |
由图 5看出,柠檬酸浓度小于0.8 mol/L时,Co、Ni、Cu、Zn的浸出率随柠檬酸浓度的增加而增大;柠檬酸浓度大于0.8 mol/L后,Co、Ni、Cu、Zn浸出率稍有下降,当柠檬酸浓度为0.8 mol/L时,Co、Zn、Ni和Cu的浸出率分别为98.34%、81.08%、77.86%和11.68%。从反应式(5)~(7)可知,柠檬酸浓度提高可促进络合反应的进行,更容易生成相应的金属络合物,使金属浸出率增大;但柠檬酸浓度过高,使浸出液中的柠檬酸-金属配合物溶解度略有下降,致使浸出率稍有降低。因此,确定柠檬酸浓度为0.8 mol/L较为合适。
2.1.3 浸出温度对浸出率的影响在柠檬酸浓度0.8 mol/L、液固比10:1、搅拌速度200 r/min、pH 1.0、浸出时间90 min条件下,浸出温度对金属浸出率的影响结果如图 6所示。
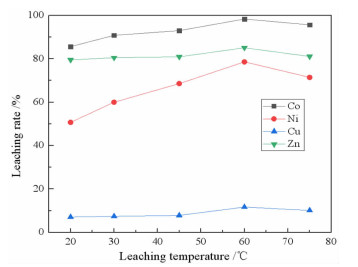 |
| 图 6 浸出温度对金属浸出率的影响 Fig.6 Effects of leaching temperature on the leaching rate of metals |
随着温度的升高,金属的浸出率均有一定程度的增加。除Ni之外的金属浸出率随温度升高的幅度变化不大,表明这些金属和柠檬酸的络合反应是热效应不太大的吸热反应。结合图 6的结果和节约能源的考虑,浸出温度选择为60 ℃为宜。
2.1.4 液固比对浸出率的影响在柠檬酸浓度0.8 mol/L、浸出温度25 ℃、搅拌速度200 r/min、pH 1.0、浸出时间90 min条件下,考察了液固比对金属浸出率的影响,结果见图 7。
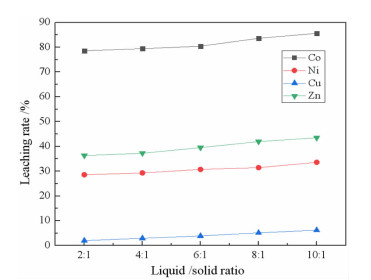 |
| 图 7 液固比对金属浸出率的影响 Fig.7 Effects of liquid/solid ratio on the leaching rate of metals |
柠檬酸浸出净化渣中有价金属的过程属于固液多相反应,当液固比较小时,浸出体系比较黏稠,不利于络合反应的进行。同时柠檬酸浓度不变时,液固比增加柠檬酸的量也增大,促进络合反应的进行。因此,在保持其它条件不变的情况下,随着液固比的增大,金属浸出率逐渐升高。当液固比超过10:1时,处理相同量的净化渣,浸出液体积增大,金属离子浓度降低,为浸出液的后续处理带来困难。因此,液固比取10:1较为合适。
2.1.5 浸出时间对浸出率的影响在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、搅拌速度200 r/min、pH 1.0、液固比10:1条件下,研究了浸出时间对金属浸出率的影响,结果如图 8所示。
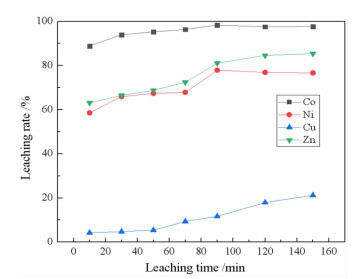 |
| 图 8 浸出时间对金属浸出率的影响 Fig.8 Effects of leaching time on the leaching rate of metals |
从图 8可知, 随着反应时间延长,Co、Ni、Cu和Zn的浸出率逐渐升高,在90 min以后,Co的浸出率基本保持不变,表明Co的浸出已达到平衡,此时,Co的浸出率达到98.34%,考虑到浸出试验主要以提取钴为主,浸出时间确定为90 min。
2.1.6 搅拌速度对浸出率的影响在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、浸出时间90 min、pH 1.0、液固比10:1条件下,搅拌速度对金属浸出率的影响结果见图 9。
 |
| 图 9 搅拌速度对金属浸出率的影响 Fig.9 Effects of stirring speed on the leaching rate of metals |
根据图 9结果可知,金属浸出率随搅拌速度增大先升高后变小。浸出反应是液-固反应,反应速率受柠檬酸根扩散至净化渣表面快慢的影响。搅拌速度较低时,柠檬酸根扩散较慢,此时提高搅拌速度有利于浸出反应的进行,亦即在相同时间内更易达到浸出完全。搅拌速度大于200 r/min时,溶液容易飞溅,导致烧瓶内壁黏附净化渣,这些少量渣不在容易受浸出剂的作用,从而使浸出率有所降低。因此200 r/min为适宜的搅拌速度。
2.1.7 pH值对浸出率的影响在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、浸出时间90 min、搅拌速度200 r/min、液固比10:1条件下,考察了pH值对金属浸出率的影响,结果如图 10所示。
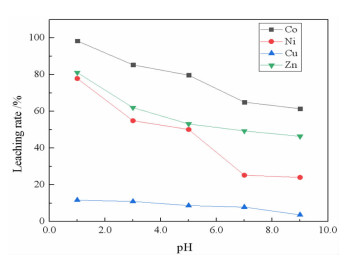 |
| 图 10 pH值对金属浸出率的影响 Fig.10 Effects of pH on the leaching rate of metals |
从图 10可知:随着pH值的增加,金属浸出率呈现逐渐降低的趋势。由于净化渣中的SiO2能和水溶液中的氢氧根离子结合生成硅烷醇,它能以化学吸附的形式争夺能和柠檬酸络合的金属阳离子, 且吸附能力随pH增加而增大,造成浸出液中金属离子浓度的减小[22-23]。因此,pH值取1.0为宜。
2.2 浸出后残余净化渣的性质在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、搅拌速度200 r/min、浸出时间90 min、液固比10:1、pH 1.0条件下,净化渣浸出且渣液分离后,采用XRD对烘干后的残余浸出渣进行物相分析结果如图 11所示。
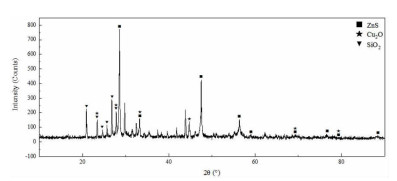 |
| 图 11 浸出残渣XRD图谱 Fig.11 XRD pattern of residue after leaching |
图 11表明,原净化渣中氧化钴的特征峰已经消失,钴基本实现浸出,残余浸出渣主要成分为二氧化硅、氧化亚铜和硫化锌。
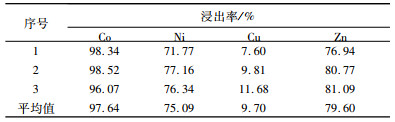
2.3 综合试验根据上述单因素试验的结果,净化渣浸出最佳条件为:柠檬酸浓度0.8 mol/L、浸出温度60 ℃、搅拌速度200 r/min、浸出时间90 min、液固比10:1、pH 1.0。分别取10.00 g预处理后的净化渣,进行3组综合验证试验,结果见表 2。
| 表 2 优化条件下的综合试验结果 Table 2 Comprehensive experimental results under optimized conditions |
|
3 结论
(1) 采用有机酸浸出湿法炼锌过程产生的净化渣中的有价金属,柠檬酸有较好的浸出效果。柠檬酸浸出体系具有对环境友好、金属浸出率高、浸出液处理方便等特点,有助于湿法炼锌行业金属资源的综合回收利用。
(2) 试验结果表明,在柠檬酸浓度0.8 mol/L、浸出温度60 ℃、搅拌速度200 r/min、液固比10:1、pH 1.0、浸出时间90 min条件下,锌、镍、铜的浸出率分别为79.60%,75.09%和9.70%,钴的浸出率高达97.64%,基本实现钴的完全浸出。
| [1] |
何耀. 锌冶炼工艺现状及有价金属高效回收利用新工艺[J]. 矿冶, 2020, 29(4): 73-79. DOI:10.3969/j.issn.1005-7854.2020.04.014 |
| [2] |
王振银, 高文成, 温建康, 等. 锌浸出渣有价金属回收及全质化利用研究进展[J]. 工程科学学报, 2020, 42(11): 1400-1410. |
| [3] |
汤裕源, 刘丽. 锌冶炼工艺综述与展望[J]. 云南冶金, 2020, 49(6): 38-41. DOI:10.3969/j.issn.1006-0308.2020.06.008 |
| [4] |
TANG L, TANG C, XIAO J, et al. A cleaner process for valuable metals recovery from hydrometallurgical zinc residue[J]. Journal of Cleaner Production, 2018, 201: 764-773. DOI:10.1016/j.jclepro.2018.08.096 |
| [5] |
雷霆, 陈利生, 余宇楠. 锌冶金[M]. 北京: 冶金工业出版社, 2012: 6-7.
|
| [6] |
蓝碧波, 丁文涛, 申开榜, 等. 从湿法炼锌钴渣中回收锌富集钴试验研究[J]. 湿法冶金, 2018, 37(6): 457-460. |
| [7] |
马进, 何国才, 程亮, 等. 湿法炼锌净化镍钴渣全湿法回收新工艺[J]. 有色金属(冶炼部分), 2013(12): 11-14. |
| [8] |
李贺, 陈露露, 王海北, 等. 锌冶炼净化钴渣综合回收工艺研究[J]. 有色金属(冶炼部分), 2019(9): 69-71. |
| [9] |
ASHTARI P, POURGHAHRAMANI P. Hydrometallurgical recycling of cobalt from zinc plants residue[J]. Journal of Material Cycles & Waste Management, 2018, 20: 155-166. DOI:10.1007/s10163-016-0558-0 |
| [10] |
BEHNAJADY B, MOGHADDAM J. Selective leaching of zinc from hazardous As-bearing zinc plant purification filter cake[J]. Chemical Engineering Research Design, 2017, 117: 564-574. DOI:10.1016/j.cherd.2016.11.019 |
| [11] |
王艳, 周春山. 铅锌冶炼渣浸出液提取镓的研究[J]. 稀有金属与硬质合金, 2001(4): 7-9. DOI:10.3969/j.issn.1004-0536.2001.04.002 |
| [12] |
周涛, 徐莉萍, 范百林, 等. 从废旧钴镍锰酸锂电池中回收有价金属的新工艺[J]. 徐州工程学院学报(自然科学版), 2017, 32(1): 6-12. |
| [13] |
方兆珩. 浸出[M]. 北京: 冶金工业出版社, 2007: 1-3.
|
| [14] |
LI Q, ZHANG B, MIN X B, et al. Acid leaching kinetics of zinc plant purification residue[J]. Transactions of Nonferrous Metals Society of China, 2013, 23: 2786-2791. DOI:10.1016/S1003-6326(13)62798-3 |
| [15] |
RUSEN A, SUNKAR A S, TOPKAYA Y A. Zinc and lead extraction from Cinkur leach residues by using hydrometallurgical method[J]. Hydrometallurgy, 2008, 93: 45-50. DOI:10.1016/j.hydromet.2008.02.018 |
| [16] |
PENG P, XIE H Q, LU L Z. Leaching of a sphalerite concentrate with H2SO4-HNO3 solutions in the presence of C2Cl4[J]. Hydrometallurgy, 2005, 80: 265-271. DOI:10.1016/j.hydromet.2005.08.004 |
| [17] |
郑莹, 胡晨, 周洁, 等. 柠檬酸浸出废旧锂离子电池回收有价金属研究[J]. 电源技术, 2019, 43(10): 1653-1683. DOI:10.3969/j.issn.1002-087X.2019.10.020 |
| [18] |
朱显峰, 赵瑞瑞, 常毅, 等. 废旧锂离子电池三元正极材料酸浸研究[J]. 电池, 2017, 47(2): 105-108. |
| [19] |
LI L, GE J, WU F, et al. Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 288-293. |
| [20] |
GOLMOHAMMADZADEH R, FARAJI F, RASHCHI F. Recovery of lithium and cobalt from spent lithium ion batteries (LIBs) using organic acids as leaching reagents: A review[J]. Resources, Conservation & Recycling, 2018, 136: 418-435. |
| [21] |
AHN J W, AHN H J, KIM M W. Chemical Leaching of Co, Cu, Ni, Al, Fe by Organic acid from Cobalt Concentrate[J]. Journal of the Korean Institute of Resources Recycling, 2011, 20(6): 63-70. DOI:10.7844/kirr.2011.20.6.063 |
| [22] |
HUANG K, INOUE K, HARADA H, et al. Leaching of heavy metals by citric acid from fly ash generated in municipal waste incineration plants[J]. Journal of Material Cycles and Waste Management, 2011, 13: 118-126. DOI:10.1007/s10163-011-0001-5 |
| [23] |
JIANG H, LI T Q, HAN X, et al. Effects of pH and low molecular weight organic acids on competitive adsorption and desorption of cadmium and lead in paddy soils[J]. Environmental Monitoring and Assessment, 2012, 184: 6325-6335. DOI:10.1007/s10661-011-2422-y |
 2021
2021



