| 碱浸除钼渣综合回收钼硫铜的试验研究 |
为了得到高纯度的仲钨酸铵产品,绝大部分钨冶炼企业采取选择性沉淀法进行钨钼分离,钨提纯过程分离出的钼形成了主要成分为含硫代钼酸根的铜盐沉淀,该沉淀被称为除钼渣[1]。随着钼矿产资源的日渐枯竭,回收利用含钼二次资源日益得到广泛重视。除钼渣来自钨冶炼生产过程,可视为一种普遍易得的钼二次资源。对除钼渣的处理方法主要分为火法焙烧和湿法浸出两种,均具有一定的可行性。火法焙烧存在大气污染、金属回收率不高等问题;而湿法浸出存在着流程长、钼铜硫三者分离不彻底等缺点[2]。据目前文献[3~7]了解,湿法处理的基本思路都是将钼、铜进行分离,分别得到含钼的溶液和含铜的浸出渣,从而实现钼和铜的分别回收利用。但经碱法处理除钼渣的方法中,有的根本不提及S2-的去向,有的则是需要引入与S2-同化学计量的铜离子形成CuS留存在渣中达到固硫的作用[8],由于铜盐价格较贵,该方法不具备实际应用价值。根据除钼渣成分分析得知其主要成分为硫代钼酸铜,1摩尔的Mo对应的是4摩尔的S,以及据前期处理经验得知:未氧化处理的S2-始终与Mo共存在于流程及钼产品中,因此,经除钼渣回收所得粗制钼酸盐产品的纯度因S2-的存在大打折扣,并且为后续加工留下隐患,本文从氧化S2-分离硫钼的角度出发,研究了碱法处理除钼渣过程中硫钼分离的方法,为制取较高纯度的钼酸盐产品提供切实可行的工艺路径。
1 试验部分 1.1 试验原料试验所用原料为国内某APT厂生产仲钨酸铵过程中采用选择性沉淀法除钼产生的新鲜除钼渣。根据化学分析结果表明,除钼渣中主要元素为Cu、Mo、S、W等,本文试验所用除钼渣的主要化学成分见表 1,所涉及的试剂:氢氧化钠(AR),硫酸(AR),氯酸钠(AR),氯化铁(AR),双氧水(AR),氧气纯度≥99.0%,纯水。
| 表 1 除钼渣的主要化学成分 Table 1 The main chemical composition of molybdenum removal sludge |

|
1.2 试验原理
除钼渣的主要成分为CuMoS4和CuS,在中性条件下比较稳定,在碱性条件下,Mo和绝大部分S被碱分解以S2-的形式进入溶液,小部分S与Cu结合以CuS形式留在渣中。采用氢氧化钠浸出新鲜除钼渣的主要化学反应[9-12]为:
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{CuMo}}{{\rm{S}}_4} + 2x{\rm{NaOH}} = \\ {\rm{CuS}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_x}{S_{4 - x}} + (x - 1){\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}} + x{{\rm{H}}_{\rm{2}}}{\rm{O}}。\end{array} $ | (1) |
从反应方程式(1)可知,S2-和MoOxS4-x2-均以阴离子形式存于溶液中,若要将S和Mo进行分离,须将S2-氧化形成较高价态的S或SO32-、SO42-才能得以实现。
常压碱浸新鲜除钼渣的滤液中存在较高浓度的S2-,先使用氧化剂氧化滤液中的S2-,再加入NaOH调节pH值,最后采用铁盐沉淀法提取钼,将钼与硫分离。在pH值1.5~3.5条件下,钼酸盐溶液中加入三价铁盐溶液可形成钼酸铁沉淀[13],从而将钼与硫分离。主要发生的氧化反应及沉淀反应的方程式为:
| $ \begin{array}{l} {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{MoO}}{{\rm{S}}_{\rm{3}}}{\rm{ + N}}{{\rm{a}}_{\rm{2}}}{\rm{S + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + NaCl}}{{\rm{O}}_{\rm{3}}} = \\ \;\;\;\;\;\;\;{{\rm{H}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + NaCl + 4S}} \end{array} $ | (2) |
| $ {{\rm{H}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2NaOH = N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O }} $ | (3) |
| $ {\rm{2F}}{{\rm{e}}_{\rm{2}}}{{\rm{(S}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{ + 3N}}{{\rm{a}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{\rm{4}}}{\rm{ = F}}{{\rm{e}}_{\rm{2}}}{{\rm{(Mo}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{ + 6N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{}} $ | (4) |
高压氧碱浸除钼渣,碱性条件下CuS不与氧气发生反应,钼所结合的硫逐渐被氧取代,形态逐渐由四硫代钼酸根向钼酸根转变[14-18],即:MoS42-→MoOS32-→MoO2S22-→MoO3S2-→MoO42-。而溶液中S2-被氧气氧化形成亚硫酸钠,亚硫酸钠溶液的溶解度随温度降低其溶解度降低,钼酸钠溶液的溶解度随温度降低的变化较小,因此利用低温条件下亚硫酸钠结晶而钼酸钠不结晶的特性[19-20],从而将硫和钼进行分离。
1.3 试验设备及方法常压浸出试验在电热恒温水浴锅的烧杯中进行;高压氧化浸出试验在高压反应釜中进行,反应温度达到设定值后开始通入氧气,当釜内压力达到1.0 MPa时停止通氧,釜内压力低于0.3 MPa重新通氧至1.0 MPa,重复过程直至反应时间结束。将除钼渣与碱溶液按一定液固体积质量比加入到烧杯或反应釜中,进行控温搅拌浸出,达到预定温度保温一定时间后,过滤,干燥,分析浸出渣或液中的Mo、S浓度或质量分数,计算Mo的浸出率和溶液中S2-的残留率等。Mo的浸出率计算,见公式(5):
| $ n = [1 - {J_{Mo}} \times J \div ({Z_{Mo}} \times Z)] \times 100\% $ | (5) |
式中:n—除钼渣中Mo浸出率, %;JMo—浸出渣中Mo质量分数, %;ZMo—除钼渣中Mo的质量分数, %;Z—除钼渣质量, g;J—浸出渣质量, g。
溶液中S2-的残留率计算,见公式(6):
| $ c = {J_S} \times V \div [\left( {{Z_S} - {Z_{Cu}} \div 64 \times 32} \right) \times Z] $ | (6) |
式中:c—溶液中S2-的残留率, %;JS—溶液中S2-的质量浓度, g/l;V—溶液体积, L;ZS—除钼渣中S质量分数, %;ZCu—除钼渣中Cu质量分数, %;Z—除钼渣质量, g。
NaOH理论用量按除钼渣中的钼和硫的量计算,不含CuS中硫,见公式(7):
| $ m = (A + B) \times 80 $ | (7) |
式中:m—NaOH理论用量, g;A—除钼渣中硫的物质的量, mol;B—除钼渣中Mo的物质的量,mol。
主要元素分析方法:溶液中S2-采用硫代硫酸钠滴定法;钼采用硫氰酸盐比色法测定;W、Cu采用电感藕合等离子发射光谱仪(ICP)分析;固体中总硫的检测方法及原理:待测物中的硫在1 200±50 ℃温度下与通入的高纯氧气发生反应,产生的SO2气体与碘作用发生氧化还原反应,根据消耗的碘标准溶液的体积计算硫的含量。
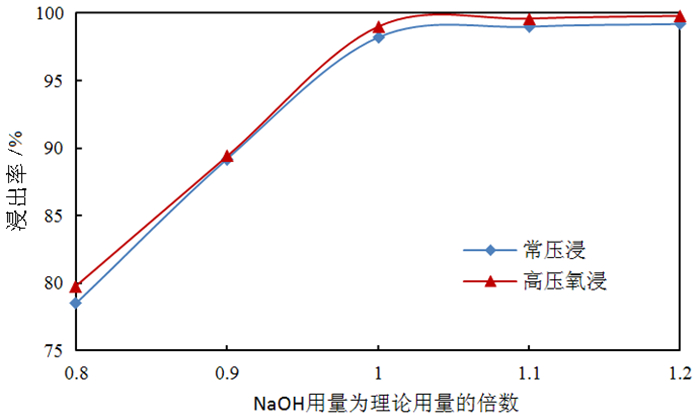
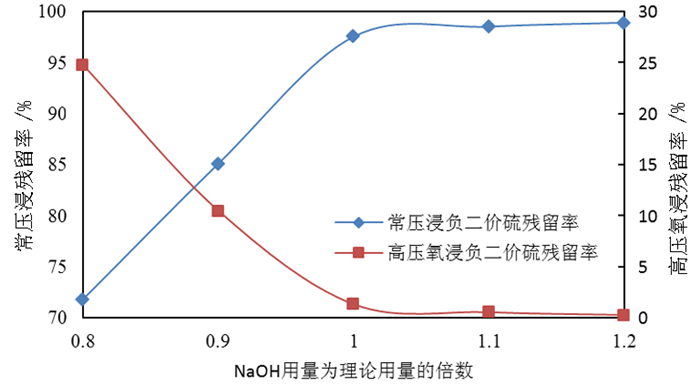
2 试验结果与讨论 2.1 氢氧化钠浸出钼、硫 2.1.1 氢氧化钠用量对钼浸出率及S2-残留率的影响按照除钼渣质量200.0 g、液固体积质量比3:1、温度85 ℃、反应时间180 min,分别开展氢氧化钠用量为理论用量(碱钼摩尔比2:1)的0.8倍、0.9倍、1.0倍、1.1倍、1.2倍条件下,分别开展常压浸出和高压氧浸出试验,氢氧化钠用量对除钼渣中钼浸出率的影响试验结果如图 1所示,氢氧化钠用量对S2-残留率的影响试验结果如图 2所示。
 |
| 图 1 氢氧化钠用量对钼浸出率的影响 Fig.1 Effect of sodium hydroxide dosage on molybdenum leaching rate |
 |
| 图 2 氢氧化钠用量对负二价硫残留率的影响 Fig.2 Effect of sodium hydroxide dosage on negative divalent sulfur residue rate |
由图 1可知,随着NaOH耗量的增加,无论是常压浸出还是高压氧浸出除钼渣,其钼浸出率均得到显著提高,当NaOH耗量增加为理论量的1.1倍以上后,钼浸出率接近100%且不再提高。由图 2可知,随着NaOH耗量的增加,常压浸出所得钼酸钠溶液中S2-残留率显著提高,说明在碱浓度(总量)不够的情况下S2-并未被浸出进入溶液,当碱量达到1.1倍时S2-几乎全部浸出进入溶液,超过1.1倍后无明显变化;而高压氧浸出所得溶液中S2-残留率显著降低;在高压氧环境下,浸出的S2-被氧化形成SO42-,故溶液中S2-的残留率显著下降,在碱用量为1.1倍时,钼酸钠溶液中S2-残留率低于0.6%;故NaOH耗量以理论消耗量的1.1倍为宜。
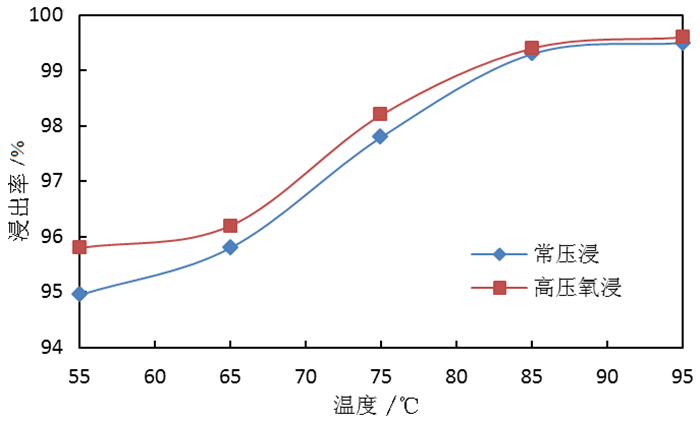
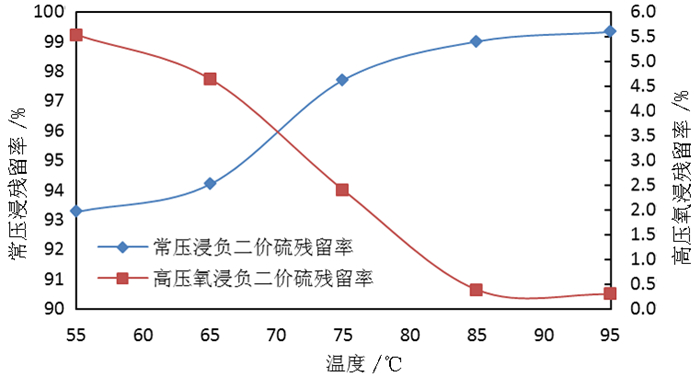
2.1.2 反应温度对钼浸出率及S2-残留率的影响按照除钼渣质量200.0 g、液固体积质量比3:1、氢氧化钠用量为理论消耗量的1.1倍、反应时间180 min,分别在55 ℃、65 ℃、75 ℃、85 ℃、95 ℃温度下常压浸出试验和高压氧浸出试验,反应温度对除钼渣中钼浸出率的影响试验结果如图 3所示,反应温度对溶液中S2-残留率的影响试验结果如图 4所示。
 |
| 图 3 反应温度对钼浸出率的影响 Fig.3 Effect of reaction temperature on molybdenum leaching rate |
 |
| 图 4 反应温度对负二价硫残留率的影响 Fig.4 Effect of reaction temperature on residual rate of negative divalent sulfur |
由图 3可知,随着反应温度的提高,常压浸出和高压氧浸出除钼渣的钼浸出率均得到显著提高,当温度达到85 ℃以上后,钼浸出率升高不明显,但采用高压氧浸出工艺所得钼浸出率略高于常压浸出。由图 4可知,随着反应温度的提高,常压浸出所得钼酸钠溶液中S2-残留率呈上升趋势,而高压氧浸出所得溶液中S2-残留率呈下降趋势;说明温度升高有利于分解硫代钼酸根,使硫更容易被浸出进入溶液;在高压氧环境下,浸出的S2-被氧化形成SO42-,故溶液中S2-的残留率呈下降趋势,在反应温度达到85 ℃时,溶液中S2-残留率低于0.5%;故反应温度宜选择85 ℃或以上。
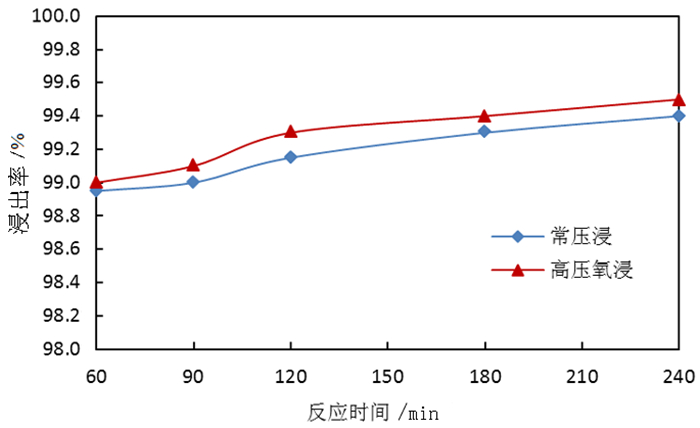
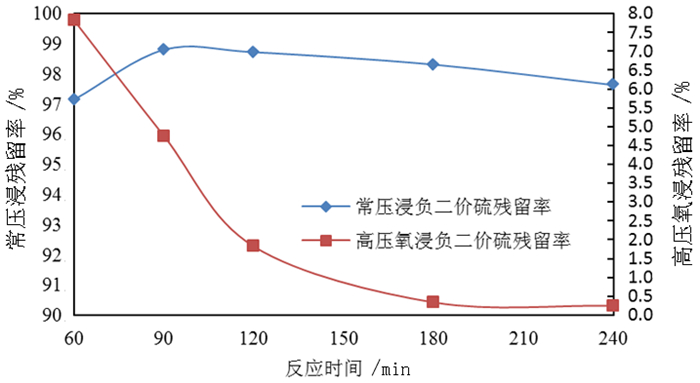
2.1.3 反应时间对钼浸出率及S2-残留率的影响按照除钼渣质量200.0 g、液固体积质量比3:1、氢氧化钠用量为理论消耗量的1.1倍,温度85 ℃,分别开展反应时间为60、90、120、180、240 min的常压浸出试验和高压氧浸出试验,反应时间对除钼渣中钼浸出率的影响试验结果如图 5所示,反应时间对溶液中S2-残留率的影响试验结果如图 6所示。
 |
| 图 5 反应时间对钼浸出率的影响 Fig.5 Effect of reaction time on molybdenum leaching rate |
 |
| 图 6 反应时间对负二价硫残留率的影响 Fig.6 Effect of reaction time on residual rate of negative divalent sulfur |
由图 5可知,随着反应时间的增加,常压浸出和高压氧浸出除钼渣的钼浸出率均呈上升趋势,但升幅较小,相同时间条件下高压氧浸出较常压浸出的浸出率更高,说明碱浸反应向右进行的动力较足,反应时间120 min后浸出率提高不明显,常压浸出时间可选择120 min。由图 6可知,随着反应时间的增加,常压浸出所得钼酸钠溶液中S2-残留率呈现先升后降的趋势,由于常压反应在有空气的情况下进行,随着反应时间的延长,物料与空气中的氧气接触时间长导致一部分S2-被氧化,故而S2-残留率有下降趋势;而高压氧浸出所得溶液中S2-残留率在反应90 min时出现拐点;在180 min时S2-残留率低于0.5%,说明在高压氧环境下,浸出的S2-被氧化需要时间,为了保持较低的S2-残留率,则高压氧浸出反应时间以180 min为宜。
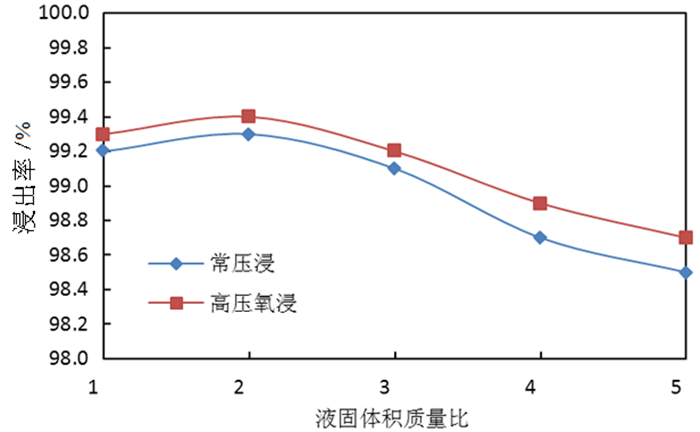
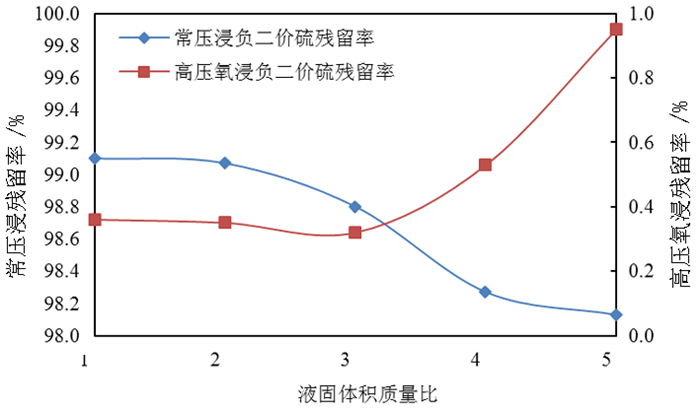
2.1.4 液固比对钼浸出率及S2-残留率的影响按照除钼渣质量200.0 g、温度85 ℃、反应时间180 min、氢氧化钠用量为理论消耗量的1.1倍,分别开展液固体积质量比1/1、2/1、3/1、4/1、5/1的常压浸出试验和高压氧浸出试验,液固体积质量比对除钼渣中钼浸出率的影响试验结果如图 7所示,液固体积质量比对溶液中S2-的影响试验结果如图 8所示。
 |
| 图 7 液固体积质量对钼浸出率的影响 Fig.7 Effect of liquid-solid volume mass on molybdenum leaching rate |
 |
| 图 8 液固体积质量对负二价硫残留率的影响 Fig.8 Effect of liquid-solid volume mass on negative divalent sulfur residue rate |
由图 7可知,随着液固比的提高,无论是常压浸出还是高压氧浸出的钼浸出率均呈现下降趋势,液固比3:1以上钼浸出率下降较明显,故浸出时液固比可选择3:1。由图 8可知,液固比从2:1提高到5:1,常压浸出所得钼酸钠溶液中S2-残留率呈下降趋势,而高压氧浸出所得溶液中S2-残留率呈上升趋势,但上升比例较小;主要原因在于在氢氧化钠用量一定条件下,液固体积质量比增大,氢氧化钠浓度降低则钼浸出率降低,浸出液中S2-浓度与钼浸出率正相关,故常压浸出S2-残留率呈下降趋势;高压氧浸出S2-残留率与氧气用量及反应时间较大关系,故液固比提高对高压氧浸出S2-残留率影响并不明显。液固体积质量比偏高,会降低钼浸出率和设备利用率;而液固体积质量比偏低,浸出后的料浆较黏稠,液固分离困难,故适宜的液固体积质量比为3:1。
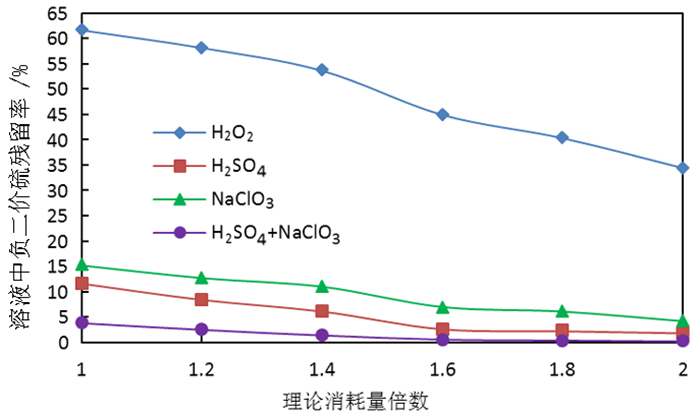
2.2 氧化常压浸出滤液中的S2-以碱浓度30 g/L为例,常压碱浸除钼渣过滤所得的钼酸盐溶液中,S2-质量浓度达到35 g/L;采用不同氧化剂不同过量系数开展氧化试验以期氧化钼酸盐溶液中的S2-。选用氧化剂为试剂级的H2O2、H2SO4、NaClO3、或H2SO4与NaClO3按质量比1:1~3:1混合使用。常温下,向常压浸出滤液中加入氧化剂,氧化剂的用量分别按照理论需要的1倍、1.2倍、1.4倍、1.6倍、1.8倍、2.0倍进行试验,试验数据如图 9所示。
 |
| 图 9 氧化剂理论消耗量对氧化后溶液中负二价硫残留率的影响 Fig.9 Effect of theoretical consumption of oxidant on residual rate of negative divalent sulfur in oxidized solution |
由图 9可看出,氧化剂消耗量随着理论消耗倍数提高,氧化后溶液中S2-残留率降低,氧化剂消耗量达到理论量的2倍时氧化效果最佳,S2-残留率最低达到0.2%;从氧化剂氧化效率来看,得出H2O2<NaClO3<H2SO4<H2SO4+NaClO3,故后续选用H2SO4与NaClO3按照一定比例混合作为氧化剂。
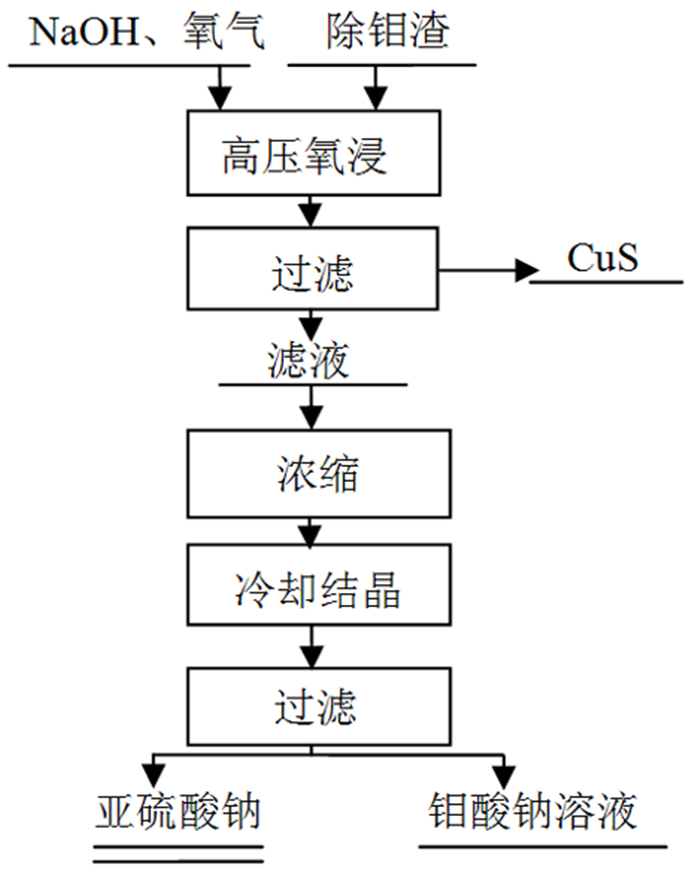
2.3 除钼渣中分离硫钼的工艺路径根据试验验证获得两条切实可行的处理除钼渣的工艺路径,其中,工艺路径一采用高压氧碱浸同步实现碱浸钼、分离铜和氧化S2-,浸出滤液所含S2-浓度低于80 mg/L,铜浓度低于100 mg/L;通过压滤实现硫化铜与溶液中的硫、钼分离,硫化铜进入渣中可作为铜精矿原料冶炼铜,滤液冷冻结晶经过滤得到亚硫酸钠固体;第一次冷冻结晶的滤液经过蒸发浓缩后二次冷冻结晶,所得钼酸钠溶液中硫浓度低,易于实现钼与硫的深度分离;该方法设备简单,流程短,效率高(工艺流程图详见图 10)。
 |
| 图 10 工艺路径一 Fig.10 process path Ⅰ |
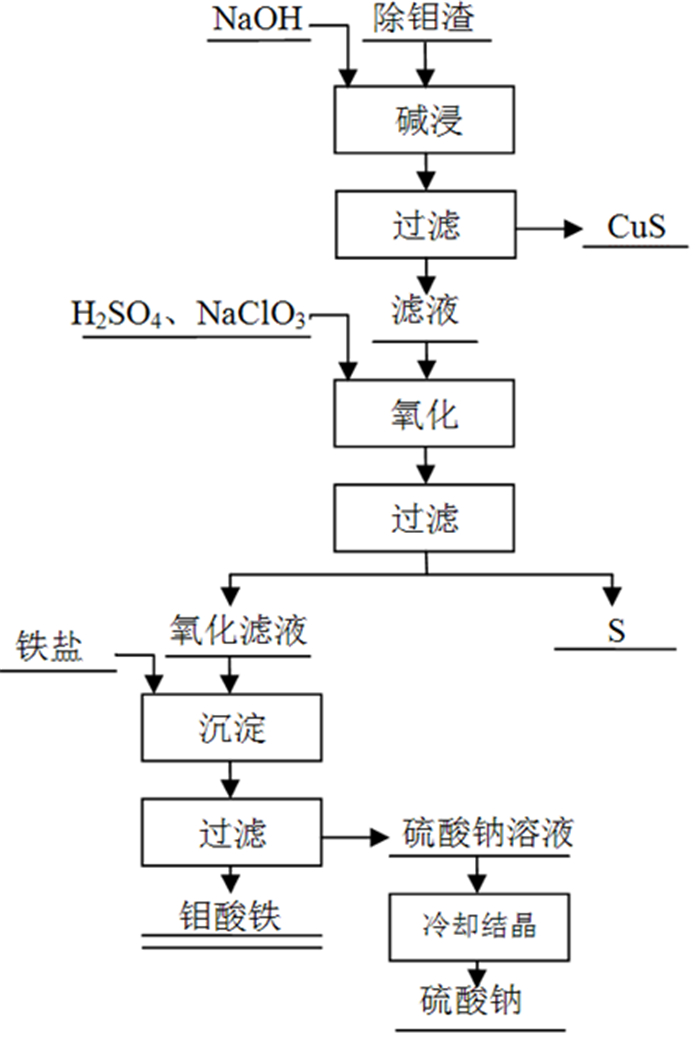
工艺路径二采用常压碱浸,铜几乎完全存于浸出渣中,碱浸滤液中S2-浓度较高,先将其氧化再与钼分离,氧化剂选择硫酸和氯酸钠按质量比1:1~3:1混合,氧化效率高;氧化后滤液加入硫酸铁溶液获得钼酸铁产品,产品洗涤后含硫低于0.5%,沉钼母液主要成分为亚硫酸钠,通过冷却结晶获得硫酸钠副产品。钼与硫得到深度分离;氧化滤液经过1~2次铁盐沉淀后,滤液含钼低于50 mg/L,铜低于10 mg/L,钼金属回收率高,所得钼酸铁产品既可用于钼酸铵深加工也可以直接用于钼铁生产(工艺流程图详见图 11)。
 |
| 图 11 工艺路径二 Fig.11 process path Ⅱ |
3 结论
(1) 采用氢氧化钠常压浸出工艺,在氢氧化钠用量为理论量1.1倍、反应时间180 min、浸出温度85 ℃、液固体积质量比3:1的最佳条件下,钼浸出率为99.48%,铜浸出率低于0.1%,S2-残留率99.3%,选用H2SO4+NaClO3混合氧化滤液中S2-的氧化效率较单独使用H2SO4、NaClO3、H2O2时要高;氧化后滤液加入三价铁盐溶液获得钼酸铁产品,产品洗涤后含硫低于0.5%。
(2) 采用氢氧化钠高压氧浸出工艺,在氢氧化钠用量为理论量1.1倍、反应时间180 min、浸出温度85 ℃、液固体积质量比3:1的最佳条件下,钼浸出率为99.82%,铜浸出率低于0.5%,S2-残留率0.28%,可通过冷却结晶获得硫酸钠副产品及钼酸钠溶液,达到了提取钼和硫钼分离的目的。
(3) 本文中采用的常压碱浸和高压氧碱浸处理除钼渣两种工艺路径,最终均能高效的分离钼和硫,提升钼金属的回收率和钼酸盐产品的纯度,产出硫酸钠副产品,具有现实的推广意义。
| [1] |
霍广生, 赵中伟, 李洪桂, 等. 不同金属硫化物从钨酸盐溶液中除钼的效果[J]. 中国有色金属学报, 2004, 14(2): 302-305. DOI:10.3321/j.issn:1004-0609.2004.02.027 |
| [2] |
霍广生. 钨冶炼过程中钨钼分离新工艺及其理论研究[D]. 长沙: 中南大学, 001.76. http://cdmd.cnki.com.cn/article/cdmd-10533-2002060683.htm
|
| [3] |
肖超, 吴海国. 陈化除钼渣处理工艺试验研究[J]. 中国钼业, 2012, 36(6): 25-28. DOI:10.3969/j.issn.1006-2602.2012.06.006 |
| [4] |
黄美萍, 朱同浩. 从硫化除钼沉淀渣中回收钨的试验[J]. 中国钨业, 1992(7): 18-19. |
| [5] |
付维琴, 杨大锦. 从除钼渣中浸出钨钼试验研究[J]. 湿法冶金, 2015, 34(3): 193-195. |
| [6] |
龚丹丹, 黄泽辉, 赵立夫, 等. 钼渣处理工艺试验研究[J]. 中国钨业, 2015(3): 38-42. DOI:10.3969/j.issn.1009-0622.2015.03.009 |
| [7] |
孙铭, 王嘉, 江英英, 等. APT铜钼渣回收工艺过程及环境影响分析[J]. 广东化工, 2012, 39(7): 145-147. DOI:10.3969/j.issn.1007-1865.2012.07.078 |
| [8] |
贾利攀, 刘旭恒, 等. 除钼渣浸出行为的热力学分析[J]. 稀有金属, 2019, 43(5): 526-531. |
| [9] |
唐忠阳. 从除钼渣中回收铜、钼新工艺的研究[D]. 长沙: 中南大学, 2002. http://cdmd.cnki.com.cn/article/cdmd-10533-2006036810.htm
|
| [10] |
李洪桂, 羊建高, 李昆. 钨冶金学[M]. 长沙: 中南大学出版社, 2010.
|
| [11] |
张义忠. 钨钼分离理论及新工艺研究[D]. 昆明: 昆明理工大学, 2002. https://d.wanfangdata.com.cn/thesis/Y482305
|
| [12] |
朱传贵, 等. 钼渣中有价金属的回收[J]. 中国钼业, 2000, 24(2): 40-41. DOI:10.3969/j.issn.1006-2602.2000.02.015 |
| [13] |
向铁根, 杨伯华. 钼冶金[M]. 长沙: 中南大学出版社, 2009.
|
| [14] |
汪洋. 从硫废料中回收相的生产实践[J]. 中国钼业, 1999, 23(2): 30-31. |
| [15] |
李洪桂. 稀有金属冶金学[M]. 北京: 冶金工业出版社, 1989.
|
| [16] |
黄万抚. 从铜精矿中回收铂的试验研究. 中国钨业. 15(2): 21-23 http://www.cnki.com.cn/Article/CJFDTotal-ZGWU200002007.htm
|
| [17] |
张邦胜, 蒋开喜, 等. 酸性加压氧化分解辉钼精矿的试验研究[J]. 稀有金属, 2007, 31(3): 384-392. DOI:10.3969/j.issn.0258-7076.2007.03.021 |
| [18] |
杨立斌, 杜娟, 沙作良, 等. 十水硫酸钠冷却结晶动力学的研究[J]. 无机盐工业, 2009, 41(4): 18-20. DOI:10.3969/j.issn.1006-4990.2009.04.006 |
| [19] |
任倩, 刘锦锐, 杨伟. 一种从除钼渣中提取钼制钼酸钠的方法: CN108893611B[P]. 2020-01-21.
|
| [20] |
刘锦锐, 任倩, 杨伟. 一种以除钼渣为原料制取钼酸铁的方法: CN 108977672 B[P]. 2020-09-25.
|
 2021
2021



