| 类锂电池体系在盐湖提锂中的研究进展 |
锂是重要的战略金属,广泛应用于能源、化工、电子、冶金、医药等诸多领域,被誉为“21世纪的新能源金属”。近年来,新能源汽车产业的发展快速,动力电池的大量生产以致对锂资源的需求量激增。全球锂资源主要赋存于盐湖卤水、锂辉石和锂云母中,其中盐湖卤水锂资源储量占全球总量的65%。目前,全球锂盐产品生产所需锂原料大多来源于盐湖,且随着优质盐湖资源的开发,盐湖的品质逐年降低。特别是对我国而言,我国是锂资源大国,其探明锂资源储量510万t,其中盐湖锂资源占总储量的71.89%。但是由于我国大部分盐湖位于青藏高原地区,且多为高镁锂比盐湖,锂资源的开发利用相较于国外优质盐湖要面临更多技术上的难题[1-5]。因此,如何高效、低成本地开发利用盐湖资源是新能源汽车产业和锂工业可持续发展亟待解决的难题。
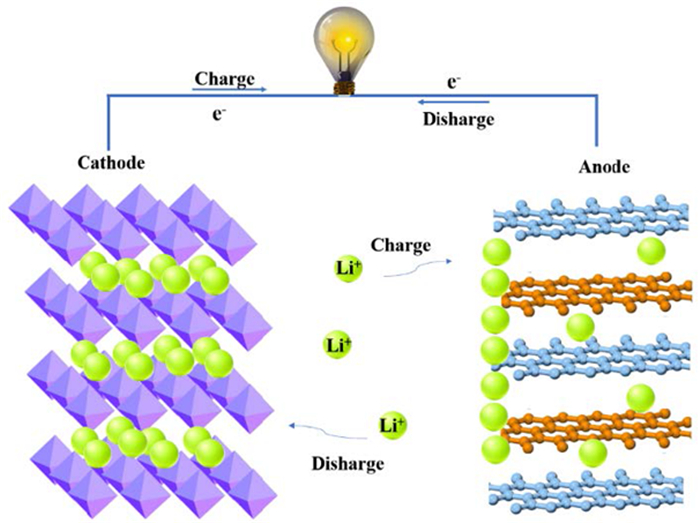
当前锂产品50%以上被用于锂离子电池材料,如钴酸锂、锰酸锂、磷酸铁锂、钛酸锂以及镍钴锰三元锂电池等的制备。对于锂离子电池而言(以锰酸锂锂离子电池为例),充电时锰酸锂材料中的锂离子会从晶格中脱出,并在电场驱动下插入负极层状石墨形成层间化合物;放电过程则相反,负极中的锂从石墨层中脱出,经电解质溶液重新进入到锰酸锂晶格中。由于锰酸锂独特的晶体结构,锂能自由地嵌入和脱出而不破坏其晶体结构,可以反复进行充放电过程,从而使电池拥有良好的循环能力,其工作原理如图 1所示[6]。
实际上,锂离子电池充放电过程中锂的嵌入和脱出行为,亦可看作一种基于电位控制下的锂的“电化学吸附”和“电化学解吸”。在此过程中,由于锂离子电池材料的晶体结构具有独特的锂离子迁移通道、稳定的电化学氧化还原位点,因而对锂离子嵌入表现出高度选择性的特性。因此,如果将含锂的盐湖卤水来“代替”传统的LiPF6锂离子电解液,采用类似于锂离子电池的工作原理,那么在新的充放电或以化学试剂来实现的氧化/还原体系中,卤水中的锂将选择性地在电极材料中进行锂的嵌入和脱出,即锂离子电极材料被氧化时锂离子从电极材料中脱出(锂的解吸过程),而再将其还原时实现锂重新嵌入至电极材料(锂的吸附过程)。
如果以锂离子电池材料来进行盐湖提锂,面临的首要问题就是材料的选择问题。传统锂离子电池工作环境主要为有机电解液体系,而盐湖提锂则要求材料需要在水溶液体系(卤水)中工作,并且材料在水溶液中应具有足够好的化学稳定性和循环稳定性。
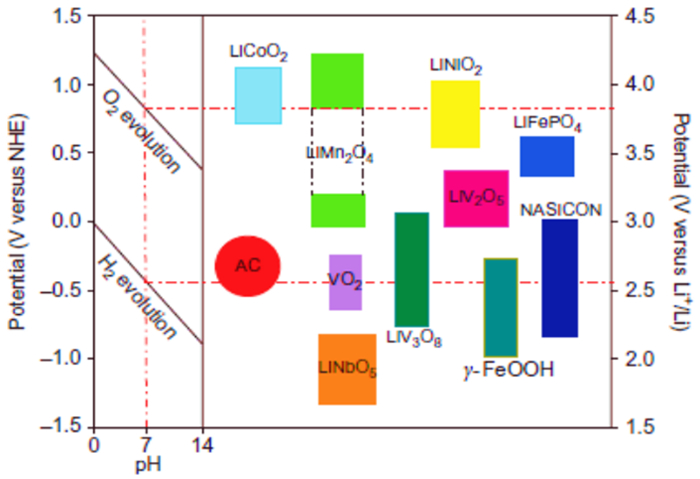
图 2所示为目前主流锂离子正极材料在水溶液中的电化学工作窗口图[7]。从图中可以看出,磷酸铁锂、钒酸锂、锰酸锂、钴酸锂等材料在一定条件下能够完全或部分在水溶液体系中实现锂离子的电化学嵌入和脱出。基于此,研究人员利用不同的提锂材料,提出和开发出了多种提锂技术和提锂模型。本文将重点阐述基于不同锂离子电池材料形成的盐湖卤水提锂体系及其基本原理。
1 锰酸锂电化学提锂体系
锰酸锂作为一种对锂选择性极强的离子筛材料,开发之初是为了制备λ-MnO2离子筛材料,用于从盐湖卤水、海水等溶液中提锂。得益于锰酸锂材料中锰元素的氧化还原特性,锰酸锂亦是最早被研究用于盐湖提锂的电极材料。
以锰酸锂为电极材料进行提锂,关键在于电极的制备。起初电极的制备是将锰酸锂溶液浆料涂布于铂电极上进行烘干,然后反复进行此过程制得锰酸锂电极[8]。以制备好的锰酸锂电极为工作电极,铂电极为对电极,在含锂以及其它碱金属和碱土金属杂质的盐溶液进行循环伏安测试,过程脱嵌锂反应如下:
| $ {\rm{L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + \mathit{ λ} - Mn}}{{\rm{O}}_{\rm{2}}}{\rm{ + e = LiM}}{{\rm{n}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}} $ | (1) |
该研究证明了以锰酸锂为原料、采用电化学的方法有望实现盐湖提锂。遗憾的是,由于所制备的锰酸锂电极材料提锂性能较差,对盐湖卤水的品位有较高的要求,难以处理低浓度盐湖卤水,需将卤水进行浓缩富集,且不足以制得高品质的碳酸锂产品[9]。特别是锰酸锂材料存在溶损,致使循环容量快速衰减,难以长期循环使用。此外,由于采用铂作为集流体和对电极,制造成本极高。因此,如何制备高性能、低成本的吸附电极是后续研究工作的重点之一。
1.1 (-)λ-MnO2|Brine|Ag(+)体系随着锂离子电池制备工艺技术的发展,电极材料的涂覆工艺日臻完善和成熟。锰酸锂电极的制备工艺也有了极大的改进。如将锰酸锂作为电极的活性物质,加入碳黑作为导电剂,聚偏氟乙烯(Poly vinylidene fluoride, 简称PVDF)作为粘接剂,将这三者按质量比8 : 1 : 1均匀搅拌混合在NMP溶剂中,然后涂布于导电基流体上烘干[10]。这一电极制备过程完全不同于之前的反复涂覆烘干方法,且电极的整体性能得到了很大提升。新方法中导电剂的加入提高了固相电极的电导率,减少了极化现象,降低了进行提锂反应所需的电位;粘接剂的加入则提高了电极材料的机械强度,避免了材料在水溶液中长期浸泡而脱落的现象;NMP不仅作为三者混合的溶剂,在烘干过程中其作为有机溶剂挥发后会形成一定大小的孔径,在提高了有效反应面积的同时还能改善高黏度卤水带来的浓差极化问题。
此外,采用银电极代替了最初的铂电极作为反应的对电极。相较于铂电极,银电极不但拥有更好的导电能力,其电极反应电位也更低;而且在提锂过程中,不再如铂电极上发生阳极析氯反应(环境污染严重)和阴极析氢反应(改变溶液酸碱性,导致吸附材料溶解),而是卤水中的氯离子与银电极发生可逆吸氯和脱氯反应(如反应2所示)。在这一过程中,溶液的pH也较为稳定,有利于体系的平稳运行。
| $ {\rm{Ag + Cl = AgCl + e}} $ | (2) |
该体系的提锂工作原理如图 3(a)[10]所示,整个过程分为两步:(1)在对体系进行充电时,盐湖卤水中的锂离子进入欠锂态锰酸锂材料晶格,而对电极上的银则负责捕集溶液中的氯离子,直至锰酸锂材料中的晶格大部分被锂离子所占据达到饱和;(2)将阴阳极对调,同时将溶液换为纯净的电解质溶液。再次对体系进行电解,锰酸锂晶格中的锂离子和氯化银电极上的氯离子同时脱出进入溶液,得到纯净的氯化锂溶液。通过反复进行这两个步骤,能够实现锂元素的富集以及锂与盐湖卤水中的其它杂质元素的分离。
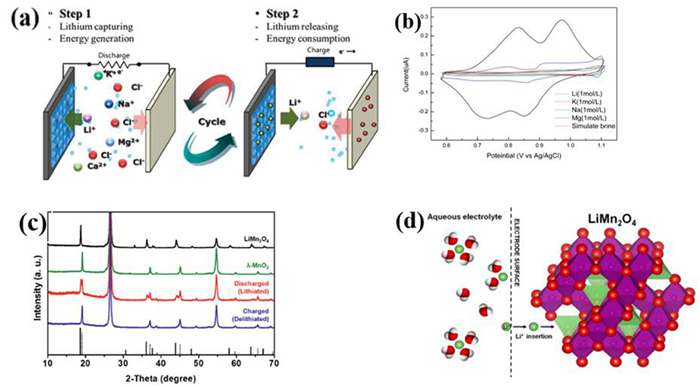 |
| 图 3 (a) 锰酸锂电极体系盐湖提锂原理示意图[10];(b)锰酸锂在不同溶液中循环伏安曲线[11];(c)锰酸锂在循环过程中不同形态XRD图谱[12];(d)锂离子嵌入锰酸锂晶格[13] Fig.3 (a) schematic of lithium manganate electrode system lithium extraction process[10], (b)the cyclic voltammetry curves of lithium manganate in different solutions[11], (c) XRD patterns of lithium manganate in the cycling process[12], (d) the process of lithium ion insertion into the lattice of lithium manganate[13] |
图 3(b)所示为锰酸锂材料在不同溶液中测得的循环伏安曲线,在1 M的氯化锂溶液中,其在Epa=0.828 V和Epa=0.96 V分别有两个脱锂峰,在Epc=0.723 V和Epc=0.845 V分别对应有嵌锂峰[11]。而在氯化钾、氯化钠、氯化镁溶液中均无明显峰形,证明锰酸锂材料对锂离子不仅有良好的选择性,其嵌入脱出循环也较为稳定。这也在如图 3(c)所示的XRD图谱中得到了证实,锰酸锂材料通过反复地脱嵌经历了从LiMnO4到λ-MnO2的反复变化,而其XRD峰形没有偏移,证明了锂离子在晶格中的嵌入脱出是可逆的[12]。图 3(d)所示为模拟的锂离子在锰酸锂材料晶格中的嵌入过程,研究者认为锂离子的嵌入不会引起晶格参数较大的变化[13]。
研究者以如前文所述制得的锰酸锂电极为工作电极,以银电极作为对电极,通过对Acatama盐湖卤水模拟液(Li+=1.5 g/L、Na+=76 g/L、K+=18.5 g/L、Mg2+=9.6 g/L)以电流密度0.5 mA/cm2嵌入和脱出过程各30 min进行提锂,4次循环后得到的富锂溶液中,Li+浓度为18 g/L,Na+浓度为1 g/L,K+、Mg2+浓度均在0.5 g/L以下。证明该体系对锂离子较好的选择性和较强的分离效果[10]。采用银电极作为反应的对电极,虽然在技术效果上取得了一定的进步,但是在实际提锂工艺过程中,银电极存在一定程度上的溶损,且银电极本身较为昂贵,导致在工业应用时工艺成本大幅提高。
1.2 (-)λ-MnO2|Brine|AC(+)体系银电极虽然其电化学性能相较于铂电极有所提高,但是其高昂的成本使得其难以进行工业应用。因此有研究者[14]尝试以活性炭为材料,通过将活性炭构筑成超级电容器来作为对电极。由于活性炭不仅对于氯离子有吸附作用,对盐湖卤水中其它杂质离子同样有一定的吸附,从而降低了体系对杂质离子的分离效果以及电极在溶液中的循环能力。
为了避免这一情况的发生,研究人员设计了一套全新的盐湖提锂方法和装置,其工作原理如图 4所示[14]。其提锂过程如下:盐湖卤水首先从入口进入第一层,其中锂离子在这一层中嵌入λ-MnO2电极形成LixMn2O4,其它杂质阳离子则由于阴离子交换膜阻挡,大部分无法进入负极室中留在这一层中。然后溶液继续进入下一层中,氯离子在负极室中被活性碳吸附。在锰酸锂达到饱和时,将溶液替换为纯净溶液,改变溶液流向和电极电位进行逆过程,活性炭上的氯离子解析下来进入溶液,同时锂离子从锰酸锂晶格中脱出,便可以在阳极室中得到纯净的氯化锂溶液。
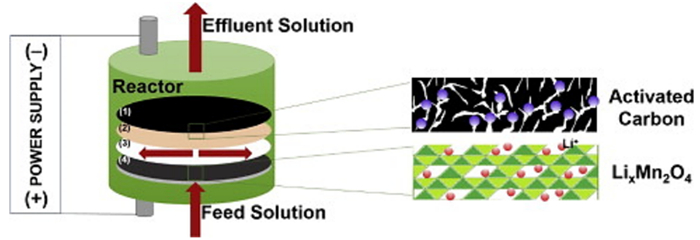 |
| 图 4 锰酸锂—活性炭体系盐湖提锂装置示意图[14]。其中(1)为活性碳电极,(2)为阴离子交换膜,(3)为尼龙垫圈,(4)λ-MnO2电极 Fig.4 Schematic of the continuous lithium recovery system[14]. (1) An activated carbon composite electrode, (2) an anion exchange membrane, (3) nylon as a spacer, and (4) a λ-MnO2 composite electrode are contained in the reactor |
1.3 (-)H1.6Mn1.6O4|Brine|Pt (+)体系
由于盐湖卤水矿化度高,且大都呈饱和溶液,黏度大。在传统的吸附法和上述利用电池材料进行提锂等工艺过程中,溶液在吸附剂或电极材料内部的扩散速度慢,路径长,导致提锂效率低。通过将吸附材料进行纳米化,可有效降低溶液在颗粒中的扩散路径,尤其对于成分复杂、盐浓度较高的盐湖卤水来说能有效减少浓差极化,提高吸附性能。同时也减少了锂离子在材料嵌入脱出引起的结构形变,抑制Jahn-Teller效应,改善了电池材料的循环性能[15]。
基于此,有研究通过高温固相法合成了纳米级锰系离子筛,作为工作电极进行盐湖提锂实验。同时选择使用具有良好导电性、高比表面积的石墨烯(r-GO)作为导电剂,r-GO的含氧功能团可以与粘接剂聚乙烯醇结合固定正极活性材料。在低电压下,其反应方程式如下:
| $ {\rm{R - }}{{\rm{H}}^{\rm{ + }}}{\rm{ + L}}{{\rm{i}}^{\rm{ + }}}{\rm{ = R - L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (3) |
| $ {\rm{R - L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}}{\rm{ = R - }}{{\rm{H}}^{\rm{ + }}}{\rm{ + L}}{{\rm{i}}^{\rm{ + }}} $ | (4) |
而在高电压下,其反应方程式如下:
| $ {\rm{R - Mn}}\left( {{\rm{IV}}} \right){\rm{ + e + L}}{{\rm{i}}^{\rm{ + }}}{\rm{ = R - Mn}}\left( {{\rm{III}}} \right){\rm{ - Li}} $ | (5) |
| $ {\rm{R - Mn}}\left( {{\rm{III}}} \right){\rm{ - Li - e = R - Mn}}\left( {{\rm{IV}}} \right){\rm{ + L}}{{\rm{i}}^{\rm{ + }}} $ | (6) |
其中R为正极材料中不参与反应的化合物。实验结果证明其吸附容量达到38.78 mg/g,且在5个循环后其循环容量仅由于Mn的歧化反应降低了1%。通过选择使用优质的导电剂改进锂离子电池材料导电性以及合成纳米级材料、混合PPy等材料降低保护材料防止溶损同时提高材料扩散性能、循环容量,将是今后锂离子电池材料在盐湖提锂中应用的热门研究方向[16]。
2 磷酸铁锂电化学提锂体系除锰酸锂外,磷酸铁锂也是近年来用于盐湖提锂的主要材料之一。作为市场上主流的电池正极材料,相较于锰酸锂,磷酸铁锂拥有更大的理论吸附容量和更低的反应电位,并且其在水环境中更为稳定。
Mauro Pasta[17]采用磷酸铁锂和银电极,构筑了(-)FePO4|Brine|Ag(+)电化学提锂体系,其工作原理如图 5(a)所示[17]。整个工艺同样由两个步骤组成:(1)磷酸铁作为阴极在自身还原时捕集卤水中的锂离子,银作为阳极通过捕集卤水中的氯离子氧化为氯化银,过程电极反应过程如反应(7)和(8)所示;(2)当阴极上的磷酸铁转变为磷酸铁锂时,将锂溶液替换为纯净的电解质溶液,以磷酸铁锂电极作为阳极,氯化银电极作为阴极进行电解,此时锂离子和氯离子分别从磷酸铁锂和氯化银电极中同时被释放出来进入溶液中,得到不含杂质的氯化锂溶液。经第二步后电极体系还原成初始形态,继续进行下一个周期的提锂循环。
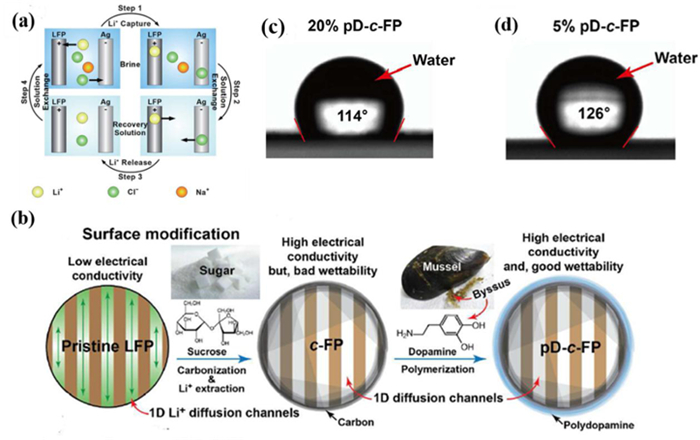 |
| 图 5 (a) 提锂循环原理示意图[17];(b)磷酸铁锂和磷酸铁的表面改性[18];(c)20%聚多巴胺涂层对磷酸铁界面性能的影响[18];(d)5%聚多巴胺涂层对磷酸铁界面性能的影响[18] Fig.5 (a)Schematic of the working principle behind a complete cycle of the lithium recovery[17], (b)surface modification of LiFePO4 and FePO4[18], (c) The effect of polydopamine coating on interfacial properties of c-FP powder. Contact angle images of 20% pD-c-FP electrodes[18], (d) 5% pD-c-FP electrodes[18] |
阴极反应:
| $ {\rm{L}}{{\rm{i}}^ + } + {\rm{FeP}}{{\rm{O}}_{\rm{4}}} + {\rm{e = LiFeP}}{{\rm{O}}_4} $ | (7) |
阳极反应:
| $ {\rm{Ag + C}}{{\rm{I}}^ - } = {\rm{AgCl + e}} $ | (8) |
采用该电化学提锂体系处理Li+浓度为0.05 M,Li/Na比为1 : 100的模拟溶液,以0.5 mA/cm2的电流密度进行电解2 h,得到的纯锂溶液中Li+浓度为0.115 M, Na+浓度为0.021 M,能有效地分离盐湖卤水中的锂离子和钠离子。
该体系证明了使用磷酸铁锂材料进行盐湖提锂的可行性,同时相较于锰酸锂—银电极体系,磷酸铁锂电极体系消耗的电能更少,对盐湖卤水的适应性也更强。
由于磷酸铁锂本身的电子导电性比较差,通过对其表面进行改性优化处理,可显著提高其提锂性能。如在FePO4|Brine|C2H2IN|Pt体系中,将磷酸铁锂粉末与蔗糖以7 : 3的质量比混合后,在高压反应釜中180 ℃反应12 h,使用离心分离得到沉淀物,将其置于烘箱中烘干,然后在氮气的保护氛围下600 ℃加热1 h得到碳包覆的磷酸铁锂(图 5(b)所示[18])。通过表面碳包覆,显著提高了磷酸铁锂材料的导电性,同时由于表面碳层可起到隔离电极材料与盐湖卤水的直接接触的作用,使材料在水溶液中的稳定性进一步加强,循环性能得到提升。
尽管通过碳包覆可以改善材料的导电性,但碳包覆后的颗粒表面疏水性较强,溶液对电极材料的浸润性差。为此又开发了氯化多巴胺溶液处理碳包覆后的磷酸铁锂材料,以改进表面疏水性。由于聚多巴胺中的儿茶酚基和氨基具有极强的极性,与材料之间有较强的作用力,可以吸附在磷酸铁锂材料表面,使其具有很好的浸润性,降低了锂离子在电极材料与电解质界面之间的传质阻力。图 5(c)和(d)为不同聚多巴胺含量处理后的磷酸铁锂材料接触角图像对比,证明了进行聚多巴胺处理可以改善材料的润湿性能。
除了上述所述的锰酸锂、磷酸铁锂体系外,还研发了诸如(-)LiMnO4 |LiCl | ZnCl2 | Zn(+)[19]、(-)LiFePO4|Brine|KNiCFe(+)[20]等多种电化学提锂体系。这些提锂体系对电极的选择不同,对工作电极材料的不同处理,提锂效果有些许差异,但其工作原理大同小异,在此不再赘述。
3 三元锂电材料电化学提锂体系Ni1/3Co1/3Mn1/3O2|Brine|Ag作为新一代锂离子电池正极材料,拥有更高的理论容量(275 mAh/g)和更好的高倍率充放电能力[21],在水溶液体系中也拥有稳定的电化学窗口,可以作为新一代的水溶液体系电容器和锂离子电池材料使用。基于LiNi1/3Co1/3Mn1/3O2材料的以上特点,有研究者[22]尝试使用其来捕集盐湖卤水中Li+。在循环伏安测试中,如图 6所示,测得纯锂溶液中在Epa=0.693 V和Epc=0.587 V时分别有锂离子的脱出和嵌入峰,而在含锂离子的混合溶液中,脱锂峰偏移至0.758 V,嵌锂峰则在0.597 V。说明溶液中杂质离子的存在对提锂过程有一定的影响。值得注意的是在不含锂离子的混合溶液中,在Epc=0.324 V时存在的峰形可能是Mn4+的还原,而在实际操作过程中进行高倍率循环时,循环时间大于20 min会出现Mn的溶解以及其它的副反应,导致溶液中Li+纯度下降,验证了这一反应的存在。该体系在盐湖卤水中长时间循环的稳定性能还有待测试,但是三元材料作为盐湖卤水提锂正极使用所表现出的高倍率充放电性能以及较高的吸附容量,都值得对该体系进行更深入的研究。
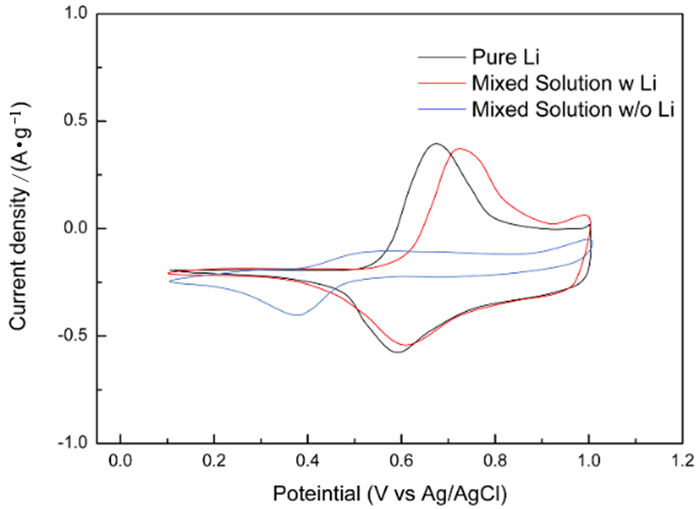 |
| 图 6 NCM材料在纯锂溶液,含锂以及不含锂的混合溶液的循环伏安曲线[22] Fig.6 Cyclic voltammogram of NCM in 1 M LiCl, in mixed solution (1 M each Mn+=Na+, Mg2+, K+, Ca2+)with and without 1M LiCl[22] |
Ni0.5Mn1.5O4|Brine|Ag已经被证明在水溶液体系的锂离子电池中,拥有147 mAh/g的高容量以及超过1 000次循环的优良循环能力。研究者[23]选用Li1-xNi0.5Mn1.5O4/Ag体系来进行盐湖卤水提锂实验,在合成材料时通过掺杂Ni元素消除Li0.5Mn1.5O4中Li离子之间的排斥能,降低了Li嵌入/脱出的能垒,使得Li+在Li1-xNi0.5Mn1.5O4结构中有着更快的传输速率。同时在LNMO材料中,Ni2+/Ni4+的还原反应也使得材料拥有更高的容量(1.259 mmol Li+/g)。以1.05 C电流对Uyuni盐湖模拟卤水进行充放电循环提锂实验,单次循环20 min,可以得到Li纯度在98.14%的富锂溶液。
4 电化学脱嵌法盐湖提锂上述由锰酸锂、磷酸铁锂或三元锂电材料为电极吸附材料而构建的提锂体系,实际在对盐湖卤水中的锂元素进行提取和解吸的只有涂覆有吸附材料的工作电极。而对电极(如银电极、铂电极等)的作用更多的是匹配工作电极上的反应,起平衡电荷的作用,其上发生的电化学反应的主要是尽量避免析氢、析氯等反应而造成污染或溶液酸碱性的变化。换言之,除了工作电极本身在进行和锂相关的反应,对电极从某种意义上而言是在“做无用功”。此外,过程中锂的吸附和解吸分两步进行,操作过程繁琐。
既然吸附和解吸过程都是通过通电的方式实现,那能否将两步合一,在同一个过程中同时完成吸附和解吸操作呢?
实际上,在锂离子电池工作过程中,电极的阴阳极属性随着充放电过程的转变也在发生相应变化。如磷酸铁锂和锰酸锂在充电脱锂时是阳极,而在放电嵌锂时则变为阴极。换言之,如果以脱锂后的FePO4为阴极,嵌锂后的LiFePO4作为阳极,来构建新的提锂体系,则有望实现阴极电化学提锂的同时,在阳极实现锂的同步解吸。
基于这一创新思路,中南大学赵中伟教授提出并构筑了“富锂态吸附材料(阳极)│支持电解质│阴离子膜│卤水│欠锂态吸附材料(阴极) ”电化学脱嵌法盐湖提锂新体系,实现了盐湖卤水中锂的高效选择性提取和富集,并且基于不同的盐湖卤水和含锂溶液,可用的吸附材料可为磷酸铁锂、锰酸锂或钛酸锂离子筛材料等材料[24, 25]。
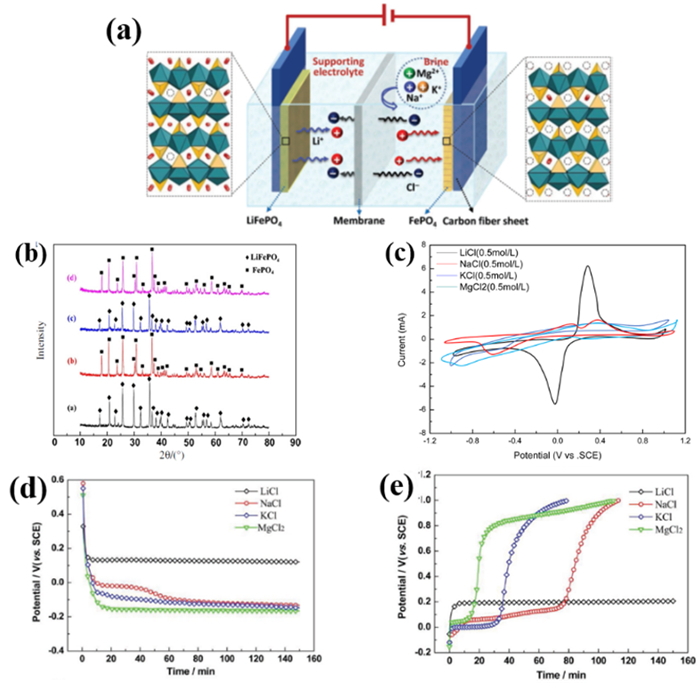
新方法的提锂原理如图 7(a)所示[7],具体而言(以LiFePO4为例):(1)采用LiFePO4为阳极,LiFePO4脱锂后的FePO4为阴极,用阴离子交换膜将阴阳极分割成两个室;(2)阳极室(即富锂室)注入NaCl等不含Mg2+的支持电解质,阴极室(卤水室)注入待提锂的盐湖卤水;(3)在阴、阳极两端施加一定电压,阳极LiFePO4失去电子将Li+脱出进入富锂室(即反应LiFePO4-e = Li++FePO4),而阴极FePO4因得到电子而迫使盐湖中的Li+进入到FePO4晶格中以维持材料的电中性(反应Li++FePO4+e = LiFePO4),与此同时,卤水室的阴离子则通过阴离子膜进入富锂室以维持整个体系的电荷平衡;(4)将完成电解周期的电极对调,进行下一周期电解,实现盐湖卤水中锂的不断提取与富集,电解提锂时阳极阴极分别如反应(9)和(10)所示。最后得到的阳极溶液中不含镁离子等杂质阳离子,仅为富含锂的纯净溶液,可以采用碳酸盐沉淀法生产碳酸锂产品。
 |
| 图 7 (a) 盐湖提锂装置结构图[7];(b)不同阶段的电极材料XRD图谱[26];(c)磷酸铁锂材料在不同镁锂比下锂离子的循环伏安曲线[7];(d)离子在阴极上嵌入计时电位曲线[7];(e)离子在阳极上脱出的计时电位曲线[7] Fig.7 (a) Structure of the electrolytic cell for lithium extraction[7], (b)XRD patterns of electrode at different stage [26], (c)Cyclic voltammetry curves of lithium ions in LiFePO4 with different magnesium lithium ratios[7], (d)Chrono potentiometric curves of the intercalation[7], (e)deintercalation of Li+, Na+, K+, and Mg2+ ions into/from FePO4/LiFePO4[7] |
| $ {\rm{LiFeP}}{{\rm{O}}_{\rm{4}}}{\rm{ - e = L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + FeP}}{{\rm{O}}_{\rm{4}}} $ | (9) |
| $ {\rm{FeP}}{{\rm{O}}_{\rm{4}}}{\rm{ + L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + e = LiFeP}}{{\rm{O}}_{\rm{4}}} $ | (10) |
值得注意的是,在该电化学脱嵌法盐湖提锂过程中,由于阴、阳极电极反应互为可逆反应,因此电解过程的理论槽电压为0 V。这也意味着,其理论直流电耗为零,外电路输入的能量主要用于过程存在电化学极化、溶液电阻和膜电阻等耗能。
通过研究对磷酸铁锂材料在不同离子溶液中的循环伏安曲线(图 7c),可以看出在氯化锂溶液中,当Epa=0.27 V(vs. SCE)有明显的氧化峰,而在Epc=¨0.04 V(vs. SCE)时有对应的还原峰,氧化还原峰的对称性较好,且面积也相当,说明Li+在LiFePO4材料中的脱出和嵌入反应具有优良的可逆性能[7]。而在氯化钠溶液中,分别在Epa=0.08 V(vs. SCE)和Epa=0.35 V(vs. SCE)有两个氧化峰,分别对应于钠离子从NaFePO4和Na0.7FePO4晶体结构中的脱出反应;而其嵌钠反应的电位为Epc=-0.60 V,相比于嵌锂反应的Epc=0.04 V(vs. SCE)要低得多,说明钠离子在材料中有一定的可逆性,但只需要控制反应电位,Li+会优先嵌入至FePO4晶格中,从而实现Li/Na的分离。而钾离子和镁离子几乎不嵌入磷酸铁锂材料,对提锂过程干扰较小。
此外,通过对比磷酸铁锂材料在反复脱嵌锂离子过程中的XRD图谱可以发现,循环前后的磷酸铁锂与磷酸铁峰形。没有发生明显的变化,可以认为锂离子在盐湖卤水体系中同样能自由地在晶格中扩散而不改变晶体结构(图 7(b)[26])。通过进一步研究盐湖卤水中主要阳离子在材料中的脱嵌行为,通过分析计时电位曲线,发现离子在阴极上的嵌入顺序为Li>Na>K>Mg,而脱出顺序则完全相反[图 7(d)和(e)],说明锂离子相较于其他杂质阳离子会被优先吸附,且即便有杂质离子进入至磷酸铁晶格内部,杂质离子会更容易脱出而不至于阻塞锂离子扩散的位点影响材料的循环性能[7]。
采用该方法处理模拟的盐湖卤水(Li+=1.4 g/L、Na+=30 g/L、K+=3.9 g/L、Mg2+=48 g/L),在0.25 V槽电压下经过4次循环,阳极溶液中锂可以达到1.75 g/L。此外,以五矿青海一里坪盐湖原卤(成分:Li 97.5 mg/L、Mg 13.1 g/L、K 3.5 g/L、Na 100.4 g/L、Mg/Li=134.4)为原料进行了提锂试验,在0.2 V槽电压连续电解50 h后,锂的回收率可达83%,提锂效果显著。此时,阳极富锂液中锂浓度上升至80 mg/L左右,而阴极卤水中的锂浓度则降至18 mg/L。尤为突出的是,所得富锂液中的镁锂比仅为1.2 : 1,远低于初始卤水中的134.4 : 1,表现出很好的镁锂分离效果[27]。
电化学脱嵌法盐湖提锂技术于2017年实现技术成果转让,并已完成了相关的工业化试验,技术经济指标优良,是极具发展潜力的绿色盐湖提锂技术之一。
5 结论与展望如何实现盐湖卤水中锂的绿色、高效提取是未来新能源汽车产业和锂工业可持续发展亟待的关键技术难题之一[28]。利用锂离子电池正极材料进行盐湖提锂越来越受到人们的重视,也是目前提锂技术的研究热点。
目前,已研究和开发的可用于盐湖卤水提锂的材料和体系众多,尤以锰酸锂和磷酸铁锂为最。在这些提取技术中,电化学脱嵌法是最具发展前景技术之一。与传统盐湖卤水提锂工艺相比,该方法大幅度降低了可处理卤水中锂的浓度,避免了传统提锂技术因盐田滩晒获取老卤原料而造成的锂大量损失;此外,生产过程中无需调节卤水的酸碱度、盐度,亦无有毒有害物质的添加和产生,提锂后的卤水无害可直接返回盐田,环保效益显著。
| [1] |
吴荣庆. 新能源材料锂:资源储量与供需形势分析[J]. 国土资源情报, 2017(1): 4-9. DOI:10.3969/j.issn.1674-3709.2017.01.002 |
| [2] |
杨卉芃, 柳林, 丁国峰. 全球锂矿资源现状及发展趋势[J]. 矿产保护与利用, 2019, 39(5): 26-40. |
| [3] |
HUANG WEINONG, SUN ZHINAN, WANG XUEKUI, et al. Progress in industrialization for lithium extraction from salt lake[J]. Modern Chemical Industry, 2008, 28(2): 14-17. |
| [4] |
王秋舒, 邱景智, 邵鹤楠, 等. 全球盐湖卤水型锂矿床成矿特征与资源潜力分析[J]. 中国矿业, 2015, 24(11): 82-88. |
| [5] |
谭秀民, 张永兴, 张利珍, 等. 能源金属锂资源开发利用现状及发展建议[J]. 矿产保护与利用, 2017(5): 87-92. |
| [6] |
徐静.锂离子电池正极锰酸锂的制备[D].呼和浩特: 内蒙古工业大学, 2019.
|
| [7] |
LIHUA HE, WENHUA XU, YUNFENG SONG, et al. Lithium-Ion Batteries: New insights into the application of lithium-ion battery materials: selective extraction of lithium from brines via a rocking-chair lithium-ion battery system (global challenges 2/2018). 2018, 2(2): 1700079.
|
| [8] |
KANOH H, OOI K, MIYAI Y, et al. Selective electroinsertion of lithium ions into a Pt/λ-MnO2 electrode in the aqueous phase[J]. Langmuir, 1991, 7(9): 1841-1842. DOI:10.1021/la00057a002 |
| [9] |
杨卉芃. 碳酸锂及钙镁杂质在扎布耶混盐碳化过程中的行为[J]. 矿产保护与利用, 2005(3): 40-42. |
| [10] |
Lee Jaehan, Yu Seung-Ho, Kim Choonsoo, et al. Highly selective lithium recovery from brine using a λ-MnO2-Ag battery, 2013, 15(20): 7690-7695.
|
| [11] |
ZHAO ALONG, LIU JINCHENG, AI XINPING, et al. Highly selective and pollution-free electrochemical extraction of lithium by a polyaniline/LixMn2O4 cell[J]. ChemSusChem, 2019, 12(7): 1361-1367. DOI:10.1002/cssc.201803045 |
| [12] |
KIM S, JOO H, MOON T, et al. Rapid and selective lithium recovery from desalination brine using an electrochemical system[J]. Environmental Science:Processes & Impacts, 2019, 21(4): 667-676. |
| [13] |
MARCHINI, FLORENCIA, WILLIANMS, et al. Electrochemical impedance spectroscopy study of the LixMn2O4 interface with natural brine[J]. Journal of Electroanalytical Chemistry:An International Journal Devoted to All Aspects of Electrode Kinetics, Interfacial Structure, Properties of Electrolytes, Colloid and Biological Electrochemistry, 2018, 819(SI): 428-434. |
| [14] |
SEONI KIM, JAEHAN LEE, JIN SOO KANG, et al. Lithium recovery from brine using a λ-MnO2/activated carbon hybrid supercapacitor system[J]. Chemosphere, 2015, 125: 50-56. DOI:10.1016/j.chemosphere.2015.01.024 |
| [15] |
伏勇胜.纳米锰酸锂及锰酸锂/石墨烯复合物的制备与电化学性质研究[D].西安: 陕西科技大学, 2015.
|
| [16] |
丁伟, 王林霞, 胡天阳, 等. 聚吡咯作为水系锂离子电池的负极材料[J]. 电源技术, 2019, 43(12): 1933-1936. |
| [17] |
PASTA M, BATTISTEL A, LA MANTIA F. Batteries for lithium recovery from brines[J]. Energy & Environmental Science, 2012, 5(11): 9487. |
| [18] |
KIM JOO-SEONG, LEE YONG-HEE, CHOI SEUNGYEON, et al. An Electrochemical Cell for Selective Lithium Capture from Seawater[J]. Environ. Sci. Technol, 2015, 49(16): 9415-9422. DOI:10.1021/acs.est.5b00032 |
| [19] |
SEONGSOO KIM, Dr. JAEHAN LEE, Dr. SEONI KIM, et al. Electrochemical Lithium Recovery with a LiMn2O4-Zinc Battery System using Zinc as a Negative Electrode[J]. Energy Technology, 2018, 6(2): 340-344. DOI:10.1002/ente.201700488 |
| [20] |
Dr. R. TróCOLI, A. BATTISTEL, Dr. F. LA MANTIA. Nickel hexacyanoferrate as suitable alternative to Ag for electrochemical lithium recovery. 2015, 8(15): 2514-2519.
|
| [21] |
桂阳海, 赵恒勤, 胡国荣. 锂离子电池正极材料锂镍钴氧化物的研究[J]. 矿产保护与利用, 2004(6): 34-38. |
| [22] |
CHOSEL P. LAWAGON, GRACE M. NISOLA, ROSEMARIE ANN I. CUEVAS, et al. Li1-xNi0.3Co1/3Mn1/3O2/Ag for electrochemical lithium recovery from brine[J]. Chemical Engineering Journal, 2018, 348: 1000-1011. DOI:10.1016/j.cej.2018.05.030 |
| [23] |
CHOSEL P. LAWAGON, GRACE M. NISOLA, ROSEMARIE ANN I, et al. Li1-xNi0.5Mn1.5O4/Ag for electrochemical lithium recovery from brine and its optimized performance via response surface methodology[J]. Separation and Purification Technology, 2018, 212: 416-426. |
| [24] |
ZHAO Z W, SI X F, LIANG X X, et al. Electrochemical behavior of Li+, Mg2+, Na+ and K+ in LiFePO4/FePO4 structures[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(4): 1157-1164. DOI:10.1016/S1003-6326(13)62578-9 |
| [25] |
ZHONGWEI ZHAO, XIUFEN SI, XUHENG LIU, et al. Li extraction from high Mg/Li ratio brine with LiFePO4/FePO4 as electrode materials[J]. Hydrometallurgy, 2013, 133: 75-83. DOI:10.1016/j.hydromet.2012.11.013 |
| [26] |
LIU X, CHEN X, ZHAO Z, et al. Effect of Na+ on Li extraction from brine using LiFePO4/FePO4 electrodes[J]. Hydrometallurgy, 2014, 146: 24-28. DOI:10.1016/j.hydromet.2014.03.010 |
| [27] |
INTARANONT N, GARCIA-ARAEZ N, HECTOR A L, et al. Selective lithium extraction from brines by chemical reaction with battery materials[J]. Journal of Materials Chemistry A, 2014, 2(18): 6374-6377. DOI:10.1039/C4TA01101E |
| [28] |
尚玺, 孟宇航, 张乾, 杨华明. 富锂矿物的锂提取与战略性应用[J]. 矿产保护与利用, 2019, 39(6): 152-158. |
 2020
2020