| 含砷金矿微生物预氧化过程强化方法研究进展 |
2. 陕西省黄金与资源重点实验室,陕西 西安 710055
2. Key Laboratory of Gold and Resources in Shaanxi Province, Xi'an 710055, China
金作为一种不可再生的贵金属资源[1],被广泛应用于装饰、电子通讯、航天航空、医药等领域。随着全球生态问题日益严重,易选易处理金矿资源日益枯竭,难处理金矿资源已成为当今世界金提取的重要来源。难处理金矿根据难处理的原因可分为三类:微细浸染型金矿、碳质金矿和复杂多金属硫化矿型金矿[2]。在微细浸染型金矿中,金通常以显微或次显微甚至晶格金的形式包裹在黄铁矿、砷黄铁矿等硫化矿物中[3-4],金的嵌布粒度特别细,即使采用细磨的方法也很难解离,因而采用传统的氰化工艺直接氰化,氰化物不能到达金的表面,阻碍了金的回收,金的回收率通常低于40%。因此对于这一类矿物,有必要在氰化工艺之前进行一定的氧化预处理,使包裹的金裸露出来。目前难处理金矿预处理的方法主要有焙烧氧化法、加压氧化法和微生物氧化法。焙烧氧化过程中容易出现结晶和烧结现象,降低金的浸出率,同时也会产生大量有毒有害气体,污染环境。加压氧化对设备要求高,投资成本大。与焙烧氧化、加压氧化相比,微生物氧化具有条件温和、环境友好、投资成本低、设备简单等优势,因而越来越受到人们的关注。
然而,微生物氧化工艺也存在氧化周期长、矿浆浓度小、原料要求苛刻等问题,尤其在处理砷黄铁矿为主要载金矿物的难处理金矿时,金的回收率往往很低,造成资源严重浪费。这主要是因为含砷矿物微生物氧化过程中会产生大量的砷[As(Ⅲ)和As(Ⅴ)],尤其是As(Ⅲ)的毒性对微生物群落的生长有显著的抑制性;另一方面,砷黄铁矿生物浸出过程中可能会生成单质硫、黄钾铁矾、砷华、氢氧化铁、磷酸铁、无定形的砷酸铁以及结晶度很高的臭葱石等中间产物和次生矿物[5-11]覆盖在矿物表面,阻碍了细菌和矿物之间的作用。
因此,如何强化难处理金矿的微生物预氧化,从而促进后续氰化浸金工艺中金的回收已成为目前黄金行业科学技术攻关的重点和难点。当前含砷难处理金矿的微生物预氧化过程强化的主要方法包括氧化剂强化、金属离子强化、表面活性剂强化以及原电池效应强化等。本文综述了目前国内外关于含砷金矿微生物预氧化过程强化的研究现状,分析总结了各种强化方法的作用机理,并探讨了该领域未来的研究方向。
1 含砷金矿细菌预氧化过程强化研究现状 1.1 氧化剂强化 1.1.1 Fe3+及其化合物一般认为砷黄铁矿的微生物氧化过程以间接作用机制为主[12-13],即Fe3+是主要的氧化剂。因此,可以考虑在生物浸出体系中直接加入Fe3+,取代细菌氧化作用生成的Fe3+,促进含砷金矿的浸出。Yu等[14]研究表明砷黄铁矿的溶解速率随Fe3+浓度的增大而升高。Mikhlin等[15]比较了不同铁盐体系中砷黄铁矿的溶解速率,得出Fe(NO3)3浸出砷黄铁矿最快,其次是Fe(Cl)3,Fe2(SO4)3最慢。Fomchenko等[10]指出在砷黄铁矿浸出初期,Fe3+破坏了其晶格表面的化学键,促进了砷黄铁矿中铁和砷的溶解。Zhang等[16]采用XANES、Raman等表面测试技术证明了Fe3+有助于S. thermosulfidooxidans菌体系中砷黄铁矿的浸出,主要是因为Fe3+能够促进细菌生长,强化表面产物单质硫和雌黄的进一步氧化。
Deng[17]研究了S. thermosulfidooxidans菌体系中FeCl3、Fe(NO3)3以及Fe2O3等Fe(Ⅲ)化合物对砷黄铁矿微生物氧化的影响。结果表明,Fe(Ⅲ)化合物的加入有效促进了毒砂的生物浸出,砷的浸出率从55%提高到64%~77%。在Fe(Ⅲ)存在的情况下,毒砂表面腐蚀更为严重,中间体S0、硫代硫酸盐和雌黄显著减少,黄钾铁矾和施氏矿物增加。这说明Fe(Ⅲ)化合物的加入提高了铁和硫的氧化活性,加速了中间产物的转化。另外,三种化合物对砷黄铁矿氧化的促进效果顺序为FeCl3>Fe(NO3)3 >Fe2O3。
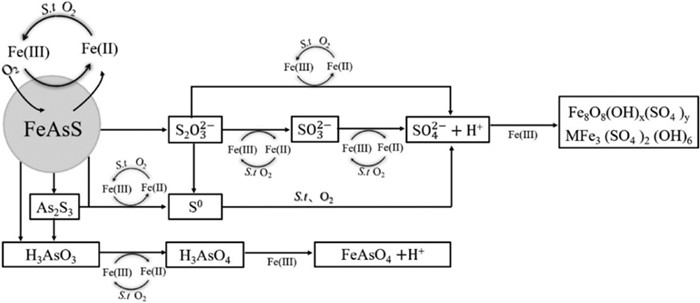 |
| 图 1 Fe(Ⅲ)存在条件下S. thermosulfidooxidans菌浸出砷黄铁矿的机理[17](当加入Fe(Ⅲ)时,M为NH4+,而不加入Fe(Ⅲ)时,M为K+) Fig.1 The mechanisms of bioleaching of arsenopyrite by S. thermosulfidooxidans with Fe(Ⅲ) added. The shaded lines refer to the process strengthened by Fe(Ⅲ) during the arsenopyrite bioleaching; when added Fe(Ⅲ) the M is NH4+, while without Fe(Ⅲ) added it is K+. |
由于砷黄铁矿是最常见的载金矿物之一,难处理金矿在细菌氧化过程中往往会产生As(Ⅲ)和As(Ⅴ),As(Ⅲ)和As(Ⅴ)对微生物群落的生长具有抑制作用,As(Ⅲ)能够与巯基结合使蛋白质失活,As(Ⅴ)会抑制ATP的合成[18];此外,As(Ⅲ)和As(Ⅴ)作用下细菌胞外多糖含量会显著降低[19],这些都会使得矿物的浸出速率受到严重影响[20-21]。由于细菌对As(Ⅴ)的耐受浓度比As(Ⅲ)的耐受浓度大得多,一般认为As(Ⅲ)的毒性高于As(Ⅴ)。因此为了提高后期氰化浸金的提金率,可以考虑加入一定的氧化剂,促进As(Ⅲ)氧化为As(Ⅴ),减小As(Ⅲ)对细菌的毒害作用,从而促进含砷矿物的氧化。
热力学分析表明,Fe3+作为氧化剂,很容易将As(Ⅲ)氧化为As(Ⅴ)。然而,在大多数情况下,该反应很难发生。有报道指出,在黄铁矿或黄铜矿存在的情况下,当体系氧化还原电位较高时,As(Ⅲ)能够氧化为As(Ⅴ) [22-23]。另外,砷黄铁矿和As(Ⅲ)对Fe3+具有竞争作用,根据热力学分析,砷黄铁矿在酸性体系中的稳定性远远低于As(Ⅲ),Fe3+优先氧化砷黄铁矿,因此体系中的Fe3+主要用来氧化砷黄铁矿,体系中砷的存在形态以As(Ⅲ)为主。
1.1.2 其他氧化剂除了Fe3+,常见的氧化剂还有臭氧、过氧化氢、次氯酸盐、高锰酸钾等。由于生物浸出的条件较为苛刻,目前采用其他氧化剂来强化生物浸出体系As(Ⅲ) 转化为As(Ⅴ) 的研究较少。李骞[24-25]研究了添加次氯酸钠和过硫酸铵强化生物氧化As(Ⅲ)的基本行为,结果表明,在生物浸出一定时间后加入次氯酸钠和过硫酸铵,可以显著促进As(Ⅲ)的氧化;当次氯酸钠的添加量超过1.5 mL/100 mL时,细菌的活性受到显著影响。但过硫酸铵的添加不影响细菌的繁殖与活性。崔日成等[26]研究发现生物预氧化含砷金矿48 h后加入质量分数30%的0.3 mL H2O2,As(Ⅲ)的浓度显著降低,说明H2O2能够促进As(Ⅲ)转化为As(Ⅴ)。
1.2 金属离子强化研究发现,一些金属离子对硫化矿的生物浸出过程具有促进作用,目前已有Hg2+、Co2+、Bi3+、Ag+和Cu2+等金属离子被成功地用作催化剂来改善各种矿物的生物浸出[27]。近年来,在含砷难处理金矿微生物预氧化方面研究较多的金属离子催化剂主要是Cu2+和Ag+。
1.2.1 Cu2+苑洪晶[28]研究发现Cu2+对含砷金矿的生物预氧化具有一定的强化作用。后来,李骞等[29]和Zhang等[30]通过试验证明了Cu2+对砷黄铁矿的生物氧化具有催化作用,能够大大缩短砷黄铁矿生物浸出的时间。对于其催化作用机制,李骞等[29]认为Cu2+能够进入由As2S2、As2S3形成的致密钝化层中参与反应,加速钝化层的溶解,使钝化层表面产生较多的裂纹和孔隙,从而促进砷黄铁矿的进一步氧化。Zhang等[30]认为Cu2+对砷黄铁矿生物氧化的强化作用是Cu2+/(Cu2S/CuS)和Fe3+/Fe2+的两个循环的共同作用。Cu2+的加入有助于Cu2S/ CuS的生成,从而加速了钝化产物(As2S2、As2S3和S0)的氧化溶解,而Cu2S/ CuS又可以被Fe3+迅速氧化成Cu2+。
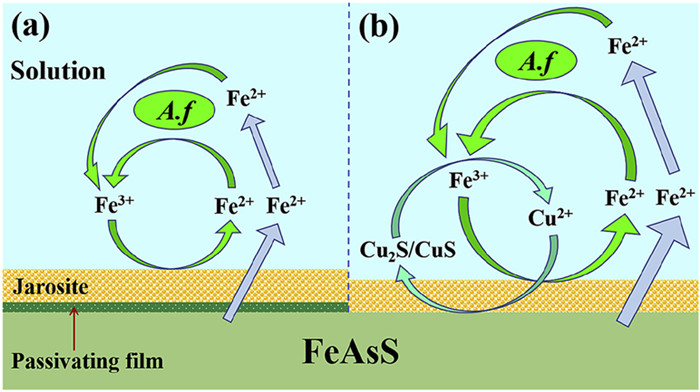 |
| 图 2 砷黄铁矿细菌浸出机理示意图[30] (a)不含Cu2+;(b)含Cu2+ Fig.2 Schematic diagram of the mechanism of arsenopyrite bioleaching by bacteria (a) without and (b) with Cu2+. |
1.2.2 Ag+
Ag+对含砷矿物生物预氧化的强化作用最早也是苑洪晶[28]在其硕士学位论文中研究证明的。在含砷金矿有菌浸出体系下,Ag+的加入有助于提高体系的酸度和电位,砷的浸出率相比无Ag+时有较大的提升,且在浓度为0.01 g/L,表现出最优的催化效果。方芳等[31]也通过研究得出Ag+对砷黄铁矿生物浸出有催化作用。在Ag+浓度为2 mg/L、矿浆浓度为2%、溶液初始pH为2.0的条件下,砷黄铁矿浸出16天后,砷的浸出率比不添加Ag+时提高了23.14%左右。
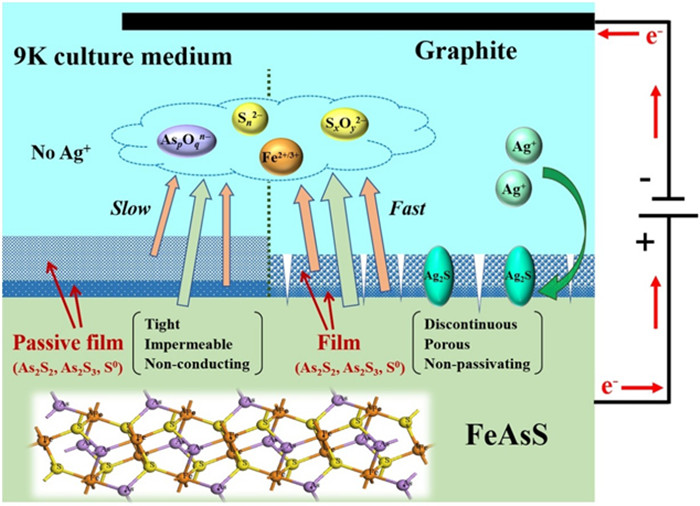 |
| 图 3 Ag+对砷黄铁矿电化学氧化溶解的催化机理[33] Fig.3 Mechanism for Ag+ catalyzing the electrochemical oxidation of arsenopyrite. |
关于其催化机理,张明[32]通过考察Ag+存在情况下含砷金精矿生物浸出过程浸出液性质的变化以及浸出渣的表征,认为Ag+取代矿物表面的As促进了Ag2S的生成,Ag2S又可以被Fe3+氧化重新生成Ag+,从而使砷黄铁矿的氧化过程加快。Zhang等[33]研究了9K培养基体系中Ag+对砷黄铁矿电化学氧化行为的影响,结合AFM、SEM和XPS等分析,得出Ag+对砷黄铁矿氧化的促进作用主要是因为Ag+的加入使砷黄铁矿表面生成了可导电的Ag2S,且该产物疏松多孔,不会阻碍砷黄铁矿的进一步溶解。
1.3 表面活性剂强化生物浸出过程中,由于浸矿微生物与氧化剂存在于浸出液中,浸出液与矿石的接触、润湿和渗透在生物浸出过程中起着关键的作用。矿物表面性质、浸出液的表面张力在一定程度上可能会阻碍矿石与浸出液的接触,不利于矿石的浸出[34]。表面活性剂因其具有独特的双亲结构,易于吸附、定向于物质界面,使溶液表面张力减小,促进溶液在物质界面的润湿和渗透,因而可应用于强化矿物浸出过程。研究表明,添加适量的表面活性剂有助于提高矿物及中间产物单质硫的亲水性,减小浸出液表面张力,使细菌更容易吸附在矿物及单质硫颗粒表面,进而促进矿物的溶解以及中间产物硫膜的氧化溶解[35-38]。
Deng等[39]使用三种表面活性剂Tween-80、Tween-20和乳化剂OP强化低品位难处理金矿的细菌浸出,试验结果表明,三种表面活性剂都能极大地提高矿石中砷的浸出率,其中Tween-80的效果最好。方芳等[40]采用木质素磺酸钙、十二烷基三甲基溴化铵(DTAB)和Tween-80这三种表面活性剂研究了对含砷金精矿细菌生长和砷浸出率的影响。结果表明,添加DTAB对砷浸出率无影响,而添加阴离子表面活性剂木质素磺酸钙和非离子表面活性剂Tween-80能提高砷的浸出率。它们的最佳质量浓度分别为30 mg/L和80 mg/L。在最佳质量浓度下,砷的浸出率分别比不添加表面活性剂时高约13.7%和9.1%。机理研究表明,加入木质素磺酸钙提高了细菌在矿物表面的附着率,降低了浸出液的表面张力。
1.4 原电池效应强化在酸性溶液体系中,静电位不同的两种矿物相接触会形成原电池,静电位低的作为阳极被氧化,静电位高的作为阴极而得到保护[41]。因此,可将原电池效应应用于强化含砷金矿的微生物预氧化中,目前研究较多的是黄铁矿-砷黄铁矿原电池反应。
1.4.1 黄铁矿-砷黄铁矿砷黄铁矿和黄铁矿作为两种重要的载金矿物,在难处理金矿中往往呈共生或伴生的关系。由于黄铁矿的静电位高于砷黄铁矿的静电位[42],因此在含砷金矿细菌氧化过程中,砷黄铁矿与黄铁矿之间形成原电池,砷黄铁矿作为阳极被氧化溶解,黄铁矿作为阴极被保护。
Taxiarchou等[43]研究表明砷黄铁矿在电位480~550 mV发生氧化,黄铁矿的氧化需要的电位要高一些,而此时砷黄铁矿的氧化几乎停止。Komnitsas等[44]得出,砷黄铁矿优先被氧化,而黄铁矿的溶解发生在后期。杨洪英等[45]通过显微镜观察难处理金矿中砷黄铁矿-黄铁矿矿物的细菌氧化过程,发现砷黄铁矿极其活泼,晶体表面氧化腐蚀严重,金属光泽消失;黄铁矿氧化腐蚀不明显,表面依然具有光泽,没有太大变化。以上研究均证明了砷黄铁矿与黄铁矿之间原电池反应现象的存在,但对于黄铁矿强化砷黄铁矿氧化过程的机理是否仅仅与原电池反应有关,是否存在其他的作用机制仍然需要进一步的研究。
崔日成等[46]进行了砷黄铁矿型高砷金精矿和砷黄铁矿纯矿物的氧化对比摇瓶试验,得出金精矿中黄铁矿的存在使细菌更易吸附到矿物表面,强化了细菌的直接氧化和间接氧化,加快了阳极砷黄铁矿氧化溶解,提高了金精矿的脱砷率。方芳等[47]考察了黄铁矿对砷黄铁矿生物浸出的影响,结果表明:黄铁矿能提高浸出体系细菌密度、降低体系pH、提高氧化还原电位,还能减少浸出过程生成黄钾铁矾;黄铁矿与砷黄铁矿之间产生原电池反应,促进阳极砷黄铁矿的氧化溶解;黄铁矿可以加速As(Ⅲ)转化为As(Ⅴ),减轻矿浆对细菌的毒害作用。
Deng等[48-49]采用电化学技术及SEM、XANES等表面测试手段研究了无菌酸性体系、无菌培养基体系及S. thermosulfidooxidans菌体系中黄铁矿对砷黄铁矿浸出行为的影响机制。无菌酸性体系中,黄铁矿的添加使体系中形成了砷黄铁矿-黄铁矿原电池,促进了砷黄铁矿的氧化,使溶液pH升高,氧化还原电位降低,抑制了臭葱石(结晶完好的砷酸铁)的生成,从而进一步促进砷黄铁矿的氧化;提高黄铁矿的添加量,有助于提高砷黄铁矿的浸出率。无菌培养基体系中,由于培养基体系的pH缓冲作用使溶液pH保持稳定,黄铁矿对砷黄铁矿氧化的强化作用只与两者之间原电池效应有关;提高黄铁矿的添加量对提高砷黄铁矿的浸出率无显著性影响。S. thermosulfidooxidans菌浸出砷黄铁矿5 d,黄铁矿的添加能够显著强化砷黄铁矿的氧化。此时黄铁矿对砷黄铁矿氧化的强化作用不仅与黄铁矿与砷黄铁矿间原电池反应有关,还与黄铁矿的添加对砷黄铁矿浸出过程中生成黄钾铁矾的表面形貌的改变有关。在黄铁矿存在的情况下,砷黄铁矿浸出过程中生成的黄钾铁矾呈絮团状,对砷黄铁矿的进一步溶解无抑制作用。S. thermosulfidooxidans菌浸出5 d后,对于质量比大于1的体系,砷黄铁矿已基本全部氧化,As(Ⅲ)氧化为As(Ⅴ)成为体系中的主要反应。增大黄铁矿与砷黄铁矿的质量比,可以明显促进As(Ⅲ)到As(Ⅴ)的转化。
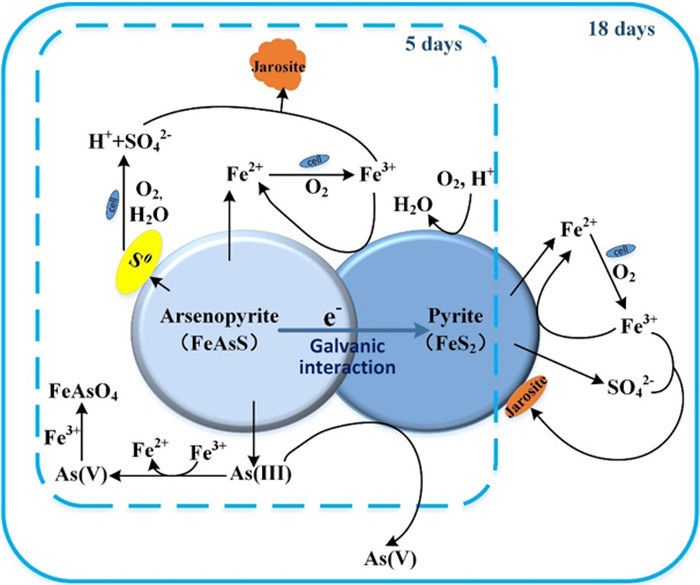 |
| 图 4 黄铁矿对砷黄铁矿生物氧化的强化作用机制[49] Fig.4 A schematic model of the role of pyrite in the bioleaching of arsenopyrite |
1.4.2 二氧化锰-砷黄铁矿
MnO2作为一种电极活性的正极材料,是一种n型半导体。从理论上来说,MnO2能够与一些静电位较低的硫化矿物之间形成原电池,MnO2作为阴极发生还原反应,硫化矿作为阳极发生氧化反应[50-53]。近年来采用MnO2来强化硫化矿的浸出研究较多,比如黄铜矿[54]、辉钼矿[55]、方铅矿[56]、辉铋矿[57]等,但大多数研究是将MnO2作为氧化剂,事实上原电池反应比一般的氧化还原反应速率要快的多,因此原电池反应是MnO2强化硫化矿浸出的关键因素。
在含砷金矿方面,张旭等[58]研究了软锰矿(MnO2)对含砷难处理金矿微生物浸出行为的影响。结果表明,软锰矿的加入使生物预氧化时间明显缩短,砷浸出率达到94.4%。氰化浸出后,金的回收率更是达到了95.8%。因此,软锰矿的加入能够促进含砷金矿的微生物预氧化。
目前,关于MnO2强化含砷金矿微生物预氧化过程的机理还不是很清楚。MnO2能够与砷黄铁矿、黄铁矿等硫化矿之间产生原电池效应,对硫化矿的电化学溶解机理以及表面钝化行为是否有影响需进一步探究。
1.5 其他方法 1.5.1 腐殖酸强化腐殖酸是自然界常见的可溶性有机质,其结构中的氨基、羧基、酚基和巯基部分可以作为有毒金属离子潜在的结合位点,因此可以作为有毒金属离子的有效吸附剂[59]。Zhang等[60]研究了腐殖酸对砷黄铁矿溶解的影响。结果表明,添加腐殖酸时生物氧化12 d后浸出渣中有7.1%的砷黄铁矿,而不添加腐殖酸时为19.3%。腐殖酸的存在改变了矿物表面的性质,矿物表面没有单质硫和砷酸铁生成。微生物和生成的黄钾铁矾呈絮状多孔结构,能吸附大量的砷,因而降低了浸出液中砷的浓度,改善了细菌的生存环境,从而提高了细菌活性,加快了浸出速率。
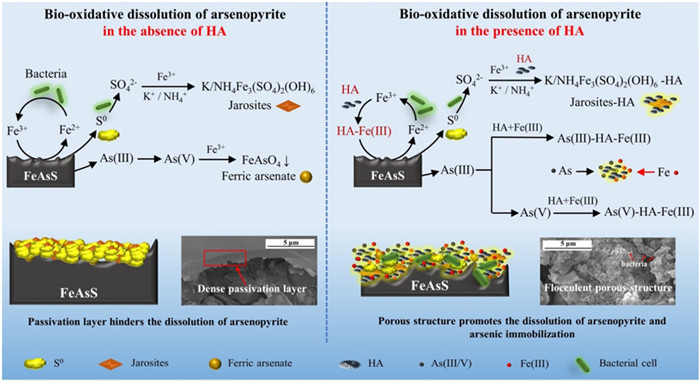 |
| 图 5 腐殖酸强化砷黄铁矿微生物浸出机理[60] Fig.5 A model for humid-promoted booxidation of arsenopyrite |
1.5.2 磁化水强化
汪模辉等[61]研究发现,采用磁化水配制的9 K培养基培养氧化亚铁硫杆菌,能够显著促进细菌生长。分析其原因,推测磁化处理使水的结构发生了一定的变化,在水-空气界面产生了压差,增加了水中的溶氧量,促进好氧的浸矿细菌生长。另外,磁化能够提高细菌生物膜的渗透性,有利于细菌对营养物质的吸收。他们还研究了磁化水对含砷金矿氧化亚铁硫杆菌氧化的影响。结果表明,采用磁化水配制9 K培养基来浸出含砷金矿,浸出15 d,砷的浸出率由69.15%提高到82.47%,说明磁化水对含砷金矿的微生物浸出具有强化作用。
2 结语与展望难处理金矿资源的开发利用是当今黄金科学技术产业研究的热点和难点。含砷金矿作为一类重要的难处理金矿资源,其微生物预氧化一直都存在着浸出效率低、浸出周期长等问题。目前,对含砷金矿微生物预氧化过程强化的方法及机理进行了大量研究,并取得了丰富的研究成果。但由于工业生产的复杂性,大多数的强化方法尚停留在基础研究探索阶段,并未实现大规模的工业应用。为了更好推动含砷金矿的微生物预氧化工艺的生产实践,在今后的研究可以从以下几个方面开展工作:
(1) 含砷金矿的微生物预氧化过程是一个较为复杂的过程,其中涉及到pH、温度、氧化还原电位等各种因素。深入研究多因素耦合条件下含砷金矿的微生物预氧化行为,寻找最佳的工艺条件,对难处理金矿的微生物预氧化工艺的生产实践具有重要意义。
(2) 光催化技术的应用。光催化技术目前已在黄铜矿、闪锌矿生物浸出强化方面有所研究[62-65],并取得了较好的效果。半导体矿物在光照作用下所激发出的光电子能够将Fe3+还原成Fe2+,而这些Fe2+能够成为浸矿细菌生长所需的能源物质。在未来,光催化技术有望应用到含砷金矿微生物预氧化当中,加快含砷金矿的浸出速率,提高金的回收。
(3) 多种强化方法的联合使用。由于有些强化方法有一定的局限性,比如Ag+较贵且过量会对微生物产生毒害作用;Fe3+过量会促进黄钾铁矾的生成,覆盖在矿物表面,阻碍矿石的进一步溶解。因此,可以考虑将多种强化方法联合使用。
| [1] |
MUDD G M. Global trends in gold mining: towards quantifying environmental and resource sustainability[J]. Resources Policy, 2007, 32(1/2): 42-56. |
| [2] |
刘汉钊. 难处理金矿石难浸的原因及预处理方法[J]. 黄金, 1997(9): 44-48. |
| [3] |
MADDOX L M, BANCROFT G M, SCAINI M J, et al. Invisible gold: Comparison of Au deposition on pyrite and arsenopyrite[J]. American Mineralogist, 1998, 83: 1240-1245. DOI:10.2138/am-1998-11-1212 |
| [4] |
CABRI L J, CHRYSSOULIS S L, De VILLIERS J P R, et al. The nature of "invisible" gold in arsenopyrite[J]. The Canadian Mineralogist, 1989, 27: 353-362. |
| [5] |
CORKHILL C L, WINCOTT P L, LLOYD J R, et al. The oxidative dissolution of arsenopyrite (FeAsS) and enargite (Cu3AsS4) by Leptospirillum ferrooxidans[J]. Geochimica et Cosmochimica Acta, 2008, 72(23): 5616-5633. DOI:10.1016/j.gca.2008.09.008 |
| [6] |
HENAO D M O, GODOY M A M. Jarosite pseudomorph formation from arsenopyrite oxidation using Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2010, 104(2): 162-168. DOI:10.1016/j.hydromet.2010.05.012 |
| [7] |
ZHU T, LU X, LIU H, et al. Quantitative X-ray photoelectron spectroscopy-based depth profiling of bioleached arsenopyrite surface by Acidithiobacillus ferrooxidans[J]. Geochimica et Cosmochimica Acta, 2014, 127: 120-139. DOI:10.1016/j.gca.2013.11.025 |
| [8] |
MURAVYOV M I, BULAEV A G. Two-step oxidation of a refractory gold-bearing sulfidic concentrate and the effect of organic nutrients on its biooxidation[J]. Minerals Engineering, 2013, 45: 108-114. DOI:10.1016/j.mineng.2013.02.007 |
| [9] |
MÁRQUEZ M A, OSPINA J D, MORALES A L. New insights about the bacterial oxidation of arsenopyrite: A mineralogical scope[J]. Minerals Engineering, 2012, 39: 248-254. DOI:10.1016/j.mineng.2012.06.012 |
| [10] |
FOMCHENKO N V, MURAVYOV M I. Thermodynamic and XRD analysis of arsenopyrite biooxidation and enhancement of oxidation efficiency of gold-bearing concentrates[J]. International Journal of Mineral Processing, 2014, 133: 112-118. DOI:10.1016/j.minpro.2014.10.009 |
| [11] |
FANTAUZZI M, LICHERI C, ATZEI D, et al. Arsenopyrite and pyrite bioleaching: evidence from XPS, XRD and ICP techniques[J]. Analytical and Bioanalytical Chemistry, 2011, 401(7): 2237-2248. DOI:10.1007/s00216-011-5300-0 |
| [12] |
EDWARDS K J, HU B, HAMERS R J, et al. A new look at microbial leaching patterns on sulfide minerals[J]. FEMS microbiology ecology, 2001, 34(3): 197-206. DOI:10.1111/j.1574-6941.2001.tb00770.x |
| [13] |
MIN X B, CHAI L Y, CHEN W L, et al. Bioleaching of refractory gold ore (Ⅱ)-Mechanism on bioleaching of arsenopyrite by Thiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China, 2002, 12(1): 142-146. |
| [14] |
YUNMEI Y, YONGXUAN Z, WILLIAMS-JONES A E, et al. A kinetic study of the oxidation of arsenopyrite in acidic solutions: implications for the environment[J]. Applied Geochemistry, 2004, 19(3): 435-444. DOI:10.1016/S0883-2927(03)00133-1 |
| [15] |
MIKHLIN Y L, ROMANCHENKO A S, ASANOV I P. Oxidation of arsenopyrite and deposition of gold on the oxidized surfaces: A scanning probe microscopy, tunneling spectroscopy and XPS study[J]. Geochimica et Cosmochimica Acta, 2006, 70(19): 4874-4888. DOI:10.1016/j.gca.2006.07.021 |
| [16] |
ZHANG D, XIA J, NIE Z, et al. Mechanism by which ferric iron promotes the bioleaching of arsenopyrite by the moderate thermophile Sulfobacillus thermosulfidooxidans[J]. Process Biochemistry, 2019, 81: 11-21. DOI:10.1016/j.procbio.2019.03.004 |
| [17] |
DENG Y, ZHANG D, XIA J, et al. Enhancement of arsenopyrite bioleaching by different Fe(Ⅲ) compounds through changing composition and structure of passivation layer[J]. Journal of Materials Research and Technology, 2020, 9(6): 12364-12377. DOI:10.1016/j.jmrt.2020.08.088 |
| [18] |
SANTINI J M, KAPPLER U, WARD S A, et al. The NT-26 cytochrome c552 and its role in arsenite oxidation[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2007, 1767(2): 189-196. DOI:10.1016/j.bbabio.2007.01.009 |
| [19] |
富瑶, 高鹭, 杨洪英, 等. As(Ⅲ)和As(Ⅴ)胁迫下浸矿细菌胞外多糖的变化特征[J]. 金属矿山, 2016(5): 81-84. DOI:10.3969/j.issn.1001-1250.2016.05.018 |
| [20] |
向兰, 柯家骏, 裘荣庆. As3+和As5+对细菌生长及含金银的毒砂矿石浸出的影响[J]. 矿产综合利用, 1991(4): 1-5. |
| [21] |
杨松荣, 邱冠周, 胡岳华. As3+及As5+对生物氧化过程的影响及其转化过程的探讨[J]. 国外金属矿选矿, 2003, 40(1): 4-7. |
| [22] |
BARRETT J, EWART D K, HUGHES M N, et al. Chemical and biological pathways in the bacterial oxidation of arsenopyrite[J]. FEMS Microbiology Reviews, 1993, 11(1): 57-62. |
| [23] |
WIERTZ J V, MATEO M, ESCOBAR B. Mechanism of pyrite catalysis of As(Ⅲ) oxidation in bioleaching solutions at 30℃ and 70℃[J]. Hydrometallurgy, 2006, 83(1-4): 35-39. DOI:10.1016/j.hydromet.2006.03.035 |
| [24] |
李骞. 含砷金矿生物预氧化提金基础研究[D]. 长沙: 中南大学, 2007.
|
| [25] |
李骞, 姜涛, 杨永斌, 等. 一种添加剂在强化细菌氧化含砷金矿上的应用: CN102634661A[P]. 20120815.
|
| [26] |
CUI R C, YANG H Y, CHEN S, et al. Valence variation of arsenic in bioleaching process of arsenic-bearing gold ore[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(6): 1171-1176. DOI:10.1016/S1003-6326(09)60274-0 |
| [27] |
PATHAK A, MORRISON L, HEALY M G. Catalytic potential of selected metal ions for bioleaching, and potential techno-economic and environmental issues: A critical review[J]. Bioresource Technology, 2017, 229: 211-221. DOI:10.1016/j.biortech.2017.01.001 |
| [28] |
苑洪晶. 协同强化含砷金矿生物预氧化的研究[D]. 长沙: 中南大学, 2013.
|
| [29] |
李骞, 齐伟, 张雁, 等. Cu2+催化砷黄铁矿生物氧化试验研究[J]. 黄金, 2019, 40(2): 49-54. |
| [30] |
ZHANG Y, LI Q, LIU X, et al. The catalytic effect of copper ion in the bioleaching of arsenopyrite by Acidithiobacillus ferrooxidans in 9K culture medium[J]. Journal of Cleaner Production, 2020, 256: 120391. DOI:10.1016/j.jclepro.2020.120391 |
| [31] |
FANG F. Catalytic effect of silver on bioleaching of arsenopyrite[J]. International Journal of Chemical Engineering and Applications, 2014(5): 474-478. |
| [32] |
张明, 杨巧文, 张广积, 等. Ag+对含砷金精矿生物浸出的影响[J]. 过程工程学报, 2012, 12(5): 781-784. |
| [33] |
ZHANG Y, LI Q, SUN S, et al. Electrochemical behaviour of the oxidative dissolution of arsenopyrite catalysed by Ag+ in 9K culture medium[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021, 614: 126169. DOI:10.1016/j.colsurfa.2021.126169 |
| [34] |
CUN-XIONG L I, HONG-SHENG X U, DENG Z G, et al. Pressure leaching of zinc silicate ore in sulfuric acid medium[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(5): 918-923. DOI:10.1016/S1003-6326(09)60236-3 |
| [35] |
PICH OTERO A, CURUTCHET G, DONATI E, et al. Action of Thiobacillus thiooxidans on sulphur in the presence of a surfactant agent and its application in the indirect dissolution of phosphorus[J]. Process Biochemistry, 1995, 30(8): 747-750. DOI:10.1016/0032-9592(95)00003-E |
| [36] |
SIEBERT H M, MARMULLA R, STAHMANN K P. Effect of SDS on planctonic Acidithiobacillus thiooxidans and bioleaching of sand samples[J]. Minerals Engineering, 2011, 24(11): 1128-1131. DOI:10.1016/j.mineng.2011.03.003 |
| [37] |
吴爱祥, 艾纯明, 王贻明, 等. 表面活性剂强化铜矿石浸出[J]. 北京科技大学学报, 2013, 35(6): 709-713. |
| [38] |
LI L, LV Z, YUAN X. Effect of l-glycine on bioleaching of collophanite by Acidithiobacillus ferrooxidans[J]. International Biodeterioration & Biodegradation, 2013, 85: 156-165. |
| [39] |
L T D, A ND, X M L, et al. Investigations of accelerating parameters for the biooxidation of low-grade refractory gold ores[J]. Minerals Engineering, 2000, 13(14/15): 1543-1553. |
| [40] |
FANG, FANG, HONG, et al. Influence of calcium lignosulfonate on bioleaching of arsenic-containing gold concentrate: 2014 International Conference on Environment and Sustainability (ICES 2014)[C].
|
| [41] |
李宏煦. 硫化矿细菌浸出过程的电化学机理及工艺研究[D]. 长沙: 中南大学, 2001.
|
| [42] |
XU J, SHI W, MA P, et al. Corrosion behavior of a pyrite and arsenopyrite galvanic pair in the presence of sulfuric acid, ferric ions and HQ0211 bacterial strain[J]. Minerals, 2019, 9(3): 169. DOI:10.3390/min9030169 |
| [43] |
TAXIARCHOU M, ADAM K, KONTOPOULOS A. Bacterial oxidation conditions for gold extraction from Olympias refractory arsenical pyrite concentrate[J]. Hydrometallurgy, 1994, 36(2): 169-185. DOI:10.1016/0304-386X(94)90004-3 |
| [44] |
KOMNITSAS K, XENIDIS A, ADAM K. Oxidation of pyrite and arsenopyrite in sulphidic spoils in Lavrion[J]. Minerals Engineering, 1995(NO.12): 1443-1454. |
| [45] |
杨洪英, 杨立, 赵玉山, 等. 难处理金矿石中硫化物细菌氧化的活性序列[J]. 有色金属工程, 2002, 54(2): 42-44. DOI:10.3969/j.issn.2095-1744.2002.02.011 |
| [46] |
崔日成, 杨洪英, 张谷平, 等. 毒砂型高砷金精矿的细菌氧化[J]. 化工学报, 2008(12): 3090-3094. DOI:10.3321/j.issn:0438-1157.2008.12.020 |
| [47] |
方芳, 钟宏, 江放明, 等. 黄铁矿对砷黄铁矿生物浸出的影响[J]. 中国有色金属学报, 2013, 23(10): 2970-2976. |
| [48] |
SHA D, GUO H. Catalytic effect of pyrite on the leaching of arsenopyrite in sulfuric acid and acid culture medium[J]. Electrochimica Acta, 2018, 263: 8-16. DOI:10.1016/j.electacta.2018.01.043 |
| [49] |
SHA D, HE G, WU B, et al. Pyrite-promoted dissolution of arsenopyrite in the presence of Sulfobacillus thermosulfidooxidans[J]. Journal of Materials Research and Technology, 2020, 9(4): 9362-9371. DOI:10.1016/j.jmrt.2020.05.068 |
| [50] |
PARAMGURU R K, MISHRA K G, KANUNGO S B. Electrochemical phenomena in MnO2-FeS2 leaching in dilute HCl. part 2: studies on polarization measurements[J]. Canadian Metallurgical Quarterly, 1998, 37(5): 395-403. |
| [51] |
GANTAYAT B P, RATH P C, PARAMGURU R K, et al. Galvanic interaction between chalcopyrite and manganese dioxide in sulfuric acid medium[J]. Metallurgical and Materials Transactions B, 2000, 31(1): 55-61. DOI:10.1007/s11663-000-0130-z |
| [52] |
PARAMGURU R K, NAYAK B B. Galvanic interaction between manganese dioxide and pyrite[J]. Journal of the Electrochemical Society, 1996, 143(12): 3987-3991. DOI:10.1149/1.1837325 |
| [53] |
MADHUCHHANDA M, DEVI N B, SRINIVASA RAO K, et al. Galvanic interaction between sulfide minerals and pyrolusite[J]. Journal of Solid State Electrochemistry, 2000, 4(4): 189-198. DOI:10.1007/s100080050194 |
| [54] |
白云龙, 谢锋, 王伟, 等. 二氧化锰对黄铜矿浸出行为的影响[J]. 有色金属(冶炼部分), 2019(11): 1-6. |
| [55] |
符剑刚. 采用软锰矿强化辉钼矿的氧化分解及联产钼酸铵与硫酸锰[D]. 长沙: 中南大学, 2009.
|
| [56] |
龙怀中. 方铅矿—软锰矿协同浸出直接制备铅、锰氧化物的研究[D]. 长沙: 中南大学, 2013.
|
| [57] |
ZHAN J, WANG Z, ZHANG C, et al. Separation and extraction of bismuth and manganese from roasted low-grade bismuthinite and pyrolusite: thermodynamic analysis and sulfur fixing[J]. JOM, 2015, 67(5): 1114-1122. DOI:10.1007/s11837-015-1391-y |
| [58] |
ZHANG X, FENG Y L, HAO-RAN L I. Enhancement of bio-oxidation of refractory arsenopyritic gold ore by adding pyrolusite in bioleaching system[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(9): 2479-2484. DOI:10.1016/S1003-6326(16)64339-X |
| [59] |
RASHID, MAMUN, STERBINSKY, et al. Kinetic and mechanistic evaluation of inorganic arsenic species adsorption onto humic acid grafted magnetite nanoparticles[J]. The journal of physical chemistry, C. Nanomaterials and interfaces, 2018, 7b-12438b. |
| [60] |
ZHANG D R, CHEN H R, XIA J L, et al. Humic acid promotes arsenopyrite bio-oxidation and arsenic immobilization[J]. Journal of Hazardous Materials, 2019, 384: 121359. |
| [61] |
汪模辉, 邓天龙, 廖梦霞. 含砷金矿的磁场强化生物预氧化[J]. 应用化学, 2000(4): 362-365. DOI:10.3969/j.issn.1000-0518.2000.04.004 |
| [62] |
YANG B, LIN M, FANG J, et al. Combined effects of jarosite and visible light on chalcopyrite dissolution mediated by Acidithiobacillus ferrooxidans[J]. Science of The Total Environment, 2020, 698: 134175. DOI:10.1016/j.scitotenv.2019.134175 |
| [63] |
ZHOU S, GAN M, ZHU J, et al. Catalytic effect of light illumination on bioleaching of chalcopyrite[J]. Bioresour Technol, 2015, 182: 345-352. DOI:10.1016/j.biortech.2015.02.010 |
| [64] |
李伟洁. 光及原电池反应对闪锌矿微生物氧化作用的影响[D]. 南京: 南京大学, 2020.
|
| [65] |
YANG B J, LUO W, LIAO Q, et al. Photogenerated-hole scavenger for enhancing photocatalytic chalcopyrite bioleaching[J]. Transactions of Nonferrous Metals Society of China, 2020, 30(1): 200-211. DOI:10.1016/S1003-6326(19)65192-7 |
 2021
2021



