| 重金属生物有效性在矿山环境评价中应用研究进展 |
2. 中国地质大学(北京) 地球科学与资源学院,北京 100083
2. China University of Geosciences, Beijing 100083, China
矿产资源开发在带来经济利益的同时,也将具有毒性的重金属由矿体带入到环境中。据统计,在我国24个铅锌矿区的土壤中,As、Cd、Cr、Cu、Pb、Zn浓度的平均值分别为216、23.63、69.08、289、3 439、3 591 mg·kg-1[1],超出土壤环境质量限定值。土壤中的重金属会通过土壤-植物-人体体系,经由食物链进入人体,对矿区居民的身体健康构成危害。广东北部大宝山矿区未经处理的酸性矿山废水富含S、Cd、Mn和Pb等多种重金属,沿地表径流、山间小溪向下游扩散,致使翁源河鱼虾绝迹,周边83个村庄、68 500 m2水田、2 200 m2水塘受重金属污染,土壤重金属累积指数Igeo高达3.77,产出的水稻和蔬菜中重金属的致癌风险指数为0.051 6,高出限定值100余倍,在1987—2014年间,共计420位村民死于食道癌、胃癌和肝癌[2, 3]。矿业活动造成的水、土、植物的重金属污染对矿区的生态环境和居民健康构成危害。
环境评价中使用最广泛的方法是潜在生态危害指数法、单因子和内梅罗综合污染指数法,均采用元素含量的高低来衡量重金属污染的生态效应。但众多研究者一致认为,以土壤中重金属的总量作为环境评价的指导标准太过简单,总量并不能总是代表重金属对环境、植物和人体的毒性。因为重金属与土壤中的矿物和有机质以吸附、共沉淀、键合等多种方式相结合,分布在不同的形态[4],而不同形态重金属的生物毒性的差异很大[5]。土壤中可被生物吸收利用的重金属为生物有效态[6]。在研究过程中通常采用化学提取法来模拟植物生长周期内与土壤中重金属的相互作用过程,以可提取态代表生物有效态,重金属的生物有效性则是指试验测得的生物有效态与总量的比值[7]。大量研究表明,以重金属的生物有效态和生物有效性作为环境风险的评价指标,比总量更能反映重金属对环境的危害。
1 重金属生物有效性概念的界定生物有效性概念首次出现于60年代,被定义为水体环境中污染物在生物传输和生物反应中被利用的程度[8],后来扩展到土壤和沉积物等固体环境中。土壤中重金属的生物有效态是指可被生物吸收的形态[6]。重金属的生物有效性是指试验测得的生物有效态与总量的比值[7]。当研究的对象为植物时,生物有效性也被称为植物有效性。重金属的植物有效性,包括重金属在土壤中的吸附-解吸、溶解-沉淀、络合-解离、迁移-滞留等过程,和重金属在植物体内吸收-储存、转运-区隔、中毒-解毒等动力学过程。在过去20年间,众多研究团队试图给出一个具有可操作性的定义,这样可以机械的理解生物有效性的概念,使测定重金属生物有效性的方法可以标准化,使生物有效性的定义能够统一。Kim等[9]、Harmsen等[10]和ISO(ISO17402—2008),将土壤中重金属的生物有效性描述为3个层次:(1)环境有效性,即土壤中可以进入孔隙水中重金属的总量,包括当下孔隙水中的重金属和一段时期内可进入孔隙水中的组分;(2)环境生物有效性,即当下孔隙水中溶解的重金属,可被生物立即吸收的组分;(3)毒性生物有效性,即通过生物的吸收和代谢在生物体内形成累积并产生毒性效应的组分。
第一层,环境有效性,是土壤中有效性重金属的总量,包含了孔隙水中溶解的实际有效态和吸附于土壤基质的可通过离子交换、还原、氧化等过程进入孔隙水的潜在有效态。实际有效态,是可供植物体或生物直接吸收的重金属,可在几个小时或几天内从土壤基质解脱下来的组分[11]。潜在有效态,则是通过与土壤孔隙水的吸附和解析动态平衡,长期或极端条件下,可以从土壤基质上解脱下来的重金属的最大量。ISO(ISO17402—2008)工作组指出土壤中有效组分的量不应该是固定组分,而应该是连续组分,因为有机体暴露的总量还与暴露的时间有关。总之,土壤的理化性质和重金属本身的特性是环境有效性的决定因素。
第二层,环境生物有效性,是指溶解于孔隙水中能够到达并穿透根土界面的重金属形态。环境生物有效性是由重金属在孔隙水中的迁移特性和暴露植物的吸收机理等诸多因素共同控制的。其中,孔隙水中重金属的离子浓度是控制植物吸收的最重要的因素。孔隙水中的重金属离子形态对植物吸收也起到至关重要的作用,如重金属与腐殖酸[12]和富里酸[13]相结合有利于植物的吸收、累积和向上迁移,而与EDTA[14]相结合后有利于植物根吸收重金属,却不利于向地上部转移。植物吸收重金属机制是环境生物有效性的决定因素。
第三层,毒性生物有效性,是指参与植物体内迁移、代谢和解毒机制,能够累积在植物体内或起毒性效应的重金属组分[15]。毒性生物有效性可以通过生物进行评估,以累积在植物根、茎、叶、谷粒中的重金属浓度比土壤中重金属的浓度,即植物的生物富集因子(BCF),BCF受植物、土壤和重金属的类别共同影响。
2 重金属生物有效性的研究方法生物有效性研究方法众多,包括物理分析、生物指示、化学提取和体外模拟等。高效、精准的研究方法是进一步理解和完善预测重金属生物有效性模型的基础。
近年来,物理分析仪器的技术有了长足的进步,通过仪器分析能够获得直观的重金属形态、形貌和结构等重要信息。这些仪器包括X射线衍射(XRD)、扫描电镜(SEM)、微区表面质谱光谱仪(μLMS)、二次离子质谱(SIMS)、红外光谱(ISM)、核磁谱(NMR)、X射线吸收光谱(XAS)等[6]。但是由于操作这些大型仪器需要丰富的操作经验和仪器本身的性能等原因,它们虽然是做研究工作的利器,但是却不利于推广。这些仪器的分析结果有助于解释化学提取和毒性测试等研究方法机理方面的关键信息。
植物指示法是研究重金属生物有效性最可靠的方法。以污染环境中某些可以作为生物指示的植物体内重金属与土壤中重金属总量的质量百分比来判断土壤中重金属的生物有效性[17]。目前已发现的指示植物有黑麦草[18]、吴淞厥[19]和小麦[20]等。黑麦幼苗法是1923年由Neabauer等提出的,将大量的黑麦幼苗与少量的土壤充分接触,从而在短期内耗竭土壤中生物有效态元素。虽然植物评估法测定的生物有效性结果直接反应出植物对重金属的生理响应或富集效果无需过多的解释,其他方法的研究结果最终也需要生物试验验证所获得的生物有效量的科学性,但是,生物评估法费时、费力、成本高,所得的评价结果与暴露时间、暴露的对象和吸收的机制有关,评价方法复杂。如果化学提取法获得的生物有效态的浓度,与生物评价法之间存在精确的关系,就可以采用化学提取评价方法,取代复杂的生物评价法。
化学提取是解释重金属活化、迁移、扩散等地球化学行为的重要手段[7],是分析土壤中重金属生物有效性常用的研究方法,是在短时间内,以特定的化学试剂和提取流程释放出土壤中特定相态的重金属,模拟整个植物生长阶段与土壤中重金属相互作用的过程。化学提取按照操作流程分为一步提取法(Single extraction)和连续提取法(Sequential extraction)。一步提取法是某种或多种混合提取剂通过一步提取,释放出土壤中重金属的特定组分的方法,具有快速、经济、操作简便等优势。一步提取法按照提取剂的性质,又可分为中性盐、弱酸和有机络合物三类。一步提取法常用试剂、分析的相态和方法特性如表 1所示。
| 表 1 一步提取法的方法特性 Table 1 Examples of extractants for assessing phytoavailable trace element contents of soils |
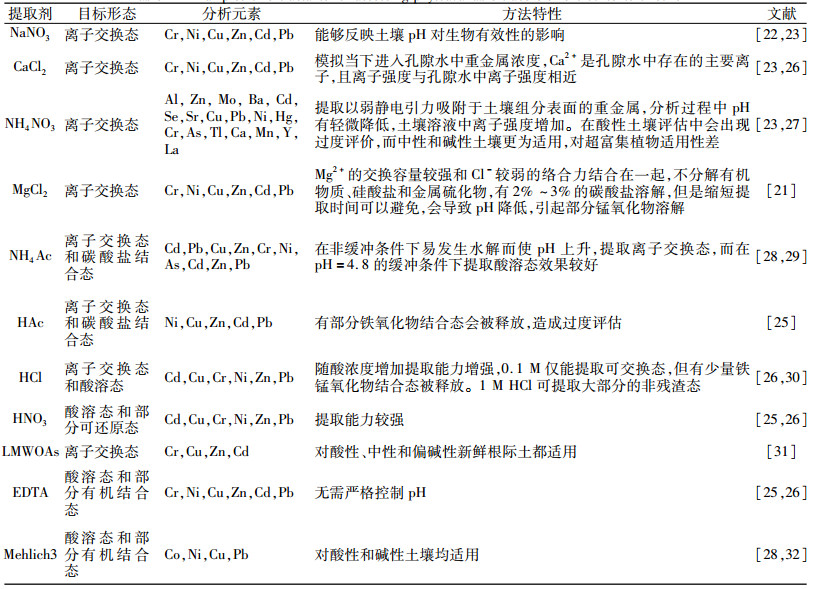 |
连续提取法模拟自然和人为的各种环境变化,采用不同性质的化学试剂,按照由弱到强的原则,依次释放出吸附于不同矿物相的痕量元素,将单一的全量评价指标变成为元素各形态的分量,提高评价质量。1979年,Tessier等[21]第一次采用顺序提取法分析了水系沉积物,将土壤中的重金属划分为离子可交换态、碳酸盐结合态,铁锰氧化物结合态、有机物和硫化物结合态和残渣态五个组分。1993年,欧共体标准局(BCR)为增强形态分析的重现性和可比性提出了BCR 3步提取法,将元素分为弱酸溶解态、可还原态、可氧化态和残渣态。
体外暴露法是研究人体直接消化吸收土壤和降尘中重金属的经济适用的研究方法。消费矿区污染农田生长的食物粘带的泥土,消化口-手传递手上粘带的土壤微尘,是人体重金属暴露的另一主要途径。而体外试验法通过模拟人体内污染物从土壤基质中释放的作用过程,获得土壤中重金属的生物有效性。该方法的前提是体外试验和活体试验结果间具有显著的相关性。近年来,研究者通过模拟人体消化系统的物质和机械蠕动建立了多种体外分析方法,如SBRC(the solubility bioavailability research consortium procedure)[33]、DIN(Deutsches institut fur Normunge.V.)[34]、PBET(the physiologically based extraction text)[34]、IVG(the in vitro gastrointestinal method)[35]、UBM(the RIVM model, the unifed barge method)[36]等。体外模拟法获得的重金属的生物有效性与动物模拟试验取得了较好的相关性。其中PBET提取法包括胃和小肠两个部分,较完整的模拟了人体的消化过程,被广泛应用。该方法在土壤中铅元素的体外模拟消化和动物模拟吸收的试验中获得了较高的相关系数R2=0.93。在酸性胃液中,土壤中Pb的溶解受胃液的pH值影响较大,当pH从1.3升高到2.5时,铅的生物有效性降低了65%,由胃相转入肠相后pH升高,铅的生物有效性下降更为明显[37]。
3 生物有效性在矿区环境风险评价中的应用 3.1 评价重金属在土壤-植物体系的迁移风险重金属生物有效性可以评估矿山土壤中重金属迁移到植物中的风险。近40年来,国内外的专家学者在土壤中重金属的形态与植物内重金属之间的关系做了大量研究(表 2),大家在以下5个方面达成共识:
| 表 2 化学提取法评估重金属迁移到植物的风险 Table 2 Applications of chemical extraction methods for evaluation of the risk of heavy metals in soils migration to plant |
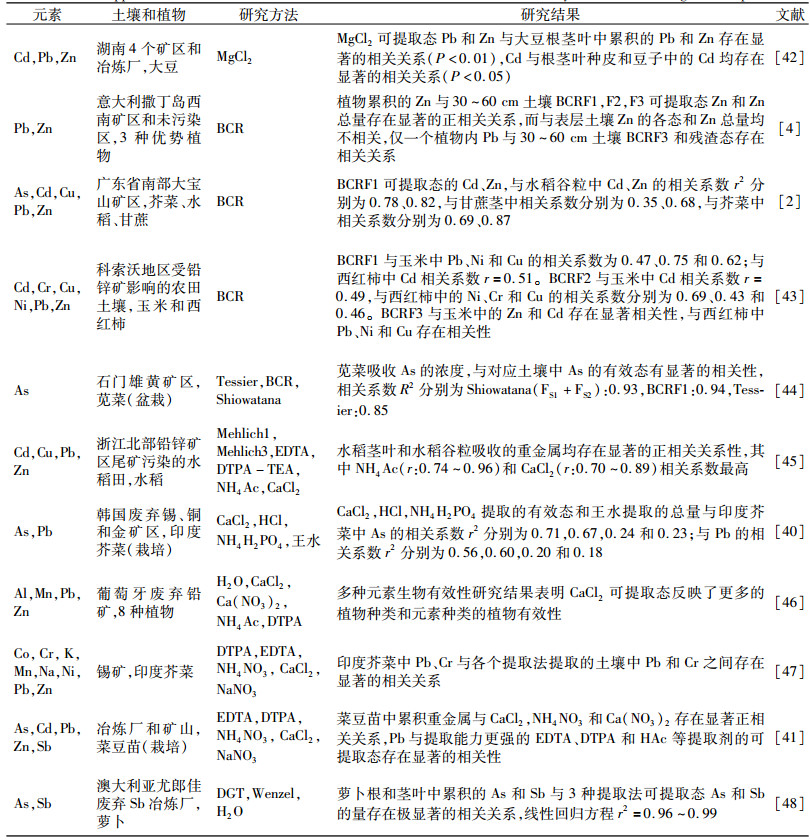 |
(1) 土壤中重金属的生物有效态比总量更能反映出重金属迁移到植物的风险。Alvarenga等[38]分析了黄铁矿成矿带上三个矿区,菜园土壤和蔬菜中重金属的浓度,土壤中As、Cu、Pb和Zn浓度超过环境标准限定值,但是蔬菜并没有表现出受污染的特征,仅阿尔茹斯特雷尔矿区7号菜园蔬菜中的Zn具有明显的毒性。7号菜园土壤中Zn总量并不比其它菜园高,但是潜在生物有效态Zn为79.9%,即时有效态Zn为1.36%,显著高于其它样点。
(2) 中性盐提取的重金属的有效量与植物中重金属的浓度存在一定的相关性,尤其是Cd、Zn等活性较高的金属,在可提取态较高的情况下相关性更好。其中,CaCl2可提取态预测植物从土壤中吸收的重金属取得了较好的效果,甚至被推荐为风险评价的通用方法[39]。在韩国金、锡、铜矿区污染土壤的研究中,CaCl2可提取态的Pb和As与栽培的印度芥菜中Pb和As显著相关(r2=0.73和r2=0.69),优于与总量的相关性(r2=0.23和r2=0.18)[40]。NH4NO3在重金属的生物有效性研究中也取得了较好的效果,被德国列为标准研究方法。在法国某废弃金矿区和Pb/Zn冶炼厂周边土壤中重金属生物有效性的研究中,NH4NO3可提取态的Pb、Zn、Cd与栽培的菜豆苗中累积Pb、Zn、Cd显著相关,相关系数为别为0.93、0.97和0.84[41]。
(3) 强提取剂可提取态的重金属(EDTA、DTPA、0.1 M HCl和0.43 M HNO3)与植物吸收的可迁移性较强的Cd、Zn等元素之间的相关性较差,而与Pb、Cu等可迁移性弱的元素相关性较好。Qasim等[41]比较CaCl2、NaNO3、NH4NO3、DTPA和EDTA在矿区周边污染的土壤中Pb、Zn、Cd植物有效性的研究中发现,EDTA和DTPA可提取态与菜豆苗中的Pb的相关系数为0.81和0.85,高于与Zn的相关系数0.14和0.67,与Cd的相关系数0.01和0.23。
(4) BCR和Tessier等连续提取法可分析重金属的形态分布规律,研究植物吸收利用重金属的有效组分[49]。BCR酸溶态(等同于Tessier的离子可交换态+碳酸盐结合态)通常被认为是植物易吸收组分,常用来研究重金属在土壤-植物系统的迁移机制[50]。Liao等[2]通过BCR法,研究广东大宝山矿区,Cd、Zn、Cu、As和Pb在矿山酸性废水污染的农田土壤和水稻、甘蔗和芥菜中的迁移规律,发现农作物的可食用部分Cd和Zn与土壤中BCR酸溶态的Cd和Zn存在线性关系。这可能是因为土壤中Cd和Zn的酸溶态浓度较高,可供植物根部持续的吸收。Barać等[43]研究Pb/Zn矿区污水影响的农田土壤和该区玉米和西红柿中Pb、Zn、Cd、Ni、Cr和Cu等重金属的迁移规律,也发现BCR酸溶态的Pb、Ni和Cu与玉米颖果和西红柿果实中的Pb、Ni和Cu存在显著的相关性。
(5) As和Sb等以阴离子形式存在的重金属,对提取试剂有特殊要求。一步化学提取法中HCl、H2SO4和HAc/NaAc缓冲溶液等酸性提取剂可以评估植物吸收采矿影响土壤中的As[51]。CaCl2、NaNO3和(NH4)2SO4提取态As与酸性污染物污染土壤中生长的白羽扁豆吸收的As存在较好的相关关系[52]。连续提取法中NH4NO3和盐酸羟胺提取的组分与植物有效态As比较接近[51]。
3.2 确定土壤中重金属的安全阈值以重金属生物有效性为基础制定的安全阈值,克服了土壤性质、植物种类的差异,提升了土壤环境质量标准的科学性和可操作性。重金属的安全阈值是土壤环境中重金属研究领域的基础性和复杂性的核心问题。确定科学的重金属安全阈值,是矿山环境进行科学评价和管理的基础。美国EPA将生物有效性引入到安全阈值的研究中[53]。2016年我国也正式启动了“农田系统重金属迁移转化和安全阈值研究”项目[54]。该项目以土壤中重金属的生物有效性和安全阈值的确定为研究重点。以铅元素为例,土壤中铅在植物可食用部分累积,通过食物链传递到人体,是人体铅暴露的主要途径。Liu等[55]对土壤中的铅通过呼吸、接触和食用污染的食物等暴露途径进行比较,依据健康风险评价模型评估,由食物引起的非致癌风险系数为0.67,占暴露风险的96%。因此,在强调以人为本的矿山环境风险评价中,要重视重金属通过食物链影响当地居民健康的评价或潜在风险评价。重金属的生物有效性,不仅可以推测植物累积重金属的浓度,也可以将模型反转应用,通过植物内允许存在的重金属浓度,反推出土壤中重金属的安全阈值。Zhang等[56]通过栽培萝卜,结合自由离子活度法、土壤孔隙水法、CaCl2提取法、HNO3提取法等生物有效性研究方法,研究贵州赫章县受铅锌尾矿和冶炼厂废弃物污染的土壤中Pb的安全阈值,研究发现以CaCl2可提取态Pb可有效预测萝卜可食用部分Pb的浓度,并推导出当CaCl2可提取态Pb浓度在0.01 mg·kg-1时,萝卜根中的铅浓度仅有5%的可能会超出食品的安全限定值。CaCl2可提取态能够预测萝卜根中铅浓度是因为其与土壤孔隙水中Pb的离子活度一致,而萝卜根中的铅有88.6%以上来自自由的Pb离子。李富荣等[57]采集广州Cd污染的菜园土进行盆栽菜心和小白菜试验,建立芸薹类叶菜类蔬菜可食用部分含量与土壤镉全量和有效态镉的含量的相关关系,建立蔬菜镉含量与土壤镉全量和有效态镉的最优回归方程分别为y=0.172x0.787(r=0.94)和y=0.342x0.634(r=0.90),推算出的x值即为芸薹类叶菜种植过程中重金属镉不超标时的蔬菜所对应的土壤镉全量及有效态(DTPA提取法测得)含量的限量阈值,分别为1.22 mg·kg-1和0.43 mg·kg-1。由此可见,化学提取和可靠的经验模型相结合,可以有效地确定土壤中重金属的安全阈值,有助于矿区污染土壤的进一步管理。
3.3 重金属的生态风险评价风险评价代码(Risk assessement code,RAC)强调了重金属的有效态对环境构成的风险,为环境风险评价提供了新的方法和思路[58]。Rodrguez等[59]在西班牙某铅锌矿的尾矿、农田和牧场土壤中重金属RAC风险评价中,发现尽管Pb比Zn浓度高,但是Zn的环境风险比Pb高。这是因为,Zn主要分布在酸溶态,而Pb主要分布在可还原态,Pb和Zn酸溶态的分布范围分别为0%~38.24%和5.39%~73.99%。陆泗进等[60]通过对云南会泽某废弃铅锌矿区农田土壤的7种重金属(Cd、As、Pb、Cr、Cu、Zn和Hg)的含量和形态进行分析,重金属酸溶态含量顺序为Cd(31.2%)>Zn(13.8%)>Cu(12.0%)>Pb(5.4%)>Cr(4.1%)>As(2.8%)>Hg(0.6%)。依据RAC的评价结果表明, 以酸溶态为主的Cd的所有点位均存在生态风险,而以残渣态为主的Hg只有2个点位存在环境风险。但是Hankanson潜在生态危害指数法可综合考虑多种重金属产生的协同作用[61, 62]。虽然RAC依据形态的评价结果与Hankanson依据总量评价的结果不完全相同,但将二者的优势结合起来,注意多种评价方法的综合使用,以便对重金属污染做出科学客观的评价。
3.4 重金属的健康风险评价以土壤中重金属可给量进行健康风险评价,能够克服以总量为评价标准带来的过度评价的问题,可避免不必要修复造成的浪费。土壤中重金属经口摄入后,溶解于人体肠胃系统中的重金属是能够被人体吸收的最大量。Liu等[63]通过UMB体外模拟法和BCR连续提取法,研究尼日利亚纳萨拉瓦州的铅锌铜银矿区土壤和降沉中Pb的可给性,发现该区域土壤和降尘中非特性吸附态、内壳层配合态、碳酸盐结合态、锰氧化物结合态、铁铝氧化物结合态、硫化物和有机物结合态的铅中平均有96.3%、65.6%、83.4%、76.6%、53.2%和86.7%为生物可给态,而残渣态Pb不具有生物可给性,铅的总可给性为68.96%。Ruby等研究Butte矿区土壤中铅的可给性小于13%[37]。因此以重金属生物可给性作为健康风险评价指标更能够真实的反应出土壤中重金属给人体带来的健康风险。重金属可给量的健康风险评价的模型为:
| $ H{I_i} = C{S_i} \times BCF \times \frac{{IR \times EF \times ED}}{{BW \times AT}} \times {10^{ - 6}} \times S{F_i} $ | (1) |
| $ H{D_i} = C{S_i} \times BCF \times \frac{{IR \times EF \times ED}}{{BW \times AT}} \times {10^{ - 6}} \times \frac{l}{{Rf{C_i}}} $ | (2) |
式中:HIi为污染物i的致癌风险;HDi为污染物i的非致癌危害商;SFi为污染物i的致癌斜率因子,kg·d/mg;CSi为污染物i的总质量分数,mg/kg;BCF为重金属人体可给因子,以总量评估法假设为1;IR为土壤摄入量,mg/d;EF为暴露频率,d/a;ED为暴露年限,a;BW为体重量,kg;AT为平均作用时间,d;RfCi为污染物i的非致癌参考量,mg/(kg·d)[64]。李继宁等[65]利用SBET体外模拟法对株洲市农田土壤中重金属的生物可给性及人体健康风险进行评估,研究发现重金属的生物可给性平均值(n=42)依次为Cd(66.0%)>Pb(59.0%)>Cu(44.9%)>Zn(35.8%)>As(16.9%)>Cr(5.72%),以生物可给量替代总量进行健康风险评估后,土壤中重金属总的致癌风险和非致癌风险系数平均值分别降低了71%和74%。土壤,尤其是老化和钝化修复的土壤中重金属的健康风险适更适于采用人体可给性进行评价。
4 展望土壤重金属生物有效性的研究,不仅增加了人们对土壤元素地球化学迁移转化规律的认知,也为矿山环境的风险评价,污染土壤的修复和治理提供了可靠的理论依据和技术手段。
(1) 现有的方法复杂多样,评价效果也不尽相同。在推测植物内重金属浓度和毒性效应等研究中,对于Cd、Ni、Zn等相对活性强的重金属推荐采用中性盐提取剂,而对于Cu、Cr和Pb等相对活性弱的重金属推荐采用0.05 M DTPA和0.43 M HNO3进行生物有效性评价。在土壤中重金属的形态分布规律和迁移转化机制等深入研究中应采用BCR等连续提取法。
(2) 应加强对生物有效性评价方法的研究。随着X射线衍射、扫描电镜-能谱仪、电子探针、微区X射线荧光光谱和同步辐射X射线近边吸收结构谱等先进技术方法的开发和应用,提升了研究土壤微区物相和元素赋存形态的分析能力,有利于提升化学提取法的理论基础和成果解释水平。
(3) 应建立以重金属形态和生物有效性为基础的生态环境风险评价标准。我国已经出台了重金属形态分析的标准方法和标准物质。为进一步将重金属的形态和生物有效性在环境评价中的应用提供了有力技术支撑。但是,还需要加强以生物有效性为评价指标的风险评估办法和评价标准方面的研究和应用。
| [1] |
徐佩, 吴超, 邱冠豪. 我国铅锌矿山土壤重金属污染规律研究[J]. 土壤通报, 2015, 46(3): 739-744. |
| [2] |
Liao J, Wen Z, Ru X, et al. Distribution and migration of heavy metals in soil and crops affected by acid mine drainage:Public health implications in Guangdong Province, China[J]. Ecotoxicology and environmental safety, 2016, 124: 460-469. DOI:10.1016/j.ecoenv.2015.11.023 |
| [3] |
蔡锦辉, 吴明光, 汪雄武, 等. 广东大宝山多金属矿山环境污染问题及启示[J]. 华南地质与矿产, 2005(4): 50-54. DOI:10.3969/j.issn.1007-3701.2005.04.009 |
| [4] |
Fernández-Ondoño E, Bacchetta G, Lallena A M, et al. Use of BCR sequential extraction procedures for soils and plant metal transfer predictions in contaminated mine tailings in Sardinia[J]. Journal of geochemical exploration, 2017, 172: 133-141. DOI:10.1016/j.gexplo.2016.09.013 |
| [5] |
Kumpiene J, Bert V, Dimitriou I, et al. Selecting chemical and ecotoxicological test batteries for risk assessment of trace element-contaminated soils (phyto)managed by gentle remediation options (GRO)[J]. Science of the total environment, 2014, 496: 510-522. DOI:10.1016/j.scitotenv.2014.06.130 |
| [6] |
Ehlers L J, Luthy R G. Contaminant bioavailability in soil and sediment[J]. Environmental science & technology, 2003, 37(15): 295-302. |
| [7] |
周国华. 土壤重金属生物有效性研究进展[J]. 物探与化探, 2014, 38(6): 1097-1106. |
| [8] |
Hamelink J L. Bioavailability:physical, chemical, and biological interaction[M]. Bocaraton: Lewis publishers, 1994.
|
| [9] |
Kim R Y, Yoon J K, Kim T S, et al. Bioavailability of heavy metals in soils:definitions and practical implementation a critical review[J]. Environmental geochemistry and health, 2015, 37(6): 1041-1061. DOI:10.1007/s10653-015-9695-y |
| [10] |
Harmsen J. Measuring bioavailability:from a scientific approach to standard methods[J]. Journal of environmental quality, 2007, 36(5): 1420-1428. DOI:10.2134/jeq2006.0492 |
| [11] |
Fedotov P S, Kördel W, Miró M, et al. Extraction and fractionation methods for exposure assessment of trace metals, metalloids, and hazardous organic compounds in terrestrial environments[J]. Critical reviews in environmental science & technology, 2012, 42(11): 1117-1171. |
| [12] |
Sánchezmarín P, Lorenzo J I, Blust R, et al. Humic acids increase dissolved lead bioavailability for marine invertebrates[J]. Environmental science & technology, 2007, 41(16): 5679-5684. |
| [13] |
Luo L, Shen Y, Liu J, et al. Investigation of Pb species in soils, celery and duckweed by synchrotron radiation X-ray absorption near-edge structure spectrometry[J]. Spectrochimica acta part B atomic spectroscopy, 2016, 122: 40-45. DOI:10.1016/j.sab.2016.05.017 |
| [14] |
Suthar V, Memon K S, Mahmood-Ul-Hassan M. EDTA-enhanced phytoremediation of contaminated calcareous soils:heavy metal bioavailability, extractability, and uptake by maize and sesbania[J]. Environmental monitoring & assessment, 2014, 186(6): 3957-3968. |
| [15] |
Ashraf U, Kanu A S, Mo Z, et al. Lead toxicity in rice:effects, mechanisms, and mitigation strategies——a mini review[J]. Environmental science and pollution research international, 2015, 22(23): 18318-18332. DOI:10.1007/s11356-015-5463-x |
| [16] |
Semple K T, Doick K J, Jones K C, et al. Defining bioavailability and bioaccessibility of contaminated soil and sediment is complicated[J]. Environmental science & technology, 2004, 38(12): 228-231. |
| [17] |
刘俊华, 张天红, 薛澄泽. 黑麦幼苗法对污泥中元素生物有效性的研究[J]. 陕西环境, 1994(1): 1-4. |
| [18] |
薛澄泽, 刘俊华, 李宗利, 等. 用黑麦幼苗法测定土壤中污染元素的生物有效性[J]. 环境化学, 1995(1): 32-37. |
| [19] |
周永章, 宋书巧, 杨志军, 等. 河流沿岸土壤对上游矿山及矿山开发的环境地球化学响应——以广西刁江流域为例[J]. 地质通报, 2005, 24(10): 945-951. DOI:10.3969/j.issn.1671-2552.2005.10.012 |
| [20] |
孟昭福, 张增强, 薛澄泽, 等. 替代黑麦幼苗测定土壤中重金属生物有效性的研究[J]. 农业环境科学学报, 2001, 20(5): 337-340. DOI:10.3321/j.issn:1672-2043.2001.05.014 |
| [21] |
Tessier A, Campbell P G, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| [22] |
Feng M H, Shan X Q, Zhang S, et al. A comparison of the rhizosphere-based method with DTPA, EDTA, CaCl2, and NaNO3 extraction methods for prediction of bioavailability of metals in soil to barley[J]. Environmental pollution, 2005, 137(2): 231-240. |
| [23] |
Pueyo M, López-Sánchez J F, Rauret G. Assessment of CaCl2, NaNO3 and NH4NO3 extraction procedures for the study of Cd, Cu, Pb and Zn extractability in contaminated soils[J]. Analytica chimica acta, 2004, 504(2): 217-226. DOI:10.1016/j.aca.2003.10.047 |
| [24] |
Ladonin D V. Heavy metal compounds in soils:problems and methods of study[J]. Eurasian soil science, 2002, 35(6): 605-613. |
| [25] |
Garforth J M, Bailey E H, Tye A M, et al. Using isotopic dilution to assess chemical extraction of labile Ni, Cu, Zn, Cd and Pb in soils[J]. Chemosphere, 2016, 155: 534-541. DOI:10.1016/j.chemosphere.2016.04.096 |
| [26] |
Römkens P F, Guo H Y, Chu C L, et al. Characterization of soil heavy metal pools in paddy fields in Taiwan:Chemical extraction and solid-solution partitioning[J]. Journal of soils and sediments, 2009, 9(3): 216-228. DOI:10.1007/s11368-009-0075-z |
| [27] |
Gryschko R, Kuhnle R, Terytze K, et al. Soil extraction of readily soluble heavy metals and as with 1 M NH4NO3-solution evaluation of DIN 19730[J]. Journal of soils and sediments, 2004, 5(2): 101-106. |
| [28] |
Zhang M, Liu Z, Wang H. Use of single extraction methods to predict bioavailability of heavy metals in polluted soils to rice[J]. Communications in soil science & plant analysis, 2010, 41(7): 820-831. |
| [29] |
Castilho P D, Rix I. Ammonium acetate extraction for soil heavy metal speciation; model aided soil test interpretation[J]. International journal of environmental analytical chemistry, 1993, 51(1-4): 59-64. DOI:10.1080/03067319308027611 |
| [30] |
Bakircioglu D, Kurtulus Y B, Hilmi, et al. Comparison of extraction procedures for assessing soil metal bioavailability of to wheat grains[J]. Clean soil air water, 2011, 39(8): 728-734. DOI:10.1002/clen.v39.8 |
| [31] |
Feng M H, Shan X Q, Zhang S Z, et al. Comparison of a rhizosphere-based method with other one-step extraction methods for assessing the bioavailability of soil metals to wheat[J]. Chemosphere, 2005, 59(7): 939-949. DOI:10.1016/j.chemosphere.2004.11.056 |
| [32] |
Qian J, Shan X Q, Wang Z J, et al. Distribution and plant availability of heavy metals in different particle size fractions of soil[J]. Science of the total environment, 1996, 187(2): 131-141. DOI:10.1016/0048-9697(96)05134-0 |
| [33] |
Li H B, Zhao D, Li J, et al. Using the SBRC assay to predict lead relative bioavailability in urban soils:contaminant source and correlation model[J]. Environmental science & technology, 2016, 50(10): 4989-4966. |
| [34] |
Li H B, Cui X Y, Li K, et al. Assessment of in vitro lead bioaccessibility in house dust and its relationship to in vivo lead relative bioavailability[J]. Environmental science & technology, 2014, 48(15): 8548-8555. |
| [35] |
And R R R, Nicholas T B, And S W C, et al. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental science & technology easton Pa, 1999, 33(4): 642-649. |
| [36] |
Denys S, Caboche J, Tack K, et al. In vivo validation of the unified BARGE method to assess the bioaccessibility of arsenic, antimony, cadmium, and lead in soils[J]. Environmental science & technology, 2012, 46(11): 6252-6260. |
| [37] |
Ruby M V, Andy D, Rosalind S, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental science & technology, 1996, 30(2): 422-430. |
| [38] |
Alvarenga P, Simoes I, Palma P, et al. Field study on the accumulation of trace elements by vegetables produced in the vicinity of abandoned pyrite mines[J]. Science of the total environment, 2014, 470-471: 1233-1242. DOI:10.1016/j.scitotenv.2013.10.087 |
| [39] |
Houba V J G, Lexmond T M, Novozamsky I, et al. State of the art and future developments in soil analysis for bioavailability assessment[J]. Science of the total environment, 1996, 178(1-3): 21-28. DOI:10.1016/0048-9697(95)04793-X |
| [40] |
Han J, Kim J, Kim M, et al. Chemical extractability of As and Pb from soils across long-term abandoned metallic mine sites in Korea and their phytoavailability assessed by brassica juncea[J]. Environmental science and pollution research international, 2015, 22(2): 1270-1278. DOI:10.1007/s11356-014-3441-3 |
| [41] |
Qasim B, Motelica-heino M, Joussein E, et al. Potentially toxic element phytoavailability assessment in technosols from former smelting and mining areas[J]. Environmental science and pollution research international, 2015, 22(8): 5961-5974. DOI:10.1007/s11356-014-3768-9 |
| [42] |
Zhou H, Zeng M, Zhou X, et al. Assessment of heavy metal contamination and bioaccumulation in soybean plants from mining and smelting areas of southern Hunan Province, China[J]. Environmental toxicology & chemistry, 2013, 32(12): 2719-2727. |
| [43] |
Barać N, Škrivanj S, Mutić J, et al. Heavy metals fractionation in agricultural soils of Pb/Zn mining region and their transfer to selected vegetables[J]. Water air soil pollution, 2016, 227(12): 481-494. DOI:10.1007/s11270-016-3177-4 |
| [44] |
Wan X, Dong H, Feng L, et al. Comparison of three sequential extraction procedures for arsenic fractionation in highly polluted sites[J]. Chemosphere, 2017, 178: 402-410. DOI:10.1016/j.chemosphere.2017.03.078 |
| [45] |
Zhang M K, Liu Z Y, Huo W. Use of single extraction methods to predict bioavailability of heavy metals in polluted soils to rice[J]. Communications in soil science & plant analysis, 2010, 41(7): 820-831. |
| [46] |
Anjos C, Magalhāes M C F, Abreu M M. Metal (Al, Mn, Pb and Zn) soils extractable reagents for available fraction assessment:comparison using plants, and dry and moist soils from the Braçal abandoned lead mine area, portugal[J]. Journal of geochemical exploration, 2012, 113: 45-55. DOI:10.1016/j.gexplo.2011.07.004 |
| [47] |
Gupta A K, Sinha S. Assessment of single extraction methods for the prediction of bioavailability of metals to Brassica juncea L. czern. (var. vaibhav) grown on tannery waste contaminated soil[J]. Journal of hazardous materials, 2007, 149(1): 144-150. DOI:10.1016/j.jhazmat.2007.03.062 |
| [48] |
Ngo L K, Pinch B M, Bennett W W, et al. Assessing the uptake of arsenic and antimony from contaminated soil by radish (raphanus sativus) using DGT and selective extractions[J]. Environmental pollution, 2016, 216: 104-114. DOI:10.1016/j.envpol.2016.05.027 |
| [49] |
Rauret G, López-Sánchez J F, Sahuquillo A, et al. Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials[J]. Journal of environmental monitoring, 1999, 1(1): 57-61. |
| [50] |
Adamo P, Iavazzo P, Albanese S, et al. Bioavailability and soil-to-plant transfer factors as indicators of potentially toxic element contamination in agricultural soils[J]. Science of the total environment, 2014, 500-501: 11-22. DOI:10.1016/j.scitotenv.2014.08.085 |
| [51] |
Anawar H M, Garcia-Sanchez A, Santa R I. Evaluation of various chemical extraction methods to estimate plant-available arsenic in mine soils[J]. Chemosphere, 2008, 70(8): 1459-1467. DOI:10.1016/j.chemosphere.2007.08.058 |
| [52] |
Vázquez S, Moreno E, Carpena R O. Bioavailability of metals and As from acidified multicontaminated soils:use of white lupin to validate several extraction methods[J]. Environmental geochemistry and health, 2008, 30(2): 193-198. DOI:10.1007/s10653-008-9143-3 |
| [53] |
Reiley M C. Science, policy, and trends of metals risk assessment at EPA:how understanding metals bioavailability has changed metals risk assessment at US EPA[J]. Aquatic toxicology, 2007, 84(2): 292-298. DOI:10.1016/j.aquatox.2007.05.014 |
| [54] |
韦东普, 马义兵. 科技部"十三五"农业面源和重金属污染农田综合防治与修复技术研发重点专项"农田系统重金属迁移转化和安全阈值研究"项目正式启动[J]. 中国生态农业学报, 2016, 24(11): 1577-1578. |
| [55] |
Liu X, Song Q, Tang Y, et al. Human health risk assessment of heavy metals in soil-vegetable system:a multi-medium analysis[J]. Science of the total environment, 2013, 463-464: 530-540. DOI:10.1016/j.scitotenv.2013.06.064 |
| [56] |
Zhang S, Song J, Cheng Y, et al. Derivation of reliable empirical models describing lead transfer from metal-polluted soils to radish (raphanus sativa L.):determining factors and soil criteria[J]. Science of the total environment, 2017, 613-614: 72-80. |
| [57] |
李富荣, 文典, 王富华, 等. 广东地区芸薹类叶菜-土壤镉污染相关性分析及土壤镉限量值研究[J]. 生态环境学报, 2016, 25(4): 705-710. |
| [58] |
Liu G, Tao L, Liu X, et al. Heavy metal speciation and pollution of agricultural soils along Jishui River in non-ferrous metal mine area in Jiangxi Province, China[J]. Journal of geochemical exploration, 2013, 132: 156-163. DOI:10.1016/j.gexplo.2013.06.017 |
| [59] |
Rodriguez L, Ruiz E, Alonso-Azcarate J, et al. Heavy metal distribution and chemical speciation in tailings and soils around a Pb-Zn mine in Spain[J]. Journal of environmental management, 2009, 90(2): 1106-1116. DOI:10.1016/j.jenvman.2008.04.007 |
| [60] |
陆泗进, 王业耀, 何立环. 会泽某铅锌矿周边农田土壤重金属生态风险评价[J]. 生态环境学报, 2014(11): 1832-1838. DOI:10.3969/j.issn.1674-5906.2014.11.017 |
| [61] |
马亚梦, 谭秀民, 毛香菊, 等. 典型铁尾矿库重金属污染评价及生态修复建议[J]. 矿产保护与利用, 2016(3): 49-56. |
| [62] |
毛香菊, 肖芳, 马亚梦, 等. 内蒙古草原某铜钼矿区土壤重金属污染潜在生态危害评价[J]. 矿产保护与利用, 2016(2): 54-57. |
| [63] |
Liu Y, Bello O, Rahman M M, et al. Investigating the relationship between lead speciation and bioaccessibility of mining impacted soils and dusts[J]. Environmental science & pollution research international, 2017, 24(20): 17056-17067. |
| [64] |
姜林, 彭超, 钟茂生, 等. 基于污染场地土壤中重金属人体可给性的健康风险评价[J]. 环境科学研究, 2014, 27(4): 406-414. |
| [65] |
李继宁, 侯红, 魏源, 等. 株洲市农田土壤重金属生物可给性及其人体健康风险评估[J]. 环境科学研究, 2013, 26(10): 1139-1146. |
 2019
2019



