| 膨胀微晶石墨的制备及对Pb2+的吸附行为 |
2. 西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;
3. 西南科技大学 分析测试中心,四川 绵阳 621010
2. Key Laboratory of Ministry of Education for Solid Waste Treatment and Resource Recycle, Southwest University of Science and Technology, Mianyang 621010, China;
3. Analytical and Testing Center, Southwest University of Science and Technology, Mianyang 621010, China
随着城市化的持续推进和冶金工业的快速发展,我国工业废水日渐增加。工业废水因其常含有重金属而成为水污染的主要来源[1]。因此,在排放工业废水前需对其进行处理。Pb作为一种具有生物毒性的金属元素,可对人体的大脑、肾脏和循环系统造成严重伤害,具有较高的迁移活性,易对水体造成严重的重金属污染[2]。
传统的重金属离子处理技术有还原法、共沉淀法、膜过滤法、离子交换法和吸附法[3]。吸附法因其成本低廉、工艺灵活、操作方便且不产生二次污染而成为去除Pb2+的常用方法。已有研究表明,活性炭[4]、沸石[5]、无机材料[6]和树脂等[7]对Pb2+表现出一定的吸附特性。近年来,碳基材料因其孔隙结构和较大的比表面积而成为良好的重金属离子的吸附剂[8, 9]。如Wang等[10]利用磁性壳聚糖/氧化石墨烯吸附水中Pb2+; Yao等[11]通过微波辅助利用硝酸对活性炭进行改性,并研究其对水中Pb2+的去除行为; Li等[12]研究了热剥离制备石墨烯纳米片对Pb2+的吸附,表明热剥离法制得的高质量石墨烯纳米片可以作为一种高效的Pb2+吸附材料。
作为碳家族的一员,膨胀石墨因其孔隙多、比表面积大和疏水性良好,使其对污染物具有较强的吸附能力。赵颖华[13]研究发现,膨胀石墨表面含有一定的含氧官能团,对铅、铬、锡等离子具有较好的吸附性。微晶石墨颗粒细小,取向性差,均质性好,经膨胀后所得膨胀微晶石墨具有更优异的理化特性。当前,膨胀微晶石墨处理含Pb2+废水的研究鲜有报道,为给膨胀微晶石墨吸附材料的实际应用提供理论依据,本文以湖南郴州微晶石墨为原料,通过氧化—膨胀方式制备膨胀微晶石墨,通过静态吸附试验考察初始Pb2+浓度、反应时间、pH和温度等因素对膨胀微晶石墨吸附性能的影响,并对其吸附机理进行初步探究。
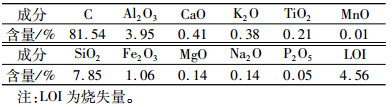
1 试验与方法 1.1 原料与试剂原料:微晶石墨样品(HJC),灰-黑色粉末,采自湖南郴州,粒度<74 μm。由天然微晶石墨样品的化学成分分析(表 1)可知,所采集的天然微晶石墨样品中石墨碳含量较高,约为81.54%。此外,还含约14.35%的灰分,其化学成分主要为SiO2、Al2O3、Fe2O3等铝硅酸盐。因此,在利用微晶石墨时,需对其进行提纯处理。
| 表 1 微晶石墨样品的化学成分分析 Table 1 Chemical composition of microcrystalline graphite sample |
 |
试剂:盐酸(HCl,36%~38%,AR);氢氟酸(HF,40%,AR);浓硫酸(H2SO4,95%~98%,AR);高锰酸钾(KMnO4,≥95%,AR);双氧水(H2O2,5%); 均为市售。
1.2 膨胀微晶石墨制备采用超声—混酸法对样品HJC进行提纯,获得高纯微晶石墨HJC-C[14]。采用改进的Hummers法对HJC-C样品进行氧化,再经高温膨胀后即得膨胀微晶石墨样品。具体试验步骤如下:
(1) 冰水浴条件下,将3.00 g高纯微晶石墨样品加入装有45 mL 98%浓硫酸的烧杯中,然后缓慢地加入1.20 g KMnO4,控制反应温度在10 ℃以下,并持续搅拌30 min;
(2) 将步骤(1)中的反应体系转移至35 ℃水浴条件下继续搅拌30 min;
(3) 向步骤(2)中的反应体系加入超纯水进行稀释,并控制温度不超过70 ℃,当温度不再上升后加入一定量5% H2O2至反应体系无气体产生,用超纯水洗涤样品至中性后,将样品在60 ℃烘箱中烘12 h后得氧化微晶石墨样品(HJC-C-1.6KP)。
(4) 将氧化微晶石墨样品置于带盖的石英坩埚中,然后放入900 ℃高温炉中保持60 s,取出后待石英坩埚降至室温即得膨胀微晶石墨样品(HJC-C-1.6P)。
1.3 膨胀微晶石墨对Pb2+的吸附采用静态批试验法对Pb2+进行吸附,主要考察初始Pb2+浓度、反应时间、pH、吸附剂用量和温度对膨胀微晶石墨吸附Pb2+的影响(每个样品在同一条件下做两个平行样,结果取平均值),具体试验步骤如下:
(1) 初始Pb2+浓度影响。准确称量25 mg膨胀微晶石墨样品若干份,分别加入25 mL浓度为30、50、70、90、110、130 mg/L的含Pb2+溶液中,在恒温摇床(298.15 K,250 r/min)内避光反应330 min后离心分离获得上清液并测定Pb2+浓度,从而获得对Pb2+吸附率大于80%的所对应的初始浓度C1。
(2) 反应时间影响。准确称量25 mg膨胀微晶石墨样品若干份,分别加入25 mL浓度为C1的含Pb2+溶液,在恒温摇床(298.15 K,250 r/min)内分别避光反应5、10、20、40、60、90、120、150、180、230、280、330 min后离心分离获得上清液并测定Pb2+浓度。
(3) pH值影响。准确称量25 mg膨胀微晶石墨样品若干份,分别加入25 mL pH值为2、3、4、5、6的含Pb2+溶液(浓度为C1)中,在恒温摇床(298.15 K,250 r/min)内分别避光反应330 min后离心分离获得上清液并测定Pb2+浓度。
(4) 吸附温度影响。准确称量25 mg膨胀微晶石墨样品若干份,分别加入25 mL浓度为90 mg/L的含Pb2+溶液中,分别在温度为293.15、298.15、303.15、308.15、313.15 K水浴恒温摇床(250 r/min)内分别避光反应330 min后离心分离获得上清液并测定Pb2+浓度。
利用公式(1)和公式(2)计算膨胀微晶石墨对Pb2+的吸附量和吸附率。
| $ D = \frac{{{C_0} - {C_e}}}{{{C_0}}} \times 100\% $ | (1) |
| $ {q_e} = \left( {{C_0} - {C_e}} \right) \times \frac{V}{m} $ | (2) |
式中,D为铅离子去除率,%;C0为铅离子吸附前的浓度,mg/L;Ce为铅离子吸附平衡时的浓度,mg/L;qe为吸附平衡时膨胀微晶石墨对铅离子的吸附量,mg/g;V为反应溶液的体积,L;m为吸附剂质量,g。
1.4 测试表征方法根据GB/T 3521—2008石墨化学分析方法依次对样品进行挥发分和灰分的测定;采用荷兰波长色散型X射线荧光光谱仪(XRF)对灰分进行化学成分测定;采用荷兰PANalytical X’pert PRO型X射线衍射仪(XRD)对样品进行晶体结构的测定,测试条件:Cu靶,管压40 kV,管流40 mA,狭缝系统:DS 1/2°,SS 0.04 rad,AAS 5.5 mm,扫描范围5°~65°;采用德国ZEISS Ultra55型场发射扫描电镜(FE-SEM)对样品进行显微形貌分析;采用美国Nicolet 5700型红外吸收光谱仪(FT-IR)对样品进行含氧官能团的测定,KBr压片法制样,扫描范围:4 000~400 cm-1;采用英国Renishaw InVia型光谱仪对样品进行Raman测试,Ar+激发源,激光波长为514.5 nm,扫描范围400~4 000 cm-1。采用原子吸收光谱仪(AAS)测定吸附平衡后的Pb2+溶液浓度。
2 结果与讨论 2.1 膨胀微晶石墨形貌与孔隙特征图 1为膨胀微晶石墨样品HJC-C-1.6P的SEM图。由图可知,膨胀微晶石墨微观形貌中具有明显的V型开裂和丰富的网络孔结构,增大了膨胀微晶石墨的比表面积,为Pb2+的附着提供了较多吸附位点。膨胀微晶石墨孔结构的形成主要与氧化微晶石墨结构层中含氧官能团、层间域中水分子及层间化合物在高温时迅速脱去所形成的气体压力有关[15]。
 |
| 图 1 膨胀微晶石墨在低倍数下的SEM图(a),膨胀微晶石墨选区放大SEM图(b) Fig.1 SEM of expanded microcrystalline graphite at low magnification (a) and high resolution of the selected areas (b) |
图 2为膨胀微晶石墨样品的氮气脱吸附曲线(a)与BJH孔径分布曲线(b)。由图可知,吸附曲线属于Ⅳ类吸附等温线,表现出介孔特征,孔径主要集中在2~5 nm。通过计算可知,膨胀微晶石墨样品的比表面积为189.75 m2/g。
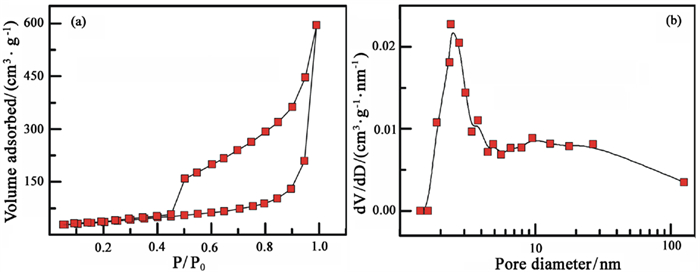 |
| 图 2 样品HJC-C-1.6P的氮气脱吸附曲线(a)与BJH孔径分布曲线(b) Fig.2 N2 adsorption-desorption isotherms (a) and BHJ pore size distributions (b) |
2.2 膨胀微晶石墨结构特征
图 3为氧化微晶石墨和膨胀微晶石墨的XRD图。由图可知,经高温膨胀后,HJC-C-1.6KP样品氧化微晶石墨特征衍射峰(d=0.784 nm)消失,微晶石墨d002特征衍射峰(d=0.343 nm)重现,表明氧化微晶石墨样品在高温膨胀后被还原。相较于热膨胀前,膨胀微晶石墨样品的d002特征衍射峰的峰形对称性更好,半峰宽减小,表明膨胀微晶石墨样品的片层堆叠更有序。
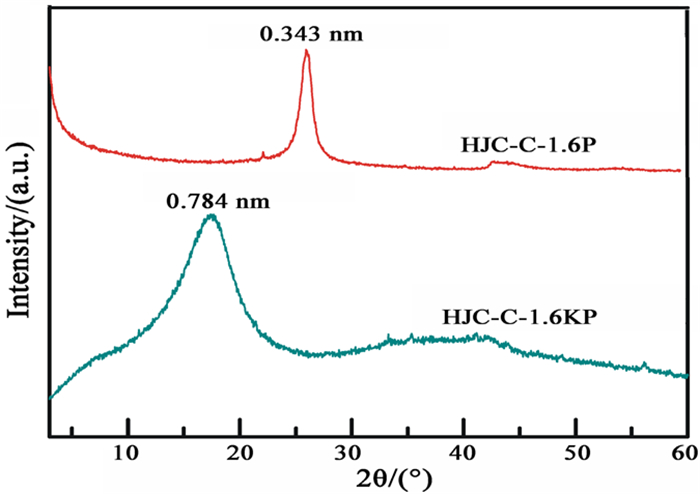 |
| 图 3 氧化微晶石墨和膨胀微晶石墨的XRD图 Fig.3 XRD of the oxidized and the expanded microcrystalline graphite samples |
图 4为氧化微晶石墨和膨胀微晶石墨的FT-IR图。由图可知,氧化微晶石墨结构中含有大量的羟基(-OH)、环氧基(C-O-C)和羧基(-COOH)等含氧官能团。经高温膨胀后,ν-OH和νC=O的伸缩振动吸收峰明显减弱或消失,表明高温膨胀时氧化微晶石墨结构中的部分含氧官能团脱失,导致氧化微晶石墨被部分还原。而残留于膨胀微晶石墨结构中的含氧官能团具有一定的阳离子交换能力,从而增强了产物的离子吸附能力。
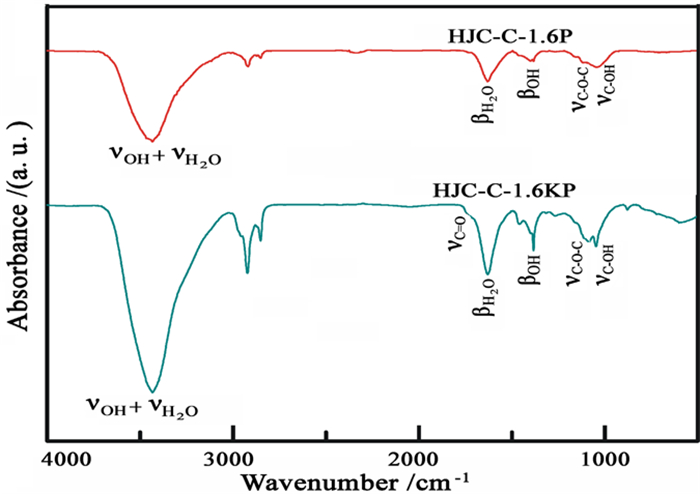 |
| 图 4 氧化微晶石墨和膨胀微晶石墨的FTIR图 Fig.4 FTIR of the oxidized and the expanded microcrystalline graphite samples |
2.3 膨胀微晶石墨对Pb2+的吸附规律
图 5为膨胀微晶石墨对Pb2+的吸附曲线图。
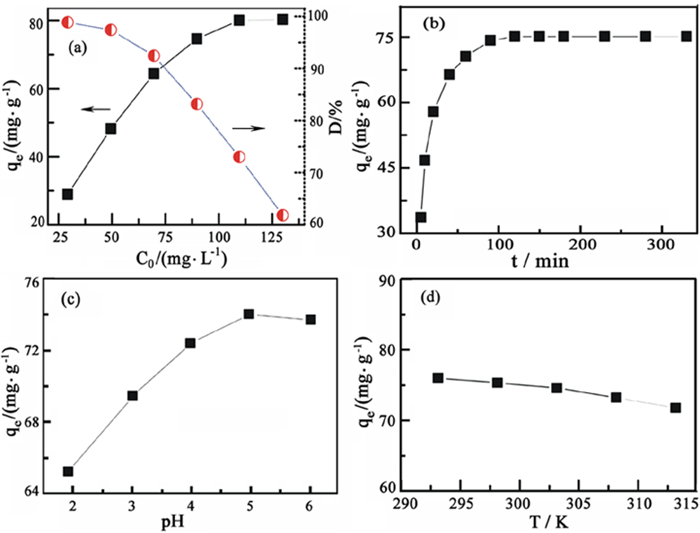 |
| 图 5 吸附条件对Pb2+吸附量的影响 Fig.5 Effect of adsorption conditions on the adsorption capacity of Pb2+: (a) initial concentration of Pb2+; (b) time; (c) pH; (d) temperature (a)初始Pb2+浓度;(b)时间;(c)pH;(d)温度 |
由图 5(a)可知,当Pb2+溶液的初始浓度小于70 mg/L时,吸附量随着初始浓度的增大而迅速增加,表明膨胀微晶石墨样品过量;当初始浓度继续增加时,吸附速率逐渐减小,并在初始浓度为110 mg/L时达到吸附饱和,吸附量为80.03 mg/g。当初始浓度小于90 mg/L时,样品的去除率大于80%,浓度继续增大,去除率迅速下降,因此,在后续的试验中选取Pb2+溶液浓度为90 mg/L。
由图 5(b)可知,吸附速率随时间的增加而逐渐减小,吸附量逐渐增加,当吸附时间为120 min时达到吸附平衡,此时吸附量分别为75.10 mg/g。
pH不仅影响溶液中Pb2+的存在形式,而且对膨胀微晶石墨的表面性质具有一定影响[16]。当pH>6时,Pb2+溶液中的Pb2+会逐渐转变为Pb(OH)+、Pb(OH)2和Pb(OH)3-[17],因此选择pH为2~6。由图 5(c)可知,吸附量随着pH增大而逐渐增大,这可能是因为pH增大,残留在膨胀微晶石墨结构中的官能团增强了表面络合能力[18],从而更有利于吸附Pb2+。当pH为5时,吸附量达到最大,分别为73.99 mg/g。由图 5(d)可知,随着温度的升高,吸附量逐渐减小,表明该吸附为放热过程,升高温度不利于吸附的进行。
因此,膨胀微晶石墨吸附Pb2+在初始浓度为90 mg/L,反应时间为2 h,反应pH为5,反应温度为293.15 K时,其吸附效果较好。
2.4 膨胀微晶石墨对Pb2+的吸附机制 2.4.1 吸附等温线分析吸附等温线可用来反映吸附剂的吸附性能,常用的吸附等温模型有Langmuir和Freundlich模型[19, 20]。前者假设表面吸附为单层均匀吸附,而后者则认为表面吸附不均匀,吸附质之间亦存在相互作用。Langmuir和Freundlich模型的线性方程分别为:
| $ \frac{{{C_e}}}{{{q_e}}}{\rm{ = }}\frac{{{C_e}}}{{{q_m}}} + \frac{1}{{{q_m}{k_l}}} $ | (3) |
| $ \ln {q_e} = \ln {k_f} + \frac{1}{n}\ln {c_e} $ | (4) |
式中,Ce为平衡时吸附质溶液的浓度,mg/L;qe为平衡时膨胀微晶石墨对Pb2+的吸附量,mg/g;qm为膨胀微晶石墨最大吸附量,mg/g;kl表示Langmuir吸附平衡常数, 与吸附容量和吸附能有关,mL/mg;kf和n是与吸附能力及吸附强度有关的Freundlich吸附系数。
图 6为膨胀微晶石墨吸附Pb2+的Langmuir和Freundlich线性拟合曲线,拟合参数列于表 2。由图可知,样品的Langmuir拟合方程的相关系数大于0.999 0,明显高于Freundlich拟合方程的相关系数(小于0.910 0),且计算得到的最大饱和吸附量与试验值基本一致(差值小于3 mg/g)。因此,Langmuir等温曲线能更好的描述膨胀微晶石墨对Pb2+的吸附规律,表明该吸附为单分子层吸附。
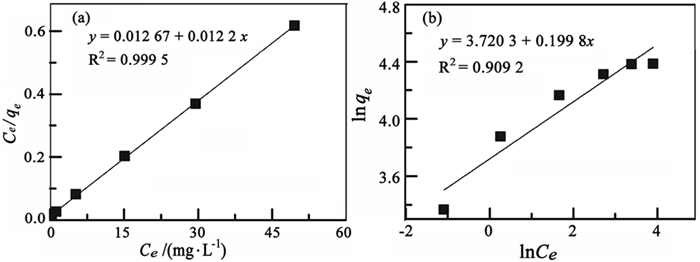 |
| 图 6 膨胀微晶石墨吸附Pb2+的Langmuir(a)、Freundlich(b)等温线 Fig.6 Langmuir isotherms (a) and Freundlich isotherms (b) of Pb2+ adsorption on the expanded microcrystalline graphite |
| 表 2 膨胀微晶石墨吸附Pb2+的等温模型参数 Table 2 Isothermal model parameters of Pb2+ adsorption on the expanded microcrystalline graphite |
 |
2.4.2 吸附动力学分析
吸附动力学的研究能够很好地说明反应路径以及反应机理。常用的吸附动力学模型为准一级动力学模型[21]和准二级动力学模型[22],其线性方程分别为:
| $ \frac{1}{q} = \frac{{{k_1}}}{{{q_e}t}} + \frac{1}{{{q_e}}} $ | (5) |
| $ \frac{t}{q} = \frac{1}{{{k_2} \times q_e^2}} + \frac{t}{{{q_e}}} $ | (6) |
式中,q为t时间的吸附量,mg/g;k1和k2分别为准一级和准二级动力学吸附速率常数。
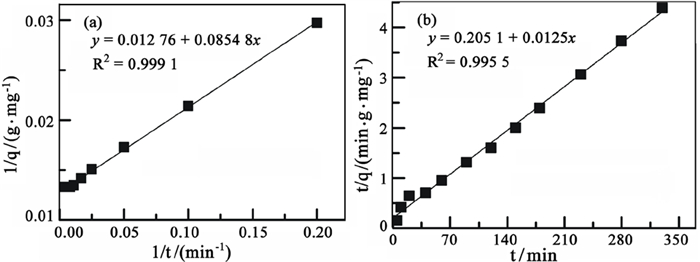
图 7为膨胀微晶石墨吸附Pb2+的动力学曲线,动力学拟合参数列于表 3。
 |
| 图 7 膨胀微晶石墨吸附Pb2+的一级(a)、二级(b)动力学曲线 Fig.7 Pseudo-first order kinetics (a) and pseudo-second order kinetics (b) of Pb2+ adsorption on the expanded microcrystalline graphite |
| 表 3 膨胀微晶石墨吸附Pb2+的动力学参数 Table 3 Kinetic parameters of Pb2+ adsorption on the expanded microcrystalline graphite |
 |
由图可知,膨胀微晶石墨吸附Pb2+的准一级动力学拟合曲线的相关系数为0.999 1,拟合得到的平衡吸附量为78.36 mg/g;膨胀微晶石墨吸附Pb2+的准二级动力学拟合曲线的相关系数为0.995 5,拟合得到的平衡吸附量为80.19 mg/g。可以看出,准一级动力学方程的拟合参数与试验值更接近,且能较好地描述吸附反应的初始阶段。因此,用准一级动力学方程能很好的描述膨胀微晶石墨对Pb2+的整个吸附过程。
2.4.3 吸附热力学分析吸附焓ΔH°、吸附熵ΔS°和吉布斯自由能ΔG°等热力学参数可以定性判断吸附的类型。相关计算公式[23]为:
| $ {k_c} = \frac{{{q_e}}}{{{c_e}}} $ | (7) |
| $ \ln {k_c} = \frac{{\Delta H^\circ }}{{RT}} + \frac{{\Delta S^\circ }}{R} $ | (8) |
| $ \Delta G^\circ = - RT\ln {k_c} $ | (9) |
式中,kc为吸附平衡常数,L/mol;R为理想气体常数,8.314 J·mol-1·K-1;ΔH°,kJ/mol;ΔG°,kJ/mol;ΔS°,J·mol-1·K-1;T为热力学温度,K。
表 4为利用公式(7)~(9)计算获得膨胀微晶石墨吸附Pb2+的热力学参数。由表可知,ΔH°为负值,表明对Pb2+的吸附为放热过程。ΔG°为负值且随温度升高而持续增大,表明吸附是自发过程,升高温度不利于吸附的进行;吸附热的绝对值小于20 kJ/mol,表明膨胀微晶石墨对Pb2+的吸附主要属于物理吸附[24]。ΔS°为负值,表明吸附Pb2+的过程中液-固表面的自由度减小,吸附过程有序进行。
| 表 4 膨胀微晶石墨吸附Pb2+的热力学参数 Table 4 Thermodynamic parameters of Pb2+ adsorption on the expanded microcrystalline graphite |
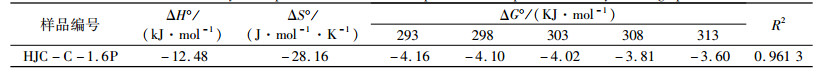 |
3 结论
(1) 膨胀微晶石墨颗粒呈“蠕虫”状,含有大量的V型开裂和丰富的网络型孔隙结构,孔径集中在2~5 nm。
(2) 高温膨胀后,氧化微晶石墨被还原,片层堆叠更有序,结构中的部分吸附水和含氧官能团被除去,结构缺陷与无序度有所减小,部分sp2区域恢复。
(3) 膨胀微晶石墨对Pb2+的吸附行为受初始浓度、时间、pH和温度的影响,吸附量与初始浓度、时间和pH呈正相关,与温度呈负相关。
(4) 膨胀微晶石墨对Pb2+的吸附为单分子层吸附,吸附过程符合Langmuir等温吸附模型和准一级动力学模型;对Pb2+的吸附为自发进行的放热吸附过程,属于物理吸附。
| [1] |
Kadirvelu K, Thamaraiselvi K, Namasivayam C. Removal of heavy metals from industrial wastewaters by adsorption onto activated carbon prepared from an agricultural solid waste[J]. Bioresource technology, 2001, 76(1): 63-65. DOI:10.1016/S0960-8524(00)00072-9 |
| [2] |
Li Y H, Wang S, Wei J, et al. Lead adsorption on carbon nanotubes[J]. Chemical physics letters, 2002, 357(3-4): 263-266. DOI:10.1016/S0009-2614(02)00502-X |
| [3] |
Madadrang C J, Kim H Y, Gao G, et al. Adsorption behavior of EDTA-graphene oxide for Pb (Ⅱ) removal[J]. ACS applied materials & interfaces, 2012, 4(3): 1186-1193. |
| [4] |
Rao M M, Ramana D K, Seshaiah K, et al. Removal of some metal ions by activated carbon prepared from phaseolus aureus hulls[J]. Journal of hazardous materials, 2009, 166(2-3): 1006-1013. DOI:10.1016/j.jhazmat.2008.12.002 |
| [5] |
Solanki P, Gupta V, Kulshrestha R. Synthesis of zeolite from fly ash and removal of heavy metal ions from newly synthesized zeolite[J]. Journal of chemistry, 2010, 7(4): 1200-1205. |
| [6] |
Cai G B, Zhao G X, Wang X K, et al. Synthesis of polyacrylic acid stabilized amorphous calcium carbonate nanoparticles and their application for removal of toxic heavy metal ions in water[J]. The journal of physical chemistry C, 2010, 114(30): 12948-12954. DOI:10.1021/jp103464p |
| [7] |
Fu F, Zeng H, Cai Q, et al. Effective removal of coordinated copper from wastewater using a new dithiocarbamate-type supramolecular heavy metal precipitant[J]. Chemosphere, 2007, 69(11): 1783-1789. DOI:10.1016/j.chemosphere.2007.05.063 |
| [8] |
Yang Z, Xia Y, Mokaya R. Enhanced hydrogen storage capacity of high surface area zeolite-like carbon materials[J]. Journal of the American chemical society, 2007, 129(6): 1673-1679. DOI:10.1021/ja067149g |
| [9] |
Chae H K, Siberio-perez D Y, Kim J, et al. A route to high surface area, porosity and inclusion of large molecules in crystals[J]. Nature, 2004, 427(6974): 523-527. DOI:10.1038/nature02311 |
| [10] |
Wang Y, Li L, Luo C, et al. Removal of Pb2+ from water environment using a novel magnetic chitosan/graphene oxide imprinted Pb2+[J]. International journal of biological macromolecules, 2016, 86: 505-511. DOI:10.1016/j.ijbiomac.2016.01.035 |
| [11] |
Yao S, Zhang J, Shen D, et al. Removal of Pb(Ⅱ) from water by the activated carbon modified by nitric acid under microwave heating[J]. Journal of colloid & interface science, 2016, 463: 118-127. |
| [12] |
Li B Q, Yuan W H, Li L. Adsorption of Pb2+ and Cd2+ on graphene nanosheets prepared using thermal exfoliation[J]. Acta physico-chimica sinica, 2016, 32(4): 997-1004. |
| [13] |
赵颖华.膨胀石墨的制备及其对金属离子去除性能的研究[D].上海: 东华大学, 2012: 24-40. http://cdmd.cnki.com.cn/Article/CDMD-10255-1012311637.htm
|
| [14] |
段佳琪, 孙红娟, 彭同江. 超声-混酸法提纯微晶石墨[J]. 非金属矿, 2017, 40(1): 58-61. DOI:10.3969/j.issn.1000-8098.2017.01.018 |
| [15] |
McAllister M J, Li J L, Adamson D H, et al. Single sheet functionalized graphene by oxidation and thermal expansion of graphite[J]. Chemistry of materials, 2007, 19(18): 4396-4404. DOI:10.1021/cm0630800 |
| [16] |
Deng S, Ting Y P. Characterization of PEI-modified biomass and biosorption of Cu(Ⅱ), Pb(Ⅱ) and Ni(Ⅱ)[J]. Water research, 2005, 39(10): 2167-2177. DOI:10.1016/j.watres.2005.03.033 |
| [17] |
Huang X, Pan M. The highly efficient adsorption of Pb(Ⅱ) on graphene oxides:a process combined by batch experiments and modeling techniques[J]. Journal of molecular liquids, 2016, 215: 410-416. DOI:10.1016/j.molliq.2015.12.061 |
| [18] |
Li Y, Liu F, Xia B, et al. Removal of copper from aqueous solution by carbon nanotube/calcium alginate composites[J]. Journal of hazardous materials, 2010, 177(1): 876-880. |
| [19] |
Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. Journal of the American chemical society, 1918, 40(9): 1361-1403. DOI:10.1021/ja02242a004 |
| [20] |
Freundlich H M F. Over the adsorption in solution[J]. Journal of chemical physics, 1906, 57: 385-470. |
| [21] |
Yin Z, Xiong J, Chen M, et al. Recovery of uranium(Ⅵ) from aqueous solution by amidoxime functionalized wool fibers[J]. Journal of radioanalytical & nuclear chemistry, 2016, 307(2): 1471-1479. |
| [22] |
Ho Y S. Review of second-order models for adsorption systems[J]. Journal of hazardous materials, 2006, 136(3): 681-689. DOI:10.1016/j.jhazmat.2005.12.043 |
| [23] |
Wang D, Liu L, Jiang X, et al. Adsorbent for p-phenylenediamine adsorption and removal based on graphene oxide functionalized with magnetic cyclodextrin[J]. Applied surface science, 2015, 329(1): 197-205. |
| [24] |
Fernandes A N, Almeida C A P, Debacher N A, et al. Isotherm and thermodynamic data of adsorption of methylene blue from aqueous solution onto peat[J]. Journal of molecular structure, 2010, 982(1): 62-65. |
 2018
2018 


