| 三元体系KCl+CaCl2+H2O在278.2 K及308.2 K下的稳定相平衡研究 |
2. 青海盐湖工业股份有限公司,青海 格尔木 816099
2. Qinghai Salt Lake Industry Co., Ltd, Golmud 816099, China
钾盐是我国粮食安全的重要保障和基石。我国钾盐需求量大,钾肥对外依存度高达50%[1-2]。中国已查明的KCl资源储量为11亿t,其中卤水钾资源占比77%,约8.5亿t[3],主要分布在青海柴达木盆地和新疆罗布泊地区。我国最大的钾肥生产基地察尔汗盐湖,采用“反浮选—冷结晶法”“冷结晶—正浮选法”“冷分解—正浮选法”等方法生产氯化钾。但由于察尔汗盐湖地质构造不同,采区晶间卤水中各离子含量不同,经盐田工艺摊晒制取出的光卤石矿原料中存在不同含量的钙,如不进行除钙,则随着生产的进行,钙逐步富集至后期加工系统,使得粗钾产品中夹杂钙而导致钾盐产品纯度较低[4]。现有氯化钾生产工艺路线制订,多以传统的Na+、K+、Mg2+//Cl--H2O四元体系相图为理论指导,对于Ca2+存在对工艺的影响考虑较少。基于此,为实现含钙卤水中钾盐的高效分离,结合察尔汗盐湖湖区温度情况,拟从三元体系KCl+CaCl2+H2O着手,开展该体系278.2 K、308.2 K相平衡研究,为卤水提钾工艺进一步优化提供数据支撑。
针对含钙水盐体系,已有部分学者开展了研究工作,POTTER Ⅱ R W等[5]、LI D D等[6]开展了二元体系CaCl2+H2O的相平衡研究,研究发现氯化钙存在多种结晶形式,且结晶水数量随温度升高减少。丁秀萍等[7]、YANG J M等[8]开展了三元体系NaCl+CaCl2+H2O 298.2 K、348.2 K的相平衡研究,研究体系均为简单三元体系,无复盐或固溶体生成。LI D C等[9]、毕玉敬等[10]、GUO L J等[11]、HAN H J等[12]开展了三元体系CaCl2+SrCl2+H2O 288.2 K、298.2 K、323.2 K相平衡研究,发现氯化钙和氯化锶易形成固溶体,且温度对氯化钙结晶形式影响较大。作者所在课题组开展了三元体系NH4Cl+CaCl2+H2O 298.2 K[13]和四元体系NH4Cl+CaCl2+AlCl3+H2O 298.2 K相平衡研究[14],研究体系均为简单体系,无复盐或固溶体生成。对于本文涉及的三元体系KCl+CaCl2+H2O,Yang J M等[8]等开展了348.2 K相平衡研究,发现体系为简单三元体系,氯化钙结晶形式为CaCl2·2H2O,暂未见该体系278.2 K、308.2 K的相平衡相关报道。为进一步获取钾钙共存氯化物体系中多温结晶析盐规律,本文用等温溶解平衡法开展了278.2 K、308.2 K下三元体系KCl+CaCl2+H2O相平衡研究,为卤水中钾、钙等资源的综合开发利用提供数据支撑。
1 试验部分 1.1 试剂与仪器试剂:去离子水(к≤5.5×10-6 S/m,pH≈6.60),KCl(分析纯,天津市科密欧化学试剂有限公司),无水CaCl2(分析纯,天津市科密欧化学试剂有限公司)。
仪器:PRACTUM224-ICN型电子分析天平(Sartorius科学仪器(北京)有限公司),WYA型阿贝折射仪(上海仪电物理光学仪器公司),DX-2700型X-ray衍射仪(丹东方圆仪器有限公司),SHH-250型恒温箱(重庆英博试验仪器有限公司),iCE-3300型火焰原子吸收光谱仪(赛默飞世尔科技(中国)有限公司)。
1.2 试验方法采用等温溶解平衡法开展三元体系KCl+CaCl2+H2O 278.2 K、308.2 K相平衡研究。以二元共饱和点的数据为基础配制初始溶液,按照梯度向初始溶液中加入另一种新盐,配制一系列组成不同的试样。将所配制的试样放置在恒温箱(278.2 K、308.2 K)中,不断振荡以促进试样达到平衡,振荡过程中需保证所配的试样中有固相存在,定期取试样上层清液并测定其组成,当组成不变时认为体系达到平衡。体系达到平衡后,停止振荡,待试样澄清后进行固液分离,取液相分析其化学组成,并采用称量瓶法测定密度、阿贝折射仪测定折光率;取湿固相分成两部分,一部分采用Schreinemaker湿渣法测定湿渣组成,另一部分在实验温度下烘干后经X-ray粉晶衍射法测定固相组成。
1.3 分析方法Ca2+含量采用EDTA络合滴定法测定[15],Cl-含量采用AgNO3容量法测定[15],K+含量采用火焰原子吸收法测定[16]。
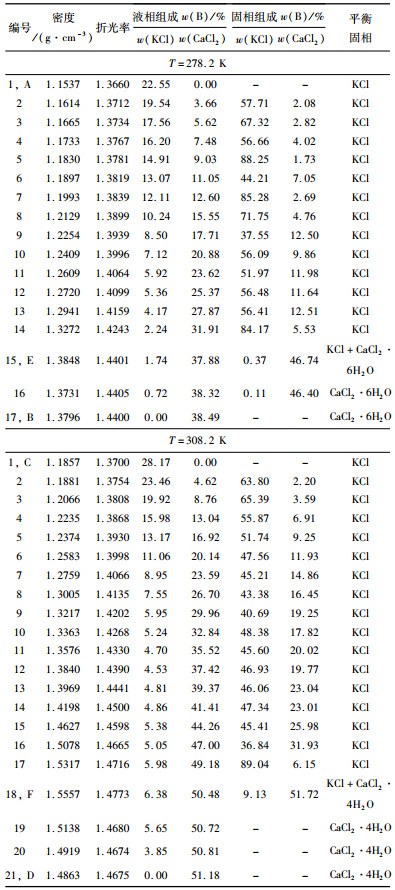
2 试验结果与讨论 2.1 三元体系KCl+CaCl2+H2O 278.2 K、308.2 K相平衡三元体系KCl+CaCl2+H2O 278.2 K、308.2 K溶解度、湿渣组成、平衡液相密度ρ和折光率nD数据列于表 1。根据表 1数据,绘制了该体系278.2 K的稳定相图,见图 1。
| 表 1 三元体系KCl+CaCl2+H2O 278.2 K、308.2K固液平衡组成、密度和折光率 Table 1 The composition, density and refractive index of the ternary system KCl+CaCl2+H2O at 278.2 K and 308.2 K |
|
 |
| 图 1 三元体系KCl+CaCl2+H2O 278.2 K稳定相图 Fig.1 Phase diagram of ternary system KCl+CaCl2+H2O at 278.2 K |
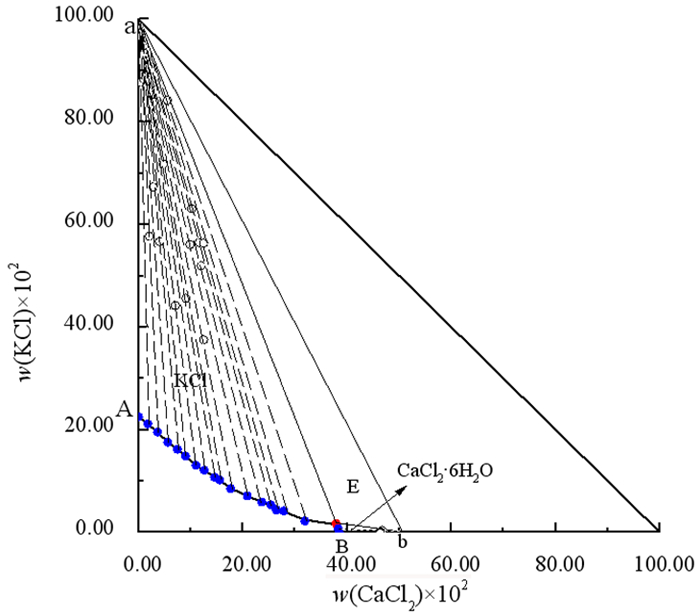
图 1中,点A、B分别表示二元体系KCl - H2O和CaCl2 - H2O中固液相达平衡的饱和状态。278.2 K时该体系稳定相图由1个三元共饱和点、2条单变量曲线和2个单盐结晶区组成。E点对应的平衡液相组成为w(KCl)=1.74%,w(CaCl2)=37.88%;经X-ray粉晶衍射分析(图 2)可知,其平衡固相组成为KCl和CaCl2·6H2O。2条单变量曲线为单盐饱和溶解度曲线,分别为:AE对应KCl的饱和溶解度曲线,BE对应CaCl2·6H2O的饱和溶解度曲线。2个单盐结晶区分别对应KCl结晶区(AEaA)、CaCl2·6H2O结晶区(BEbB),其中KCl结晶区大于CaCl2·6H2O的结晶区,表明KCl易从体系中结晶析出。
 |
| 图 2 三元体系KCl+CaCl2+H2O 278.2 K时E点平衡固相XRD图谱 Fig.2 XRD pattern of the point E of ternary system KCl+CaCl2+H2O at 278.2 K |
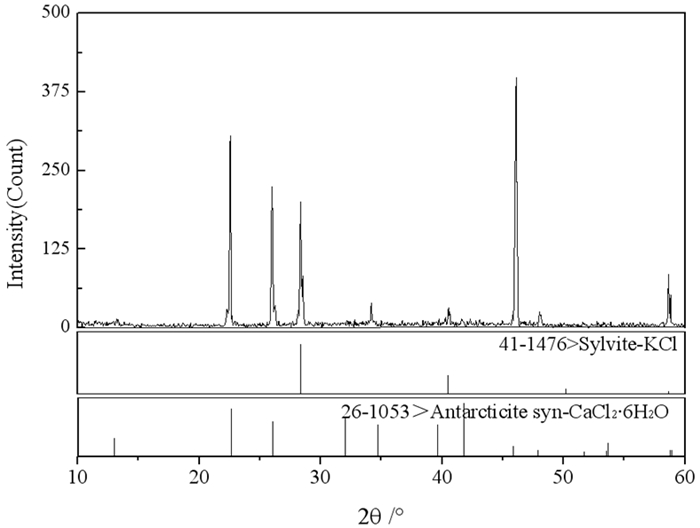
为考察温度对体系盐类结晶形式的影响,同时开展了该体系308.2 K时的相平衡研究。根据表 1数据,绘制了308.2 K时三元体系KCl+CaCl2+H2O的稳定相图,见图 3。从图 3可知,该体系308.2 K时的稳定相图由2个结晶区,2条单变量曲线和1个共饱和点组成。经湿渣法和X-ray粉晶衍射法分析(图 4)确定F点处固相组成为KCl和CaCl2·4H2O,对应的平衡液相组成为:w(KCl)=6.38%,w(CaCl2)=50.48%。
 |
| 图 3 三元体系KCl+CaCl2+H2O 308.2 K时稳定相图 Fig.3 Phase diagram of ternary system KCl+CaCl2+H2O at 308.2 K |
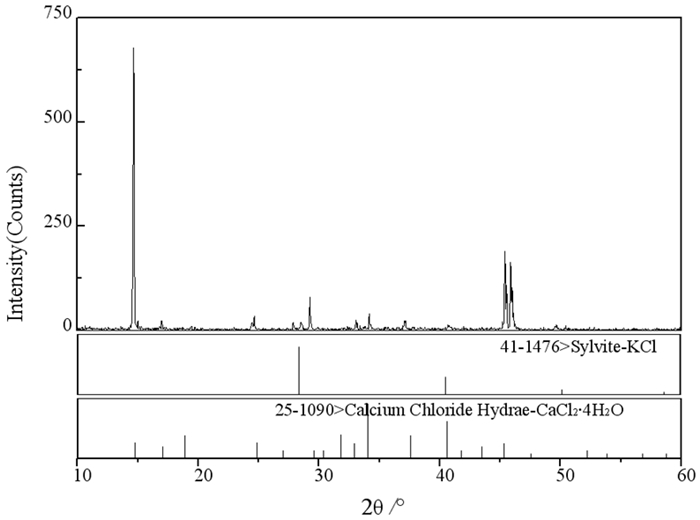 |
| 图 4 三元体系KCl+CaCl2+H2O 308.2 K时F点的平衡固相XRD图谱 Fig.4 XRD pattern of the point F of ternary system KCl+CaCl2+ H2O at 308.2 K |
针对不同温度下CaCl2结晶形式,前人开展了系列研究工作[6],获得了不同结晶形式CaCl2转化的温度范围:当224.58 K<T<303.35 K时,氯化钙结晶形式为CaCl2·6H2O;当T=303.35 K时,CaCl2·6H2O转变为CaCl2·4H2O;当T=316.82 K时,CaCl2·4H2O转变为CaCl2·2H2O;当T=448.19 K时,CaCl2·2H2O转变为CaCl2·H2O;当T=462.05 K时,CaCl2·H2O转变为CaCl2·1/3H2O。本文研究体系对应温度下所获得的氯化钙结晶形式分别为CaCl2·6H2O和CaCl2·4H2O,与前人研究结果一致。
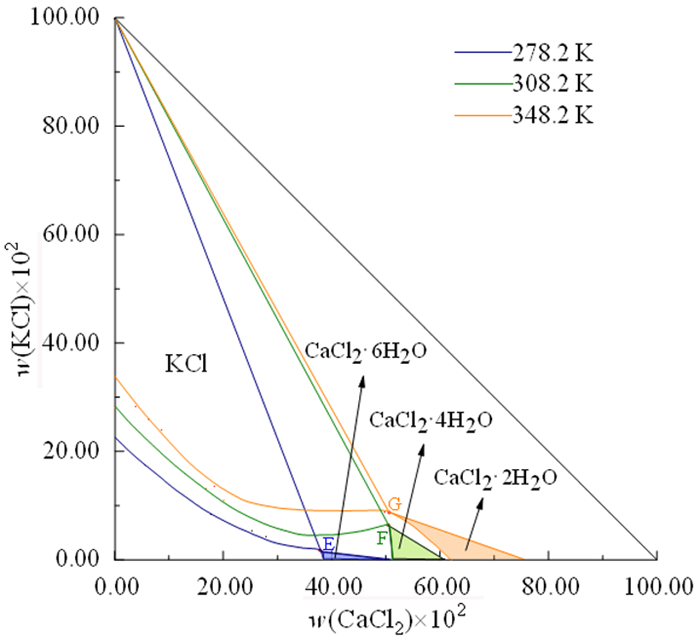
2.2 三元体系KCl+CaCl2+H2O多温对比对比三元体系KCl+CaCl2+H2O (278.2 K、308.2 K、348.2 K[8])稳定相图(图 5)发现:当温度为278.2 K时,CaCl2的结晶形式为CaCl2·6H2O;当温度为308.2 K时,CaCl2的结晶形式为CaCl2·4H2O;当温度为348.2 K时,CaCl2的结晶形式CaCl2·2H2O。由图 5可知:随着温度升高,氯化钙的结晶形式发生转变,由CaCl2·6H2O转变为CaCl2·2H2O,且对应的氯化钙结晶区增大;308.2 K时氯化钾结晶区最大,有利于氯化钾析出。
 |
| 图 5 三元体系KCl+CaCl2+H2O多温对比相图 Fig.5 Multi temperature phase diagram of ternary system KCl+CaCl2+H2O |
2.3 平衡液相物化性质研究
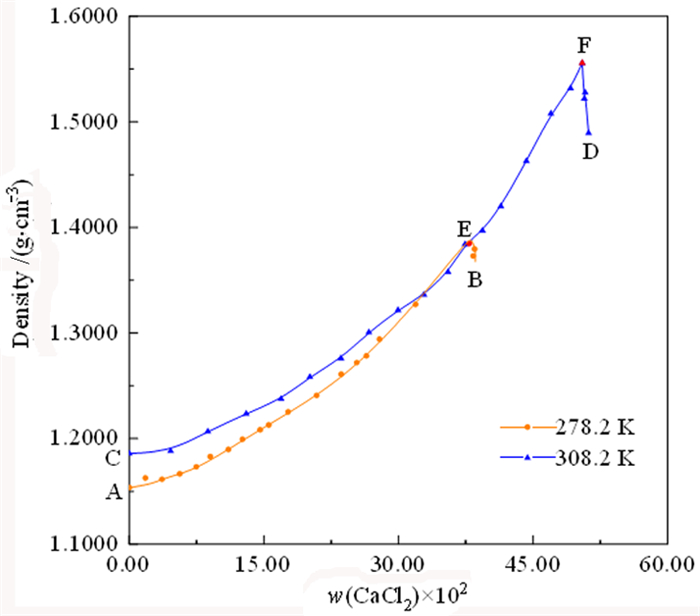
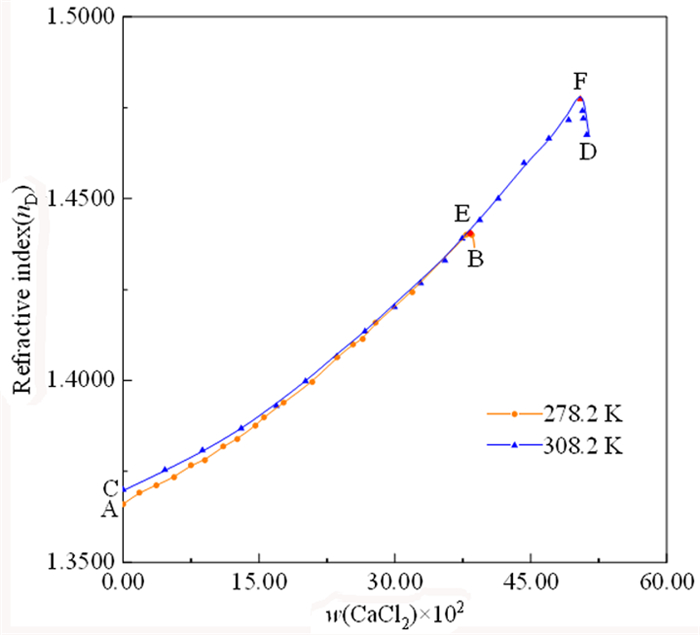
在三元体系KCl+CaCl2+H2O中,CaCl2溶解度远大于KCl,因而溶液中CaCl2含量是影响溶液物化性质的主要因素。鉴于此,以w(CaCl2)为横坐标,密度/折光率为纵坐标,绘制了278.2 K和308.2 K下三元体系KCl+CaCl2+H2O的密度—组成图(图 6)和折光率—组成图(图 7)。由图 6和图 7可知:该体系平衡液相的密度和折光率均随溶液中氯化钙含量的增加而增大,分别在E点和F点处达最大值。
 |
| 图 6 三元体系KCl+CaCl2+H2O 278.2 K、308.2K时的密度—组成图 Fig.6 Density vs composition diagram of ternary system KCl+CaCl2+H2O at 278.2 K and 308.2 K |
 |
| 图 7 三元体系KCl+CaCl2+H2O 278.2 K、308.2 K下的折光率—组成图 Fig.7 Refractive index vs composition diagram of ternary system KCl+CaCl2+H2O at 278.2 K and 308.2 K |
3 结论
(1) 三元体系KCl+CaCl2+H2O在278.2 K和308.2 K下无复盐或固溶体生成,属于简单三元体系,其稳定相图均包含1个共饱和点、2条单变量曲线以及2个结晶区。KCl的结晶区大于CaCl2的结晶区,表明KCl更易析出。
(2) 通过对比三元体系KCl+CaCl2+H2O 278.2 K、308.2 K、348.2 K相图发现:308.2 K时氯化钾结晶区最大,表明此时氯化钾最易析出;氯化钙的结晶形式随温度升高,由CaCl2·6H2O转变为CaCl2·2H2O。
(3) 根据三元体系KCl+CaCl2+H2O多温对比氯化钙结晶区变化情况,在氯化钾生产工艺中,可以考虑在加工系统精钾离心机后加入除钙结晶器,控制温度为308.2 K,采用冷结晶原理除去钙离子。
| [1] |
熊增华, 王石军. 中国钾资源开发利用技术及产业发展综述[J]. 矿产保护与利用, 2020, 40(6): 1-7. |
| [2] |
杨卉芃, 曹飞. 世界钾资源研究系列之一——资源概况及供需分析[J]. 矿产保护与利用, 2015, 35(1): 75-78. |
| [3] |
郑绵平, 张震, 侯献华, 等. 中国钾资源远景与矿业发展战略[J]. 国土资源情报, 2015(10): 3-9. DOI:10.3969/j.issn.1674-3709.2015.10.001 |
| [4] |
熊增华, 王石军. 察尔汗盐湖资源开发利用现状及关键技术进展[J]. 化工矿物与加工, 2021, 50(1): 33-37. |
| [5] |
POTTER Ⅱ R W, CLYNNE M A, CALIF M P. Solubility of highly soluble salts in aqueous media-part 1, NaCl, KC1, CaCl2, Na2SO4, and K2SO4 solubilities to 100 ℃[J]. Journal of Research of the U. S. Geological Survey, 1978, 6(6): 701-705. |
| [6] |
LI D D, ZENG D W, YIN X, et al. Phase diagrams and thermochemical modeling of salt lake brine systems. ii. NaCl+H2O, KCl+H2O, MgCl2+ H2O and CaCl2+H2O systems[J]. Calphad Computer Coupling of Phase Diagrams and Thermochemistry, 2016, 53: 78-89. |
| [7] |
丁秀萍, 毕玉敬, 时历杰, 等. 三元体系NaCl-CaCl2-H2O 25 ℃相关系研究[J]. 盐湖研究, 2009, 17(3): 40-43. |
| [8] |
YANG J M, LIU X L, LIANG P P. Solubilities of salts in the ternary systems NaCl+CaCl2+H2O and KCl+CaCl2+H2O at 75 ℃[J]. Russian Journal of Physical Chemistry A, 2011, 85(7): 1149-1154. |
| [9] |
LI D C, ZHANG Z Y, FAN R, et al. Solid-liquid phase equilibria in the aqueous systems (CaCl2+SrCl2+H2O) and (NaCl+CaCl2+SrCl2+H2O) at 288.15 K[J]. Journal of Chemical and Engineering Data, 2019, 64(6): 2767-2773. DOI:10.1021/acs.jced.9b00154 |
| [10] |
毕玉敬, 孙柏, 赵静, 等. 25 ℃时三元体系SrCl2-CaCl2-H2O相平衡研究[J]. 无机化学学报, 2011, 27(9): 1765-1771. |
| [11] |
GUO L J, ZENG D W, YAO Y, et al. Isopiestic measurement and solubility evaluation of the ternary system (CaCl2+SrCl2+H2O) at T=298.15 K[J]. Journal of Chemical Thermodynamics, 2013, 63: 60-66. DOI:10.1016/j.jct.2013.03.021 |
| [12] |
HAN H J, JI X, MA J J, et al. Water activity, solubility determination, and model simulation of the CaCl2-SrCl2-H2O Ternary System at 323.15 K[J]. Journal of Chemical and Engineering Data, 2018, 63: 1636-1641. |
| [13] |
WANG L, YU X D, LI M L, et al. Phase equilibrium for the aqueous ternary systems NH4+, Sr2+(Ca2+) // Cl--H2O at T = 298 K[J]. Journal of Chemical Engineering of Japan, 2018, 51: 551-555.
|
| [14] |
YU X D, LIU M, ZHENG Q F, et al. Measurement and correlation of phase equilibria of ammonium, calcium, aluminum, and chloride in aqueous solution at 298.15 K[J]. Journal of Chemical and Engineering Data., 2019, 64: 3514-3520. |
| [15] |
中国科学院青海盐湖研究所. 卤水和盐的分析方法[M]. 北京: 科学出版社, 1988: 56-59, 69-71.
|
| [16] |
中国有色金属工业协会. 铝及铝合金化学分析方法第33部分: 钾含量的测定火焰原子吸收光谱法: GB/T 20975.33—2020[S]. 2020-11-19.
|
 2021
2021



