聚酰胺(Polyamide,缩写PA),又称尼龙,是主链中含有重复酰胺基团的聚合物的总称[1, 2]。按其重复单元链段中芳香环的数目,尼龙分为脂肪族尼龙(如聚己二酰己二胺(PA66))、半芳香族尼龙(如聚对苯二甲酰己二胺(PA6T))、全芳香族尼龙(如聚对苯二甲酰对苯二胺(PPTA))等三类[3]。由于结构上的差异,不同种类的尼龙在性能和用途上存在较大的差异。芳香族尼龙由于刚性链段的存在使其耐热性和机械性能优于脂肪族尼龙[4],但是,半芳香族尼龙的熔点与热分解温度接近,不易进行熔融加工,而全芳香族尼龙的熔点则高于其分解温度,不能直接熔融加工。因此,芳香族尼龙的研究大多聚焦于它们的改性[5~9],主要有两种方式:① 通过改变二胺的碳原子数目,即次甲基的数量,调控尼龙的熔点和性能[10]。例如,采用壬二胺代替己二胺,与对苯二甲酸反应生成聚对苯二甲酰壬二胺(PA9T)就可降低熔点。② 与脂肪族尼龙共聚制备共聚尼龙,降低半芳香族尼龙熔点,改善其熔融加工性[11]。后一种方法能结合脂肪族尼龙和半芳香族尼龙的优点,且所采用的单体比长碳链二胺更易得到,因此备受青睐。
尼龙通常是由二元胺和二元酸缩聚反应得到的。为了获得高分子量的尼龙,需要严格控制二元胺和二元酸等摩尔比反应[12, 13]。因此,尼龙的制备通常是将二元胺和二元酸反应生成它们对应的尼龙盐,然后在高压釜中进行缩聚[14~17]。尼龙盐的合成主要通过溶液法[18~20]制得,其盐的特征或纯度对相应尼龙产品性能有很大的影响。顾亮等[21]通过研究己二胺(HMDA)和对苯二甲酸(PTA)反应生成的尼龙6T盐对后续聚合的影响,发现尼龙6T盐中含有过量的PTA会使缩聚反应提前终止,导致聚合产物分子量不高;而己二胺(HMDA)过量时,容易引起亚酰化反应。陈琦君[22]通过对尼龙盐水溶液的pH值测定,发现pH高,游离的己二胺含量多,尼龙盐的稳定性差;若pH过低,说明未反应的己二酸或对苯二甲酸多,聚合产物的分子量就会偏低。
聚酰胺共聚改性通常涉及到脂肪族尼龙盐和芳香族尼龙盐两种尼龙盐[18, 19],尼龙的共聚从聚合原料的角度进行分类,一般分为两大类:一是以两种不同的尼龙盐作为共聚的原料。另一种是以两种不同的酸与其对应的二胺作为原料,经过预聚和终聚两个阶段得到终聚物。第二种方法由于程序简单,能够减少能耗。因此,非常有必要研究芳香族酸和脂肪族酸与脂肪族胺同时成盐反应过程,以寻求同时成盐的影响因素以及最佳成盐条件。本研究以PA66和PA6T共聚合的成盐过程为例,通过pH和反应温升实时测量等方式对己二酸、对苯二甲酸混合体系与己二胺反应生成尼龙66盐/尼龙6T盐的成盐过程进行了研究,并考察了反应配比和反应温度等因素对混合成盐过程的影响。
2 实验材料和方法 2.1 实验材料己二酸(ADA,国药集团,分子量为146.14,AR);对苯二甲酸(PTA,仪征化纤总公司,分子量为166.13,工业级);己二胺(HMDA,国药集团,分子量为116.21,AR)。
2.2 成盐过程研究尼龙66盐或尼龙6T单盐:称取0.076 mol ADA或PTA,加入到玻璃夹套釜中,加入60 mL水,采用恒温槽将夹套釜的温度控制在某一温度(30、40、50或60℃),然后将等摩尔的HMDA溶解于20 mL的水中,并加热HMDA水溶液使温度与ADA或PTA悬浊液的温度相同时,将其加入夹套釜与ADA或PTA反应,反应30 min,反应过程中,采用精密酸度计和温度计实时监测反应体系的pH和温度变化。
尼龙66/尼龙6T混合盐:分别称取0.035 mol的PTA和ADA,将它们加入到夹套釜中,然后加入30 mL蒸馏水,使用超级恒温槽控制温度为30℃,55℃。称量与两种二酸等摩尔的HMDA溶于10 mL水中,加热使其温度与酸的悬浊液温度相等后,加入到夹套釜中与两种二酸进行反应。整个反应过程采用精密酸度计和温度计实时监测反应体系的pH和温度。随后热抽滤,取滤液进行旋蒸至有晶体析出,多次重结晶、水洗后将固体样品放置真空烘箱于70℃下干燥12 h。最后,改变HMDA的加入量,使加入的HMDA只能与25%、50%或75%的酸反应,重复上述实验。将PTA以及ADA的实验量增大至0.2 mol,称取对应量的HMDA在55℃下重复上述实验。
2.3 尼龙盐的表征(1) 红外光谱(FTIR)分析:采用美国热电公司的Nicolet 5700红外光谱仪对样品进行分析;样品处理采用溴化钾压片法。
(2) 核磁共振(NMR):采用瑞士Bruker公司Advance 2B/400M核磁共振仪对样品进行1H NMR分析;内标为四甲基硅烷(TMS),溶剂为重水(D2O)。
(3) 热性能分析:在氮气氛围下,采用美国TA公司的TA-Q500热重分析仪分析尼龙盐的稳定性,升温速率为10℃·min-1,温度测试范围为50 ~ 600℃。
(4) pH测定:采用上海大普仪器有限公司的PHS-2C型酸度计,测量范围为1~14。
3 实验结果与讨论 3.1 ADA、PTA与HMDA相对含量和pH的关系尼龙66盐和尼龙6T盐的水溶液的pH计算可当作弱酸弱碱的一级电离处理,即
| ${\rm{pH}} = 7 + \frac{1}{2}p{K_a} - \frac{1}{2}p{K_b}$ | (1) |
其中,Ka是一定温度下弱酸的电离常数;pKa是弱酸电离常数的负对数;Kb是同一温度下弱碱的电离常数;pKb是弱碱电离常数的负对数[22]。在25℃时,ADA和PTA的pKa分别为4.42和3.54,HMDA的pKb为3.66[22~24]。通过式(1) 可知25 ℃下尼龙66盐和尼龙6T盐的理论pH分别为7.38和6.94。若尼龙盐中含有过量的二胺或二酸,pH会升高或降低,因此,可用pH的变化来研究成盐过程。
定义X为二酸相对HMDA的过量摩尔分数,即:
| $X = \frac{{{n_{{\rm{acid}}}} - {n_{{\rm{HMDA}}}}}}{{{n_{{\rm{HMDA}}}}}} \times 100\% $ | (2) |
其中,nacid是二酸的摩尔浓度,nHMDA是HMDA的摩尔浓度。图 1对比了25℃下ADA和PTA分别与HMDA反应的X与pH的关系图。从图中可以发现,随着ADA或PTA用量的增加,溶液的pH都呈现下降的趋势。当X为负数,即HMDA过量时,加入ADA与PTA的曲线基本重合。这是因为加入的二酸不能使HMDA完全反应,溶液的pH值主要由溶液中过量的HMDA所决定。当X = 0时,二酸和二胺达到等摩尔比,此时,尼龙66盐和尼龙6T盐水溶液在25℃下的pH分别为7.92和7.80。两者都比理论值高,因为理论计算时,活度系数γ=1,但实际测量时,γ<1。故测得的pH都比理论值高。当X>0时,HMDA已完全与二酸反应,此时pH的下降是过量的ADA或PTA在相应盐溶液中的溶解造成的。从图 1可明显看出:加入PTA比加入ADA的pH下降得更快,这说明PTA的酸性比ADA的强。同时,也必须注意到,当PTA过量超过5%时,反应体系的pH不再变化,这主要是由于PTA在水中溶解度已达到饱和,继续加入PTA,它将以固体颗粒形式存在水中,并不产生H+。而对于ADA体系,直至ADA过量50%时,体系的pH仍然呈现下降趋势。说明ADA的溶解并未达到饱和,还能溶解其中从而产生H+,使得pH下降。
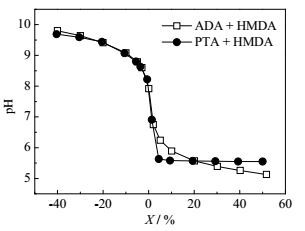
|
图 1 25℃下ADA和PTA与HMDA相对过量摩尔分数和pH的关系 Fig.1 Relationship between pH and relative excess molar percentage of ADA-HMDA and PTA-HMDA at 25℃ |
由于PTA和ADA在水中的溶解度较低[25, 26],在成盐反应前它们仅部分溶于水,呈乳白色的悬浊液。加入HMDA后,溶解于水中的ADA或PTA立即与HMDA反应生成可溶于水的尼龙盐,同时ADA和PTA也不断溶于水,继续与HMDA反应,最后溶液变澄清。为了更好的分析成盐过程,采用温度计和精密酸度计实时监测二胺溶液加到二酸悬浊液中生成尼龙盐过程的温度和pH变化。
ADA和HMDA反应生成尼龙66盐过程的温度和pH变化分别如图 2和图 3所示。从图 2可以看出,不论反应初始温度如何,HMDA的加入都会使反应体系的温度迅速升高,说明尼龙66盐的成盐过程是一个放热反应。另外,随着初始反应温度的提高,反应体系温升速率加快,达到最高温度的时间缩短,并且最大温升也相应的增加,如表 1所示。反应温度对尼龙66成盐过程的pH变化也有很大的影响。如图 3所示,当反应温度为30℃和40℃时,反应体系的pH先急剧上升,随后下降到一定值再缓慢上升,直至最后pH达到稳定;而当反应温度为50和60℃时,pH先迅速增大,然后逐渐达到稳定。当初始反应温度为30和40℃时,ADA在100 g水中的溶解度仅为3.07和4.60 g[27],且ADA的溶解速率小于HMDA与ADA的反应速度,使得反应初期存在大量未反应的HMDA,所以当HMDA加入ADA悬浊液中时,pH先急剧上升。随着ADA和HMDA反应放热,使得ADA在水中的溶解度增加,中和溶液中的HMDA,导致pH下降,最后随着反应体系的温度降低,由于水的解离度降低,pH又缓慢上升。而当初始反应温度为50和60℃时,ADA在100 g水中的溶解度增加为6.81和10.69 g[27],溶解速度加快,使得ADA的溶解速度大于ADA与HMDA的反应速度,当HMDA水溶液加入到ADA悬浊液中时,随着时间的延长,ADA不断被消耗,pH增加直至达到平衡。因此,对于HMDA和ADA反应成盐过程,在40℃以下,反应主要受溶解控制,而在50℃以上,则转变为反应控制。
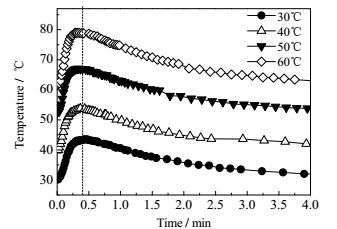
|
图 2 不同反应温度下ADA与HMDA反应体系的温度随时间的变化 Fig.2 Temperature profiles of ADA/HMDA reaction under different reaction temperatures |
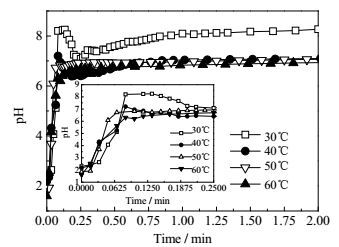
|
图 3 不同反应温度下ADA与HMDA反应体系的pH随时间的变化 Fig.3 pH profiles of ADA/HMDA reaction under different reaction temperatures |
| 表 1 不同反应温度下尼龙66盐和尼龙6T盐成盐反应体系温升 Table 1 Temperature rise during PA66 and PA6T salts formation under different reaction temperatures |
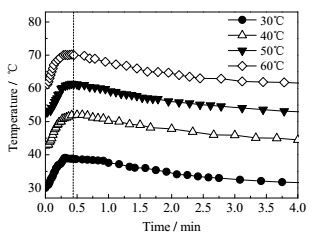
图 4和图 5分别为不同反应温度下制备尼龙6T盐过程中的pH和温度变化。从图 4可看出,不论反应温度如何,反应体系的pH都迅速增大而后逐渐降低,这不同于尼龙66盐制备过程中的pH变化曲线。这是因为PTA在水中的溶解度远低于ADA的,如在30、40以及50℃时,PTA在100 g水中的溶解度分别为0.005、0.006和0.007 g,即使在60℃下,在100 g水中的溶解度仅为只有0.010 g[26],来不及与所加入的HMDA(0.076 mol)反应,导致pH急剧上升。随后,PTA不断溶解于水中,与HMDA反应生成盐,使得pH不断下降,直至达到平衡。可见,PTA和HMDA的成盐反应主要是由PTA的溶解所控制的。从图 4还可以注意到,反应温度越高,pH随时间变化曲线的峰值越低。这是因为随着反应温度的升高,初始溶解在水中的PTA略微增加,能与更多的HMDA反应,使得pH峰值略有下降。进一步说明,尼龙6T盐的成盐过程与PTA的溶解度息息相关。但温度从30℃上升到60℃,PTA的溶解度最多仅增加了0.005 g,并不会造成放热量的明显增加,所以反应体系温升速率相同,且最大温升几乎相同(如图 5和表 1所示)。
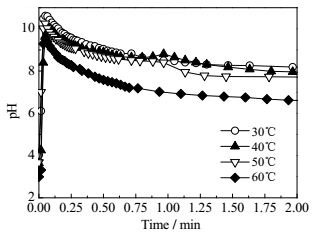
|
图 4 不同反应温度下PTA与HMDA反应体系的pH随时间的变化 Fig.4 pH profiles of PTA/HMDA reaction under different reaction temperatures |
|
图 5 不同反应温度下PTA与HMDA反应体系的温度随时间的变化 Fig.5 Temperature profiles of PTA/HMDA reaction under different reaction temperatures |
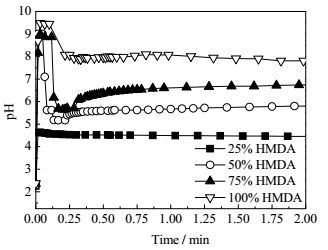
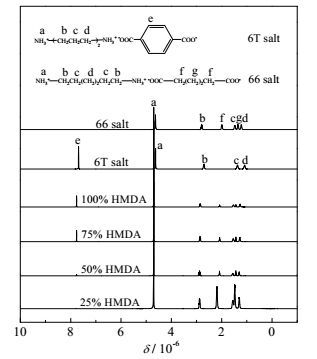
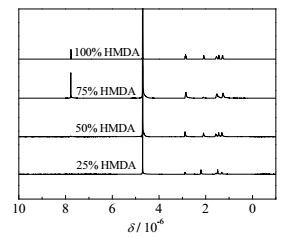
在30℃下,ADA和PTA在100 g水中的溶解度分别为3.07 g(0.021 mol)和小于0.01 g,因此在等摩尔比的ADA/PTA混合酸中加入摩尔量为混合酸的25%的HMDA(0.018 mol)时,水中已溶解的二酸可以完全与HMDA反应;达到50%时,水中溶解的二酸已不足以与加入的HMDA完全反应;高于50%后,则两种二元酸都必须参与反应,才能使HMDA反应完全。这四种反应体系的pH随反应时间的变化如图 6所示。从图中可以看出,当加入混合酸25%的HMDA(0.018 mol)后,反应体系的pH先急剧增加,然后达到平衡,类似于反应控制的成盐体系的pH变化,表明HMDA主要与反应体系中已溶解的混合酸反应。由于PTA在水中溶解度远低于ADA的,因此,该条件下主要发生HMDA和ADA的反应。这也可以从所制备的尼龙盐的1H-NMR谱图得到证实。如图 7所示,加入混合酸25%的HMDA所制备尼龙盐的1H-NMR谱图在4.70处存在尼龙盐上NH3+氢的吸收峰,2.87,1.49和1.29处存在与N相连的C上的氢吸收峰,2.19和1.47处是与C相连的亚甲基的氢的吸收峰,与纯的尼龙66盐的完全一致,表明反应生成的尼龙盐主要是尼龙66盐。可见,HMDA的用量低于水中已溶解的二酸的量时,主要与ADA反应,生成尼龙66盐。
|
图 6 30 ℃下混酸中加入不同含量HMDA的pH变化 Fig.6 pH variation with different HMDA contents in mixed acid solution at 30℃ |
|
图 7 30 ℃下不同HMDA添加量得到的样品的1H NMR Fig.7 1H NMR of samples with different HMDA contents at 30℃ |
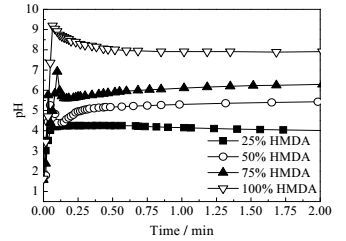
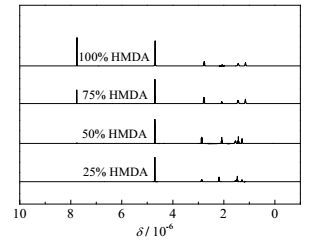
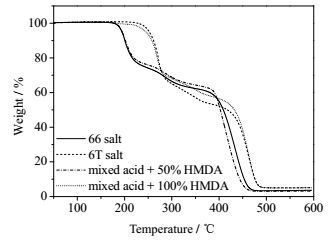
当HMDA加入量增加到混合酸50%以上后,水中已溶解的二酸不足以与加入的HMDA完全反应,使得反应体系的pH先急剧上升,而后下降到某一值再缓慢上升到稳定值(如图 6所示),表明成盐过程逐渐由反应控制转变为溶解控制。若将反应体系的温度升高至55 ℃,ADA在水中的溶解度增加两倍多,可以完全消耗所加入的HMDA,成盐反应体系pH随时间的变化类似于加入25% HMDA反应体系,都是先急剧增加而后达到平衡(如图 8所示),表明此时成盐反应还是由反应控制。从图 7和图 9可注意到,HMDA用量为二酸的50%时,不论溶解控制还是反应控制,所制备的尼龙盐的1H-NMR谱图都与尼龙66盐的相近,表明此时的产物仍是以尼龙66盐为主。这也可以进一步从55℃所得到尼龙盐的TGA曲线得到证实。如图 10所示,加入混合酸50% HMDA到ADA/PTA混合酸中所得的样品的热失重曲线不是介于尼龙66和尼龙6T之间,而是与尼龙66盐的基本重合,表明所得样品大部分为尼龙66盐。可见,HMDA的用量仅能与其中一种二酸完全反应时,成盐反应也主要以HMDA与ADA的反应为主。
|
图 8 55℃下混酸中加入不同含量HMDA的pH变化图 Fig.8 pH variation with different HMDA contents in mixed acid solution at 55℃ |
|
图 9 55℃下不同HMDA添加量得到的样品的1H-NMR Fig.9 1H-NMR of samples with different HMDA contents at 55℃ |
|
图 10 添加HMDA样品和纯尼龙盐的热失重曲线 Fig.10 Thermogravimetric curves of pure nylon salts and samples adding HMDA |
当HMDA加入量增加到75%或100%混合酸时,其用量高于ADA的摩尔量,所制备的尼龙盐的1H-NMR在7.75 ppm处出现了苯环特征峰(如图 7和图 9所示),表明PTA也与HMDA发生了反应。并且,二酸中加入75%的HMDA时,温升的数值几乎等于与ADA完全反应和与50% PTA反应的温升之和,这很有可能说明HMDA与混合二酸反应时,HMDA首先主要与ADA反应生成尼龙66盐,然后再与PTA反应生成尼龙6T盐。为排除共成盐过程中实验量对实验结果可能造成的影响,将ADA和PTA的实验用量增大6倍,在55℃下加入不同量的HMDA与二酸反应。所制备产物的1H-NMR谱图如图 11所示。从图 11可知,HMDA的加入量低于50%时,产物的谱图与纯的尼龙66盐的完全一致,仍看不到苯环的特征峰,表明HMDA的确首先主要与ADA反应生成尼龙66盐。
|
图 11 55℃下不同HMDA添加量得到的样品的1H NMR(6倍实验量) Fig.11 1H NMR of samples with different HMDA contents at 55℃(reactants was scaled up for 6 times) |
综上所述,由于PTA在水中的溶解度和溶解速度远比ADA在水中的低,所以当HMDA加入PTA/ADA悬浊液时,HMDA主要首先和体系中的ADA反应生成尼龙66盐,然后再和PTA反应生成尼龙6T盐。
4 结论ADA和PTA混合二酸与己二胺反应生成尼龙66盐/尼龙6T盐的成盐过程可以通过pH和反应温升变化来反映。
(1) 当温度低于40℃时,ADA与HMDA反应生成尼龙66盐是由己二酸的溶解速率所控制的;当温度高于50℃时,则转变为反应控制;PTA与HMDA的反应在30~60℃内都是由PTA的溶解速率控制。
(2) 当HMDA加入ADA和PTA悬浊液中,尽管PTA的酸性比ADA的强,但是由于PTA在水中的溶解度比ADA低,HMDA首先主要与ADA反应生成尼龙66盐,然后再与PTA反应生成尼龙66盐。
| [1] | QU Lan(瞿兰), ZHANG Mei-lin(张美林), LONG Sheng-ru(龙盛如), et al. Synthesis and properties study of PA6/6T by reaction extrusion(反应性挤出合成PA6/6T及其性能研究)[J]. China Plastic Industry(塑料工业) , 2013, 41(s01): 78-80. |
| [2] | Wang X C, Zheng Q, Du L B, et al. Influence of preparation methods on the structures and properties for the blends between polyamide 6co6T and polyamide 6:melt-mixing and in-situ blending[J]. Journal of Polymer Science:Part B:Polymer Physics , 2008, 46(10): 201-211. |
| [3] | García J M, García F C, Serna F, et al. High-performance aromatic polyamides[J]. Progress in Polymer Science , 2010, 35(5): 623-686. DOI:10.1016/j.progpolymsci.2009.09.002. |
| [4] | GU Hong-bo(谷红波), HE Jin-mei(贺金梅), HU Jun(胡君), et al. Synthesis and characterization of new semi-aromatic polyamide(含苯并噁唑半芳香聚酰胺的合成与表征)[J]. Materials Science & Technology(材料科学与工艺) , 2012, 18(1): 107-110. |
| [5] | Wang W Z, Huang A M, Liu A X, et al. Synthesis and characterization of long chain semiaromatic polyamides based on undecanediamine[J]. Journal of Wuhan University of Technology , 2012, 27(4): 689-693. DOI:10.1007/s11595-012-0530-3. |
| [6] | Novitsky T F, Lange C A, Mathias L J. Eutectic melting behavior of polyamide 10, T-co-6, T and 12, T-co-6, T copolyterephthalamides[J]. Polymer , 2010, 51(11): 2417-2425. DOI:10.1016/j.polymer.2010.03.045. |
| [7] | O'connor I, Hayden H, Coleman J N, et al. High-strength, high-toughness composite fibers by swelling Kevlar in nanotube suspensions[J]. Small , 2009, 5(4): 466-469. DOI:10.1002/smll.v5:4. |
| [8] | Kim Y J, Yohana K E, Lee H, et al. Solid-state polymerization of semiaromatic copolyamides of nylon-4, T and nylon-4, 6:composition ratio effect and thermal properties[J]. Industrial & Engineering Chemistry Research , 2012, 51(49): 15801-15810. |
| [9] | Novitsky T F, Mathias L J, Osborn S, et al. Synthesis and thermal behavior of polyamide 12, T random and block copolymers[J]. Macromolecular Symposia , 2012, 313-314(1): 90-99. DOI:10.1002/masy.v313.1. |
| [10] | PEI Xiao-hui(裴晓辉), ZHAO Qing-xiang(赵清香), LIU Min-ying(刘民英), et al. Synthesis and characterization of two new semi-aromatic polyamides(双苯环长碳链半芳香尼龙的合成与表征)[J]. China Plastic Industry(塑料工业) , 2005, 33(1): 7-18. |
| [11] | ZHANG Hong-rong(张红荣), WEI Yun-fang(魏运方). The properties of high performance semi aromatic nylon engineering plastics and progress in application(高性能半芳香族尼龙工程塑料的性能及应用进展)[J]. Fine Chemical Intermediates(精细化工中间体) , 2002, 32(6): 1-4. |
| [12] | Kricheldorf H R, Zolotukhin M G, Cárdenas J. Non-stoichiometric polycondensations and the synthesis of high molar mass polycondensates[J]. Macromolecular Rapid Communications , 2012, 33(21): 1814-1832. DOI:10.1002/marc.v33.21. |
| [13] | Papaspyrides C D, Vouyiouka S N, Bletsos I V. New process for the production of dry hexamethylenediammonium adipate[J]. Journal of Applied Polymer Science , 2003, 88(5): 1252-1257. DOI:10.1002/(ISSN)1097-4628. |
| [14] | Volokhlna A V, Kudryavtsev G L, Skuratov S M, et al. The polyamidation process in the solid state[J]. Journal of Polymer Science , 1961, 53(158): 289-291. DOI:10.1002/pol.v53.158. |
| [15] | Makoto N K, Mariko M, Mitsuhiro K. Method for producing nylon salt powder, and method for producing nylon:US, 9, 045, 591[P]. 2013-03-21. |
| [16] | Boussia A C, Damianou C C, Vouyiouka S N, et al. Potential in situ preparation of aliphatic polyamide-based nanocomposites:the organoclay-polyamide salt interaction[J]. Journal of Applied Polymer Science , 2010, 116(6): 3291-3302. |
| [17] | WANG Shuang (王双). A study in the synthetic technology and properties of semi-aromatic polyamide PA6T/66 (半芳香聚酰胺PA6T / 66的合成工艺及性能研究) [D]. Zhengzhou (郑州): Zhengzhou University (郑州大学), 2014. http://cdmd.cnki.com.cn/Article/CDMD-10459-1014391058.htm |
| [18] | Porfyris A, Vouyiouka S, PapaspyrideS C, et al. Investigating alternative routes for semi-aromatic polyamaide salt preparation:The case of tetramethylenediammonium terephthalate[J]. Journal of applied polymer science , 2015, 133(13): 1-11. |
| [19] | Grolman E, Rulkens R. Process for preparing a diamine/dicarboxylic acid salt:WO/2013/014236[P]. 2013-01-31. |
| [20] | Studhoime M B, Orpin M R. Process for the preparation of nylon salts:EU, 0, 411, 790A1[P]. 1991-06-02. |
| [21] | GU Liang(顾亮), GU Xing(顾星), ZHANG Hong-xing(张红星), et al. A preparation method of semi-aromatic nylon(半芳香族尼龙的制备方法)[J]. Polyester Industry(聚酯工业) , 2012, 25(4): 23-26. |
| [22] | CHEN Qi-jun(陈琦君). The study on nylon 66 salt pH values(关于尼龙66盐pH值的研究)[J]. China Synthetic Fiber Industry(合成纤维工业) , 1980(5): 15-17. |
| [23] | FU Xian-cai(傅献彩). University chemistry(大学化学)[M].Beijing(北京): Higher Education Press(高等教育出版社), 1999. |
| [24] | Dissociation constant of organic acids/bases in aqueous solution (25℃)(有机酸/碱在水溶液中的解离常数(25℃))[Z/OL]. 2013-06-08[2016-12-30]. http://www.doc88.com/p-8025956343172.html |
| [25] | JIN Hui-yi (金会义). The study on reclaiming and solubility of adipic acid (己二酸回收技术及溶解度研究) [D]. Tianjin (天津): Tianjin University (天津大学), 2004. http://cdmd.cnki.com.cn/Article/CDMD-10056-2006052847.htm |
| [26] | ZHU Liang(朱良), WANG Li-sheng(王利生). Solubility of o-phthalic, m-phthalic and p-phthalic acid in water(邻苯二甲酸、间苯二甲酸和对苯二甲酸在水中的溶解度)[J]. Chemical Industry and Engineering(化学工业与工程) , 1999, 16(4): 236-238. |
| [27] | CHEN Ya-chun(陈亚春), LIU Zhen-jiang(刘镇江), ZHU Zi-qiang(朱子强). Application of recrystallization in adipic acid production(重结晶法在己二酸生产中的应用)[J]. Zhejiang Chemical Industry(浙江化工) , 2004, 35(8): 20-21. |




