2. 云南省高校磷化工重点实验室,云南 昆明 650500
2. The Higher Educational Key Laboratory for Phosphorous Chemical Engineering of Yunnan Province, Kunming University of Science and Technology, Kunming 650500, China
全世界黄磷主要以磷矿石、焦炭和硅石为原料,采用电炉法生产而得,三种原料的主要成分分别为Ca5(PO4)3F、C及SiO2,其中焦炭主要用作还原剂并兼具导体,硅石主要充当助熔剂与磷矿分解物CaO结合成稳定的硅酸盐,并促进磷酸盐的还原反应[1~3]。其反应方程式如式(1):
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 30C + 21Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 20CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ |
电炉法所得的单质磷是制造磷化物及其衍生物不可替代的原料,是食品级、电子级、医药级磷酸的重要原料,同时还是军事工业产品的基本原料[4, 5]。然而,为了方便排渣,电炉法黄磷生产时的操作温度需高于残渣熔点150℃左右,故而吨黄磷电耗在13000~15000 kW·h,属于典型的高能耗产业[6, 7]。因此,开发节能降耗、清洁生产技术是推进电炉法黄磷工业可持续发展的重要途径。
国内外学者对助熔剂进行了大量研究,并获得了不同助熔剂对化学反应的影响机制。Húlan等[8]研究发现钾长石作为助熔剂在黏土加热及冷却过程中有利于玻璃相的生成;段锦等[9]向长平煤中添加单助熔剂CaO、MgO和钙镁复合助熔剂,由于煤灰熔融过程中,Ca2+、Mg2+可引起硅酸盐结构重组生成钙长石、镁橄榄石等低温共熔体,发现助熔剂可将煤灰熔融温度降至1297℃;Wang Y等[10]研究发现熔渣的熔化温度随着NaCl添加量的增加而降低,随着SiO2的增加而升高,但与Al2O3添加量关系则是先升高后降低;孙文娟等[11]采用ADF和ADC做煤炭熔融的助熔剂,结果表明,助熔剂在不同的温度下,容易与煤炭中其它矿物质形成赤铁矿、铁尖晶石和钙长石等助熔矿物,从而降低煤炭熔融温度。但针对电炉法黄磷生产的助熔剂,仅刘河云[12]为了提高磷炉渣活性,用铝土矿替代硅石用于电炉造渣,证明铝土矿可有效提高磷渣活性,且对电炉生产操作和产品能耗无明显影响。
钾长石中主要以SiO2为主,其次是Al2O3且伴有含量不等的碱金属,可与氧化钙形成熔点更低的共熔物,具有一定的助熔效果[13, 14]。因此,在同等酸度值下,本文使用钾长石作为助熔剂与传统硅石进行比较,研究磷矿石磷转化率与助熔剂关系及其过程机理,以期为钾长石用于电炉法黄磷生产提供理论依据。
2 实验 2.1 原料与方法实验原料磷矿、钾长石、硅石、焦炭均取自云南相关企业,经XRD分析,磷矿石主要矿物相为氟磷灰石Ca5(PO4)3F、钾长石为KAlSi3O8、硅石为α-SiO2;各原料的成分分析结果见表 1及表 2。
| 表 1 原料化学成分 Table 1 Table 1 Chemical composition of raw materials / %(wt) |
| 表 2 焦炭工业分析 Table 2 Industry analysis of coke / % |
将磷矿、焦炭分别与助熔剂按实验设计称量后混合均匀,称取一定量的混合物置于石墨坩埚中,放入预先通氩气并达到预定温度的高温管式炉恒温区,达到反应时间后取出并置于干燥器中冷却至室温,取出残渣称重后研磨过180目筛,筛余量<5%,作为分析表征原料。
2.3 样品分析磷的含量采用GB / T 1871-80进行分析,磷的转化率计算公式如式(2):
| $ X = \frac{{M-{M_1}}}{M} \times 100\% $ | (2) |
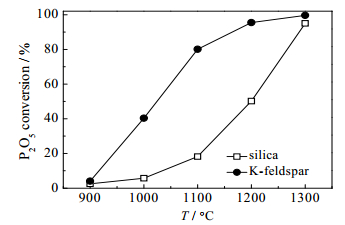
固定反应时间为40 min,在温度900℃~1300℃考察不同助熔剂对磷转化率的影响,结果如图 1所示。从图 1中可以看出,随着温度的升高,磷的转化率逐渐增大,在相同条件下,钾长石助熔时磷的转化率均高于硅石。900~1100℃钾长石助熔时磷的转化率迅速激增,而硅石在1100℃时,磷的转化率仅为18.22%。以实际生产控制指标渣磷率0.8%~1.0%,磷转化率>95%为标准[15],钾长石助熔在1200℃可满足要求,而硅石则需1300 ℃。
|
图 1 温度对磷转化率的影响 Fig.1 Effects of temperature on P2O5 conversion |
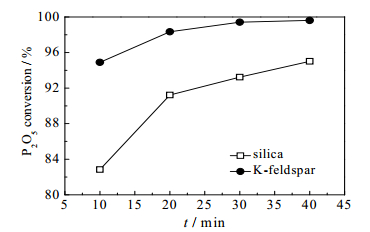
在酸度值、焦炭过剩系数不变的情况下,设定反应温度为1300℃,通过钾长石与硅石体系实验对比,考察不同助剂下反应时间与磷转化率的关系,结果如图 2所示。从图 2可知,钾长石助熔时,反应时间在10 min以上时,磷转化率即可达95%以上,而硅石助熔时则约需40 min,由此可知,钾长石对磷矿碳热反应有类似“催化”效果,可大大提高反应速率,缩短反应时间,从而实现节能降耗。
|
图 2 时间对磷转化率的影响 Fig.2 Effects of time on P2O5 conversion |
吉布斯自由能的变化是化学反应能否发生的第一判据,只有当反应的ΔG<0时,此反应才能发生。磷矿石中磷以Ca5(PO4)3F形式存在,磷矿碳热还原反应制磷过程其实就是Ca5(PO4)3F的高温碳热还原过程。式(3)~式(10)是不同助熔剂时磷矿碳热还原最可能发生的反应形式[16, 17]。反应式中的焦炭为C(A),即无定型碳。为了探究不同助熔剂下磷矿碳热还原反应过程的可能性,本文采用HSC Chemistry 5.0软件计算了各反应的吉布斯自由能变(ΔG)随温度(T)的变化关系,结果如图 3、4所示。
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 30C}}\left( {\rm{A}} \right){\rm{ + 21Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 20CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (3) |
| $ {\rm{24C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 180C}}\left( {\rm{A}} \right){\rm{ + 46Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 36}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 40C}}{{\rm{a}}_{\rm{3}}}{\rm{Si}}{{\rm{O}}_{\rm{5}}}{\rm{ + 6Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 180CO}}\left( {\rm{g}} \right) $ | (4) |
| $ {\rm{12C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 90C}}\left( {\rm{A}} \right){\rm{ + 43Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 18}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 20C}}{{\rm{a}}_{\rm{3}}}{\rm{S}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{\rm{7}}}{\rm{ + 3Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 90CO}}\left( {\rm{g}} \right) $ | (5) |
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 7KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 30C}}\left( {\rm{A}} \right){\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 3}}{\rm{.5CaA}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{6}}}\\{\rm{ + 16}}{\rm{.5CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 3}}{\rm{.5}}{{\rm{K}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (6) |
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 8}}{\rm{.4KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 30C}}\left( {\rm{A}} \right){\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 4}}{\rm{.2CaA}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{2}}}\\{{\rm{O}}_{\rm{8}}}{\rm{ + 15}}{\rm{.8CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 4}}{\rm{.2}}{{\rm{K}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (7) |
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 6KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 30C}}\left( {\rm{A}} \right){\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 3C}}{{\rm{a}}_{\rm{2}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}\\{{\rm{O}}_{\rm{7}}}{\rm{ + 14CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 3}}{{\rm{K}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (8) |
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 7KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 30C}}\left( {\rm{A}} \right){\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 3}}{\rm{.5C}}{{\rm{a}}_{\rm{3}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}\\{\rm{S}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{{\rm{12}}}}{\rm{ + 9}}{\rm{.5CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 3}}{\rm{.5}}{{\rm{K}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (9) |
| $ {\rm{4C}}{{\rm{a}}_{\rm{5}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{3}}}{\rm{F + 6KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 30C}}\left( {\rm{A}} \right){\rm{ = 6}}{{\rm{P}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 3CaA}}{{\rm{l}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{ + 17CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}\\{{\rm{F}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ + 3}}{{\rm{K}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right){\rm{ + 30CO}}\left( {\rm{g}} \right) $ | (10) |
|
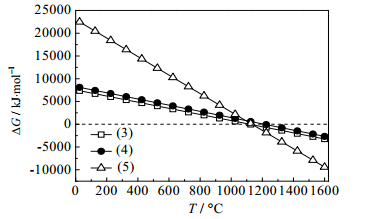
图 3 式(3)~式(5)吉布斯自由能与温度的关系图 Fig.3 Profiles of ΔG-T from chemical reaction equations (3)~(5) |
|
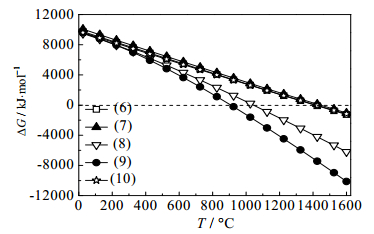
图 4 式(6)~式(10)吉布斯自由能与温度的关系图 Fig.4 Profiles of ΔG-T from chemical reaction equations (6)~(10) |
由图 3可知,式(3)~式(5)ΔG=0的温度分别为1120、1210、1132℃,但该体系最可能的反应方式为式(3)。由图 4可知,随温度的升高,钾长石作为助熔剂时式(9)在温度905℃时ΔG等于零,说明此反应在温度高于905℃可发生。由此可知,Ca5(PO4)3F用KAlSi3O8和SiO2作助熔剂相比,碳热还原反应起始温度可降低215℃,节能降耗效果明显。
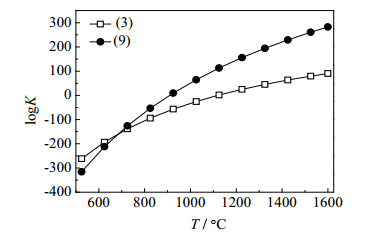
图 5为Ca5(PO4)3F碳热还原反应以SiO2和KAlSi3O8作助熔剂时式(3)与式(9)反应平衡常数的对数值logK与温度T的变化趋势图。从图 5可知,钾长石助熔下logK-T斜率为0.51,而硅石助熔下logK-T斜率为0.26,由此可知,当反应时间相同时提高相同温度,钾长石助熔时磷的转化率高于硅石助熔。
|
图 5 式(3)与式(9)平衡常数对数值与温度的关系图 Fig.5 Profiles of logK-T from chemical reaction equations (3) and (9) |
实际生产中酸度值即酸性物质与碱性物质的质量比[(SiO2+Al2O3)/(CaO+MgO)],一般控制在0.85~0.95,焦炭的过剩系数为1.05~1.10[18],为了探明助熔剂对磷矿石碳热反应过程的影响,拟固定酸度值为0.85、碳过剩系数为1.05,研究传统硅石和钾长石助熔下磷矿石碳热还原的动力学。在氩气保护下,采用TGA-STA449F3型同步热分析仪对不同助熔剂下的磷矿碳热还原反应进行热重分析。取样8 mg左右置于托盘内,以5 K·min-1的升温速率升温到1400℃保温20 min,自动记录热解过程的质量变化,获得样品的连续热重(TG)记录曲线和微分失重热解(DTG)曲线。
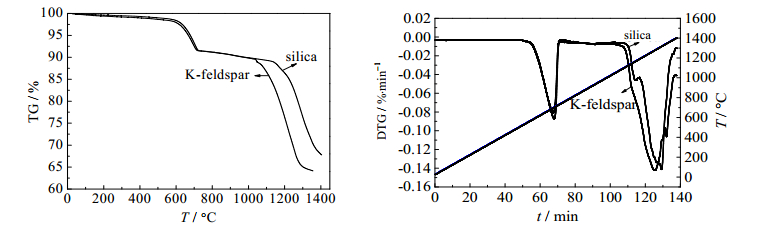
图 6为升温速率5 K·min-1下硅石、钾长石分别作为助熔剂时的失重TG和微分失重DTG曲线。从图中看出,550~700℃有明显失重,应为原料中的结合水和碳酸盐分解所致;钾长石助熔时起始反应温度约为1020℃,结束温度约为1350℃,而硅石助熔时,起始反应温度接近为1170℃,结束温度则超过1400℃。与热力学分析相比,结果存在一定差异,应为实际物料中存在掺杂物的影响所致。
|
图 6 磷矿-焦炭-硅石体系与磷矿-焦炭-钾长石体系的TG、DTG曲线 Fig.6 TG DTG curves of phosphate rock-coke-silica and phosphate rock-coke-K-feldspar systems |
利用热重(TGA)分析方法,采用动态法研究不同助熔剂下磷矿碳热反应动力学,定义磷矿还原的转化率为X,则
| $ X = \frac{{{m_0}-{m_{\rm{t}}}}}{{{m_0}-{m_\infty }}} $ | (11) |
根据Arrhenius公式,采用Coats-Redfern法处理积分动力学公式,得到
| $ \ln \frac{{g(x)}}{{{T^2}}} = \ln \frac{{AR}}{{\alpha {E_a}}}-\frac{{{E_a}}}{{RT}} $ | (12) |
可以看出,式(12)是一个自变量为1/T,因变量为ln[g(x)/T2]的一次线性关系式。固-固反应常用的反应机理函数有20种[19],将不同的模型函数代入式(12)进行计算机拟合,并进行优化遴选,选取相关系数接近于1且活化能较低的函数作为该反应的机理模型[20]。反应动力学参数计算见表 3。由表 3可知,拟合度均达到99%以上,计算结果可以较好地描述磷矿的碳热还原过程。两种助熔剂下均符合反应级数为1/2的球形相界面反应模型,钾长石助熔时最大反应温度降低,反应时间缩短,失重率增大,结果与热力学分析一致。同时还发现钾长石体系活化能小于硅石体系,说明钾长石助熔时相同转化率下的反应温度低于硅石助熔。
| 表 3 磷矿-焦炭-硅石体系与磷矿-焦炭-钾长石体系的动力学参数 Table 3 Kinetic parameters of phosphate rock-coke-silica and phosphate rock-coke-K-feldspar system |
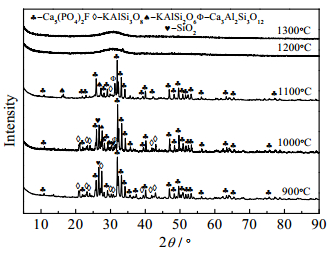
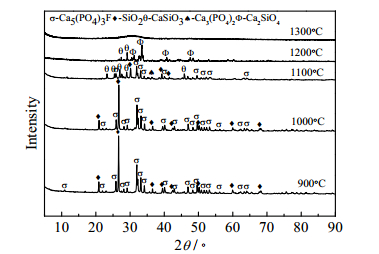
在扫描电压为36 kV,电流为40 mV,扫描步长为2 °·min-1时,利用D / max-3B型X射线衍射仪对渣样进行测定。对图 1实验残渣进行XRD分析,结果如图 7、图 8所示。
|
图 7 不同温度下磷矿-焦炭-硅石体系渣的XRD图谱 Fig.7 XRD patterns of phosphate rock-coke-silica system slag at different temperatures |
|
图 8 不同温度下磷矿-焦炭-钾长石体系渣的XRD图谱 Fig.8 XRD patterns of phosphate rock-coke-K-feldspar system slag at different temperatures |
由图 7可知,900℃和1000℃时,磷矿-焦炭-硅石体系的渣中主要物质还是Ca5(PO4)3F和SiO2,此时反应还没有发生;当温度升至1100℃时,Ca5(PO4)3F的衍射峰强度减弱,出现了较强的CaSiO3特征峰和少量的Ca3(PO4)2特征峰,说明磷矿中Ca5(PO4)3F发生了脱氟反应,同时检测到有Ca3(PO4)2特征峰存在,一方面说明Ca3(PO4)2碳热还原反应不彻底,生成物CaO量少,另一方面,此时体系中SiO2过量,CaO随即与SiO2反应生成CaSiO3,这就是其XRD图谱中无CaO特征峰的原因;随着温度的升高至1200℃时,Ca5(PO4)3F脱氟和Ca3(PO4)2碳热还原反应速率增加,Ca5(PO4)3F和Ca3(PO4)2特征峰均消失,此时体系CaO出现富余,与CaSiO3进一步生成Ca2SiO4,XRD图谱中CaSiO3特征峰减弱而Ca2SiO4特征峰增强,同时可观察到XRD峰中有少量的“鼓包”,说明体系中形成了少量的CaO-SiO2为主的低共熔物,即体系出现液相,这也是导致此温度矿物特征峰较1100℃及以下温度弱的主要原因;随着温度升高至1300℃时,XRD“鼓包”更明显,特征峰全部消失,此时体系反应残渣中所有的CaO-SiO2全部形成低共熔物,反应残渣为玻璃态熔融体。
上述分析可知,硅石助熔时,当温度超过1000℃时,首先发生脱氟反应,至1100℃时脱氟反应速率加快,同时伴有Ca3(PO4)2的还原反应生成CaSiO3,脱氟反应首先完成,磷转化率受Ca3(PO4)2还原反应速率控制,同时CaSiO3与Ca3(PO4)2分还原产物CaO继续反应生成Ca2SiO4,在1200℃时掺杂物与少量CaO、SiO2形成低共熔物,特征峰中出现“鼓包”,但残渣中仍以CaSiO3、Ca2SiO4为主并有少量Ca3(PO4)2,随着温度进一步升高,Ca3(PO4)2消失,残渣在1300℃形成玻璃相,特征峰消失,由此可知,硅石助熔时,磷矿石炭热反应按式(3)进行,与热力学分析一致,反应历程如下:
| $ \begin{array}{*{20}{l}} {{\rm{C}}{{\rm{a}}_{\rm{5}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{3}}}{\rm{F + Si}}{{\rm{O}}_{\rm{2}}} \to {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}{\rm{ + CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}}\\ {\;\;\;\;\;\;\;\;{\rm{C}}{{\rm{a}}_{\rm{3}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}{\rm{ + C}} \to {\rm{CaO + C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{P}}_{\rm{2}}}\left( {{\rm{控制步骤}}} \right)}\\ {\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + CaO}} \to {\rm{C}}{{\rm{a}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{4}}}} \end{array} $ |
由图 8可知,900℃时体系特征峰为反应原料中的物相即Ca5(PO4)3F、KAlSi3O8和SiO2,此时磷矿石、钾长石和焦炭独立存在,未发生反应,但温度升至1000℃时,KAlSi3O8首先发生分解反应生成白榴石(KAlSi2O6)并释放出SiO2,分解的SiO2反应活性好,随即与Ca5(PO4)3F发生脱氟反应,但由于分解物SiO2量少,故而脱氟产物Ca3(PO4)2量亦少,新生成的CaO与钾长石分解物KAlSi2O6反应活性均较高,进一步反应生成Ca3Al2Si3O12和CaSiO3,而CaSiO3与原料中杂质碱金属盐生成玻璃体低共熔物,这就是此温度下XRD图中出现“鼓包”和未出现碱金属硅酸盐、CaSiO3特征峰的原因,亦是此温度下特征峰以Ca5(PO4)3F、KAlSi3O8为主,并伴有少量KAlSi2O6、Ca3Al2Si3O12特征峰的结果,同时还发现有明显的SiO2特征峰存在,说明原料中带入的SiO2反应活性差,此温度下不参与反应;随着温度升高至1100℃时,特征峰Ca3Al2Si3O12进一步增强,同时“鼓包”现象亦更明显,Ca5(PO4)3F特征峰强度减弱,磷矿中杂质SiO2熔入液相而消失;当温度至1200℃时,液相大量产生,增大了Ca5(PO4)3F脱氟和还原反应速率,反应基本结束,并形成以CaO-Al2O3-SiO2-Na2O-K2O多元相组成的低共熔物,所有矿物特征峰消失;温度继续升高至1300℃,反应残渣因温度升高而黏度降低,流动性变好。
上述分析可知,钾长石助熔时,当温度超过900℃时,KAlSi3O8首先发生分解生成白榴石(KAlSi2O6)并释放出SiO2,新生成的SiO2活性好,可在较低温度下与Ca5(PO4)3F发生脱氟反应生成Ca3(PO4)2,Ca3(PO4)2因碳热还原反应而消失,中间产物CaO、KAlSi2O6反应活性均较高,随即反应生成Ca3Al2Si3O12、CaSiO3,并与钾长石中的碱金属盐及掺杂物一起在约1000℃形成低共熔物,加快了反应物之间的传递,增加了磷矿还原反应速率,磷矿的碳热反应在1200℃内即可完成。通过上述分析并结合XRD图谱,以钾长石助熔时,在较低温度下形成液相,是钾长石助熔效果较硅石好的主要因素,其总反应按式(9)进行,与热力学分析一致,反应历程如下:
| $ \begin{array}{*{20}{l}} {\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}} \to {\rm{Si}}{{\rm{O}}_{\rm{2}}}{\rm{ + KAlS}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{\rm{6}}}}\\ {{\rm{C}}{{\rm{a}}_{\rm{5}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{3}}}{\rm{F + Si}}{{\rm{O}}_{\rm{2}}} \to {\rm{C}}{{\rm{a}}_{\rm{3}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}{\rm{ + CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + Si}}{{\rm{F}}_{\rm{4}}}\left( {{\rm{控制步骤}}} \right)}\\ {\;\;\;\;\;\;\;\;\;\;\;{\rm{C}}{{\rm{a}}_{\rm{3}}}{{\left( {{\rm{P}}{{\rm{O}}_{\rm{4}}}} \right)}_{\rm{2}}}{\rm{ + 11C}} \to {\rm{3CaO + 11CO + }}{{\rm{P}}_{\rm{2}}}}\\ {\;\;\;\;\;{\rm{2KAlS}}{{\rm{i}}_{\rm{2}}}{{\rm{O}}_{\rm{6}}}{\rm{ + 5CaO}} \to {\rm{3CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{K}}_{\rm{2}}}{\rm{O + C}}{{\rm{a}}_{\rm{3}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{S}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{{\rm{12}}}}} \end{array} $ |
在热力学分析的基础上,结合动力学及残渣XRD分析,得出以下结论:
(1) 固定酸度值为0.85,焦炭过剩系数为1.05,在相同温度、时间下,钾长石作助熔时磷的转化率明显高于硅石,即钾长石有利于促进磷矿碳热还原反应的进行。
(2) 热力学分析表明,钾长石替代硅石作为助熔剂时,可使磷矿石的反应温度降低215℃,实际体系研究亦表明,钾长石替换硅石后可降低反应温度100℃以上;同等酸度值下,通过动力学研究,硅石助熔时的反应活化能为23.89 kJ·mol-1,钾长石助熔时的活化能为20.69 kJ·mol-1。
(3) 两种助熔剂反应残渣XRD分析表明:不论是何种助熔剂,首先是磷矿脱氟,继而是磷酸钙碳热还原反应。钾长石助熔效果优于硅石的主要原因是:钾长石分解释放SiO2反应活性高,Ca5(PO4)3F可在较低温度下发生脱氟反应,同时因有碱金属参与造渣,可在较低温度下形成液相,促进主反应的进行。
符号说明:
| [1] | Wang Z H, Jiang M, Ning P. Thermodynamic modeling and gaseous pollution prediction of the yellow phosphorus production[J]. Industrial & Engineering Chemistry Research , 2011, 50(21): 12194-12202. |
| [2] | LI Xi(李茜), HU Biao(胡彪), WU Yuan-xin(吴元欣), et al. Reaction kinetics of phosphate ore with carbon by smelting reduction technology(固态碳熔融还原磷矿反应动力学)[J]. Chemical Engineering(化学工程) , 2013, 41(4): 53-56. |
| [3] | ZHONG Ben-he(钟本和), CHEN Liang(陈亮), LI Jun(李军), et al. New progress in purification of wet-process phosphoric acid by solvent extraction(溶剂萃取法净化湿法磷酸的新进展)[J]. Chemical Industry and Engineering Progress(化工进展) , 2005, 24(6): 592-602. |
| [4] | Wang X J, Tang L, Jiang Z. Numerical simulation of Venturi ejector reactor in yellow phosphorus purification system[J]. Nuclear Engineering & Design , 2014, 268(3): 18-23. |
| [5] | Ma L P, Ning P, Zang Y Y. Experimental and modeling of fixed-bed reactor for yellow phosphorous tail gas purification over impregnated activated carbon[J]. Chemical Engineering Journal , 2008, 137(3): 471-479. DOI:10.1016/j.cej.2007.04.032. |
| [6] | TANG An-jiang(唐安江), JIANG Dong-hai(蒋东海), CHEN Hong-jin(陈红锦), et al. Numerical simulation of phosphorus furnace(黄磷电炉数值模拟)[J]. Phosphate & Compound Fertilizer(磷肥与复肥) , 2011, 26(6): 42-45. |
| [7] | Geng R X, Xia J P, Chen Z J. Effects of potassium feldspar on slagging and fluxing in phosphorus produced via electric furnace[J]. Phosphorus, Sulfur and Silicon Related Elements , 2017, 192(4): 475-480. DOI:10.1080/10426507.2016.1259233. |
| [8] | Tomáš H, Tiit K, Igor Š. Investigation of elastic and inelastic properties of Estonian clay from a locality in Kunda during thermal treatment[J]. Journal of Thermal Analysis & Calorimetry , 2016, 363(3): 1-7. |
| [9] | DUAN Jin(段锦), LI Han-xu(李寒旭), HAO Hua-dong(郝华东), et al. Effect of calcium and magnesium compound flux on Changping coal ash fusibility(钙镁复合助熔剂对长平煤灰熔融特性影响研究)[J]. Bulletin of the Chinese Ceramic Society(硅酸盐通报) , 2016, 35(12): 3936-3941. |
| [10] | Wang Y G, Zhao Q X, Ma H D. Experimental on ash fusion characteristics of Zhundong coal[J]. Journal of Chinese Society of Power Engineering , 2013, 33(11): 841-846. |
| [11] | SUN Wen-juan(孙文娟), LIANG Guo-zhi(梁国治). Effect of fluxes on the ash behavior of coal(助熔剂对煤灰熔融过程矿物行为的影响)[J]. Coal Conversion(煤炭转化) , 2012, 35(2): 31-35. |
| [12] | LIU He-yun(刘河云). With bauxite instead of silica production of phosphorus, improve the activity of phosphorus slag(用铝矾土替代硅石生产黄磷, 提高制磷炉渣活性)[J]. Phosphate & Compound Fertilizer(磷肥与复肥) , 2013, 28(3): 65, 72. |
| [13] | Gan Z X, Cui Z, Yue H R. An efficient methodology for utilization of K-feldspar and phosphogypsum with reduced energy consumption and CO2 emissions[J]. Chinese Journal of Chemical Engineering , 2016, 24(11): 1-11. |
| [14] | Gao J, Wen G, Huang T. Effect of slag-steel reaction on the structure and viscosity of CaO-SiO2 based mold fluxing during high Al steel casting[J]. Journal of Non Crystalline Solids , 2016, 452: 130-135. DOI:10.1016/j.jnoncrysol.2016.08.027. |
| [15] | Phosphate Fertilizer Plant of Nanjing Industry Company (南京化学工业公司磷肥厂). Yellow phosphorus production by electric furnace method(电炉法生产黄磷)[M].Beijing(北京): Chemical Industry Press(化学工业出版), 1978. |
| [16] | QIU Li-you(邱礼有), LIANG Bin(梁斌), JIANG Li-ke(江礼科). Investigation of the solid state reduction of fluxorapatite(氟磷灰石固态还原过程的实验研究)[J]. Journal of Chemical Industry and Engineering(化工学报) , 1996, 47(1): 65-71. |
| [17] | LI Xi(李茜), HU Biao(胡彪), WU Yuan-xin(吴元欣), et al. Process parameters and kinetics of smelting reduction technology for low-grade phosphate ore reduction(熔融法还原中低品位磷矿的工艺及动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(4): 905-910. |
| [18] | QIN Yang-song(覃扬颂), WANG Chong-hua(王重华), HUANG Xiao-feng(黄小凤), et al. Utilization of melting yellow phosphor furnace slag(熔融态黄磷炉渣的综合利用现状)[J]. Chemical Industry and Engineering Progress(化工进展) , 2012, 31(10): 2319-2323. |
| [19] | Vyazovkin S, Wight C A. Isothermal and non-isothermal kinetics of thermally stimulated reaction solids[J]. Internation Reviews in Physical Chemistry , 1998, 17(3): 407-433. DOI:10.1080/014423598230108. |
| [20] | YAO Mei-qin(姚梅琴), YU Jian(于剑), GUO Feng(郭凤), et al. Non-isotherm kinetics of iron oxide reduction by graphite(氧化铁石墨固相还原非等温反应动力学)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2013, 64(6): 2071-2079. |




