2. 氟氮化工资源高效开发与利用国家重点实验室, 陕西 西安 710065;
3. 中国兵器工业标准化研究所, 北京 100089
2. State Key Laboratory of Fluorine & Nitrogen Chemicals, Xi'an 710065, China;
3. China Ordance Industrial Standardization Research Institute, Beijing 100089, China
在三唑分子结构中,较多的氮氢元素使得分子内及分子间易形成氢键,氮原子的孤对电子参与共轭也使得整个分子的方向性增加,而且三唑环的键长和键角进一步平均化,环张力相对较小[1-6]。因此,基于三唑分子具有结构稳定、氮含量高、易于修饰、制备方便等优点,在药物合成、农药、气体发生剂和含能材料等民用和军事领域均具有广泛应用价值。现有多数杀菌剂、植物调节剂、抗过敏药、糖苷酶抑制剂及安全气囊的气体发生剂均含有三唑基团[7-11]。
将氨基引入三唑环分子中,不仅能提高氮含量和稳定性,还可以增加反应位点,利于衍生化。因此,氨基三唑类化合物是三唑化合物中的重要研究方向[12-15]。其中,3, 5-二氨基-1, 2, 4-1H-三唑是一种重要的精细化工中间体,广泛用于医药、农药和消毒剂等领域;而5-氨基-3-硝基-1, 2, 4-1H-三唑是一种综合性能优异的高能低感炸药,可用作不敏感弹药的候选组分。氰基取代三唑环上的氢后,氰基可通过水解、环合等反应实现不同官能团的转化[16-22]。因此,氨基氰基三唑在医药中间体和光学材料等领域有广泛应用[12-19]。
3-氰基-5-氨基-1, 2, 4-1H-三唑(ATCN)具有化学位点丰富、易于衍生化等优点,国外利用此化合物合成了3-(1H-四唑-5-基)-5-硝胺基-1H-1, 2, 3-三唑、3-(1H-四唑-5-基)-5-硝基-1H-1, 2, 3-三唑和3-(1H-四唑-5-基)-5-叠氮基-1H-1, 2, 3-三唑等功能性材料,在药物合成、气体发生剂和含能材料领域有着广阔的应用前景[23-28]。Kukuljan等[28]报道了3-甲酰胺基-5-氨基-1, 2, 4-1H-三唑在五氧化二磷/乙腈体系中室温反应制备ATCN的方法,收率仅为37.0%,较低的收率在一定程度上制约了该化合物的推广应用。因此,为解决ATCN合成收率低的问题,发现五氧化二磷作为脱水剂时,反应过程中产生黏稠的偏磷酸、焦磷酸等副产物[29];随着反应的进行,副产物的产生导致反应体系逐渐变黏,搅拌困难,不利于体系传质传热,使得反应不充分、收率较低。通过分析发现,高温体系下副产物偏磷酸、焦磷酸的黏度会变小,在溶剂中更易分散,可强化传质传热过程,将有利于ATCN合成反应的顺利进行,并有望大幅提高ATCN的收率。因此,本文以氨基胍碳酸盐和乙二酸为原料,通过缩合、环化、酯化、氨化和氧化等反应获得目标化合物ATCN,采用核磁共振(NMR)、红外吸收(IR)和元素分析等综合手段进行结构表征,并从反应体系、反应温度及反应时间等方面对制约ATCN合成的氧化反应进行工艺优化。同时,利用差示扫描量热法(DSC)和原位红外技术研究了ATCN的热性能和热裂解特性,获得了热分析动力学参数,为ATCN制备工艺放大、使用和衍生化反应的安全控制提供支撑。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料氨基胍碳酸盐,分析纯,山东西亚化学工业有限公司;乙二酸、亚硝酸钠、氢氧化钠,分析纯,上海阿拉丁生化科技股份有限公司;氨水、硫酸、乙醇、乙腈,分析纯,西陇化工股份有限公司。
2.1.2 仪器AV 500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司;NEXUS 870型傅里叶变换红外光谱仪,美国Thermo-Fisher公司;LC-2010A型高效液相色谱仪,日本岛津公司;VARIO-EL-3型元素分析仪,德国EXEMENTAR公司;DSC 204型差示扫描量热仪,德国NETZSCH公司。
2.2 合成路线以氨基胍碳酸盐为原料,通过其与乙二酸的缩合、环合反应制得3-羧基-5-氨基-1, 2, 4-1H-三唑(ATCOH),然后经酰化、酯化反应制得5-氨基-1, 2, 4-1H-三唑-甲酸乙酯(ATCOE),再经氨化反应得到3-甲酰胺基-5-氨基-1, 2, 4-1H-三唑(ATCOA),最后经五氧化二磷/甲苯体系的氧化反应制得目标化合物3-氰基-5-氨基-1, 2, 4-1H-三唑(ATCN),合成路线如图 1所示。
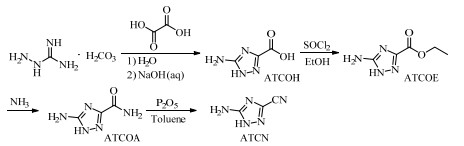
|
图 1 ATCN的合成路线 Fig.1 Synthetic route of ATCN |
将草酸(10 g,0.11 mol)和50 mL水加入250 mL四口烧瓶中,加热至50 ℃使草酸充分溶解,然后在强力搅拌下,分批加入氨基胍碳酸盐(9.45 g,0.07 mol),之后将反应混合物加热至回流,维持反应5 h。反应结束后,待反应液降至室温,向其中加入25 mL浓度为5 mol·L -1的氢氧化钠溶液,充分搅拌反应,混合物变为澄清溶液,再加热回流2 h降至室温后,用浓盐酸调节pH值至3。最后,将析出的白色沉淀过滤,并用大量水洗涤,晾干后得到白色粉末(7.1 g,收率79.8%)。1H NMR (DMSO-d6, 500 MHz) 化学位移δ:11.75 (s, 1H), 7.47 (s, 1H), 6.07~5.75 (s, 2H)。13C NMR (DMSO-d6, 125 MHz) δ:161.92, 158.37, 147.97。IR (KBr, cm-1):3 344~ 3 030(波数νNH), 2 792~2 588 (νCH), 1 685 (νC=N), 1 558~1 500 (δNH), 1 369~1 242 (δC–N)。
2.3.2 ATCOE的合成将ATCOH(60.0 g, 0.195 mol)和500 mL无水乙醇加入1 000 mL烧瓶中,开启搅拌,在冰水浴下降温至0~5 ℃后,将氯化亚砜(72 mL, 0.258 mol)置于恒压滴液漏斗中逐滴滴入反应瓶,滴加过程控制温度不超过10 ℃,滴加完毕后撤去冰水浴,室温下维持搅拌20 min。之后,开启加热,逐步升温至回流,然后维持反应10 h。然后,待反应液降至室温后,减压蒸除过量的氯化亚砜和乙醇溶剂,得到无色或浅黄色黏稠液体;最后,关闭加热,撤去油浴,待反应混合物降温至40 ℃以下后,向反应瓶中加入480 mL饱和乙酸钠水溶液,有大量白色固体析出。加毕,室温下维持搅拌1 h,然后减压抽滤,滤饼用水(4×50 mL)充分洗涤,得到白色固体(60.2 g,收率82.3%)。1H NMR (DMSO-d6, 500 MHz) δ:12.64 (s, 1H, NH), 6.26 (s, 2H, NH2), 4.25 (q, 2H, CH2), 1.27 (t, 3H, CH3)。13C NMR (DMSO-d6, 125 MHz) δ:159.72, 156.78, 151.21, 59.74, 13.52。IR (KBr, cm-1):3451 (νNH), 3 145, 2 981, 2 915, 1 724, 1 639 (νC=N), 1 508, 1 467, 1 392, 1 357 (δC–N), 1 234, 1 124, 1 030, 731。C5H8N4O2元素分析, %:理论值:C 38.46, H 5.16, N 35.88; 实测值:C 38.27, H 5.41, N 35.31。
2.3.3 ATCOA的合成将2.3.2节制得的60.2 g ATCOE和300 mL浓氨水加入500 mL烧瓶中,开启搅拌,室温下维持搅拌20 min后开启加热,逐步升温至70 ℃,在该温度下反应8 h,反应液由白色悬浊液变为近无色澄清溶液,后又变为白色悬浊液。之后,关闭加热,待反应液降至室温后,用冰乙酸调节体系pH值至4,维持搅拌45 min后减压过滤,滤饼用水(4×50 mL)充分洗涤,晾干后得到白色固体(42.0 g,收率85.7%)。1H NMR (DMSO-d6, 500 MHz) δ:12.55 (s, 1H), 7.43-7.40 (d, 2H), 6.07 (s, 2H)。13C NMR (DMSO-d6, 125 MHz) δ:161.78, 158.21, 154.18。IR (KBr, cm-1):3 346~3 143 (νNH), 2 931, 2 767 (νC–H), 1 647 (νC=N), 1 573~1 485 (δN–H), 1 413~1 299 (δC–N)。C3H5N5O元素分析, %:理论值:C 28.35, H 3.97, N 55.10; 实测值:C 28.13, H 4.04, N 54.77。
2.3.4 ATCN的合成将ATCOA(5 g, 0.039 mol)、P2O5(33.5 g, 0.236 mol)和200 mL甲苯加入500 mL四口烧瓶中,然后升温至110 ℃,维持搅拌8 h。其后将溶剂减压蒸除,向反应瓶中加入100 mL水使残余物充分溶解,再用乙酸乙酯(4×50 mL)萃取,合并有机相,经干燥、过滤、浓缩得浅黄色固体(3.5 g,收率81.6%)。熔点:156.0~157.5 ℃。1H NMR (DMSO-d6, 500 MHz) δ:13.12 (s, 1H, NH), 6.64 (s, 2H, NH2)。13C NMR (DMSO-d6, 125 MHz) δ:158.03, 136.10, 114.26。IR (KBr, cm-1):3 436, 3 292 (νNH), 3 163, 2 262, 1 747, 1 644 (νC=N), 1 590 (δN–H), 1 564, 1 490, 1 365 (δC–N), 1 309, 1 129, 1 053, 1 018, 732。C3H3N5元素分析, %:理论值:C 33.03, H 2.77, N 64.20; 实测值:C 33.05, H 3.11, N 64.28。
3 实验结果与讨论 3.1 ATCN的合成工艺优化 3.1.1 反应体系的选择除五氧化二磷(P2O5)之外,还考察了氯化亚砜(SOCl2)和三氯氧磷(POCl3)等常用脱水剂对ATCN合成的适用性,具体结果如下:
以SOCl2为脱水剂,无论有无N, N-二甲基甲酰胺(DMF)、吡啶和三乙胺等有机缚酸剂,在常温及加热条件下,于4 h内薄层色谱均未观察到新点生成,这可能是由于SOCl2对原料ATCOA的脱水作用太弱。而以POCl3为脱水剂,常温条件下通过薄层色谱于4 h内可观察到新点生成,而加热能够加快反应进程,但是加热时间过长会有副产物生成,而且POCl3存放时间过长,使用前需蒸馏精制,否则会产生副反应给后续分离带来困难。
以P2O5为脱水剂,分别考察了以甲苯和乙腈作为分散溶剂的脱水体系。结果发现,以P2O5为脱水剂进行ATCN的合成,反应过程较为温和,通过改变反应温度和反应时间易于控制反应进程,并且较高的反应温度更有利于促进反应进程。此外,若溶剂中残余水分干燥不彻底,那么P2O5会因残余水分会变得黏稠,导致P2O5与原料ATCOA相互包覆,使得反应不充分。由于甲苯的沸点(110.6 ℃)高于乙腈的沸点(81.1 ℃),并且甲苯比乙腈更易干燥除水。综合考虑,ATCN的合成优选P2O5/甲苯体系。
3.1.2 反应温度对收率的影响选择P2O5/甲苯体系,ATCOA和P2O5的摩尔比为1:6,反应时间为8 h,考察了反应温度对ATCN收率的影响,具体结果见表 1。
|
|
表 1 反应温度对ATCN收率的影响 Table 1 Effects of reaction temperature on ATCN yields |
由表 1可知,70 ℃下ATCN的收率即为55.2%,高于文献[28]报道的收率37.0%。而随着反应温度升高,反应收率也随之进一步提高,比如反应温度为80、90、100和110 ℃的反应收率分别为62.7%、73.4%、77.1%和81.6%。反应收率随着反应温度升高而升高,这可归因为温度升高后,副产物焦磷酸和偏磷酸在溶剂中的分散性变好,强化了传质传热,提高了反应速率,有利于化学平衡向产物方向移动。当反应温度达到110 ℃时,甲苯回流,ATCN的收率高达81.6%。因此,ATCN合成的较佳反应温度为110 ℃。
3.1.3 反应时间对收率的影响选择P2O5/甲苯体系,ATCOA和P2O5的摩尔比为1:6,反应温度为110 ℃,考察了反应时间对ATCN收率的影响,具体结果见表 2。
|
|
表 2 反应时间对ATCN收率的影响 Table 2 Effects of reaction time on ATCN yields |
由表 2可知,随着反应时间的延长,反应收率有一定幅度的提升,但反应时间为8 h之后,继续延长反应时间收率变化不明显,并且开始观察到副反应发生。因此,ATCN合成的较佳反应时间为8 h。
综上,ATCN的优化合成工艺为:以P2O5/甲苯为反应体系,反应温度为110 ℃,反应时间为8 h。
3.2 ATCN的结构表征ATCOE、ATCOA和ATCN的核磁氢谱如图 2所示。由图 2可知,ATCN的核磁氢谱中有2种氢,分别为δ=13.12处的N─H以及δ=6.64处的C─NH2,由于氰基吸电性强于甲酰胺基和甲酸乙酯基,使得分子整体电荷密度降低。因此,ATCN的N─H、C─NH2均比ATCOE和ATCOA的相应出峰向低场移动。

|
图 2 ATCOE、ATCOA和ATCN的核磁氢谱 Fig.2 1H NMR spectra of ATCOE, ATCOA and ATCN |
ATCOH、ATCOE、ATCOA和ATCN的红外谱图如图 3所示。由图 3可知,随着氨基三唑中3-位基团由羧基相继转换为甲酸乙酯基、甲酰胺基、氰基,分子整体的电荷密度降低,电荷屏蔽效应减弱,红外谱图中氨基的特征吸收峰逐渐明显,并且在2 262 cm-1处新增氰基的较强特征吸收峰,而1 700 cm-1左右的羰基吸收峰消失,表明甲酰胺基已转换为氰基。
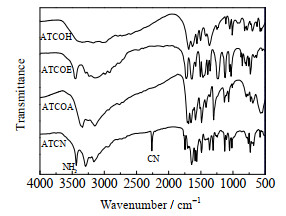
|
图 3 ATCOH、ATCOE、ATCOA和ATCN的红外谱图 Fig.3 IR spectra of ATCOH, ATCOE, ATCOA and ATCN |
在氮气氛围下,在温度为40~400 ℃时以10 ℃·min-1为升温速率测试了ATCN的DSC曲线,结果见图 4。由图 4可知,ATCN在40~400 ℃存在1个吸热过程和2个放热过程。其中,吸热过程的吸热峰值温度为156.94 ℃,与通过熔点仪获得的ATCN的熔点(156.0~157.5 ℃)吻合,表明该吸热过程为ATCN的熔融过程;随后,发生了第1个分解放热过程,热分解峰值温度为163.01 ℃,200 ℃之后发生了第2个放热过程,热分解峰值温度为244.29 ℃。参考文献[29],第1个放热历程可归为ATCN分子结构中氨基和氰基的断裂,第2个放热历程可归为三唑环结构的裂解。
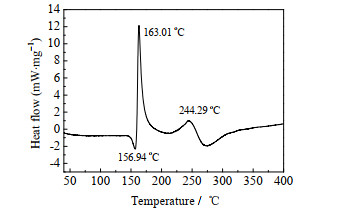
|
图 4 ATCN的DSC曲线 Fig.4 DSC curve of ATCN |
为了验证由DSC推测的ATCN的热分解历程,随后通过原位红外技术获得ATCN程序升温条件下原位裂解红外吸收谱图的变化情况。首先,将1.0 mg ATCN样品粉碎成粉末状,然后加入250 mg经干燥研细的KBr粉末,充分研磨后压片,获得直径13 mm、厚约1 mm的均匀半透明的盐片,放入变温池中,在40~400 ℃以升温速率10 ℃·min-1程序升温。
实验采集Series得到的ATCN的三维谱图如图 5所示,从图中可以观察到ATCN官能团及骨架振动吸收峰的变化情况。其中,当加热温度高于200 ℃后,ATCN的官能团特征吸收峰强度急剧下降,这和DSC谱图中第1个加热过程相吻合,之后红外谱图上只余下ATCN三唑环结构的骨架振动吸收峰,并且随着温度进一步升高其相应信号也逐渐减弱,这与推测的DSC谱图中第2个分解过程相对应。此外,还具体考察了ATCN的氨基和氰基两个官能团红外特征吸收峰的形状和强度随加热温度的变化情况。
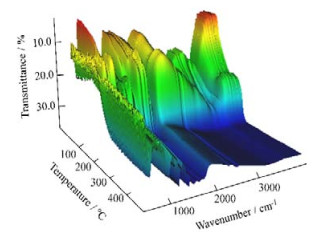
|
图 5 ATCN的原位热裂解三位谱图 Fig.5 3D in-situ pyrolytic spectra of ATCN |
从获得的ATCN三维红外谱图中,提取了140~200 ℃温度区间的10张谱图,相应谱图如图 6所示。由图 6(a)可知,在温度为140~160 ℃,位于3 434和3 289 cm-1的两处氨基特征红外吸收峰的形状和强度均无较大变化,这与DSC曲线中的熔融过程相对应;而随着温度进一步升高,其吸收峰形状和强度均变差,而180 ℃之后则观察不到氨基特征吸收峰,这个DSC曲线中第1个放热过程相对应。同样,在图 6(b)中,位于2 259 cm-1的氰基红外特征吸收峰的形状和强度也观察到类似变化过程。
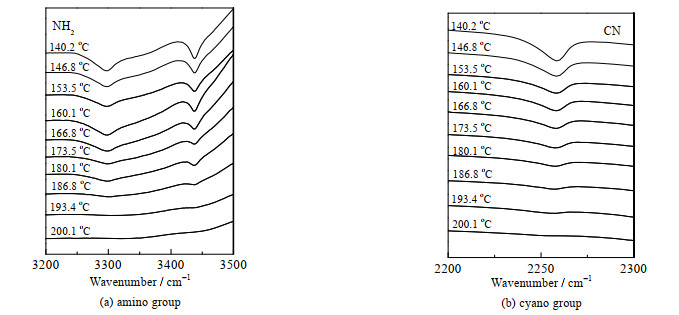
|
图 6 不同温度下ATCN的原位红外光谱图 Fig.6 In-situ IR spectra of ATCN under different temperatures |
为获得ATCN第1个热分解过程、即氨基与氰基断裂过程的反应活化能,分别以5、10、15和20 ℃·min-1为升温速率在氮气氛围下测试了ATCN的热分析动力学DSC曲线,结果见图 7。由图 7可知,ATCN在5、10、15和20 ℃·min-1升温速率下的热分解峰值温度分别为156.14、163.01、167.04和169.31 ℃。
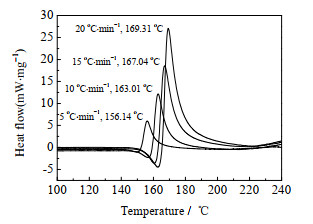
|
图 7 ATCN的热分析动力学DSC曲线 Fig.7 Thermal kinetic DSC curves of ATCN |
然后,采用Kissinger方程(式(1))和Ozawa方程(式(2))获得ATCN的热分析动力学参数,结果列于表 3。
|
|
表 3 ATCN的活化能计算结果 Table 3 Calculation results of ATCN activation energy |
| ${\ln _{}}\left( {\frac{\beta }{{T_{\rm{p}}^2}}} \right) = {\ln _{}}\frac{{AR}}{E} - \frac{E}{{R{T_{\rm{p}}}}}$ | (1) |
式中:β为升温速率,K·min-1;
| $\log \beta = C - {\rm{0}}{\rm{.45}}{{\rm{6}}_{}}{\rm{7}}\frac{E}{{R{T_{\rm{p}}}}}$ | (2) |
式中:C = log [AE/RG(α)]-2.315,G(α)为机理函数的积分式。
由表 3可知,通过Kissinger方程和Ozawa方程获得的ATCN的活化能分别为156.76和155.67 kJ·mol-1,二者比较接近,而2种方法的线性相关系数R2分别为0.997 8和0.998 4,接近于1。
3.3.4 活化焓、活化熵和活化吉布斯自由能通过方程式(3)~(5)[32-33],计算出ATCN热分解反应的活化焓ΔH、活化吉布斯自由能ΔG和活化熵ΔS分别为153.26 kJ·mol-1,109.80 kJ·mol-1和103.40 J·K-1·mol-1。
| $A{{\rm{e}}^{\left( { - \frac{E}{{R{T_p}}}} \right)}} = \frac{{k{T_{\rm{p}}}}}{h}{{\rm{e}}^{\left( { - \frac{{\Delta G}}{{R{T_p}}}} \right)}}$ | (3) |
| $\Delta H{\rm{ = }}E - R{T_{\rm{p}}}$ | (4) |
| $\Delta G{\rm{ = }}\Delta H - {T_{\rm{p}}}\Delta S$ | (5) |
| ${T_{{\rm{p, }}i}}{\rm{ = }}{T_{{\rm{p0}}}} + m{\beta _i} + n\beta _i^2{\rm{ }}i{\rm{ = 1 \sim 4}}$ | (6) |
式中:k为玻尔兹曼常量,J·K-1;h为普朗克常量,J·s;βi为第i种升温速率,K·min-1;
热爆炸临界温度Tb可以用于评价含能材料的热安定性和安全性,其值可通过式(7)计算[13]:
| ${T_{\rm{b}}} = \frac{{{E_0} - \sqrt {E_0^2 - 4{E_0}R{T_{{\rm{p0 }}}}} }}{{2R}}$ | (7) |
式中:E0为β→0时的热分解反应活化能,kJ·mol-1。由式(6)求得Tp0为420.39 K,当E0取156.76 kJ·mol-1时,由式(7)可得Tb为430.21 K。
4 结论(1) 以氨基胍碳酸盐为原料,经缩合、环合、酰化、酯化、氨化和氧化等反应合成了目标化合物ATCN,并通过NMR、IR和元素分析等手段表征了目标产物的结构。
(2) 探讨反应体系、反应温度、反应时间等对氧化反应收率的影响,得到ATCN的较佳工艺参数为:以P2O5/甲苯为反应体系,反应温度为110 ℃,反应时间为8 h,反应收率可达81.6%。
(3) 热分析和原位裂解红外结果表明,ATCN第1个热分解峰值温度为163.01 ℃,对应为氨基和氰基的断裂;第2个热分解峰值温度为244.29 ℃,对应为三唑环结构的裂解。此外,通过Kissinger方程和Ozawa方程获得的ATCN的活化能分别为156.76和155.67 kJ·mol-1;通过热力学参数计算获得ATCN第1个热分解过程的ΔH、ΔG和ΔS分别为153.26、109.80 kJ·mol-1和103.40 J·K-1·mol-1,热爆炸临界温度为430.21 K。
| [1] |
TANG Y, HE C, IMLER G H, et al. Ring closure of polynitroazoles via an N, N'-alkylene bridge: Towards high thermally stable energetic compounds[J]. Journal of Materials Chemistry A, 2018, 6(18): 8382-8387. DOI:10.1039/C8TA02704H |
| [2] |
MA Q, CHEN Y, LIAO L, et al. Energetic π-conjugated vinyl bridged triazoles: A thermally stable and insensitive heterocyclic cation[J]. Dalton Transactions, 2017, 46(23): 7467-7479. DOI:10.1039/C7DT01261F |
| [3] |
HUANG S, TIAN J, QI X, et al. Synthesis of gem-dinitromethylated and fluorodinitromethylated derivatives of 5, 5'-dinitro-bis-1, 2, 4-triazole as promising high-energy-density materials[J]. Chemistry-A European Journal, 2017, 23(52): 12787-12794. DOI:10.1002/chem.201702451 |
| [4] |
杨雷, 谭明, 刘玉存, 等. 含氟唑类含能化合物分子设计及性能预测[J]. 火炸药学报, 2020, 43(2): 188-194, 220. YANG L, TAN M, LIU Y C, et al. Molecular design of fluorine-containing azole energetic compounds and its application performance prediction[J]. Chinese Journal of Explosives & Propellants, 2020, 43(2): 188-194, 220. |
| [5] |
李亚南, 王彬, 张红武, 等. 5-(4-叠氮呋咱基)-[1, 2, 3] 三唑[4, 5-c]并呋咱内盐的合成、晶体结构及性能[J]. 火炸药学报, 2020, 43(1): 28-32. LI Y N, WANG B, ZHANG H W, et al. Synthesis, crystal structure and properties of 5-(4-azidofurazan-3-yl)-[1, 2, 3] triazolo[4, 5-c]furazan inner salt[J]. Chinese Journal of Explosives & Propellants, 2020, 43(1): 28-32. |
| [6] |
霍欢, 郭涛, 王子俊, 等. 高能不敏感离子盐HDNMT和ADNMT的合成、热行为与能量特性[J]. 火炸药学报, 2019, 42(5): 445-449. HUO H, GUO T, WANG Z J, et al. Synthesis, thermal behavior and energy characteristics of insensitive high energetic ionic salts of HDNMT and ADNMT[J]. Chinese Journal of Explosives & Propellants, 2019, 42(5): 445-449. |
| [7] |
QU Y, BABAILOV S P. Azo-linked high-nitrogen energetic materials[J]. Journal of Materials Chemistry A, 2018, 6(5): 1915-1940. DOI:10.1039/C7TA09593G |
| [8] |
谭成侠, 张谦. 杀菌剂戊唑醇的合成及表征[J]. 高校化学工程学报, 2007, 21(6): 1030-1033. TAN C X, ZHANG Q. Synthesis and characterization of fungicide tebuconazole[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(6): 1030-1033. DOI:10.3321/j.issn:1003-9015.2007.06.022 |
| [9] |
段丽君, 杨健, 徐坤. 普仑司特中间体的合成工艺优化[J]. 高校化学工程学报, 2013, 27(5): 861-864. DUAN L J, YANG J, XU K, et al. Optimization of the synthesis of Pranlukast intermediate[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(5): 861-864. DOI:10.3969/j.issn.1003-9015.2013.05.021 |
| [10] |
刘安昌, 郑怡倩, 汪焱鲁, 等. 水稻田除草剂三唑酰草胺的合成[J]. 农药, 2019, 58(1): 23-25. LIU A C, ZHENG Y Q, WANG Y L, et al. Synthesis of herbicides ipfencarbazone[J]. Agrochemicals, 2019, 58(1): 23-25. |
| [11] |
陈英, 李普, 陈梅, 等. 含硫醚三唑的1, 4-戊二烯-3-酮衍生物合成及生物活性研究[J]. 有机化学, 2019, 39(10): 2813-2820. CHEN Y, LI P, CHEN M, et al. Syntheses and biological activities of 1, 4-pentadien-3-one derivatives containing thioethertriazole moiety[J]. Chinese Journal of Organic Chemistry, 2019, 39(10): 2813-2820. |
| [12] |
杜志明, 张英豪, 韩志跃, 等. 三唑类富氮化合物的研究进展[J]. 北京理工大学学报, 2016, 36(6): 551-557. DU Z M, ZHANG Y H, HAN Z Y, et al. Research progress on triazole nitrogen-rich compounds[J]. Transactions of Beijing Institute of Technology, 2016, 36(6): 551-557. |
| [13] |
高福磊, 汪营磊, 赵宝东, 等. N1-(2, 2, 2-三硝基乙基)-1, 5-二氨基四唑的合成工艺改进与热性能[J]. 高校化学工程学报, 2019, 33(3): 652-656. GAO F L, WANG Y L, ZHAO B D, et al. Synthesis process improvement and thermal properties of N1-(2, 2, 2-trinitroethyl)-1, 5-diamino-1H-tetrazole[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(3): 652-656. DOI:10.3969/j.issn.1003-9015.2019.03.019 |
| [14] |
刘卫孝, 尉涛, 陆婷婷, 等. 3, 5-二氨基-1, 2, 4-三唑二硝酰胺盐合成、晶体结构及性能[J]. 高校化学工程学报, 2019, 33(4): 1005-1011. LIU W X, YU T, LU T T, et al. Synthesis, crystal structure and properties of 3, 5-diamino-1, 2, 4-triazolium dinitramide[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 1005-1011. DOI:10.3969/j.issn.1003-9015.2019.04.029 |
| [15] |
李亚南, 常佩, 王彬, 等. 氮杂芳环N-氨化物及其含能衍生物研究进展[J]. 高校化学工程学报, 2019, 33(2): 263-273. LI Y N, CHANG P, WANG B, et al. Review on N-amino compounds with N-heteroaromatic rings and their energetic derivatives[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(2): 263-273. DOI:10.3969/j.issn.1003-9015.2019.02.002 |
| [16] |
DIPPOLD A A, IZSÁK D, KLAPÖTKE T M, et al. Combining the advantages of tetrazoles and 1, 2, 3-triazoles: 4, 5-Bis(tetrazol-5-yl)-1, 2, 3-triazole, 4, 5-bis(1-hydroxytetrazol-5-yl)-1, 2, 3-triazole, and their energetic derivatives[J]. Chemistry-A European Journal, 2016, 22(5): 1768-1778. DOI:10.1002/chem.201504624 |
| [17] |
QIN J, LI T, ZHANG J G, et al. The nitrogen-rich energetic compound 4-carboxamide-5-(1H-tetrazol-5-yl)-1H-1, 2, 3-triazole and its 1D sodium complex: Synthesis and properties[J]. RSC Advances, 2016, 6(103): 101430-101436. DOI:10.1039/C6RA22151C |
| [18] |
李亚南, 胡建建, 常佩, 等. 3-偕二硝甲基-1, 2, 4-三唑的合成及表征[J]. 高校化学工程学报, 2019, 33(1): 141-145. LI Y N, HU J J, CHANG P, et al. Synthesis and characterization of 3-dinitromethyl-1, 2, 4-triazole[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 141-145. DOI:10.3969/j.issn.1003-9015.2019.01.018 |
| [19] |
李亚南, 舒远杰, 张生勇, 等. 3-氟偕二硝甲基-1, 2, 4-三唑的合成及性能[J]. 含能材料, 2017, 25(7): 612-616. LI Y N, SHU Y J, ZHANG S Y, et al. Synthesis and properties of 3-fluorodinitromethyl-1, 2, 4-triazole[J]. Chinese Journal of Energetic Materials, 2017, 25(7): 612-616. |
| [20] |
张艳芳, 熊华林, 林秋汉, 等. 4, 5-二(1H-5-四唑基)-1, 2, 3-三唑及其含能盐的合成与表征[J]. 火炸药学报, 2017, 40(2): 41-46. ZHANG Y F, XIONG H L, LIN Q H, et al. Synthesis and characterization of 4, 5-bis(tetrazol-5-yl)-1, 2, 3-triazole and its energetic salts[J]. Chinese Journal of Explosives & Propellants, 2017, 40(2): 41-46. |
| [21] |
张敏, 许诚, 葛忠学, 等. 两种新型2-偕二硝甲基-5-硝基四唑含能离子盐的合成、表征及性能预估[J]. 火炸药学报, 2017, 40(5): 24-29, 55. ZHANG M, XU C, GE Z X, et al. Synthesis, characterization and performance prediction of two kinds of novel energetic ionic salts of 2-dinitromethyl-5-nitrotetrazolate[J]. Chinese Journal of Explosives & Propellants, 2017, 40(5): 24-29, 55. |
| [22] |
翟连杰, 王伯周, 樊学忠, 等. 3, 3'-二(四唑-5-基)-4, 4'-偶氮氧化呋咱的合成及性能预估[J]. 火炸药学报, 2018, 41(1): 21-25. ZHAI L J, WANG B Z, FAN X Z, et al. Synthesis and performance prediction of 3, 3'-bis(5-tetrazole) -4, 4'-azofuroxan[J]. Chinese Journal of Explosives & Propellants, 2018, 41(1): 21-25. |
| [23] |
HUBER S, IZSÁK D, KARAGHIOSOFF K, et al. Energetic salts of 5-(5-azido-1H-1, 2, 4-triazol-3-yl) tetrazole[J]. Propellants, Explosives, Pyrotechnics, 2014, 39(6): 793-801. DOI:10.1002/prep.201300203 |
| [24] |
DIPPOLD A A, KLAPÖTKE T M. Synthesis and characterization of 5-(1, 2, 4-triazol-3-yl) tetrazoles with various energetic functionalities[J]. Chemistry-An Asian Journal, 2013, 8(7): 1463-1471. DOI:10.1002/asia.201300063 |
| [25] |
DIPPOLD A A, IZSÁK D, KLAPÖTKE T M. A study of 5-(1, 2, 4-triazol-C-yl) tetrazol-1-ols: Combining the benefits of different heterocycles for the design of energetic materials[J]. Chemistry-A European Journal, 2013, 19(36): 12042-12051. DOI:10.1002/chem.201301339 |
| [26] |
DACHS M, DIPPOLD A A, GAAR J, et al. A comparative study on insensitive energetic derivatives of 5-(1, 2, 4-triazol-C-yl)-tetrazoles and their 1-hydroxy-tetrazole analogues[J]. Zeitschrift für Anorganische und Allgemeine Chemie, 2013, 639(12-13): 2171-2180. DOI:10.1002/zaac.201300304 |
| [27] |
IZSÁK D, KLAPÖTKE T M, REUTER S. Salts of 5-(5-azido-1H-1, 2, 4-triazol-3-yl) tetrazol-1-ol: From highly sensitive primary explosives to insensitive nitrogen-rich salts[J]. European Journal of Inorganic Chemistry, 2013, 2013(32): 5641-5651. DOI:10.1002/ejic.201300900 |
| [28] |
KUKULJAN L, KRANJC K. 3-(5-Amino-1, 2, 4-triazole)-1, 2, 4-oxadiazole: A new biheterocyclic scaffold for the synthesis of energetic materials[J]. Tetrahedron Letters, 2019, 60(2): 207-209. DOI:10.1016/j.tetlet.2018.12.014 |
| [29] |
赵宝东, 闫峥峰, 刘亚静, 等. 5-氰基-4-氨基咪唑的合成及热性能[J]. 精细化工, 2020, 37(2): 290-293. ZHAO B D, YAN Z F, LIU Y J, et al. Synthesis and thermal behavior of 5-cyano-4-aminoimidazole[J]. Fine Chemicals, 2020, 37(2): 290-293. |
| [30] |
KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [31] |
张天萍, 甄卫军, 赵玲. 配方对有机硅橡胶非等温硫化动力学的影响[J]. 高校化学工程学报, 2020, 34(1): 222-229. ZHANG T P, ZHEN W J, ZHAO L, et al. Effects of formulations of silicon rubber on its non-isothermal vulcanization kinetics[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(1): 222-229. |
| [32] |
牛芊, 周彩荣, 詹自力. 甲硫氨酸的非等温热分解动力学的研究[J]. 高校化学工程学报, 2018, 32(5): 1112-1118. NIU Q, ZHOU C R, ZHAN Z L, et al. Study on non-isothermal decomposition kinetics of methionine[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(5): 1112-1118. DOI:10.3969/j.issn.1003-9015.2018.05.016 |
| [33] |
焦帅帅, 詹自力. 丝氨酸非等温热分解动力学研究[J]. 高校化学工程学报, 2019, 33(5): 1107-1112. JIAO S S, ZHAN Z L. Study on non-isothermal thermal decomposition kinetics of serine[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(5): 1107-1112. |




