2. 珠江三角洲水源保护与水质安全教育部重点实验室,广东 广州 510006
2. Key Laboratory of Ministry of Education for Water Quality Security and Protection in Pearl River Delta, Guangzhou 510006, China
环戊酮是一种重要的精细化工中间体,也是香料及医药工业的原料[1],可用于制备新型香料二氢茉莉酮酸甲酯[2]、白兰酮[3]、2-正己基环戊酮[4]及多种抗炎、抗癌药物[5~7],也可合成橡胶,还用于生化研究[8]、杀虫剂[9]和除草剂[10]的合成。
环戊酮的制备方法主要有两种,即己二酸及其衍生物高温热解法和环戊烯氧化法[11~13]。己二酸及其衍生物高温热解法是目前工业采用的主要生产技术,但原料依赖于己二酸的生产,涉及步骤比较多,而且在生产过程涉及脱羧过程,理论质量收率为57.5%,原子经济性不高。环戊烯氧化法是制备环戊酮的另一条技术路线,一般采用Wacker型氧化催化剂。但原料环戊烯的来源非常有限,价格昂贵,限制了这种方法的实用性。因此开发环戊酮的制备新原料、新路线、特别是利用廉价丰富的生物质资源,具有重要的意义。
糠醛在工业上以廉价的农林废弃物 (如:玉米芯、甘蔗渣、棉籽壳等) 作为原料大规模生产且年产量达30多万吨,占全球生产总量的80%以上[14]。目前糠醛主要是用来制备糠醇,可工业化的下游产品种类少。随着石油资源的日趋枯竭,加强对糠醛深加工的产品开发和利用将会具有广阔的空间。
最近,研究者们发现糠醛是一种合成环戊酮很好的原料[15~17]。近期文献[18~23]报道,在水作溶剂时,采用负载型贵金属催化剂、Raney铜、NiCu/SBA-15、Ni/CNTs、Cu-Co、Cu-Ni-Al等催化糠醛选择性加氢可得环戊酮。反应压力高,选择性低,稳定性差是目前研究当中普遍存在的问题。本文主要针对反应压力高的问题进行研究,采用化学还原法制备了一系列Ni-Cu-B非晶态合金催化剂,并用于糠醛加氢制备环戊酮反应中,考察了镍盐、硼镍物质的量比、铜添加量对催化剂加氢性能的影响,通过对Ni-B和Ni-Cu-B非晶态催化剂表征分析探讨助剂Cu对催化剂吸氢性能、化学环境的影响,对该反应进行了工艺条件的优化,考察了反应温度、氢气分压和反应时间对该工艺的影响,最后考察了Ni-Cu-B非晶态催化剂的活性稳定性,研究了该催化剂的失活机理。
2 实验部分 2.1 试剂NiCl2·6H2O、NiAc2·6H2O、Ni (NO3)2·6H2O、KBH4、糠醛为分析纯,天津市大茂化学试剂厂;NaOH、无水乙醇为分析纯,天津市致远化学试剂有限公司;Cu (NO3)2·3H2O为分析纯,广州化学试剂厂。
2.2 催化剂的制备利用化学还原法制备Ni-B和Ni-Cu-B催化剂,在圆底烧瓶中加入一定量0.1 mol×L-1镍盐溶液 (或NiCl2·6H2O和Cu (NO3)2·3H2O的混合溶液,铜的组分摩尔分数计算公式xCu=nCu/(nCu+nNi),其中xCu是铜的摩尔分数,nNi和nCu分别为镍和铜的摩尔量),并将其置于0 ℃的冰水浴中,按一定的硼镍物质的量比准确称取硼氢化钾,配制成pH ≈ 12的0.5 mol×L-1的硼氢化钾溶液 (用0.2 mol×L-1的NaOH溶液调节),将其逐滴加入上述溶液中。滴加结束后,反应至无气体放出,停止反应,过滤,将黑色沉淀用蒸馏水反复洗涤至pH=7,然后用无水乙醇洗涤3次,最后保存在无水乙醇中备用。
2.3 催化剂的活性评价准确称取一定量的糠醛,水和催化剂,并依次加入50 mL带磁力搅拌的高压反应釜中。密封后反复通氢气6次,以便排尽高压反应釜中的空气,将氢气的压力调至一设定值。将其置于磁力搅拌油浴锅中,在一定温度下加热反应数小时。冷却后抽出釜内溶液,过滤得产物。
2.4 催化剂的表征和分析方法采用D/MAX2500V型X射线粉末衍射仪 (日本Rigaku Corporation公司) 进行XRD测试;采用ASAP2020型比表面积和孔隙度吸附仪 (美国Merck公司) 进行比表面积、孔结构测试;采用JSM-7001F型场发射扫描电子显微镜 (日本JEOL公司) 进行形貌分析;采用TP-5076型多用吸附仪 (天津先权公司) 进行TPD测试;采用Thermo escalab 250Xi型多用光电子能谱仪 (美国热电) 进行XPS测试。
产物在日本岛津公司GC-2014C型气相色谱仪上进行分析,色谱条件分别为:OPTIMA-5色谱柱,氢火焰 (FID) 检测器,载气为N2。进样口温度为170℃,检测器温度为250℃,柱温为程序升温控制,先以60℃恒温5 min后,以15℃×min-1升温至170℃。采用面积内标法对目标产物环戊酮进行了定量分析,内标物为N, N-二甲基甲酰胺。
3 结果与讨论 3.1 不同镍源对Ni-B催化剂结构与催化加氢性能的影响由三种镍源制得催化剂的XRD谱图和催化加氢实验结果分别见图 1和表 1。
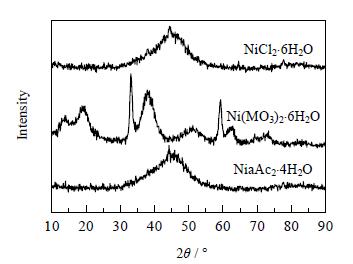
|
图 1 不同镍源制备的Ni-B非晶态催化剂的XRD谱图 Fig.1 XRD patterns of amorphous Ni-B catalysts prepared with different nickel sources |
| 表 1 不同镍源对Ni-B非晶态催化剂催化糠醛加氢合成环戊酮的影响 Table 1 Effects of different nickel sources of amorphous Ni-B catalysts on furfural hydrogenation to prepare cyclopentanone |
由图 1可知,以氯化镍和乙酸镍为镍源制备的Ni-B催化剂在2θ=45°出现宽的弥散峰,说明催化剂具有典型的非晶态结构[24~26]。而以硝酸镍为原料制备的Ni-B催化剂在2θ=45°并没有出现宽的弥散峰,而在2θ=34°、60°出现尖峰,说明催化剂已部分被氧化[27],氧化态的镍无法呈现与非晶态金属镍相同的催化加氢性能,从而导致在表 1中所呈现的实验结果,即以硝酸镍为前驱物所制备的催化剂的加氢性能较差。产生该差异的主要原因可能是具有强氧化性能的硝酸根离子与具有强还原活性的非晶态Ni-B物种发生氧化还原反应,破坏了非晶态的Ni-B合金结构。比较表 1可知,制备非晶态Ni-B合金的合适前驱物为氯化镍。
3.2 不同硼镍物质的量比对Ni-B催化剂结构与催化加氢性能的影响由不同硼镍物质的量比制得的催化剂的XRD谱图和催化加氢实验结果分别见图 2和图 3。
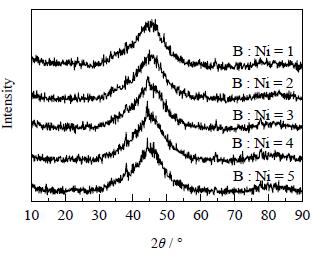
|
图 2 不同硼镍物质的量比制备的Ni-B非晶态催化剂的XRD谱图 Fig.2 XRD patterns of amorphous Ni-B catalysts prepared with different boron nickel mole ratios |
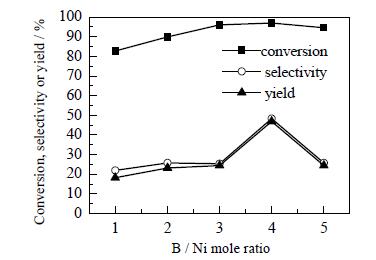
|
图 3 不同硼镍物质的量比对Ni-B非晶态催化剂催化糠醛加氢合成环戊酮的影响 Fig.3 Effects of different boron nickel mole ratios of the catalyst on catalytic hydrogenation to prepare cyclopentanone |
由图 2可见,用五种不同硼镍物质的量比制得的催化剂的XRD谱图均在2θ=45 °处出现宽的弥散峰,说明催化剂均为非晶态结构。结合活性数据可知,适宜的硼镍物质的量比为4。从图 3可以看出,当硼镍物质的量比小于4时,随着硼镍物质的量比的升高,转化率和选择性逐渐增大,当硼镍物质的量比达到4时,催化活性最好。当硼镍物质的量比升高至5时,催化剂的活性反而下降,这是由于Ni为非晶态Ni-B催化剂中的活性组分[28, 29],因而当催化剂的非晶态结构完全形成后,过量的类金属原子B将覆盖Ni组分的活性位,使得催化剂的活性位减少,对催化剂的催化加氢性能不利。
3.3 铜添加量对Ni-Cu-B催化剂结构与催化加氢性能的影响第三组分金属的添加不仅可以稳定非晶态结构,而且可以提高其热稳定性。不同铜添加量下制备的Ni-Cu-B催化剂的XRD谱图、SEM谱图和催化加氢实验结果分别见图 4、图 5和图 6。
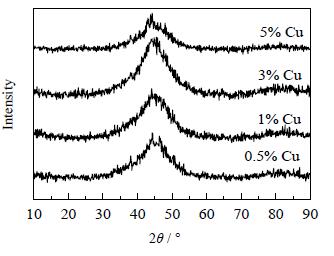
|
图 4 不同铜添加量所制备的Ni-Cu-B非晶态催化剂的XRD谱图 Fig.4 XRD patterns of amorphous Ni-Cu-B catalysts prepared with different Cu contents |

|
图 5 不同铜添加量所制备的Ni-Cu-B非晶态催化剂的SEM谱图 Fig.5 micrographs of the amorphous Ni-Cu-B catalysts prepared with different Cu contents (0.5%(a), 1%(b), 3%(c), 5%(d)) |
|
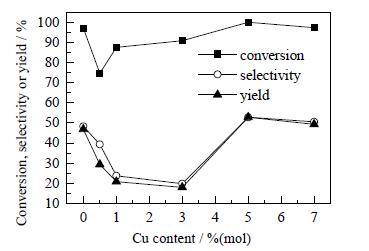
图 6 铜含量对非晶态Ni-Cu-B催化剂催化糠醛加氢制环戊酮的影响 Fig.6 Effects of Cu content of the amorphous Ni-Cu-B catalysts on catalytic hydrogenation of furfural to prepare cyclopentanone |
从图 4可以看出,不同铜添加量对Ni-Cu-B催化剂晶体结构影响不大,4种催化剂均在2 θ=45 °处出现宽弥散峰,说明均具有典型的非晶态结构。从图 5可以看出,随着Cu含量的增加,催化剂逐渐形成球形颗粒,当xCu=5%(mol) 时催化剂颗粒粒径较均匀,分散性较好,无团聚现象。从图 6可以看出,糠醛的转化率和环戊酮的选择性均出现了先下降后增加而后下降的现象,原因可能是当铜的含量较小时,形成了部分Cu-B非晶态合金,使镍的还原量减少,活性中心数减少,导致活性减小;当铜的含量过高时,过量的铜将覆盖镍的活性中心,使活性减小。因此,只有添加适量的助剂才能够增大催化剂的活性,从图 6中可以看出,最适宜的铜添加量为5%(mol)。
3.4 Cu的添加对Ni-B非晶态催化剂吸氢性能的影响为了考察Cu对Ni-B非晶态催化剂吸氢性能的影响,分别对Ni-B和Ni-Cu-B非晶态催化剂进行了氢的程序升温脱附 (TPD) 实验,实验结果如图 7所示。
|
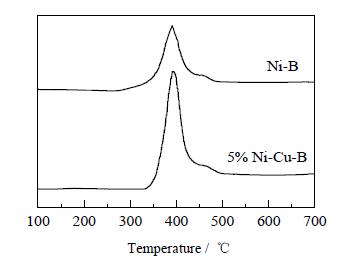
图 7 Ni-B和Ni-Cu-B非晶态催化剂的H2-TPD谱图 Fig.7 H2-TPD patterns of the amorphous Ni-B and Ni-Cu-B catalysts |
由图 7可见,Ni-B和Ni-Cu-B催化剂均出现两个脱附峰,表明有两种氢的吸附中心,两个高温脱附峰归结为化学吸附H2的脱附。添加了助剂Cu之后的催化剂,脱附峰面积明显增大,由此说明Ni和Cu之间产生相互作用,使得氢的吸附程度发生变化,活性中心数目增多,从而使得吸附的氢物种更易于在催化剂表面流动并参与反应[30],有助于催化剂活性的提高。
3.5 Cu的添加对Ni-B非晶态催化剂化学环境影响为了考察催化剂的表面电子状态,对Ni-Cu-B非晶态催化剂进行X射线光电子能谱 (XPS) 分析,实验结果如图 8所示。
|
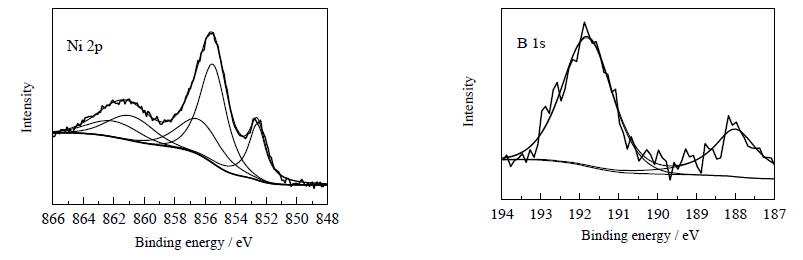
图 8 Ni-Cu-B非晶态催化剂的XPS谱图 Fig.8 XPS patterns of the amorphous Ni-Cu-B catalysts |
从图 8可见,在Ni-Cu-B非晶态催化剂的Ni 2p谱图中,852.6 eV的峰归属于元素态Ni,855.5和856.4 eV的峰分别归属于NiO和Ni (OH)2,860.9和862.0 eV的峰分别归属于NiO的多重分裂峰和电子能量损失峰[31]。在Ni-Cu-B非晶态催化剂的B 1s谱图中,188.0和192.7 eV的峰分别归属于元素态B和氧化态B[32]。在未改性的Ni-B非晶态催化剂中并没有观察到NiO物种的峰[33],因此可以断定由于Ni离子和Cu离子之间的相互作用,使得部分Ni物种不能够被BH4-所还原。与纯金属镍 (852.8 eV) 和无定形硼粉 (187.5 eV) 的标准结合能相比,Ni-Cu-B中金属Ni的结合能减少了0.2 eV,合金B的结合能增加了0.5 eV,表明部分电子由B向Ni转移,导致Ni-Cu-B中的金属Ni为富电子状态,而B为缺电子状态,这种状态导致吸附在催化剂表面的糠醛的醛基氧上的孤对电子与缺电子状态的B原子存在相互作用,富电子状态的Ni原子进攻醛基碳原子,从而使得糠醛得到活化,提高了催化反应活性。
3.6 反应温度对糠醛加氢合成环戊酮工艺的影响在氢气分压为0.8 MPa,反应时间为6 h的条件下,考察反应温度对糠醛加氢合成环戊酮工艺的影响,结果如图 9所示。
|
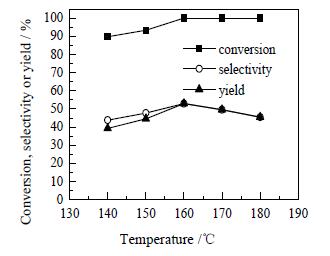
图 9 反应温度对糠醛加氢合成环戊酮的影响 Fig.9 Effects of reaction temperature on furfural hydrogenation to prepare cyclopentanone |
由图 9可见,当反应温度低于160℃时,随着反应温度的升高,糠醛的转化率、环戊酮的选择性和收率逐渐增大,且达到160℃时,糠醛基本上完全转化;当反应温度高于160℃时,随着反应温度的升高,糠醛转化率维持不变,环戊酮的选择性和收率不断减小。这可能是由于虽然升高温度会提高糠醛加氢的速率,但是与此同时,也会导致其他副反应的发生,使得环戊酮的选择性降低。显而易见,160℃是糠醛加氢合成环戊酮的最佳反应温度,此时,糠醛的转化率、环戊酮的选择性和收率分别为100%、52.9%和52.9%。
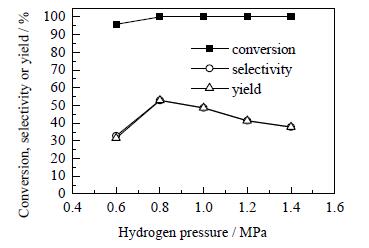
3.7 氢气分压对糠醛加氢合成环戊酮工艺的影响在反应时间为6 h,反应温度为160℃的条件下,考察氢气分压对糠醛加氢合成环戊酮的影响,结果如图 10所示。
|
图 10 氢气分压对糠醛加氢合成环戊酮的影响 Fig.10 Effects of hydrogen pressure on furfural hydrogenation to prepare cyclopentanone |
由图 10可知,当氢气分压低于0.8 MPa时,随着氢气分压的增大,糠醛的转化率、环戊酮的选择性和收率逐渐增大,当氢气分压达到0.8 MPa时,糠醛基本上完全转化,环戊酮的选择性和收率分别为52.9%和52.9%,比氢气分压为0.6 MPa时分别提高了20%和20.7%;当氢气分压超过0.8 MPa后,糠醛的转化率维持不变,环戊酮的选择性和收率随氢气分压的增大而减小。这可能是因为反应压力过高,有利于其他副反应的发生。与Raney铜催化剂[19]相比,转化率和选择性相差无几,但反应压力降低了2.2 MPa,与NiCu/SBA-15、Ni/CNTs、Cu-Co、Cu-Ni-Al等催化剂[20~23]相比,反应压力也大大降低,解决了该反应普遍压力高的问题。
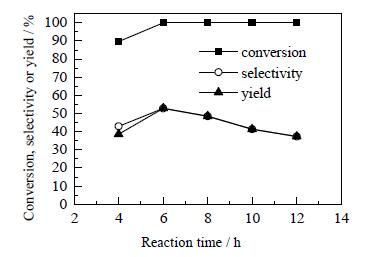
3.8 反应时间对糠醛加氢合成环戊酮工艺的影响在反应温度为160℃,氢气分压为0.8 MPa的条件下,考察反应时间对糠醛加氢合成环戊酮的影响,结果如图 11所示。
|
图 11 反应时间对糠醛加氢合成环戊酮的影响 Fig.11 Effects of reaction time on furfural hydrogenation to prepare cyclopentanone |
由图 11可知,当反应时间小于6 h时,糠醛的转化率、环戊酮的选择性和收率都随反应时间的延长而增大,且达到6 h时,糠醛基本上完全转化;当反应时间大于6 h时,糠醛转化率维持不变、环戊酮的选择性和收率不断减小。这可能是由于反应时间短,糠醛未能得到足够的活化,故短时间内糠醛的转化率相对较低,另外反应中间体进一步转化为环戊酮也需要一定的时间,所以在反应时间较短时,环戊酮的选择性和收率相对较低;当反应时间过长也会导致环戊酮的选择性和收率不高,这是因为过度的反应会使环戊酮继续生成其他的物质。显而易见,6 h为糠醛加氢合成环戊酮的最佳反应时间,此时,糠醛的转化率、环戊酮的选择性和收率分别为100%、52.9%和52.9%。
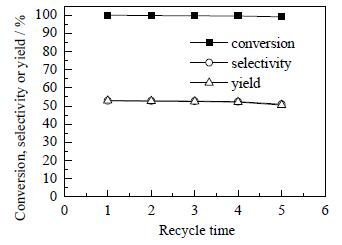
3.9 催化剂的稳定性考察催化剂的稳定性数据是催化剂走向工业化应用的关键,为此在反应温度为160℃、氢气分压为0.8 MPa、反应时间为6 h的条件下,考察了非晶态Ni-Cu-B催化剂的稳定性,结果如图 12所示。
|
图 12 非晶态Ni-Cu-B催化剂的活性与反应次数的关系 Fig.12 Effects of recycle time on catalyst activity |
从图 12可以看出,Ni-Cu-B催化剂在使用5次后,反应的转化率和选择性略有降低但降低幅度很小,说明催化剂的活性较稳定。
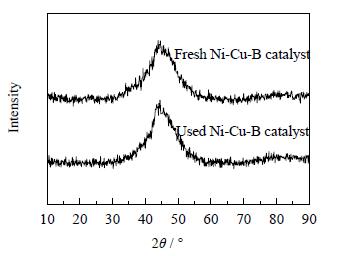
3.10 Ni-Cu-B非晶态催化剂失活机理分析为了了解催化剂的失活机理,分别对新鲜催化剂和使用5次后的催化剂进行了表征分析。
由图 13可知,使用前后催化剂的XRD谱图大致相同,均只在2θ=45°处出现宽的弥散峰,该峰为非晶态催化剂的特征衍射峰,这表明非晶态Ni-Cu-B催化剂使用5次后仍保持非晶态结构。反应5次后的非晶态Ni-Cu-B催化剂在2θ=45°处的峰几乎没变,根据Scherrer公式:D=Kλ/βcosθ(K为常数,λ为衍射波长,β为半峰宽) 可以得到,反应5次后的非晶态Ni-Cu-B催化剂的颗粒大小没变。由图 14可以看出,反应5次后的催化剂已经开始团聚,反应物分子接触到催化剂的活性中心的几率减少,因此催化剂的活性降低。由表 3可知,非晶态催化剂的比表面积和孔容减小,而孔径反而增大,原因可能是反应后的催化剂部分团聚使得比表面积和孔容变小;反应后的催化剂会积炭,积炭一方面会堵塞部分微孔 (小孔),使得微孔所占的比例降低,大孔的比例相对增加,另一方面,积炭分子可以搭建成一些大的机械孔 (二次孔),同样使得大孔比例增加或是温度高时小孔塌陷了转变成大孔了,从而使得孔径增大。
|
图 13 非晶态Ni-Cu-B催化剂使用前后的XRD谱图 Fig.13 XRD patterns of the fresh and used amorphous Ni-Cu-B catalysts |

|
图 14 非晶态Ni-Cu-B催化剂的SEM谱图 Fig.14 SEM micrographs of the fresh (a) and used (b) amorphous Ni-Cu-B catalysts |
| 表 3 非晶态Ni-Cu-B催化剂使用前后的质构特性 Table 3 Properties of the fresh and used amorphous Ni-Cu-B catalysts |
采用化学还原法制备了Ni-B和Ni-Cu-B非晶态合金催化剂,以Ni-B催化剂为研究对象考察了镍源、硼镍摩尔比、Cu添加量对催化剂加氢性能的影响,通过对Ni-B和Ni-Cu-B非晶态催化剂表征分析探讨助剂Cu对催化剂吸氢性能、化学环境的影响,对该反应进行了工艺条件的优化,考察了反应温度、氢气分压和反应时间对该工艺的影响,最后考察了非晶态Ni-Cu-B非晶态催化剂的活性稳定性,研究了该催化剂的失活机理,得出以下结论:(1) 采用化学还原法制备Ni-Cu-B非晶态合金催化剂的最佳条件为:以氯化镍为镍源,硼镍摩尔比为4,xCu=5%(mol)。(2) 助剂Cu的添加增大了催化剂的吸氢能力,导致Ni-Cu-B中的金属Ni为富电子状态,而B为缺电子状态,更利于加氢反应。(3) 该反应的最佳工艺条件为反应温度160℃、氢气分压0.8 MPa以及反应时间6 h。(4) 非晶态Ni-Cu-B催化剂在循环使用5次后保持不失活,说明催化剂有较好的活性稳定性。(5) 对反应5次后的催化剂进行表征分析发现,反应后的催化剂的比表面积和孔容均减少,并产生团聚现象,但其非晶态结构不变,说明催化剂活性降低的原因可能是反应中产生的副产物覆盖了催化剂的活性中心,导致反应物分子接触到催化剂活性中心的几率减少。
| [1] | ZHAO Tian-bao(赵天宝), et al. Handbook of chemical reagents and chemicals(化学试剂·化学药品手册)[M].2nd edition.Beijing(北京): Chemical Industry Press(化学工业出版社), 2006: 315-316. |
| [2] | SUN Xiao-li(孙晓莉), ZHANG Sheng-yong(张生勇), ZHOU Heng-yin(周恒寅), et al. The research on technological means of prodution of methyl dihydrojasmonate(二氢茉莉酮酸甲酯生产工艺的研究)[J]. Flavour Fragrance Cosmetics(香料香精化妆品) , 2002(3): 11-13. |
| [3] | Hailes H C. Advances in flavours and fragrances[J]. Special Publication-Royal Society of Chemistry , 2002, 277: 127-137. |
| [4] | MA Shu-yun(马淑云), HOU Ling(侯玲), GU Tie-sheng(顾铁生). Synthesis of 2-hexanalcyclopentanone(2-正己基环戊酮的合成)[J]. Journal of Shenyang University of Technology(沈阳工业大学学报) , 2005, 27(2): 235-237. |
| [5] | YUAN Jian-yong(袁建勇), GUO Hui-yuan(郭惠元), LI Zhuo-rong(李卓荣), et al. Studies on total synthesis of enediyne antitumor antibiotics. Synthesis of acyclic derivative of Ⅲ 10-membered cyclic enediyne unit(烯二炔类抗肿瘤抗生素全合成研究Ⅲ.十元环状烯二炔单元开链衍生物的合成)[J]. Chinese Journal of Antibiotics(中国抗生素杂志) , 2000, 25(2): 150-152. |
| [6] | HAN Juan (韩娟). Studies on synthesis of an analogue of Cefpirome (头孢匹罗类似物的合成研究) [D]. Tianjin (天津): Tianjin University (天津大学), 2005. |
| [7] | XU Li-ying(徐莉英), DONG Jin-hua(董金华), CHEN Guo-liang(陈国良), et al. Synthesis and antiinflammatory activity of 2-(E)-(3, 5-di-tert-butyl-4-hydroxybenzylidene) cyclopentanone and its derivatives((2-(E)-(3, 5-二叔丁基-4-羟基亚苄基) 环戊酮类化合物的合成及其抗炎活性))[J]. Chinese Journal of Medicinal Chemistry(中国药物化学杂志) , 2000, 10(4): 235-238. |
| [8] | YAO Yan-lai(姚燕来), MIN Hang(闵航), LÜ Zhen-hua(吕振华). Advances in microbial degradation pathways of cyclopentanone and cyclohexanone and the involved enzymes and genes(环戊酮和环己酮的微生物降解途径、相关酶和基因研究进展)[J]. Chinese Journal of Applied & Environmental Biology(应用与环境生物学报) , 2006, 12(3): 445-448. |
| [9] | ZHANG Zhen-ming(张振明), JIA Yong-gang(贾永刚), WANG Can-ming(汪灿明), et al. The synthesis of phenylurea fungicide, pencycuron(脲类杀菌剂戊菌隆的合成)[J]. Pesticides(农药) , 2003, 42(11): 19-20. |
| [10] | MA Jing-zhong(马敬中), HU Chao-nan(胡超男), ZHAN Sheng-wei(占升卫), et al. Study on synthesis and herbicidal effects of novel 1, 4-dioxoquinoxaline formaldehyde dihydrazones(1, 4-二氧喹喔啉甲醛双腙的合成及除草活性研究)[J]. Modern Chemical Industry(现代化工) , 2005, 25(6): 34-37. |
| [11] | Renz M. Ketonization of carboxylic acids by decarboxylation:mechanism and scope[J]. European Journal of Organic Chemistry , 2005, 36(29): 979-988. |
| [12] | Dubkov K A, Panov G I, Starokon E V, et al. Non-catalytic liquid phase oxidation of alkenes with nitrous oxide. 2. Oxidation of cyclopentene to cyclopentanone[J]. Reaction Kinetics & Catalysis Letters , 2002, 77(77): 197-205. |
| [13] | Marquie J, Laporterie A, Dubac J, et al. Graphite-supported ketodecarboxylation of carboxylic diacids[J]. Synlett , 2001(4): 493-496. |
| [14] | XU Jie (徐杰), YANG Yan-liang (杨艳良), DU Zhong-tian (杜中田), et al. Method for preparing cyclopentanone by using furfural as raw material (一种以糠醛为原料制备环戊酮的方法): CN, 103159606A [P]. 2013-06-19. |
| [15] | Hronec M, Fulajtarova K. Selective transformation of furfural to cyclopentanone[J]. Catalysis Communications , 2012, 24: 100-104. DOI:10.1016/j.catcom.2012.03.020. |
| [16] | Hronec M, Fulajtarova K, Liptaj T. Effect of catalyst and solvent on the furan ring rearrangement to cyclopentanone[J]. Applied Catalysis A:General , 2012, 437-438: 104-111. DOI:10.1016/j.apcata.2012.06.018. |
| [17] | Hronec M, Fulajtarova K, Micusik M. Influence of furanic polymers on selectivity of furfural rearrangement to cyclopentanone[J]. Applied Catalysis A:General , 2013, 468: 426-431. DOI:10.1016/j.apcata.2013.08.052. |
| [18] | Fang R, Liu H, Luque R, et al. Efficient and selective hydrogenation of biomass-derived furfural to cyclopentanone using Ru catalysts[J]. Green Chemistry , 2015, 17: 4183-4188. DOI:10.1039/C5GC01462J. |
| [19] | LI Meng-jie(李孟杰), ZHAO Hui-ji(赵会吉), DING Ning(丁宁), et al. Selective hydrogenation of furfural to synthesize cyclopentanone and cyclopentanol over raney copper catalyst(Raney铜催化糠醛选择性加氢制备环戊酮和环戊醇)[J]. Fine Chemicals(精细化工) , 2015, 32(1): 116-120. |
| [20] | Yang Y, Du Z, Huang Y, et al. Conversion of furfural into cyclopentanone over Ni-Cu bimetallic catalysts[J]. Green Chemistry , 2013, 15: 1932-1940. DOI:10.1039/c3gc37133f. |
| [21] | Zhou M, Zhu H, Lei N, et al. Catalytic hydroprocessing of furfural to cyclopentanol over Ni/CNTs catalysts:model reaction for upgrading of bio-oil[J]. Catalysis Letters , 2014, 144(2): 235-241. DOI:10.1007/s10562-013-1149-5. |
| [22] | Li X L, Deng J, Shi J, et al. Selective conversion of furfural to cyclopentanone or cyclopentanol using different preparation methods of Cu-Co catalysts[J]. Green Chemistry , 2015, 17: 1038-1046. DOI:10.1039/C4GC01601G. |
| [23] | Zhu H, Zhou M, Zeng Z, et al. Selective hydrogenation of furfural to cyclopentanone over Cu-Ni-Al hydrotalcite-based catalysts[J]. Korean Journal of Chemical Engineering , 2014, 31(4): 593-597. DOI:10.1007/s11814-013-0253-y. |
| [24] | Yokoyama A, Komiyama H, Inoue H, et al. The hydrogenation of carbon monoxide by amorphous ribbons[J]. Journal of Catalysis , 1981, 68(2): 355-361. DOI:10.1016/0021-9517(81)90104-4. |
| [25] | Yoshida S, Yamashita H, Funabiki T, et al. Hydrogenation of olefins over amorphous Ni-P and Ni-B alloys prepered by the rapid quenching method[J]. Journal of the Chemical Society Chemical Communications , 1982, 16(16): 964-965. |
| [26] | SUN Jun-qing(孙军庆), YAN Xin-huan(严新焕), LI Bo(李波), et al. Liquid-phase hydrogenation of m-chloronitrobenze over Ni-M-P amorphous alloy catalyst(非晶态Ni-M-P催化剂用于间氯硝基苯加氢的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2006, 20(6): 1009-1012. |
| [27] | ZHANG Yan-xia(张艳霞), BAI Xue-feng(白雪峰). Study on preparation and catalytic hydrogenation property of amorphous alloys Ni-Mo-B catalyst(Ni-Mo-B非晶态合金催化剂制备及其催化加氢性能研究)[J]. Chemistry and Adhesion(化学与粘合) , 2010, 32(2): 7-10. |
| [28] | Li H, Zhao Q, Li H. Selective hydrogenation of p-chloronitrobenzene over Ni-P-B amorphous catalyst and synergistic promoting effects of B and P[J]. Journal of Molecular Catalysis A:Chemical , 2008, 285(1-2): 29-35. DOI:10.1016/j.molcata.2008.01.025. |
| [29] | Yan X, Sun J, Wang Y, et al. A Fe-promoted Ni-P amorphous alloy catalyst (Ni-Fe-P) for liquid phase hydrogenation of m-and p-chloronitrobenzene[J]. Journal of Molecular Catalysis A:Chemical , 2006, 252(1-2): 17-22. DOI:10.1016/j.molcata.2006.01.060. |
| [30] | SHI Qiu-jie(石秋杰), LEI Jing-xin(雷经新), ZHANG Ning(张宁). Modification of Ni-B/TiO2-Al2O3(S) amorphous alloy catalyst Mo for liquid-phase furfural hydrogenation(糠醛液相加氢用Mo改性Ni-B/TiO2-Al2O3(S) 非晶态合金催化剂)[J]. Acta Physico-Chimica Sinica(物理化学学报) , 2007, 23(1): 98-102. |
| [31] | Shen J H, Chen Y W. Catalytic properties of bimetallic NiCoB nanoalloy catalysts for hydrogenation of p-chloronitrobenzene[J]. Journal of Molecular Catalysis A:Chemical , 2007, 273(1-2): 265-276. DOI:10.1016/j.molcata.2007.04.015. |
| [32] | Lu X, Yao K, Ouyang J, et al. Tribological characteristics and tribo-chemical mechanisms of Al-Mg-Ti-B coatings under water-glycol lubrication[J]. Wear , 2015, 326-327: 68-73. DOI:10.1016/j.wear.2014.12.034. |
| [33] | Li H, Li H, Deng J F. Glucose hydrogenation over Ni-B/TiO2 amorphous alloy catalyst and the promoting effect of metal dopants[J]. Catalysis Today , 2002, 74(1-2): 53-63. DOI:10.1016/S0920-5861(01)00530-2. |




