苯并噁嗪是一种新型热固性树脂,不仅具有良好的热性能、力学性能、阻燃性能和耐化学腐蚀性等,还具有较低的吸水率、表面能及灵活的分子设计性等,近年来受到了国内外的广泛关注。苯并噁嗪中的噁嗪环为扭曲的半椅式结构,稳定性较差,可在较高温度下发生开环反应,形成一对可逆的亚胺离子和碳正离子中间体,碳正离子中间体通过优先进攻酚羟基的邻、对位(也可与酚氧负离子或活性较低的苯胺对位反应)而引起链增长,并最终得到类似酚醛树脂结构的聚苯并噁嗪。但是,苯并噁嗪热开环聚合温度较高(一般高于180 ℃)、固化时间较长,使其不易成型加工。因此,降低苯并噁嗪开环聚合温度、提高其固化速率一直都是该领域的研究热点[1-5]。
降低苯并噁嗪开环聚合温度的途径主要有2种,一是利用灵活的分子设计性制备具有特殊基团或结构的新型苯并噁嗪单体,如羧基[6]、羟基[7-8]、氰基[9]、氨基[10]、烯丙基[11]等,尽管这些基团的引入可以降低苯并噁嗪的开环聚合温度,但也存在着原料价格较高、合成困难或产率较低等不足,影响了其在实际生产中的应用。另一种就是向苯并噁嗪中加入催化剂,常用的催化剂包括质子酸、路易斯酸和有机碱等。其中,质子酸有乙酸、烯酸、苯磺酸等[5, 12-13],路易斯酸包括FeCl3、AlCl3、PCl5、TiCl4[14-16]、乙酰丙酮与第四周期金属复合物[17]及二芳基碘鎓盐[18]等,有机碱包括咪唑、4, 4’-联吡啶[19]等。与第1种方法相比,催化剂的引入尤其具有方便、经济等优点,更有利于苯并噁嗪的推广应用。因此,对于苯并噁嗪开环聚合催化剂的研究一直备受关注。
4-二甲氨基吡啶(DMAP)是一种近年来在有机合成、聚合反应等中得到广泛应用的新型催化剂[20-22],作为一种有机碱,其也可能促进苯并噁嗪的开环聚合,而且以前的研究表明,苯并噁嗪中吡啶基团的引入可以促进其开环聚合[23],4, 4’-联吡啶也可降低苯并噁嗪的固化温度[19]。但目前并无DMAP用于苯并噁嗪开环聚合的研究,而且与路易斯酸、有机质子酸等相比,DMAP还具有易储存、使用方便等优势,因此,本文进行了DMAP对苯并噁嗪开环聚合影响的研究。考虑到DMAP中可能仅有吡啶环上的N原子对噁嗪环的开环起促进作用,为进一步降低苯并噁嗪开环聚合温度,本文也同时研究了乙醇胺(其中的羟基和氨基都可能催化噁嗪环的开环)对其固化反应的影响,并以二者为混合催化剂,采用DSC、FTIR、in-situ FTIR和TGA研究它们对苯并噁嗪开环聚合过程、结构演变及其固化物热稳定性的影响。
2 实验部分 2.1 实验原料多聚甲醛,国药集团化学试剂有限公司;苯胺,天津市大茂试剂厂;苯酚、乙醇胺,广州市金华大化学试剂有限公司;4-二甲氨基吡啶(DMAP), 上海柏卡化学技术有限公司;甲苯、丙酮,成都市科龙化工试剂厂。
苯酚-苯胺型苯并噁嗪(pa)采用溶剂法制备:将0.2 mol多聚甲醛加入蒸馏水中(质量分数w=37%),溶解后降至室温,加入0.1 mol苯胺和适量甲苯,冰浴下反应0.5 h,然后加入0.1 mol苯酚,升温至80 ℃,反应5 h。接着依次用NaOH溶液和去离子水分别洗涤反应混合液直至中性,经除溶剂和真空干燥后,得浅黄色固体产品,经甲苯重结晶后为白色固体。FT-IR (KBr,cm-1):943(噁嗪环吸收峰),1 031和1 227 (C─O─C对称和不对称伸缩振动峰),1 599、1 583、1 490和1 456(苯环骨架振动峰)。1HNMR(CDCl3为溶剂,TMDS为内标,10-6):6.85~7.34(Ar─H),5.41(N─CH2─O),4.68(N─CH2─Ar)。Tm=56.6 ℃。pa的合成过程如图 1所示。文中除FTIR测试和动力学研究所用pa为重结晶样品外,其他实验所用pa均未经重结晶处理。

|
图 1 pa合成过程示意图 Fig.1 Synthetic route of pa |
DMAP和pa混合体系的制备:将pa溶于丙酮中,然后加入DMAP,于50 ℃下搅拌3 h,接着通过旋转蒸发仪和真空干燥除去溶剂,得到DMAP和pa混合体系。其中,DMAP与pa的w为3:97、5:95、7:93和10:90,分别记做3d/pa、5d/pa、7d/pa和10d/pa。
乙醇胺和pa混合体系的制备与d/pa相似,其中乙醇胺和pa的w为3:97、5:95和7:93,分别记做3e/pa、5e/pa和7e/pa。
DMAP、乙醇胺和pa混合体系的制备也与d/pa相同,当DMAP和乙醇胺的质量比为1:9、3:7、5:5和7:3,且混合催化剂与pa的w为1:9时,分别记做1d9e/pa、3d7e/pa、5d5e/pa和7d3e/pa。当DMAP和乙醇胺的质量相同时,二者与pa w为3:97、5:95和7:93的混合体系分别记做3de/pa、5de/pa和7de/pa。
2.3 聚苯并噁嗪的制备将pa在100 ℃真空干燥1 h,然后至鼓风干燥箱,按照以下程序固化:110 ℃/1 h、120 ℃/1 h、130 ℃/1 h、140 ℃/1 h、150 ℃/1 h、160 ℃/1 h、170 ℃/1 h、180 ℃/1 h、190 ℃/2 h,得聚苯并噁嗪Ppa。
3de/pa、5de/pa和7de/pa聚合物(简称为P3de/pa、P5de/pa和P7de/pa)的制备同Ppa。
2.4 测试表征傅里叶变换红外光谱(FT-IR):通过美国Nicolet公司IS 10型红外光谱仪进行测试,采用KBr压片法制备样品,扫描范围4 000~400 cm-1。
差示扫描量热分析(DSC):采用美国TA Q20差示扫描量热仪,氮气流速50 mL·min-1,升温速率分别为:2、5、10、15和20 ℃·min-1,温度测试范围:40~320 ℃。
原位傅里叶变换红外光谱(in situ-FTIR):采用PerkinElmer Frontier仪器,配备PIKE Technologies的Diffus IR反射附件。样品与KBr研磨混合制样,升温速率为2 ℃·min-1,测试温度范围为40~270 ℃,扫描范围4 000~400 cm-1。
热重分析(TGA):采用美国TA公司Discovery系列进行测试。样品量7~8 mg,氮气气氛,流量25 mL·min-1,升温速率10 ℃·min-1,测试范围40~810 ℃。
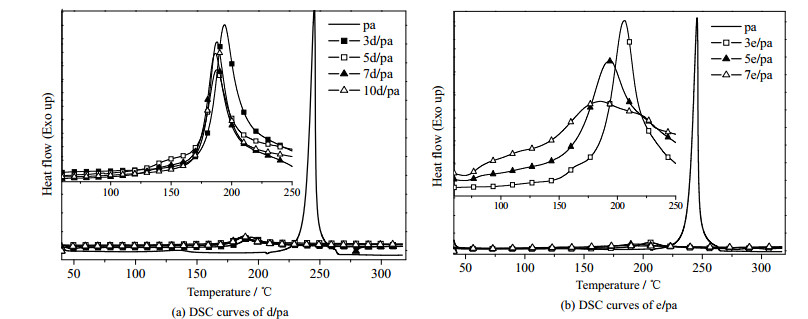
3 结果与讨论 3.1 DMAP和乙醇胺对pa开环聚合过程的影响 3.1.1 DSC测试d/pa混合物的DSC测试结果如图 2(a)和表 1所示。可见,随着DMAP的加入,pa的放热峰明显变宽,且其开环聚合的起始温度(Ti)和峰值温度(Tp)均向低温处明显移动。表明DMAP的加入不仅可促进pa的开环聚合,还可克服其聚合时放热集中的不足,有利于其成型加工。此外,图 2(a)和表 1也表明,当DMAP的加入量超过w = 5%后,pa的Ti和Tp变化不大,即使其含量达到w = 10%时,其Ti值仍较高(109.2 ℃)。为进一步降低苯并噁嗪开环聚合温度,下面尝试将乙醇胺加入到pa中。
|
图 2 d/pa和e/pa的DSC曲线 Fig.2 DSC curves of d/pa and e/pa |
|
|
表 1 DMAP和乙醇胺对pa开环聚合影响的DSC数据 Table 1 DSC results of DMAP/ethanolamine effects on the ring-opening polymerization of pa |
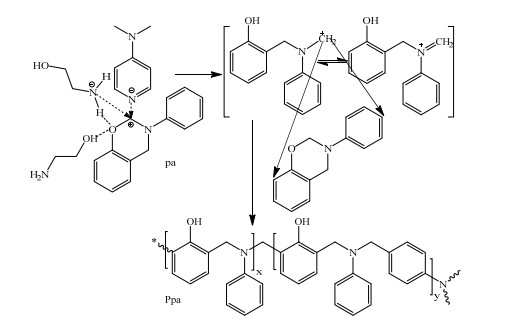
图 2(b)为e/pa的DSC曲线图,可见乙醇胺也能显著改善pa聚合放热集中的现象、明显降低其Ti和Tp,当乙醇胺的含量达到w = 5%时,pa的Ti值降低到72.7 ℃。可见与DMAP相比,乙醇胺更易使苯并噁嗪发生开环反应。这应该是由于乙醇胺中的─OH和─NH2不但均可与pa噁嗪环上的O原子形成氢键,其─NH2中富电子的N还可能与噁嗪环上N、O原子间带部分正电荷的C原子相互作用;但DMAP只有吡啶环上富电子的N原子可与带部分正电荷的C原子相互作用(见图 3)[8, 24]。这些相互作用的形成削弱了C─O键,使其更易断裂,导致噁嗪环的开环。但是与DMAP(沸点211 ℃)相比,乙醇胺(沸点170.5 ℃)较易挥发,不适于单独使用。因而,下面以乙醇胺和DMAP为混合催化剂,研究其对苯并噁嗪开环聚合的影响。
|
图 3 DMAP和乙醇胺对pa开环聚合的影响 Fig.3 Effects of DMAP and ethanolamine on the ring-opening polymerization of pa |
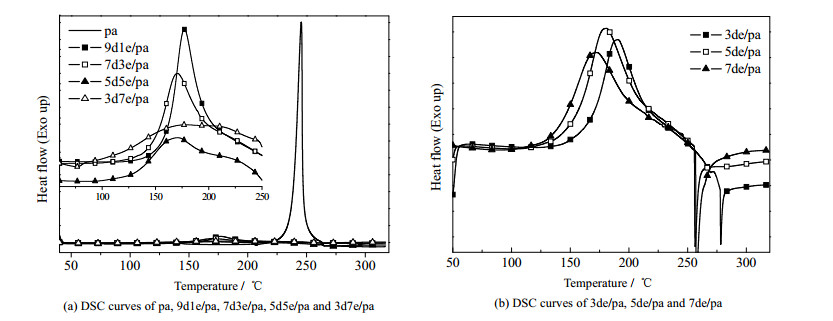
图 4(a)为乙醇胺和DMAP混合催化剂(总量均为pa的w = 10%)对pa开环聚合影响的DSC图,可见随着混合催化剂中乙醇胺比例的增加,pa的Ti逐渐向低温处移动、聚合放热峰也变得更宽,当DMAP和乙醇胺之比为3/7时,pa的Ti值降低到77.8 ℃,进一步表明乙醇胺更能促进pa的开环反应。由于乙醇胺较易挥发,下面选择等比例混合的DMAP和乙醇胺(简称为de)进行研究。de对pa开环聚合的影响如图 4(b)和表 1所示,可见随着de的增加,pa的Ti和Tp都逐渐降低。由表 1还可以看出,当上述催化剂在pa中的质量分数相同时,de/pa的Tp低于e/pa和d/pa,意味着乙醇胺和DMAP存在着一定的协同效应,即二者混合使用更能促进苯并噁嗪的开环聚合。
|
图 4 DMAP和乙醇胺混合体系对pa开环聚合的影响 Fig.4 Effects of DMAP and ethanolamine mixtures on the ring-opening polymerization of pa |
此外,还对不同固化阶段的pa和5 de/pa进行了DSC测试,结果见图 5。可见对于同一固化阶段的剩余热焓,5de/pa均明显低于pa,且5de/pa在180 ℃固化1 h后的剩余热焓基本为零,即此时pa已基本固化完全。表明乙醇胺和DMAP不仅可促进苯并噁嗪的开环,还可加速其聚合反应的进行。

|
图 5 pa和5de/pa在不同固化阶段的DSC曲线 Fig.5 DSC curves of pa and 5de/pa at the different curing stages |
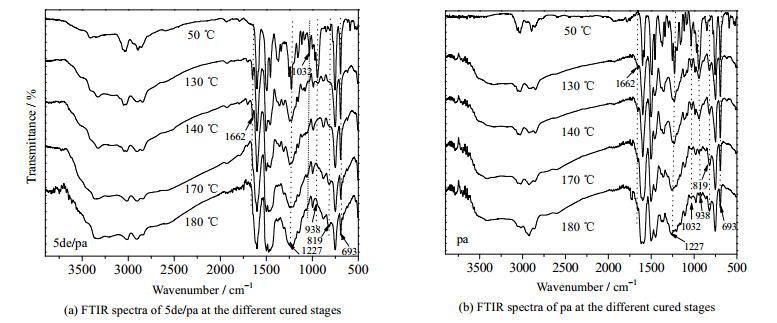
为进一步说明乙醇胺和DMAP混合体系对pa开环聚合的影响,下面以pa和5de/pa为例,对其在50 ℃搅拌3 h和不同固化阶段(见实验部分)的结构进行了FTIR测试,结果如图 6所示。对于5de/pa,在50 ℃搅拌3 h后,其在3 400到3 300 cm-1之间出现了酚羟基的吸收峰,说明此时pa已经发生了开环聚合反应;在130 ℃处理1 h后,其在938 cm-1处噁嗪环的特征峰及1 032、1 227 cm-1处C─O─C的对称和不对称吸收峰明显减弱;在140 ℃继续处理1 h后,噁嗪环的吸收峰消失、C─O─C的吸收峰也几乎观察不到,表明此时噁嗪环已基本全部开环;但其在1 662 cm-1处亚胺离子中间体(CH2=N+ < )的吸收峰[14]依然存在,说明苯并噁嗪开环和聚合是依次先后进行的过程;直到170 ℃固化1 h后,5de/pa中亚胺离子中间体的吸收峰才观察不到,表明此时pa已基本固化完全,而且,上面图 5的DSC测试也表明此时的剩余热焓仅为8.8 J·g-1,固化程度很高。
|
图 6 5de/pa和pa在不同固化阶段的FTIR图谱 Fig.6 FTIR spectra of 5de/pa and pa at the different curing stages |
至于pa,经过50 ℃搅拌3 h后,并没有出现酚羟基的吸收峰,说明无开环反应发生;在130 ℃固化1 h时可观察到亚胺离子中间体和酚羟基的吸收峰,表明发生了开环聚合反应,但其亚胺离子吸收峰明显弱于5de/pa;直到170 ℃固化1 h后,仍可在938、1 032和1 227 cm-1处观察到较明显的噁嗪环和C─O─C的吸收峰,说明此时pa中仍有较多噁嗪环存在。此外,1 662 cm-1处亚胺离子中间体的吸收峰在180 ℃固化1 h后依然存在,表明此时苯并噁嗪的聚合反应仍在继续进行,图 5的DSC测试结果也表明此时pa中仍有部分剩余热焓(8.8 J·g-1)。直至190 ℃固化2 h后,pa的噁嗪环才全部消失(见图 8),聚合反应基本结束。
此外,从图 6也可看出,除噁嗪环和C─O─C吸收峰的变弱、消失速率不同外,pa和5de/pa在每个固化阶段的吸收峰位置基本相似,意味着乙醇胺和DMAP混合体系的添加几乎不影响苯并噁嗪聚合过程中的结构变化,即DMAP和乙醇胺可能只影响苯并噁嗪开环聚合动力学。为进一步证明这种推断,下面采用in situ-FTIR和FTIR对pa和5de/pa聚合过程中的化学结构演变和最终固化物结构进行了分析。
3.2 DMAP和乙醇胺对苯并噁嗪聚合过程结构演变及固化物结构的影响 3.2.1 in-situ FTIR测试pa和5de/pa在110到270 ℃间的in-situ FTIR测试结果见图 7。其中,1 559至1 455 cm-1为苯环骨架振动吸收峰,1 374 cm-1处为─CH2的摇摆振动吸收峰,1 227和1 032(或1 033) cm-1是噁嗪环上C─O─C的不对称和对称振动吸收峰,944(或945) cm-1是噁嗪环的特征峰,816(或817) cm-1是1, 4-二取代苯环上C─H吸收峰,750和694(或755和693) cm-1是单取代苯环C─H吸收峰。可见,随着温度升高,pa和5de/pa的噁嗪环及C─O─C吸收峰逐渐减弱,噁嗪环逐渐开环;817(或816) cm-1处吸收峰的出现表明噁嗪环开环后形成的碳正离子中间体与苯胺对位发生亲电取代反应,生成1, 4-二取代苯环结构(见图 3);由于碳正离子与酚羟基邻位反应生成的1, 2, 6-三取代苯环吸收峰也出现在755 cm-1附近,加上单取代苯胺结构的减少,755与694 cm-1附近吸收峰的相对强度也在不断变化。而且,随着聚合的进行、苯环取代度的变化,苯环骨架振动吸收峰的位置和强度也在改变。此外,由图 7还可以看出,随着温度升高,pa和5de/pa各吸收峰的位置及其变化趋势基本一致,即DMAP和乙醇胺的引入几乎不影响苯并噁嗪开环聚合过程中的结构演变。
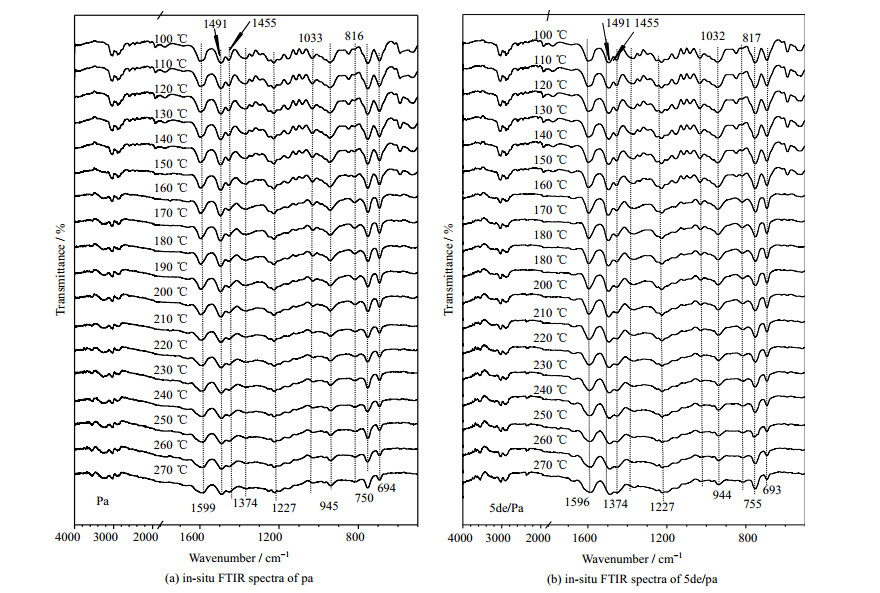
|
图 7 pa和5de/pa的in-situ FTIR图 Fig.7 In-situ FTIR spectra of pa and 5de/pa |
上述不同固化阶段的FTIR和in-situ FTIR测试表明,DMAP和乙醇胺几乎不影响苯并噁嗪聚合过程中的化学结构演变,因而二者也可能不影响苯并噁嗪固化物的化学结构。图 8为Ppa和Ppa/5de的FTIR测试结果,可见Ppa和P5de/pa各吸收峰的位置和强度度几乎一致,证明了DMAP和乙醇胺的加入几乎不影响聚苯并噁嗪的化学结构。
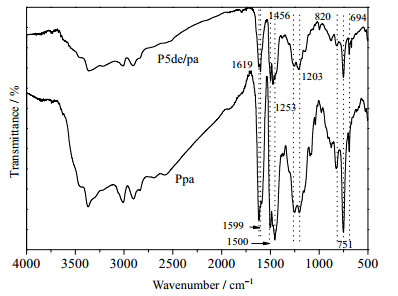
|
图 8 Ppa和P5de/pa的FTIR图 Fig.8 FTIR spectra of Ppa and P5de/pa |
Kissinger和Ozawa方法在动力学研究中常用于各种反应活化能的计算,其在苯并噁嗪聚合和降解动力学研究中也被广泛应用,Kissinger和Ozawa方程如式(1)和(2)所示。下面通过对pa和5de/pa体系进行非等温DSC测试,并采用Kissinger和Ozawa方法计算其开环聚合反应的表观活化能(Ea)。DSC测试结果如图 9和表 2所示。
| $ \text{Kissinger}法:\ln \left(\beta / T_{\mathrm{p}}^{2}\right)=-E_{\mathrm{a}} / R T_{\mathrm{p}}+\ln \left(A R / E_{\mathrm{a}}\right) $ | (1) |
| $ \text{Ozawa}法:\ln \beta=\ln \left(A E_{\mathrm{a}} / R\right)-\ln F(\alpha)-5.331-1.052\left(E_{\mathrm{a}} / R T_{\mathrm{p}}\right) $ | (2) |
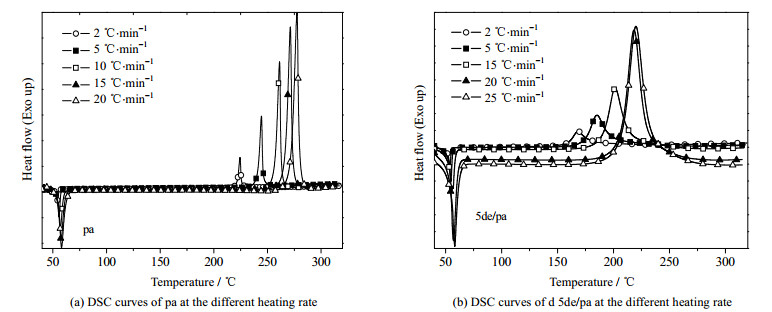
|
图 9 不同升温速率下的pa和5de/pa的DSC曲线图 Fig.9 DSC curves of pa and 5de/pa under different heating rates |
|
|
表 2 pa和5de/pa在不同升温速率下的Tp值 Table 2 Tp of pa and 5de/pa under different heating rates |
式中F (α)是常数方程;β = dT /dt是升温速率;Ea是反应活化能;A是指前因子;Tp为峰值温度;R是气体常数(8.314 J·(mol·K)-1)。
对于Kissinger方法,以ln ( β /Tp2)、1/T分别为纵、横坐标作图;至于Ozawa方法,以lnβ、1/T分别为纵、横作图,所得拟合直线如图 10所示。根据拟合直线的斜率及截距,可分别计算出Ea。其中,通过Kissinger方法所得pa和5de/pa的Ea分别是90.95和68.74 kJ·mol-1,采用Ozawa方法所得pa和5de/pa的Ea分别是95.84和72.72 kJ·mol-1。可见与pa相比,5de/pa的Ea显著下降,Ea越小、反应越容易进行,进一步证明了DMAP和乙醇胺对苯并噁嗪开环聚合的促进作用。
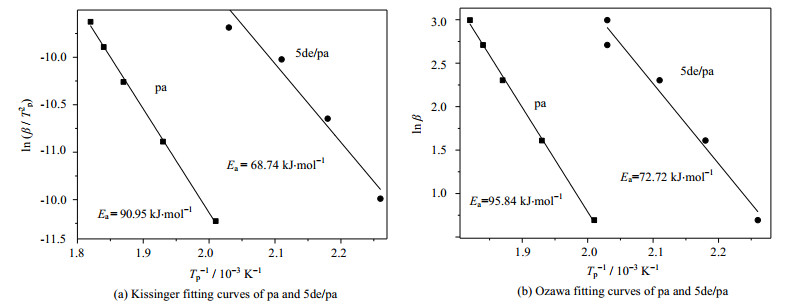
|
图 10 pa和5de/pa的Kissinger和Ozawa拟合曲线图 Fig.10 Kissinger and Ozawa fitting curves of pa and 5de/pa |
图 11为Ppa和P3de/pa、P5de/pa和P7de/pa的TGA测试结果。TGA曲线表明,DMAP和乙醇胺的加入使得聚苯并噁嗪的初始热稳定性降低,5%和10%失重向低温处移动;DTG曲线也表明Pde/pa在130到220 ℃间的热失重速率大于Ppa,这应该是由于DMAP和乙醇胺(沸点为211和170.5 ℃)在此温度范围内的挥发所致,造成Pde/pa在此阶段的重量损失速率大于Ppa。

|
图 11 Ppa、P3de/pa、P5de/pa和P7de/pa的TG和DTG曲线 Fig.11 TG and DTG curves of Ppa, P3de/pa, P5de/pa and P7de/pa |
此外,图 11中的DTG曲线还表明Ppa和Pde/pa均表现出相似的3阶段失重模式,分别发生在100~250、250~450和450~800 ℃,意味着DMAP和乙醇胺混合体系的加入基本不影响聚苯并噁嗪的结构,也与前述FTIR和in-situ FTR测试结果一致。因而Ppa和Pde/pa在800 ℃的残炭率也基本相同。
4 结论DMAP和乙醇胺不仅均可促进苯并噁嗪的开环聚合、使其固化起始和峰值温度明显降低,还可明显改善苯并噁嗪聚合放热集中的不足,乙醇胺甚至可使苯并噁嗪开环聚合起始温度降低至80 ℃以下。此外,DMAP和乙醇胺几乎不影响苯并噁嗪开环聚合过程中的结构演变及其最终固化物的结构,因此也基本不影响聚苯并噁嗪的热稳定性。即DMAP和乙醇胺只改变苯并噁嗪的固化动力学,而不影响其聚合物结构。加之DMAP和乙醇胺具有价格便宜、使用方便的优点,因而,它们是一类非常适宜于工业化应用的苯并噁嗪开环聚合催化剂,使苯并噁嗪更易加工成型。
| [1] |
DAI J Y, TANG N, PENG Y Y, et al. Biobased benzoxazine derived from daidzein and furfurylamine: microwave-assisted synthesis and thermal properties investigation[J]. ChemSusChem, 2018, 11(18): 1-10. |
| [2] |
WANG Z, ZHU H B, HE J, et al. Formation and mechanism of a super-hydrophobic surface with wear and salt spray resistance[J]. RSC Advances, 2017, 7(68): 43181-43185. DOI:10.1039/C7RA06669D |
| [3] |
闫红强, 王华清, 程捷, 等. 苎麻/苯并噁嗪层压板的制备及其阻燃改性[J]. 高校化学工程学报, 2015, 29(2): 366-371. YAN H Q, WANG H Q, CHENG J, et al. Preparation of ramie/benzoxazine laminate and its modification for flame retarding[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(2): 366-371. |
| [4] |
XU M Z, REN D X, CHEN L, et al. Understanding of the polymerization mechanism of the phthalonitrile-based resins containing benzoxazine and their thermal stability[J]. Polymer, 2018, 143(9): 28-39. |
| [5] |
DUNKERS J, ISHIDA H. Reaction of benzoxazine-based phenolic resins with strong and weak carboxylic acids and phenols as catalysts[J]. Journal of Polymer Science Part A Polymer Chemistry, 1999, 37(13): 1913-1921. DOI:10.1002/(SICI)1099-0518(19990701)37:13<1913::AID-POLA4>3.0.CO;2-E |
| [6] |
WANG Y X, ISHIDA H. Cationic ring-opening polymerization of benzoxazines[J]. Polymer, 1999, 40(16): 4563-4570. DOI:10.1016/S0032-3861(99)00074-9 |
| [7] |
MEN W W, LU Z J, ZHAN Z. Synthesis of a novel benzoxazine precursor containing phenol hydroxyl groups and its polymer[J]. Journal of Applied Polymer Science, 2008, 109(4): 2219-2223. DOI:10.1002/app.28247 |
| [8] |
ZHANG K, FROIMOWICZ P, HAN L, et al. Hydrogen-bonding characteristics and unique ring-opening polymerization behavior of ortho-methylol functional benzoxazine[J]. Journal of Polymer Science Part A Polymer Chemistry, 2016, 54(22): 3635-3642. DOI:10.1002/pola.28253 |
| [9] |
OHASH S, KILBANE J, HEYL T, et al. Synthesis and characterization of cyanate ester functional benzoxazine and its polymer[J]. Macromolecules, 2015, 48(23): 8412-8417. DOI:10.1021/acs.macromol.5b02285 |
| [10] |
WANG M W, LIN C H, JUANG T Y. Steric hindrance control synthesis of primary amine-containing benzoxazines and properties of the resulting poly(benzoxazine imide) thermosetting films[J]. Macromolecules, 2013, 46(22): 8853-8863. DOI:10.1021/ma401756d |
| [11] |
AGAG T A, TAKEICHI T. Synthesis and characterization of novel benzoxazine monomers containing allyl groups and their high performance thermosets[J]. Macromolecules, 2003, 36(16): 6010-6017. DOI:10.1021/ma021775q |
| [12] |
WANG B, YANG P, LI Y, et al. Blends of polybenzoxazine/poly(acrylic acid): Hydrogen bonds and enhanced performances[J]. Polymer International, 2017, 66(8): 1159-1163. DOI:10.1002/pi.5370 |
| [13] |
SUDO A, YAMASHITA H, ENDO T. Ring-opening polymerization of 1, 3-benzoxazines by p-toluenesulfonates as thermally latent initiators[J]. Journal of Polymer Science Part A Polymer Chemistry, 2011, 49(16): 3631-3636. DOI:10.1002/pola.24801 |
| [14] |
RAN Q C, ZHANG D X, ZHU R Q, et al. The structural transformation during polymerization of benzoxazine/FeCl3 and the effect on the thermal stability[J]. Polymer, 2012, 53(19): 4119-4127. DOI:10.1016/j.polymer.2012.07.033 |
| [15] |
ANG Y X, ISHIDA H. Cationic ring-opening polymerization of benzoxazines[J]. Polymer, 1999, 40(16): 4563-4570. DOI:10.1016/S0032-3861(99)00074-9 |
| [16] |
LIU C, SHEN D, SEBASTI R M. Catalyst effects on the ring-opening polymerization of 1, 3-benzoxazine and on the polymer structure[J]. Polymer, 2013, 54(16): 2873-2878. |
| [17] |
SUDO A, HIRAYAMA S, ENDO T. Highly efficient catalysts-acetylacetonato complexes of transition metals in the 4th period for ring-opening polymerization of 1, 3-benzoxazine[J]. Journal of Polymer Science Part A Polymer Chemistry, 2010, 48(2): 479-484. DOI:10.1002/pola.23810 |
| [18] |
ZHANG D, YUE J, LI H, et al. Curing kinetics study of benzoxazine using diaryliodonium salts as thermal initiators[J]. Thermochimica Acta, 2016, 643(11): 13-22. |
| [19] |
王彬, 杨坡, 徐宏彬, 等. 双酚A-苯胺型苯并噁嗪/4, 4'-联吡啶共混物研究[J]. 热固性树脂, 2017, 32(3): 25-29. WANG B, YANG P, XU H B, et al. Study on the blends of bisphenol A-aniline based polybenzoxazine/4, 4'-bipyridine[J]. Thermosetting Resin, 2017, 32(3): 25-29. |
| [20] |
黄新炜, 刘建利. 基于烯胺腈结构的吡喃香豆素并嘧啶类化合物的合成及抗肿瘤活性研究[J]. 有机化学, 2018, 38(1): 1233-1241. HUANG X W, LIU J L. Synthesis and anticancer activities of novel pyranocoumarin fused pyrimidine based on cyanoenamine[J]. Chinese Journal of Organic Chemistry, 2018, 38(1): 1233-1241. |
| [21] |
张林, 林赛赛, 魏平, 等. 4-二甲氨基吡啶催化的界面聚合法制备超支化聚乙烯亚胺复合膜[J]. 催化学报, 2012, 33(10): 1730-1735. ZHANG L, LIN S S, WEI P, et al. Preparation of hyperbranched polyethyleneimine composite membrane using interfacial polymerization catalyzed by 4-dimethylamiopryidine[J]. Chinese Journal of Catalysis, 2012, 33(10): 1730-1735. |
| [22] |
周德文, 翟佳欣, 李硕.环氧/酸酐/DMPA体系固化动力学与溶解性研究[J]. 2017, 29(11): 1760-1764. ZHOU D W, ZHAI J X, LI S. Study on curing behavior and solubility of epoxy/anhydride/DMAP[J]. Chemical Research and Application.2017, 29(11): 1760-1764. |
| [23] |
SHIBAYAMA Y, KAWAUCHI T, TAKEICHI T. Synthesis and properties of polybenzoxazines containing pyridyl group[J]. High Performance Polymer, 2014, 26(1): 60-68. DOI:10.1177/0954008313495245 |
| [24] |
SUN J Q, WEI W, XU Y Z, et al. A curing system of benzoxazine with amine: Reactivity, reaction mechanism and material properties[J]. RSC Advances, 2015, 5(25): 19048-19057. DOI:10.1039/C4RA16582A |




