2-乙基己醇(2-ethylhexanol,2EHO,在丁辛醇行业内又称辛醇)是重要的基本有机化工原料,主要用于生产对苯二甲酸二辛酯、乙二酸二辛酯等增塑剂,亦可作为制备压敏粘合剂、表面活性剂等的原料[1-2]。目前,2-乙基己醇的工业生产主要由丙烯氢甲酰化合成正丁醛、正丁醛自缩合生成2-乙基-2-己烯醛和2-乙基-2-己烯醛加氢得到2-乙基己醇三个反应过程组成。将正丁醛自缩合反应与2-乙基-2-己烯醛加氢反应进行集成,实现正丁醛一步合成2-乙基己醇反应,可省去中间分离精制过程、简化工艺流程、缩短生产周期、降低生产成本。在该反应集成体系中,存在正丁醛自缩合与正丁醛加氢两个相互竞争的平行反应,还存在正丁醛自缩合与其产物加氢两个连串反应,缩合产物加氢与正丁醛加氢也形成平行反应。因此,如何提高目的产物的选择性,特别是提高2-乙基己醇与正丁醇选择性之比尤为重要。
目前,有关正丁醛一步合成2-乙基己醇反应的研究较少。KELLY等[3-4]在2段固定床反应器上研究了正丁醛自缩合与2-乙基-2-己烯醛加氢反应过程集成,催化剂分别为Na/SiO2和Cu/ZnO。正丁醛转化率最高为31.7%,产物中2-乙基己醇仅占23.3%,其余为正丁醇。SHARMA等[5-8]以镁铝水滑石负载钌络合物为催化剂,以丙烯与合成气为原料,通过“一锅法”分步液相反应合成C8醛和C8醇。结果表明,在反应温度250 ℃下、采用镁铝比为3.5的催化剂,2-乙基己醇的选择性最高为18%。LIANG等[9]制备了Ni/Ce-Al2O3双功能催化剂,在适宜的反应条件下,正丁醛转化率为100%,2-乙基己醇收率为66.9%,但正丁醛直接加氢副反应影响较大,2-乙基己醇与正丁醇选择性之比(S2EHO/SBO)仅为2.71。
镁铝水滑石是一种具有典型的层状结构的阴离子黏土材料,由层间阴离子与带正电荷层板组成。由镁铝水滑石焙烧得到的复合氧化物MgAlOx同时具有酸性中心和碱性中心,酸碱协同作用使得催化剂具有更好的催化效果[10],并且其表面酸碱性可以通过改变Mg/Al摩尔比、阳离子种类和焙烧条件等方法来调变[11-12]。本文利用镁铝水滑石的层状结构,将铜离子浸渍至水滑石中,制备了富含酸碱活性中心和加氢活性中心的多功能Cu-Mg-Al催化剂,以期提高2-乙基己醇的选择性,特别是提高2-乙基己醇与正丁醇选择性之比。
2 实验部分 2.1 化学原料与试剂正丁醛、碳酸钠、硝酸镁、硝酸铝和硝酸铜为分析纯,购自天津市大茂化学试剂厂;无水乙醇和氢氧化钠也为分析纯,购自天津市风船化学试剂科技有限公司。所有试剂和原料使用前均未进行提纯精制处理。
2.2 催化剂的制备首先采用共沉淀法制备不同Mg/Al摩尔比的水滑石化合物,再用等体积浸渍法制备Cu-Mg-Al催化剂,具体操作如下。称取一定摩尔比的Mg(NO3)2·6H2O和Al(NO3)3·9H2O,将其溶解到蒸馏水中制得溶液A;将一定质量比的NaOH和Na2CO3加入到蒸馏水中,溶解后得到溶液B。将溶液A与溶液B在搅拌条件下采用双滴共沉淀法混合,维持体系的pH值在9.5左右。混合液于85 ℃下老化18 h,过滤并采用蒸馏水洗涤沉淀直至中性。将所得滤饼于110 ℃下干燥12 h得到Mg-Al水滑石化合物。将一定量的硝酸铜溶液浸渍到水滑石化合物上得到催化剂前驱体CuMgAl-LDH,在室温下老化24 h后,于110 ℃下干燥12 h,再于550 ℃下焙烧4 h后得到混合氧化物CuMgAl-LDO。最后,将CuMgAl-LDO在H2含量为30%的N2-H2混合气中于250 ℃还原处理4 h,得到金属-酸-碱多功能催化剂Cu/MgAlOx。
2.3 催化剂表征在日本理学株式会社生产的Rigaku D/max-2500型X射线衍射仪上对催化剂样品进行物相分析。Cu靶,SS/DS = 1°,RS = 0.15 mm,石墨单色滤光片,100 mA,40 kV,2θ = 10°~90°,扫描速率12 °·min-1。采用德国Bruker公司生产的VECTOR 22型傅立叶红外光谱分析法测定样品中所含的官能团。仪器分辨率为4 cm-1,波数:400~4 000 cm-1,扫描速度:0.2 cm-1,采用溴化钾与催化剂粉末混合压片制备试样。采用美国Micromeritics AutoChem II-2920化学吸附仪对催化剂表面的酸碱性进行测试。采用英国马尔文(Marlvem)公司生产的Mastersizer2000型激光粒度分析仪对制备得到的水滑石样品的粒径分布进行分析。使用FEI公司Nova Nano SEM 450场发射扫描电子显微镜对催化剂进行SEM分析,加速电压为200 kV。
2.4 活性评价正丁醛一步合成2-乙基己醇反应在100 mL高压反应釜中进行。具体操作过程如下:向高压反应釜中加入30 g正丁醛和一定量固体催化剂,在确保反应釜气密性良好的前提下,用H2置换釜内空气3次;将反应混合物在搅拌下升温至180 ℃后向釜中充入H2,并维持釜内压力,到达反应时间后停止加热并停止充入H2;将反应釜于冰水中冷却,放气泄压拆釜,将产液减压抽滤,再用气相色谱对滤液进行定量分析。
2.5 产物分析采用北京北分瑞利分析仪器有限责任公司的3420A型气相色谱仪对产物进行定量分析。色谱分析条件:载气为N2,载气流量30 mL·min-1,氢火焰检测器,检测器温度220 ℃,气化室温度220 ℃,进样量0.2 μL。KB-1毛细管柱,采用程序升温控制色谱柱温:初温100 ℃,保持2 min,以10 ℃·min-1的速率升温至200 ℃,保持10 min。
3 结果与讨论作为一种层状晶体材料,镁铝水滑石层板和层间离子具有很强的可调控性。不同的制备条件会对水滑石的晶粒结构和形貌特性产生不同影响,进而影响以水滑石为前驱体衍生的催化剂的催化性能。因此,本文开展了Cu/Mg/Al摩尔比、晶化过程、焙烧温度和还原温度等因素对水滑石衍生催化剂催化性能影响的研究。
3.1 Cu/Mg/Al摩尔比的影响 3.1.1 催化剂前驱体的结构表征在65 ℃下晶化18 h制备得到的水滑石样品MgAl-LDHs及浸渍硝酸铜后得到CuMgAl-LDHs样品的XRD分析如图 1和图 2所示。可以看出,在2θ为12.1°、23.5°、34.0°、37.9°、48.0°、61.0°、61.9°和66.9°附近出现了水滑石(003)、(006)、(012)、(015)、(018)、(110)、(113)和(116)晶面对应的特征峰,表明合成的样品是水滑石结构[13]。图 1中样品2和3谱图的出峰位置均轻微向低角方向发生移动,是由于Mg2+的增加和Al3+的相对减少使得层板正电荷与层间阴离子的作用相应减小造成的,层间距随之增大。由图 2可以看出,在2θ为12.1°、23.5°、34.0°、37.9°、61.0°和61.9°附近同样出现了水滑石的特征峰,表明在浸渍硝酸铜后,水滑石仍然保持着特有的层状结构。
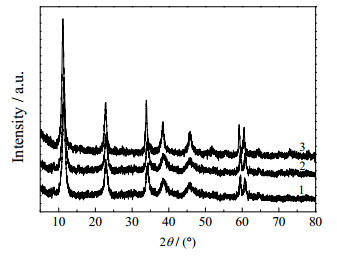
|
图 1 MgAl-LDHs样品的XRD谱图 Fig.1 XRD patterns of MgAl-LDHs samples 1. Mg2Al-LDH 2. Mg2.5Al-LDH 3. Mg3Al-LDH |
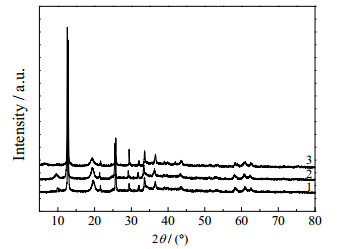
|
图 2 CuMgAl-LDHs样品的XRD谱图 Fig.2 XRD patterns of CuMgAl-LDHs samples 1. CuMg2Al-LDH 2. CuMg2.5Al-LDH 3. CuMg3Al-LDH |
为了进一步分析样品的水滑石结构,对水滑石前驱体样品进行了FT-IR分析,结果如图 3所示。可以看出,在3 494 cm-1处出现了归属于羟基中氢键的伸缩振动峰,与在3 600 cm-1附近游离的─OH伸缩振动峰相比,该吸收峰向低波数方向产生了偏移且峰宽变大,这是因为水滑石层间存在的分子内水受层板羟基静电作用力的影响,使该振动峰发生了偏移。在1 644 cm-1处出现了归属于结晶水中羟基的弯曲振动峰,表明所得样品层间插入水分子或者表面吸附水分子。在1 380 cm-1处的尖峰可能是样品浸渍硝酸铜后表面吸附的NO3-[14]。在651和427 cm-1处的吸收峰归属于M─O (M=Cu,Mg,Al)八面体中的晶格振动,以及M─O─M和O─M─O的弯曲振动。随着Cu/Mg/Al比的改变,M─O─M比的改变,M─O─M的振动峰位置略有所变化,说明金属离子之间的相互作用随着金属离子的配比不同而有所不同。
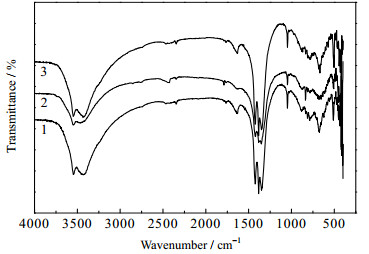
|
图 3 CuMgAl-LDHs样品的FT-IR谱图 Fig.3 FT-IR spectra of CuMgAl-LDHs samples 1. CuMg2Al-LDH 2. CuMg2.5Al-LDH 3. CuMg3Al-LDH |
经过550 ℃焙烧4 h和450 ℃还原4 h得到了不同Mg含量的Cu-Mg-Al催化剂(其中Cu/Mg/Al分别为1:2:1,1:2.5:1和1:3:1),评价了其催化性能,结果见表 1。可以看出,随着Mg/Al比的增加,C8的选择性(S2E2H+S2EH+S2EHO)增大。推测这是由于MgO在催化剂中提供碱性位,碱中心尤其是与活性中心Cu0产生协同作用的强碱位的增多,可以与羰基C=O基团的π*轨道进行相互作用,活化底物分子上的羰基,使得羰基变得更加容易进攻,从而使催化反应能够更迅速有效地进行[15-16],促进了正丁醛的缩合反应。同时,催化剂表面产生的大量Cu活性中心以及Cu和MgO界面上存在的缺陷中心能够很好地相互作用[17],也使得催化剂具有更好的催化加氢性能。但是,随着碱中心的增加,与Cu0相互作用的碱中心过量,使得正丁醛上被活化的羰基还未缩合便发生了加氢反应,不利于2-乙基己醇的选择性提高,同时,当催化剂中镁含量过高时,其表面的强碱中心O2-太多而阻碍了反应中间体(2E2H)的脱附[18],从而影响了2E2H进一步的加氢反应,导致产液中有大量2E2H。由表 2可以看出,最佳的Mg/Al为2.5:1。
|
|
表 1 不同Mg/Al比的Cu-Mg-Al催化剂催化活性评价 Table 1 Activity of Cu-Mg-Al catalysts with different Mg/Al ratios |
|
|
表 2 Cu-Mg-Al催化剂的酸碱性 Table 2 Acidity and basicity of Cu-Mg-Al catalysts |
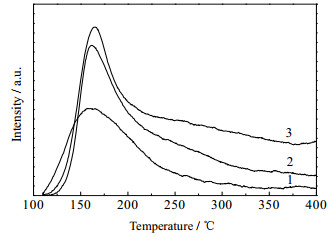
对制备的不同Mg/Al比的Cu-Mg-Al催化剂进行了NH3-TPD和CO2-TPD分析,结果如图 4和5所示,酸碱位积分数据如表 2所示。由图 4的NH3-TPD曲线可看出,3个样品均在低温有一个脱附峰,随着催化剂中Mg的比例逐渐增大,脱附峰的峰温逐渐向低温移动,脱附面积逐渐减小,其中样品2出现了肩峰,样品3在高温区出现了很弱的NH3脱附峰。推测这是因为催化剂中Mg和Al发生相互作用[10],随着Mg含量的增大,在Mg2+周围增加了较强的路易斯酸位点。由表 2中数据可以看出整体上催化剂中酸性位随着Mg的比例的增加而减少,酸强度降低。由图 5的CO2-TPD曲线可以看出,3个样品均在低温出现CO2脱附峰,随着催化剂中Mg的比例的增大,催化剂的CO2的脱附峰稍微向高温偏移,CO2脱附峰的面积明显增大。表明随着催化剂中Mg含量的增加,催化剂碱量增大,碱强度增强。由图 4和图 5可以得出,催化剂Cu/Mg2.5AlOx表面既含有弱酸位又含有较少量的弱碱位。酸-碱两性物质中的碱性位可以促进C=C键的加氢,提高C=C键加氢速率;酸性位可以促进C=O键加氢,提高C=O键加氢速率[20]。
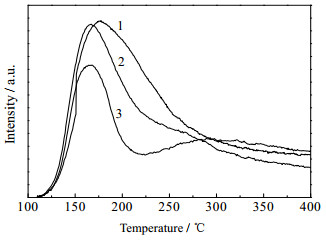
|
图 4 Cu-Mg-Al催化剂的NH3-TPD曲线 Fig.4 NH3-TPD curves of Cu-Mg-Al catalysts 1. Cu/Mg2AlOx 2. Cu/Mg2.5AlOx 3. Cu/Mg3AlOx |
|
图 5 Cu-Mg-Al催化剂的CO2-TPD曲线 Fig.5 CO2-TPD curves of Cu-Mg-Al catalysts 1. Cu/Mg2AlOx 2. Cu/Mg2.5AlOx 3. Cu/Mg3AlOx |
催化剂Cu/Mg2.5AlOx中匹配的酸碱中心使产物2-乙基己醇的选择性较高,其具有较好的催化效果。所以,下面固定Mg/Al比为2.5:1,考察不同铜含量的催化剂的活性,结果见表 3。
|
|
表 3 不同Cu含量的催化剂活性评价 Table 3 Activity of catalysts with different Cu contents |
Cu含量较低时会降低催化剂的加氢活性,使2-乙基-2-己烯醛无法完全加氢为2-乙基己醇;而较高的Cu含量虽然可以提高催化剂的加氢活性,同时也增强了正丁醛加氢反应对羟醛缩合反应的竞争力,不利于C8的选择性提高,从而使得2-乙基己醇的选择性降低。由表 3可看出,随Cu含量的提高,正丁醇收率增加,2-乙基己醇的收率和C8产物的选择性先升高后降低,正丁醛加氢副反应的竞争力逐渐增强。当催化剂中Cu:Mg:Al比为0.5:2.5:1时,加氢活性中心比较少,催化剂的加氢活性较低;当催化剂中Cu:Mg:Al比为1.5:2.5:1时,虽然催化剂的加氢活性较高,但催化正丁醛直接加氢的性能也较高,产物中正丁醇较多。总之,当催化剂中Cu:Mg:Al比为1:2.5:1时,催化剂活性最好,S2EHO/SBO为4.65,2-乙基己醇的收率最高,为57.6%。
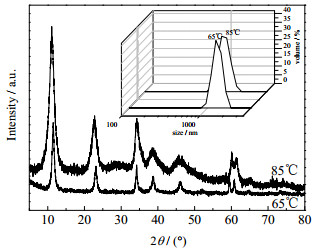
3.2 晶化过程的影响 3.2.1 晶化温度的影响影响晶体生长的重要的因素之一是晶化温度。由图 6可以看出,在其它条件不变的条件下,越高的晶化温度使得Mg-Al水滑石晶体生长速率也越快,晶粒尺寸越大,晶体结构往往越完整。反之,晶化温度越低,晶化速率慢,晶粒尺寸小,结构不完整。评价了在65和85 ℃ 2个晶化温度制备的Cu/Mg2.5AlOx的催化性能,结果如表 4所示。可以看出,在65和85 ℃晶化18 h得到的催化剂活性变化不明显,85 ℃晶化得到的催化剂的2-乙基己醇的收率稍微高一些。65和85 ℃晶化制得水滑石焙烧后复合氧化物的比表面积分别为45.7和51.3 m·g-1。这可能是由于85 ℃晶化得到水滑石的晶体结构较为完整所致。较大比表面的复合氧化物上铜分散度更高,从而有利于2-乙基-2-己烯醛加氢生成2-乙基己醇。
|
图 6 不同晶化温度制备得到的Mg2.5Al-LDHs的XRD谱图和粒度分析 Fig.6 XRD patterns and particle size analysis of Mg2.5Al-LDHs catalysts prepared at different crystallization temperatures |
|
|
表 4 不同晶化温度制备的催化剂Cu/Mg2.5AlOx活性评价 Table 4 Activity of Cu/Mg2.5AlOx catalysts prepared at different crystallization temperatures |
对在85 ℃晶化温度下,不同晶化时间制备得到的Mg2.5Al-LDHs水滑石样品进行了粒径分析。晶化时间2、5、8和18 h得到的水滑石粒径分别是615、1 419、2 050和2 215 nm。在水滑石的晶化过程中,晶化时间对水滑石晶体颗粒大小和晶体结构均匀性有着重要的影响。在晶化的最初几个小时里影响最为明显,其片状结构的生长速度较快,但随着晶化时间的增长,片状结构的形成减慢,晶化时间对粒子生长的影响减小。所以,如果晶化时间过短,结构不完整,生成的水滑石晶体杂晶多;时间过长,晶体结构已较为完整,但有可能使晶粒生长过度,LDH表面或者骨架内的Al3+向液相迁移形成Al2(CO3)3,进而影响水滑石衍生氧化物的催化性能[19]。
通过SEM对不同晶化时间制备的水滑石前驱体的表面形貌进行了分析。由图 7样品1和2可看出,85 ℃晶化2 h得到的水滑石Mg2.5Al-LDH,粒子的尺寸很小,约0.2 μm左右,晶化18 h后水滑石的粒子尺寸大小约1 μm左右。样品3是通过将硝酸铜浸渍至晶化18 h制备得到的Mg2.5Al-LDH后样品CuMg2.5Al-LDH的表面形貌。可以看出浸渍后的催化剂,仍然保持着水滑石的片状结构。

|
图 7 Mg2.5Al-LDHs和CuMg2.5Al-LDH样品的扫描电镜分析 Fig.7 SEM micrographs of CuMg2.5Al-LDH and Mg2.5Al-LDHs samples crystallized for different times 1. 2 hours 2. 18 hours 3. CuMg2.5Al-LDH |
表 5为不同晶化时间制备的Cu/Mg2.5AlOx催化性能评价数据。通过图 7的分析表明晶化时间对水滑石前驱体的形貌影响较大,结合表 5中数据结果可看出,不同晶化时间制备的催化剂对于正丁醛的转化率基本上没有影响,但对催化剂的加氢性能影响较明显。在晶化时间较短时,正丁醇的收率较高,随着晶化时间的延长,C8的选择性逐渐增大,2-乙基己醇的收率逐渐增大。推测这是由于通过水滑石前驱体制备催化剂,能够显著地提高金属与载体之间的相互作用,从而阻止活性金属粒子的团聚,提高活性金属的分散性[21]。同时,表明了由晶体结构完整均匀的水滑石前驱体制备得到的催化剂更有利于C8的加氢。因此,选择18 h作为适宜的晶化时间。
|
|
表 5 不同晶化时间制备Cu/Mg2.5AlOx催化剂活性评价 Table 5 Activity of Cu/Mg2.5AlOx catalysts prepared by different crystallization times |
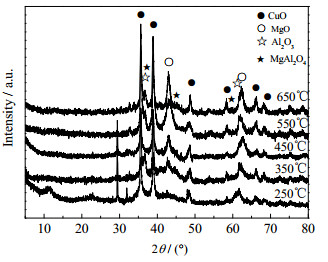
将CuMg2.5Al-LDH样品在不同温度下焙烧4 h后进行XRD分析,结果见图 8。可以看出,在250 ℃焙烧后的样品中,12.1°和23.5°对应的水滑石(003)和(006)晶面的衍射峰的强度有所减小,并出现了氧化物的峰,这可能由于在经250 ℃焙烧后,层间吸附水及部分羟基失去,层状结构开始有所破坏。在350~450 ℃,随着焙烧温度的升高,水滑石的结构消失,氧化物的衍射峰逐渐增强。据特征峰可以证实为氧化铜、氧化镁和氧化铝的衍射峰,并且随着焙烧温度的升高,氧化物的衍射峰强度增大,在焙烧温度为650 ℃时出现了镁铝尖晶石相的峰。
|
图 8 在不同温度下焙烧样品的XRD谱图 Fig.8 XRD patterns of samples prepared at different calcination temperatures |
评价不同焙烧温度下制备Cu/Mg2.5AlOx催化剂的性能,结果如表 6所示。当焙烧温度为250 ℃时,正丁醛的转化率和2-乙基己醇的收率都很低。随着温度的升高,正丁醛的转化率和2-乙基己醇的收率也在不断增大。当焙烧温度为550 ℃时,正丁醛的转化率达到97.9%,2-乙基己醇的收率达到59.5%,均达到最高。推测这是因为焙烧温度较低时,水滑石结构未完全破坏,羟醛缩合的活性中心主要来源于层间的羟基,单纯的羟基作为碱活性中心,使得催化剂的活性不高。提高焙烧温度后,伴随着CO2和H2O的脱除,具有碱性的晶格氧暴露出来,表面碱性增强,同时酸性中心也暴露出来。酸碱活性位可以同时对醛酮分子的α-H和C=O起活化作用,即起酸碱协同催化效应,有利于正丁醛缩合的进行[10]。而焙烧温度升至650 ℃时,正丁醛的转化率和2-乙基己醇的收率均有所降低,推测这是由于过高的焙烧温度,会引起催化剂的烧结而形成比表面积较小的尖晶石相MgAl2O4,从而影响到催化剂的活性。
|
|
表 6 不同焙烧温度下制备得到的催化剂Cu/Mg2.5AlOx活性评价 Table 6 Activity of Cu/Mg2.5AlOx catalysts prepared by different calcination temperatures |
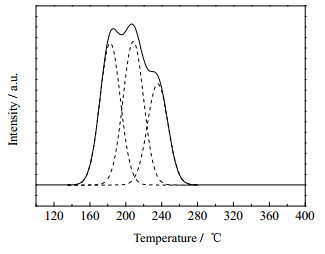
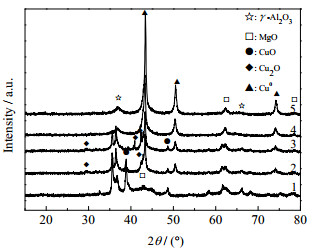
为了表征焙烧产物CuMg2.5Al-LDO样品的还原性,对其进行了氢气程序升温还原分析,结果如图 9所示。在图 9中程序升温还原曲线中,所有的氢气消耗都对应于样品中Cu2+物种的还原。在样品CuMg2.5Al-LDO中,温度区间为150~280 ℃的宽泛的氢气还原峰可以分为3个还原峰:峰位置低于200 ℃的峰对应于离散的髙分散CuO物种的还原,峰位置为210 ℃的还原峰可归属于小颗粒CuO物种的还原,峰位置为240 ℃的峰可归属于大颗粒的体相CuO物种的还原[22]。不同温度还原后的催化剂XRD谱图分析如图 10所示,水滑石经过550 ℃焙烧但未经还原的样品1中出现了归属于γ-Al2O3、MgO和CuO的特征峰。37.8°和67°处出现γ-Al2O3的特征衍射峰,43.0°、62.3°、74.6°和78.3°处出现MgO的特征衍射峰,38.7°和48.7°处出现了CuO的特征峰。在2和3样品的图谱中,29.6°、36.5°和42.4°分别归属于Cu2O在(110)、(111)和(200)晶面的衍射封,而随着还原温度的升高(样品4和5)在29.6°和36.5°处归属于Cu2O的峰消失,同时,在43.3°、50.4°和74.1°分别归属于Cu单质在(111)、(200)和(220)晶面上的特征衍射峰逐渐加强。由此可得出,随着还原温度的升高,样品经历了:CuO → Cu2O+Cu → Cu的还原过程。
|
图 9 催化剂CuMg2.5Al-LDO的H2-TPR图谱 Fig.9 H2-TPR curves of CuMg2.5Al-LDO catalysts |
|
图 10 不同温度还原后的催化剂XRD谱图 Fig.10 XRD patterns of catalysts with different reduction temperatures 1. unreduced 2. 150℃ 3. 250 ℃ 4. 350 ℃ 5. 450 ℃ |
表 7为不同还原温度制备的Cu/Mg2.5AlOx催化剂催化性能对比。可以看出,随着还原温度的升高,正丁醇的收率逐渐增大,而2-乙基己醇的收率呈先增大后降低的趋势。还原温度对催化剂性能的影响很大,由于在还原性气氛下,随着还原温度的升高,Cu0倾向于由体相向表面迁移[23],正丁醇收率逐渐增大,2-乙基己醇收率先增加后降低。当催化剂的还原温度为150 ℃时,虽然C8产物选择性最高,正丁醛羟醛缩合反应性能最好,但其较弱的加氢活性导致缩合产物不能完全加氢,反应产物主要为2-乙基-2-己烯醛。当催化剂的还原温度高于250 ℃时,因为正丁醇的收率逐渐增大,使得S2EHO/SBO降低。当催化剂的还原温度为250 ℃时,2-乙基己醇收率最高为61.3%。因此,选择还原温度较低的250 ℃作为催化剂适宜的还原温度。
|
|
表 7 还原温度对Cu/Mg2.5AlOx催化剂性能的影响 Table 7 Effects of reduction temperature on Cu/Mg2.5AlOx catalytic performance |
对Cu/Mg2.5AlOx催化正丁醛一步合成2-乙基己醇反应液进行了GC-MS分析,发现反应液中除了含有原料正丁醛和产物2-乙基己醇以外,还有正丁醇、2-甲基丁醇、正丁酸、丁酸乙酯、4-庚酮、丁酸丁酯、2-乙基-2-己烯醛、2-乙基-3-己烯醛、2-乙基己醛、2-乙基-2-己烯醇、丁酸-2-乙基己酯、丁酸-2-乙基-3-羟基己酯等。与本课题组LIANG等[9]采用Ni/Ce-Al2O3为催化剂催化正丁醛一步合成2-乙基己醇的反应体系分析对比,以Cu/Mg2.5AlOx为催化剂的反应体系中副产物数量明显减少。推测原因一方面Cu/Mg2.5AlOx催化剂中适宜强度及数量的酸碱活性位协同作用有利于中间产物的稳定,促进正丁醛向2-乙基-2-己烯醛的方向进行,减少了其他副反应发生的几率[10, 24];另一方面是催化剂中Cu对C=O键加氢的活跃程度要低于Ni [25],使反应体系中2-乙基-3-羟基己醛加氢速率较缓慢,不易生成2-乙基-1, 3-己二醇等副产物。
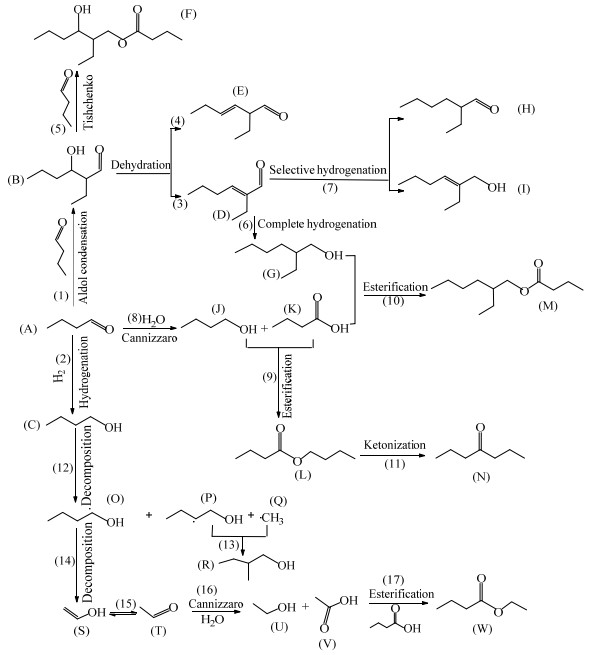
根据GC-MS的分析结果,对Cu/Mg2.5AlOx催化正丁醛一步合成2-乙基己醇体系的副反应进行了推测,进而建立了Cu/Mg2.5AlOx催化正丁醛一步合成2-乙基己醇的反应网络,如图 11所示。正丁醛(A)在催化剂的作用下主要发生羟醛缩合反应(1)生成2-乙基-3-羟基己醛(B)。体系中存在大量的氢气,部分正丁醛直接加氢(2)生成正丁醇(C)。2-乙基-3-羟基己醛(B)脱水(3, 4)主要生成双键共轭的2-乙基-2-己烯醛(D),但也有2-乙基-3-己烯醛(E)生成。部分2-乙基-3-羟基己醛可与正丁醛发生季先科反应(5)生成丁酸-2-乙基-3-羟基己酯(F),这与刘肖红等[26]和TSUJI等[27]的研究结果相符。2-乙基-2-己烯醛(D)完全加氢(6)生成2-乙基己醇(G)。2-乙基-2-己烯醛(D)选择性加氢(7)生成2-乙基己醛(H)和2-乙基-2-己烯醇(I)。正丁醛在水和催化剂存在下发生了歧化反应(8)生成正丁酸(J)和正丁醇(K)。正丁酸(J)和正丁醇(K)进一步发生酯化反应(9)得到了丁酸丁酯(L)[28-30]。正丁酸和2-乙基己醇在催化剂酸碱中心上发生酯化反应(10)而生成丁酸-2-乙基己酯(M)。副产物4-庚酮(N)可能是由丁酸丁酯(L)酮化生成(11),这与LIANG等[9]等的研究一致。根据HARPER等[31]对正丁醛分解反应机理的研究结论,推测反应体系中的正丁醇首先发生裂解反应(12)生成不稳定的自由基,包括1-正丁醇自由基(O)、2-正丁醇自由基(P)和甲基自由基(Q)等;不稳定的自由基会进一步反应(13):2-正丁醇自由基与甲基自由基快速反应生成2-甲基丁醇(R);2-正丁醇自由基发生裂解反应(14)生成乙烯醇(S)和乙基自由基;乙烯醇(S)又进一步转化(15)为乙醛(T)。因为体系中有水存在,乙醛(T)与水发生Cannizarro反应(16)生成乙酸(U)和乙醇(V),乙醇与正丁酸发生酯化反应(17)生成丁酸乙酯(W)。
|
图 11 Cu/Mg2.5AlOx催化正丁醛一步合成2-乙基己醇的反应网络 Fig.11 Reaction network of 2-ethylhexyl alcohol via one-step synthesis from n-Butyraldehyde catalyzed by Cu/Mg2.5AlOx |
(1) 采用共沉淀-浸渍法制备出以水滑石为前体的Cu-Mg-Al金属-酸碱多功能催化剂,该催化剂对正丁醛一步合成2-乙基己醇反应具有较好的催化性能,2-乙基己醇的收率最高可达61.3%,同时2-乙基己醇与正丁醇的选择性之比为6.13。
(2) Cu-Mg-Al催化剂适宜的制备条件为:Cu/Mg/Al摩尔比为1:2.5:1,晶化温度为85 ℃,晶化时间为18 h,焙烧温度550 ℃,还原温度250 ℃。结合催化剂表征和活性评价结果可知,催化剂的酸碱位分别可以促进C=O键和C=C键加氢,Cu0负载量则会影响正丁醛直接加氢与其羟醛自缩合的竞争关系,故需要匹配Cu/Mg/Al的摩尔比;水滑石的晶化结构越完整,得到催化剂的比表面越大,越有利于活性位的分散及原料与活性位的接触。
(3) 通过对正丁醛一步合成2-乙基己醇反应体系中的副产物的分析,推测了可能的副反应,建立了Cu/Mg2.5AlOx催化正丁醛一步合成2-乙基己醇的反应网络。反应体系中主要涉及季先科反应、酯化反应和酮化反应等副反应。
| [1] |
ZHAO L L, WANG Y, AN H L, et al. Catalytic performance of Ni/γ-Al2O3 for hydrogenation of 2-ethyl-2-hexenal[J]. Catalysis Communications, 2018, 103(1): 74-77. |
| [2] |
刘肖红.正丁醛自缩合及"一锅法"合成2-乙基己醇反应固体催化剂研究[D].天津: 河北工业大学, 2015. LIU X H. Solid catalyst for n-butanal aldol condensation and for one-pot sequential aldol condensation-hydrogenation to 2-ethylhexanol[D]. Tianjin: Hebei University of Technology, 2015. |
| [3] |
KELLY G J, KING F, KETT M. Waste elimination in condensation reactions of industrial importance[J]. Green Chemistry, 2002, 4(4): 392-399. DOI:10.1039/b201982p |
| [4] |
HAMILTON C A, JACKSON S D, KELLY G J. Solid base catalysts and combined solid base hydrogenation catalysts for the aldol condensation of branched and linear aldehydes[J]. Applied Catalysis A General, 2004, 263(1): 63-70. DOI:10.1016/j.apcata.2003.12.009 |
| [5] |
SRIVASTAVA V K, SHARMA S K, SHUKLA R S, et al. The 'single-pot' synthesis of C2n+2-aldol derivatives from Cn-alkenes using multi-functional catalyst[J]. Catalysis Communications, 2006, 7(11): 879-884. DOI:10.1016/j.catcom.2006.03.011 |
| [6] |
SHARMA S K, SRIVASTAVA V K, SHUKLA R S, et al. One-pot synthesis of C8 aldehydes/alcohols from propylene using eco-friendly hydrotalcite supported HRhCO(PPh3)3 catalyst[J]. New Journal of Chemistry, 2007, 31: 277-286. DOI:10.1039/b616977e |
| [7] |
SRIVASTAVA V K, SHARMA S K, SHUKLA R S, et al. Rhodium metal complex and hydrotalcite based environmentally friendly catalyst system for the selective synthesis of C8-aldehydes from propylene[J]. Industrial & Engineering Chemistry Research, 2008, 47(11): 3795-3803. |
| [8] |
SHARMA S K, SHUKLA R S, PARIKH P A, et al. The multi-step reactions for the synthesis of C8 aldehydes and alcohol from propene in a single pot using an eco-friendly multi-functional catalyst system: Kinetic performance for parametric optimization[J]. Journal of Molecular Catalysis A: Chemical, 2009, 304(1/2): 33-39. |
| [9] |
LIANG N, ZHANG X L, AN H L, et al. Direct synthesis of 2-ethylhexanol via n-butanal aldol condensation-hydrogenation reaction integration over a Ni/Ce-Al2O3 bifunctional catalyst[J]. Green Chemistry, 2015, 17(3): 2959-2972. |
| [10] |
MIAO S, AN H L, ZHAO X Q, et al. Catalytic performance of Cu-Mg-Al in the one-step synthesis of 2-ethylhexanol from n -butyraldehyde[J]. Reaction Kinetics Mechanisms & Catalysis, 2018, 125(6): 773-788. |
| [11] |
STOSIC D, HOSOGLU F, BENNICI S, et al. Methanol and ethanol reactivity in the presence of hydrotalcites with Mg/Al ratios varying from 2 to 7[J]. Catalysis Communications, 2017, 89(1): 14-18. |
| [12] |
ZHAO L, DUAN J, YANG S, et al. Cu promoted hydrotalcite-based NiAl mixed oxides in adsoption and oxidation of SO2, reaction: Experimental and theoretical study[J]. Separation & Purification Technology, 2018, 207(12): 231-139. |
| [13] |
TAO X, LIU D, CONG W, et al. Controllable synthesis of starch-modified ZnMgAl-LDHs for adsorption property improvement[J]. Applied Surface Science, 2018, 457(11): 572-579. |
| [14] |
AHMED A A A, TALIB Z A, HUSSEIN M Z. Synthesis and optimization of electric conductivity and thermal diffusivity of zinc-aluminum hydroxide (Zn-Al-NO3-LDH) prepared at different pH values[J]. Materials Today Proceedings, 2016, 3(2): 130-144. DOI:10.1016/j.matpr.2016.01.044 |
| [15] |
NAGARAJA B M, PADMASRI A H, RAJU B D, et al. Vapor phase selective hydrogenation of furfural to furfuryl alcohol over Cu-MgO coprecipitated catalysts[J]. Journal of Molecular Catalysis A Chemical, 2007, 265(1/2): 90-97. |
| [16] |
刘瀚文, 碱性位促进的高分散Cu和Ni基纳米催化材料的结构及其催化性能[D].北京: 北京化工大学, 2015. LIU H W. Basic sites promoted highly dispersed Cu-based and Ni-based nano-catalysts and performances[D]. Beijing: Beijing University of Chemical Technology, 2015. |
| [17] |
DASIREDDY V D B C, STEFANCIC N S, LIKOZAR B. Correlation between synthesis pH, structure and Cu/MgO/Al2O3 heterogeneous catalyst activity and selectivity in CO2 hydrogenation to methanol[J]. Journal of CO2 Utilization, 2018, 28(12): 189-199. |
| [18] |
COSIMO J I D, DIEZ V K, XU M, et al. Structure and surface and catalytic properties of Mg-Al basic oxides[J]. Journal of Catalysis, 1998, 178(2): 499-510. DOI:10.1006/jcat.1998.2161 |
| [19] |
王芳珠, 杨坤, 柴永明, 等. 以镁铝水滑石为前驱体制备复合氧化物催化丙酮气相缩合反应[J]. 无机化学学报, 2008, 24(9): 1417-1423. WANG F Z, YANG K, CHAI Y M, et al. Acetone gas phase condensation on Mg-Al composite oxides catalysts prepared via Mg-Al hydrotalcites precursor[J]. Chinese Journal of Inorganic Chemistry, 2008, 24(9): 1417-1423. DOI:10.3321/j.issn:1001-4861.2008.09.009 |
| [20] |
赵丽丽, 王毅, 安华良, 等. 酸碱性对负载型Ni基催化剂催化辛烯醛液相加氢反应性能的影响[J]. 高校化学工程学报, 2017, 31(6): 1333-1339. ZHAO L L, WANG Y, AN H L, et al. Effects of acid-base properties on catalytic performance of supported nickel-based catalysts for 2-ethyl-2-hexenal hydrogenation[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(6): 1333-1339. DOI:10.3969/j.issn.1003-9015.2017.06.011 |
| [21] |
HE L, HUANG Y, WANG A. A noble-metal-free catalyst derived from Ni-Al hydrotalcite for hydrogen generation from N2H4·H2O decomposition[J]. Angewandte Chemie, 2012, 124(25): 6295-6298. DOI:10.1002/ange.201201737 |
| [22] |
ROSELIN L S, CHIU H W. Production of hydrogen by oxidative steam reforming of methanol over Cu/SiO2 catalysts[J]. Journal of Saudi Chemical Society, 2018, 22(6): 692-704. DOI:10.1016/j.jscs.2017.12.001 |
| [23] |
尹安远.新型纳米铜基催化材料的构筑及其在草酸二甲酯气相加氢反应中的应用研究[D].上海: 复旦大学, 2011. YIN A Y. Construction of novel nano-Cu based catalytic materials and their application in gas phase hydrogenation of dimethyl oxalate[D]. Shanghai: Fudan University, 2011. |
| [24] |
DUMITRIU E, HULEA V, CHELARU C, et al. Influence of the acid-base properties of solid catalysts derived from hydrotalcite-like compounds on the condensation of formaldehyde and acetaldehyde[J]. Applied Catalysis A General, 1999, 178(2): 145-157. DOI:10.1016/S0926-860X(98)00282-8 |
| [25] |
MUTSCHLER R, MOIOLI E, LUO W, et al. CO2 hydrogenation reaction over pristine Fe, Co, Ni, Cu and Al2O3 supported Ru: Comparison and determination of the activation energies[J]. Journal of Catalysis, 2018, 366(10): 139-149. |
| [26] |
刘肖红, 王毅, 安华良, 等. La-Al2O3催化正丁醛自缩合合成辛烯醛反应[J]. 化工学报, 2016, 67(5): 1884-1891. LIU X H, WANG Y, AN H L, et al. Synthesis of 2-ethyl-2-hexenal via n-butanal self-condensation catalyzed by La-Al2O3[J]. CIESC Journal, 2016, 67(5): 1884-1891. |
| [27] |
TSUJI H, YAGI F, HATTORI H, et al. Self-condensation of n-butyraldehyde over solid base catalysts[J]. Journal of Catalysis, 1994, 148(2): 759-770. DOI:10.1006/jcat.1994.1262 |
| [28] |
杨树武, 周卓华. Cu/ZnO/Al2O3/ZrO2催化剂上乙醇脱氢合成乙酸乙酯:I.催化反应性能及机理[J]. 催化学报, 1996, 17(1): 5-9. YANG S W, ZHOU Z H. Synthesis of ethyl acetate by dehydrogenation of ethanol over Cu/ZnO/Al2O3/ZrO2 catalyst: I. Catalytic performance and mechanism[J]. Chinese Journal of Catalysis, 1996, 17(1): 5-9. |
| [29] |
杨树武, 周卓华. Cu/ZnO/Al2O3/ZrO2催化剂上乙醇脱氢合成乙酸乙酯:Ⅱ.催化剂的表征[J]. 催化学报, 1996, 17(1): 10-15. YANG S W, ZHOU Z H. Synthesis of ethyl acetate by dehydrogenation of ethanol over Cu/ZnO/Al2O3/ZrO2 catalyst: II. Characterization of the catalyst[J]. Chinese Journal of Catalysis, 1996, 17(1): 10-15. |
| [30] |
苑静, 杨树武, 周卓华. 负载型铜基催化剂上乙醇脱氢直接合成乙酸乙酯[J]. 辽宁师范大学学报(自然科学版), 2002, 25(1): 46-49. YUAN J, YANG S W, ZHOU Z H. Direct synthesis of ethyl acetate by dehydrogenation of ethanol over copper-based catalysts[J]. Journal of Liaoning Normal University (Natural Science Edition), 2002, 25(1): 46-49. |
| [31] |
HARPER M R, VAN GEEM K M, Pyl S P, et al. Comprehensive reaction mechanism for n-butanol pyrolysis and combustion[J]. Combustion and Flame, 2011, 158(1): 16-41. DOI:10.1016/j.combustflame.2010.06.002 |




