生物膜法水处理技术主要是利用载体表面的生物膜吸附并转化污水中的污染物,从而达到净化水质的目的。载体材料的材质、粗糙度、表面化学特性等因素均能影响微生物的固着效果。因此,制备出有利于微生物固着的载体材料,对于满足日益增加的污水处理压力具有重要意义[1]。
碳纤维因其表面物化性能稳定,能耐微生物分解以及可长期循环利用等优点,已广泛应用于污水处理[2]。然而原生碳纤维表面光滑、缺乏大量化学活性官能团,不能完全发挥其固着能力,因而需要进行表面改性,使其生物亲和性得到提高,进而增强对污水的净化能力。聚酰胺酸,作为聚酰亚胺的前驱体,不但主链中包含耐温的酰胺基团,而且具有大量羧基,通过电化学沉积法,可以在基体表面沉积一层薄膜,从而增加基体表面的润湿性。Yuan等[3]利用聚酰胺酸乳液在碳纤维表面覆盖一层均匀的薄膜,使得表面含氧官能团的含量增加,润湿性得到提高,并且增大了与树脂基之间的范德华力,黏附效果也随之增强。
DLVO理论,是由Derjaguin、Landan、Verwey、Overbeek 4位科学家共同提出关于胶体稳定性的基本理论[4]。微生物尺寸为0.5~2 μm,与胶体粒子尺寸相近,因而DLVO理论在微生物领域也得到广泛的应用[5-6]。
本文采用聚酰胺酸乳液对碳纤维进行表面改性,根据乳液形成过程中不同的羧基摩尔比制备出3种改性载体,通过大肠杆菌固着实验表征其固着能力,利用DLVO理论计算载体与大肠杆菌之间的总势能并分析固着机理,最后通过挂膜实验评价载体固着污水中微生物的实际效果。
2 实验部分 2.1 实验材料与仪器主要试剂:4, 4’-二氨基二苯醚(ODA),N, N-二甲基甲酰胺(DMAc),均苯四甲酸二酐(PMDA),三乙胺(TEA),甲醇,丙酮,牛肉膏,蛋白胨,氯化钠,氯化钾,磷酸二氢钾,磷酸氢二钾,戊二醛,无水乙醇,二碘甲烷,尿素,磷酸二氢钠,无水氯化钙,硫酸镁。试剂均为分析纯。
主要仪器:直流电源(M8853型),场发射扫描电镜(Quanta FEG 250型),傅里叶红外光谱仪(Nicolet 5700型),可见光分光光度计(7200型),动态接触角测试仪(DCAT 15型),Zeta电位分析仪(SurPASS 3型),激光粒度仪(NICOMP380 Z3000型)。
2.2 聚酰胺酸乳液的制备取0.015 mol ODA溶于DMAc中,称取相同摩尔的PMDA加入溶液中,配成质量分数为15%的溶液。将混合液在冰水浴中搅拌8 h,然后室温下搅拌12 h,得到聚酰胺酸溶液。
称取10 g聚酰胺酸溶液,加入适量DMAc进行稀释,再加入一定量的TEA中和溶液中的羧基(其中TEA与聚酰胺酸中羧基的摩尔比为rB),生成聚酰胺酸盐溶液。搅拌1 h后,向溶液中加入乳化剂甲醇(甲醇体积为DMAc体积的3倍)后搅拌0.5 h,最终得到聚酰胺酸乳液[7]。
2.3 改性碳纤维载体的制备实验所采用的碳纤维原样,购于兰州炭素厂。将原生碳纤维经过预处理去除表面上浆剂后标记为CF-0。将rB值分别为1.0、2.0和3.0的聚酰胺酸乳液作为电解液,碳纤维作正极,石墨作负极,在50 V电压下,进行10 min电化学沉积,在此实验条件下所获得的载体分别标记为CF-1.0、CF-2.0、CF-3.0,并在50 ℃下烘干12 h。
2.4 大肠杆菌固着实验本实验所选取的大肠杆菌(革兰氏阴性菌的代表菌种),购于美国标准生物品收藏中心。将大肠杆菌置于营养肉汤培养基(10 g·L-1蛋白胨,3 g·L-1牛肉膏,5 g·L-1 NaCl)中活化培养,37 ℃恒温振荡20 h,接着在对数期通过离心富集(2 500 g,15 min),重新悬浮于0.01 mol·L-1磷酸盐缓冲液(135 mmol·L-1 NaCl,10 mmol·L-1 KCl,1.5 mmol·L-1 KH2PO4,8 mmol·L-1 K2HPO4,pH = 7.2,I=202 mmol·L-1)中,调节悬浮液浓度,使其在600 nm处的光密度值(OD600)为0.65(1.3 × 109 CFU·mL-1)。碳纤维载体浸入定量悬浮液中固着大肠杆菌,并在摇床上缓慢振荡,用可见光分光光度计在不同时间点测定悬浮液的OD600值。
在2 h固着实验后,取出碳纤维载体,在2.5%戊二醛中浸泡12 h以固定大肠杆菌的形态,然后用梯度浓度的乙醇进行脱水(30%、50%、70%、85%、95%、99.5%,每次15 min)。最后将所有碳纤维载体冷冻干燥、粘台,扫描电镜喷金观察。
2.5 DLVO理论分析碳纤维载体与微生物之间的总势能由范德华势能和静电势能两部分组成。
2.5.1 范德华势能载体材料与微生物之间的范德华势能计算式为[8]
| ${G_{{\rm{LW}}}} = - {A_{{\rm{BWS}}}}\alpha {(6h)^{ - 1}}$ | (1) |
其中,Hamaker常数A可以通过式(2)计算[9]
| ${A_{{\rm{BWS}}}} = 24\pi h_0^2(\sqrt {\gamma _{\rm{b}}^{{\rm{LW}}}} - \sqrt {\gamma _{\rm{w}}^{{\rm{LW}}}} )(\sqrt {\gamma _{\rm{s}}^{{\rm{LW}}}} - \sqrt {\gamma _{\rm{w}}^{{\rm{LW}}}} )$ | (2) |
对于范德华能量组分,可以通过杨氏公式来求解[10]
| ${\gamma _1}(1 + \cos \theta ) = 2\sqrt {\gamma _{\rm{s}}^{{\rm{LW}}}\gamma _{\rm{l}}^{{\rm{LW}}}} + 2\sqrt {\gamma _{\rm{s}}^{\rm{ + }}\gamma _{\rm{l}}^ - } + 2\sqrt {\gamma _{\rm{s}}^ - \gamma _{\rm{l}}^{\rm{ + }}} $ | (3) |
接触角采用动态接触角测试仪进行测量,通过将碳纤维载体浸入二碘甲烷标准测试液(γl=γlLW=50.8 mJ·m-2,γ-=γ+=0 mJ·m-2)中进行5次测量后取平均值。
2.5.2 静电势能载体材料与微生物之间的静电势能计算式为[11]
| ${G_{{\rm{EL}}}} = \pi {\varepsilon _{\rm{r}}}{\varepsilon _0}\alpha [{({\psi _{\rm{s}}} + {\psi _b})^2}\ln (1 + {{\rm{e}}^{ - \kappa h}}) + ({\psi _{\rm{s}}} - {\psi _{\rm{b}}})\ln (1 - {{\rm{e}}^{ - \kappa {\rm{h}}}})]$ | (4) |
分别用固体表面Zeta电位分析仪和激光粒度仪对碳纤维载体和微生物进行3次测量,取平均后得到表面Zeta电位数值。
2.6 挂膜实验活性污泥样品取自成都市污水处理厂,培养在模拟的有机污水中:质量浓度为0.48 g·L-1蛋白胨,0.32 g·L-1牛肉膏,0.08 g·L-1尿素,0.024 g·L-1 NaCl,0.08 g·L-1 NaH2PO4,0.011 g·L-1 KCl,0.011 g·L-1 CaCl2,0.008 g·L-1 MgSO4。在25 ℃下于恒温容器中通气培养1个月,并将活性污泥悬浮液固体浓度调节至4 000 mg·L-1,pH值调节至7.8。碳纤维载体剪切成质量为2 g的碳纤维束,浸入活性污泥悬浮液中,在每个取样时间点,取下2个碳纤维束干燥称重,计算每克碳纤维载体挂膜的平均质量。
3 实验结果与讨论 3.1 碳纤维载体表面特性图 1为碳纤维载体表面的扫描电镜形貌图。通过电泳沉积后,载体表面被聚酰胺酸所覆盖,并且粗糙度有明显改变。随着三乙胺的加入量越大,表面粗糙度和薄膜厚度增加越明显。

|
图 1 碳纤维载体的扫描电镜形貌图 Fig.1 SEM images of carbon fiber supports |
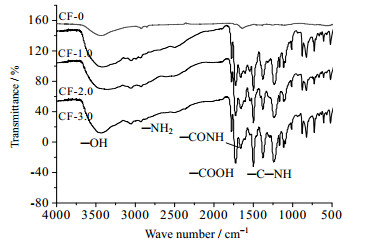
图 2为碳纤维载体的傅里叶红外光谱图。主要特征峰为[12]:峰位在3 437 cm-1处对应O─H伸缩振动;峰位在1 720 cm-1处对应C=O(─COOH)伸缩振动;峰位在1 660 cm-1处对应C=O(─CONH)伸缩振动;峰位在1 550 cm-1处对应C─N(─C─NH)伸缩振动;峰位在2 800~3 200 cm-1处对应N─H伸缩振动。
|
图 2 碳纤维载体的傅里叶红外光谱图 Fig.2 FITR spectra of carbon fiber supports |
结果表明:改性碳纤维表面─C=O、─C─O和─OH等含氧基团的含量增加,表面的亲水性得到提高,因而活性面积明显扩大,从而增强对微生物的吸引力;与此同时,载体表面出现─CONH,─C─NH以及─NH2等含氮基团的特征峰,其含量的增加会降低载体表面的负电荷,从而减小与微生物之间的斥力。随着三乙胺的加入量越大,含氧和含氮基团的含量增加越明显。
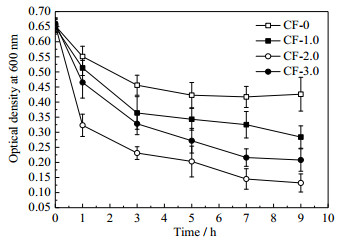
3.2 大肠杆菌固着实验图 3为大肠杆菌悬浮液OD600的数值随着固着时间的变化曲线图。在整个固着过程中,改性碳纤维载体OD600数值的减少更显著,证明其固着大肠杆菌的能力更强。CF-2.0的OD600数值下降最明显,固着结束时仅为0.15,明显低于其他2种改性载体,因而固着能力最强。
|
图 3 大肠杆菌悬浮液的OD600值随固着时间的变化图 Fig.3 Profiles of OD600 of E. coli suspension |
图 4为碳纤维载体表面固着大肠杆菌的扫描电镜形貌图。从图中可以看出,原生碳纤维只能固着较少的大肠杆菌,通过沉积聚酰胺酸薄膜后,碳纤维载体对于大肠杆菌的固着量有了明显增加,表明其固着大肠杆菌能力得到增强。当rB=2.0时,可以看出大肠杆菌固着数量最多,并且生物聚集体的规模最大。

|
图 4 碳纤维载体固着大肠杆菌的扫描电镜形貌图 Fig.4 SEM images of E. coli on carbon fiber supports |
表 1总结了微生物的平均半径、Zeta电位和范德华能量组分;表 2总结了碳纤维载体的二碘甲烷接触角、Zeta电位、范德华能量组分以及Hamaker常数。结合式(1)、(2)和(3),可知范德华势能与载体表面的二碘甲烷接触角相关,接触角越小,范德华势能越小,因而对微生物的引力越大,而接触角主要受表面化学组成和粗糙度影响,含氧官能团的增加会引起接触角的减小。当接触角为锐角时,粗糙度的增加会进一步减小接触角。结合式(4)可知,静电势能与碳纤维载体表面的Zeta电位相关,Zeta电位越大,其静电势能越小,对微生物的斥力越小。
|
|
表 1 微生物的表面参数 Table 1 Surface parameters of microorganisms |
|
|
表 2 碳纤维载体的表面参数 Table 2 Surface parameters of carbon fiber supports |
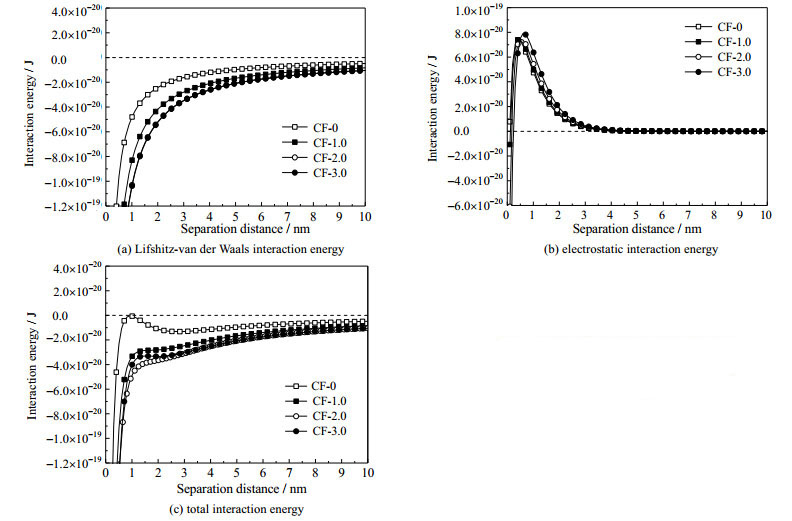
图 5 (a)和(b)为碳纤维载体与大肠杆菌之间的范德华势能和静电势能图。与CF-0相比,改性载体有更小的二碘甲烷接触角,并且当三乙胺加入量越大,表面粗糙度越大,活性基团含量越多,其接触角越小,范德华势能越小;但表面Zeta电位数值减小,导致静电势能增加,并且三乙胺加入量越大,静电势能增加越明显。图 5(c)为碳纤维载体与大肠杆菌之间的总势能图。从图中可知,改性碳纤维载体与大肠杆菌之间的总势能更低,并且体系中能量势垒表现出明显地降低,使得更多的大肠杆菌能够越过此能垒,较容易固着在载体表面,从而增强固着能力。
|
图 5 碳纤维载体与大肠杆菌之间的势能图 Fig.5 Interaction energy between E. coli and carbon fiber supports |
比较3种改性碳纤维载体可知:当固着距离大于3 nm时,CF-1.0的总势能较大,CF-2.0和CF-3.0的总势能基本相同,原因在于长距离的固着过程中,范德华势能起主要作用,CF-1.0的接触角明显大于另外2种改性碳纤维载体,因而其范德华势能数值最大,导致总势能最大。当距离减少到1~2 nm时,可以发现总势能曲线出现了能量势垒,从大到小分别为CF-1.0,CF-3.0及CF-2.0。在短距离固着过程中,静电势能对总势能影响较大,而CF-3.0的Zeta电位小于其他2种改性碳纤维载体,使得其静电势能迅速增加,导致所产生的能量势垒大于CF-2.0,因而其固着能力低于CF-2.0。因此,3种改性碳纤维载体中,当rB=2.0时,碳纤维载体的总势能最低,对于大肠杆菌的固着能力最强。
综上所述,沉积聚酰胺酸薄膜后,碳纤维载体与大肠杆菌之间的范德华势能降低,但静电势能出现升高,而总势能在二者的叠加后仍是降低的,并且明显低于原生碳纤维。除此之外,总势能在变化过程中始终为负值,表示范德华势能处于主导地位,表面沉积的聚酰胺酸薄膜可以显著提高范德华势能,降低静电势能的负面影响,从而使得大量的大肠杆菌能固着在载体表面上。
因此,在对材料进行优化时,既要增加表面粗糙度以及含氧官能团,降低表面的接触角,增加范德华势能,还应尽量增加表面正电荷,避免静电势能对微生物固着的排斥效应。
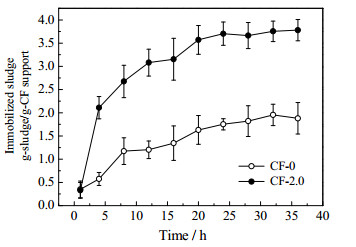
3.4 挂膜实验对CF-2.0载体进行挂膜实验,研究在污水中实际固着效果,结果如图 6所示。与原生碳纤维相比,CF-2.0具有较高的挂膜量,每g载体可以固看3.8 g污泥,是原生碳纤维挂膜量的2倍以上。Bao和Dai[14]采用阳极氧化法改性碳纤维,得到最佳氧化碳纤维的挂膜量达到250% (每克载体固着2.5 g污泥)。Hayashi等[15]采用镍铁颗粒作为生物膜载体材料,发现具有高生物亲和性,最高挂膜量可达2.5~3.0 g·m-2。因此,本文CF-2.0具有更大挂膜量,固着效果更佳。
|
图 6 碳纤维载体的挂膜量随挂膜时间变化曲线图 Fig.6 Profiles of immobilized sludge amounts of different carbon fiber supports |
聚酰胺酸改性碳纤维载体能够增强其固着大肠杆菌的能力。根据DLVO理论,聚酰胺酸薄膜虽然使体系的静电势能升高,但显著降低了范德华势能。在二者叠加后,总势能远低于原生碳纤维,使得更多的大肠杆菌稳定地固着在碳纤维表面。当羧基摩尔比为2.0时,制备出的碳纤维载体拥有最低的总势能,固着大肠杆菌的能力最强,最大挂膜量达到每克载体固着3.8 g污泥,污水中的固着效果明显优于原生碳纤维。因此,聚酰胺酸改性碳纤维为具有高生物亲和性的生物膜载体。
符号说明:
|
|
| [1] |
张磊, 郎建峰, 牛姗姗. 生物膜法在污水处理中的研究进展[J]. 水科学与工程技术, 2010(5): 38-41. ZHANG L, LANG J F, NIU S S. Biofilm research progress in wastewater treatment[J]. Water Sciences and Engineering Technology, 2010(5): 38-41. |
| [2] |
陈思宇, 韦晓群, 唐远. 活性炭纤维负载生物膜处理污水的研究[J]. 材料研究与应用, 2010, 4(4): 410-413. CHEN S Y, WEI X Q, TANG Y. Study on the wastewater treatment by biofilm method using activated carbon fiber as support[J]. Materials Research and Application, 2010, 4(4): 410-413. |
| [3] |
YUAN H J, ZHANG S C, LU C X, et al. Improved interfacial adhesion in carbon fiber/polyether sulfone composites through an organic solvent-free polyamic acid sizing[J]. Applied Surface Science, 2013, 279: 279-284. DOI:10.1016/j.apsusc.2013.04.085 |
| [4] |
周祖康, 顾惕人, 马季铭. 胶体化学基础[M]. 北京: 北京大学出版社, 1996. ZHOU Z K, GU T R, MA J M. Basics of colloid chemistry[M]. Beijing: Peking University Press, 1996. |
| [5] |
HARIMAWAN A, ZHONG S P, LIM C T, et al. Adhesion of B. subtilis spores and vegetative cells onto stainless-steel- DLVO theories and AFM spectroscopy[J]. Journal of Colloid Interface Science, 2013, 405: 233-241. DOI:10.1016/j.jcis.2013.05.031 |
| [6] |
PERNI S, PREEDY E C, PRIKOPOVICH P. Success and failure of colloidal approaches in adhesion of microorganisms to surfaces[J]. Advances in Colloid and Interface Science, 2014, 206: 265-274. DOI:10.1016/j.cis.2013.11.008 |
| [7] |
李垚, 刘俊凯, 赵九蓬.一种电沉积聚酰胺酸制备低介电聚酰亚胺薄膜的方法: 中国, CN103980528A [P]. 2014-08-13. LI Y, LIU J K, ZHAO J P. Method for preparing low-dielectric polyimide film by electrodeposition of polyamic acid: China, CN103980528A[P]. 2014-08-13. |
| [8] |
FARAHAT M, HIRAJIMA T, SASAKI K, et al. Adhesion of Escherichia coli onto quartz, hematite and corundum: Extended -DLVO theory and flotation behavior[J]. Colloids and Surface B, 2009, 74(1): 140-149. DOI:10.1016/j.colsurfb.2009.07.009 |
| [9] |
HONG H, LIN H, MEI R, et al. Membrane fouling in a membrane bioreactor: A novel method for membrane surface morphology construction and its application in interaction energy assessment[J]. Journal of Membrane Science, 2016, 516: 135-143. DOI:10.1016/j.memsci.2016.06.006 |
| [10] |
CAI X, ZHANG M, YANG L, et al. Quantification of interfacial interactions between a rough sludge floc and membrane surface in a membrane bioreactor[J]. Journal of Colloid and Interface Science, 2017, 490: 710-718. DOI:10.1016/j.jcis.2016.12.005 |
| [11] |
ISRAELACHVILI J. Intermolecular and surface forces[M]. New York: Academic Press, 1992.
|
| [12] |
李焱, 于俊荣, 刘兆峰. 聚酰胺酸的合成及其酰亚胺化研究[J]. 合成纤维, 2006(4): 6-9. LI Y, YU J R, LIU Z F. Study on the synthesis and imidization of polyamic acid[J]. Synthetic Fiber in China, 2006(4): 6-9. |
| [13] |
FERIANCIKOVA L, BARDY S L, WANG L, et al. Effects of outer membrane protein tolc on the transport of Escherichia coli within saturated quartz sands[J]. Environmental Science and Technology, 2013, 47(11): 5720-5728. DOI:10.1021/es400292x |
| [14] |
BAO Y L, DAI G Z. Anodic oxidation and electro-polymerization on CF surface and effects on immobilization of microorganism in waste water[J]. Applied Mechanics and Materials, 2013, 253: 975-979. |
| [15] |
HAYASHI H, ONO M, TSUNEDA S, et al. Three dimensional immobilization of bacterial cells with a fibrous network and its application in a high-rate fixed-bed nitrifying bioreactor[J]. Journal of Chemical Engineering of Japan, 2002, 35(1): 68-75. DOI:10.1252/jcej.35.68 |




